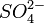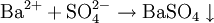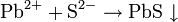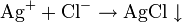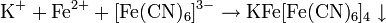качественные реакции что это
Качественные реакции
Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны. Качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаружить катионы или анионы.
Качественные реакции
Примеры качественных реакций на катионы
| Катион | Воздействие и реактив | Наблюдаемая реакция |
|---|---|---|
| Li + | Пламя | Карминово-красное окрашивание |
| Na + | Пламя | Желтое окрашивание |
| K + | Пламя | Фиолетовое окрашивание |
| Ca 2 + | Пламя | Кирпично-красное окрашивание |
| Sr 2 + | Пламя | Карминово-красное окрашивание |
| Ba 2 + | 1. Пламя |
2.
2. Выпадение белого осадка, не растворимого в кислотах.
Литература
Полезное
Смотреть что такое «Качественные реакции» в других словарях:
Качественный анализ (химия) — Качественный анализ совокупность химических, физико химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют… … Википедия
Молочная кислота — Молочная кислота … Википедия
Антраниловая кислота — ароматическая аминокислота. Производные антраниловой кислоты применяются в производстве … Википедия
Качественный анализ — совокупность химических, физико химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые,… … Википедия
Гликозиды — Гликозид кверцетина Гликозиды органические соединения, молекулы которых состоят из двух частей: углеводного (пиранозидного или фуранозидного) ос … Википедия
Е270 — Молочная кислота Молочная кислота α оксипропионовая кислота, CH3CH(OH)COOH. tпл 25–26 °С оптически активная + или – форма. tпл 18 °C рацемическая форма. Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем… … Википедия
Лактат — Молочная кислота Молочная кислота α оксипропионовая кислота, CH3CH(OH)COOH. tпл 25–26 °С оптически активная + или – форма. tпл 18 °C рацемическая форма. Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем… … Википедия
Полимер — (Polymer) Определение полимера, виды полимеризации, синтетические полимеры Информация об определении полимера, виды полимеризации, синтетические полимеры Содержание Содержание Определение Историческая справка Наука о Полимеризация Виды… … Энциклопедия инвестора
ЖЕЛУДОК — ЖЕЛУДОК. (gaster, ventriculus), расширенный отдел кишечника, имеющий благодаря наличию специальных желез значение особо важного пищеварительного органа. Ясно диференцированные «желудки» многих беспозвоночных, особенно членистоногих и… … Большая медицинская энциклопедия
Железо — (техн.) Ж. есть наиболее распространенный и наиболее употребительный из металлов. Ж. было известно еще египтянам во время постройки пирамид; у греков упоминается о нем в Илиаде Гомера, причем о нем говорится, как о трудно обрабатываемом металле,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Качественные реакции органических и неорганических веществ: таблица
Правила растворимости химических соединений:
Качественные реакции органических веществ
Вещество, функциональная группа
Реактив
Схема реакции
Характерные признаки
Непредельные углеводороды (алкены, алкины, диены), кратные связи
Ацетилен
образование осадка (ацетиленид серебра) белого цвета (взрывоопасен)
Бензол
образование тяжелой жидкости светло-желтого цвета с запахом горького миндаля
Толуол
Фенол (карболовая кислота)
р-р FeCl3 (светло-желтый)
окрашивание р-ра в фиолетовый цвет
насыщенный р-р Br2(бромная вода)
образование белого осадка со специфическим запахом
Анилин (аминобензол)
р-р хлорной извести CaOCl2 (бесцветный)
окрашивание р-ра в фиолетовый цвет
Этанол
насыщенный р-р I2 + р-р NaOH
C2H5OH + I2 + NaOH → CHI3↓ + HCOONa + NaI + H2O
образование мелкокристаллического осадка СНI3 светло-желтого цвета со специфическим запахом
CuO (прокаленная медная проволока)
выделение металлической меди, специфический запах ацетальдегида
Гидроксогруппа (спирты, фенол, гидроксикислоты)
выделение пузырьков газа (Н2), образование бесцветной студенистой массы
Эфиры (простые и сложные)
Н2О (гидролиз) в присутствии NaOH при нагревании
Многоатомные спирты, глюкоза
Свежеосажденный гидроксид меди (II) в сильно щелочной среде
ярко-синее окрашивание р-ра
Карбонильная группа – СНО (альдегиды, глюкоза)
образование блестящего налета Ag («серебряное зеркало») на стенках сосудов
образование красного осадка Сu2O
Карбоновые кислоты
окрашивание р-ра в розовый цвет
специфический запах образующегося сложного эфира
Муравьиная кислота
образование красного осадка Сu2O
«серебряное зеркало» на стенках сосуда
Олеиновая кислота
р-р KMnO4 (розовый) или I2 (бурый) или Br2(желтый)
Ацетаты (соли уксусной кислоты)
окрашивание р-ра в красно-бурый цвет
Стеарат натрия (мыло)
Н2О (гидролиз) + фенолфталеин
окрашивание р-ра в малиновый цвет
насыщенный р-р соли кальция
образование серого осадка
Концентрированная неорганическая кислота
образование белого осадка
Белок
запах «паленого», жженых перьев
ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка)
биуретовая реакция (образуется комплексное соединение)
сине-фиолетовое окрашивание р-ра
Качественные реакции неорганических веществ на катионы, анионы, для газов и для щелочных металлов
Качественные реакции на катионы
Катион
Реактив
Реакция
Характерные признаки
Красное окрашивание
Розовое окрашивание
Ва 2+
Растворимые сульфаты, серная кислота.
Пламя спиртовки.
Белый мелкодисперсный осадок BaSO4, нерастворимый в H2O и HNO3.
Желто-зеленая окраска пламени.
Растворимые хлориды, соляная кислота
Белый творожистый осадок AgCl, нерастворимый в H2O и HNO3
NH 4+
Раствор щелочи, нагревание, влажная фильтровальная бумажка, пропитанная лакмусом или фенолфталеином; палочка, смоченная HCl(конц)
Специфический запах аммиака. Изменение окраски бумажки. Палочка, смоченная HCl(конц) «дымит»
Al 3+
Растворы щелочи, кислоты
Белый осадок Al(OH)3, растворимый в кислоте в избытке щелочи
Zn 2+
Растворы щелочи, кислоты
Белый осадок Zn(OH)2, растворимый в кислоте в избытке щелочи
Mg 2+
Белый осадок Mg(OH)2, нерастворимый в избытке щелочи
Cr 3+
Растворы щелочи, кислоты
Cеро-зеленый осадок Cr(OH)3, растворимый в кислоте в избытке щелочи
Fe 2+
Раствор красной кровяной соли K3[Fe(CN)6]
Fe 3+
Раствор роданида аммония NH4CNS
Раствор желтой кровяной соли K4[Fe(CN)6]
Кроваво-красное окрашивание раствора Образование берлинской лазури Fe4[Fe(CN)6]3
Cu 2+
Раствор щелочи с последующим нагреванием
Ярко-голубой студенистый осадок, нерастворимый в избытке щелочи, разлагающийся при нагревании на черный осадок CuO и воду
4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
а с нитратом серебра с образованием белого творожистого осадка AgCl
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
| Катион | Реактив | Признак реакции |
| Ba 2+ | SO4 2- | Красное окрашивание |