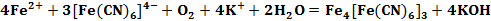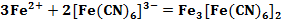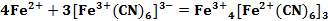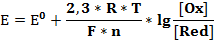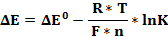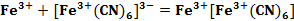калия гексацианоферрат что это
Ферроцианид калия (Е536)
Необработанная натуральная соль обладает сероватым оттенком (да, она на первый взгляд выглядит грязной и некрасивой). В процессе добавления Е536 соль приобретает белый и чистый оттенок, а, следовательно, и более притягательный для потребителя эстетический вид. Это играет на руку производителям, так как внешний вид продукта позволяет существенно повысить цену на столь популярный среди потребителей продукт.
Некоторые производители добавляют добавку Е536 в качестве эмульгатора в виноделии, в производстве колбасных изделий. Также ферроцианид калия используется при приготовлении некоторых видов сыров. В сыре данная пищевая добавка действует в качестве эмульгатора и придает однородность цвета данному молочному продукту.
Также добавляют E536 в недорогие сорта творога, для того чтобы улучшить его цвет и придать рассыпчатую консистенцию продукту (показатель наличия добавки в твороге – это одинаковые, рассыпчатые сырные зерна).
Накопление в организме человека вредно и может вызвать много побочных эффектов, которые будет сложно устранить. Стоит учитывать, что твердые сыры входят в рацион детей, беременных женщин, женщин в период лактации, в диеты послеоперационные, в рацион пожилых людей. Наличие в данном молочном продукте ферроцианида калия может запустить необратимые процессы в различных системах организма.
Определить наличие ферроцианида калия в составе продукта достаточно просто. Для таких продуктов характерен белесый налет на оболочке.
Следовательно, если в период осмотра продукта наблюдается белый налет на упаковке сыра, колбасы или иного продукта, рекомендуется отказаться от покупки и выбрать иной вид товара.
Какую опасность таит в себе Е536
В нашей стране использование данной добавки в пищевой и в химической промышленности разрешено, но есть определенные ограничения по ее количеству. Для соли допустимая норма – до 20 миллиграмм Е536 на 1 килограмм продукта.

Порошок представляет собой кристаллы желтого цвета. Это химически синтезированная добавка, которая получается в процессе очистки газа на газовых заводах.
Из самого названия ферроцианида калия становится понятно, что в составе данной добавки есть цианистые соединения. Добавка Е536 может быть получена разными способами и при этом в ней варьируется количество цианидов и синильной кислоты.
Ученые не комментируют ситуацию с использованием данного опасного эмульгатора в особенности там, где от его использования можно отказаться.
На сегодняшний день ферроцианид калия производится из уже отработанных материалов, в составе которых отмечается большое количество цианистых соединений.
При покупке разных продуктов стоит внимательно изучать этикетки с указанием состава и по возможности избегать покупки продуктов с наличием Е536, так как при неправильном использовании данной добавки (в случае нарушенной технологии ее производства) можно спровоцировать тяжелые последствия для организма человека.
Использование Е536 в промышленности
В случае наличия большого количества Е536 в красителях и других промышленных товарах можно спровоцировать следующие реакции организма: аллергическая сыпь, покраснения, зуд, язвы, головная боль, поражение слизистых и т.д.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Гексацианоферрат(II) калия
| Гексацианоферрат(II) калия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Гексацианоферрат(II) калия |
| Химическая формула | K4[Fe(CN)6] |
| Эмпирическая формула | C6N6FeK4 |
| Физические свойства | |
| Состояние (ст. усл.) | безводный – бесцветные кристаллы, тригидрат – бледно-жёлтые кристаллы |
| Отн. молек. масса | 368 а. е. м. |
| Молярная масса | 368,35 г/моль |
| Плотность | тригидрата 1,85 г/см³ |
| Термические свойства | |
| Температура плавления | 69-71 °C |
| Температура разложения | |
| Классификация | |
| Рег. номер CAS | 13943-58-3 [1] |
Гексацианоферра́т(II) ка́лия (железистосинеро́дистый ка́лий, ферроциани́д ка́лия, гексацианоферриа́т ка́лия) — комплексное соединение двухвалентного железа K4[Fe(CN)6], существующее обычно в виде тригидрата K4[Fe(CN)6]·3H2O.
Содержание
История открытия и тривиальные названия
Тривиальное название появилось из-за того, что ранее «жёлтую кровяную соль» получали путем сплавления отходов с боен (в частности, крови) с поташом и железными опилками. Это, а также жёлтый цвет кристаллов, обусловили название соединения.
Получение
В настоящее время в промышленности получают из отработанной массы (содержит цианистые соединения) после очистки газов на газовых заводах; эту массу обрабатывают суспензией Ca(OH)2, фильтрат содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он также может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит Fe 2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
2. затем осадок растворяется в избытке KCN с образованием «жёлтой кровяной соли»:
Химические свойства
Светло-жёлтые кристаллы с тетрагональной решеткой, существующие в виде тригидрата K4[Fe(CN)6]·3Н2О.
Плотность 1,853 г/см³ при 17 °C. Растворимость в воде 31,5 г/100 г при 25 °C, 48,3 при 50 °C. Практически не растворяется в эфире, этаноле, пиридине, анилине, этилацетате.
Гексацианоферрат(II) калия диамагнитен.
Выше 87,3 °C (по другим данным, выше 120 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
С концентрированной серной кислотой реагирует по уравнению:
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
С солями металлов в степени окисления +2 и +3, образует малорастворимые соединения гексацианоферратов(II) (см. в разделе «применение»).
В водных растворах окисляется хлором и другими окислителями, такими, как перекись водорода до K3[Fe(CN)6]:
Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
1. Fe 3+ : образуется малорастворимый синий осадок «берлинской лазури»:
или, в ионной форме
Получающийся гексацианоферрат(II) калия-железа(III) слабо растворим (с образованием коллоидного раствора), поэтому носит название «растворимая берлинская лазурь».
2. Zn 2+ : образуется белый осадок гексацианоферрата(II) цинка-калия [2] :
или, в ионной форме
3. Cu 2+ : из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
или, в ионной форме
Может использоваться для получения синильной кислоты:
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. [3] Применяется как добавка к поваренной соли.
Мнемоническое правило
Для того, чтобы запомнить формулу желтой кровяной соли K4[Fe(CN)6] и не спутать ее с красной кровяной солью K3[Fe(CN)6], существует мнемоническое правило:
См. также
Ссылки
Полезное
Смотреть что такое «Гексацианоферрат(II) калия» в других словарях:
Гексацианоферрат(III) калия — гексацианоферрат (III) калия (красная кровяная соль) Гексацианоферрат(III) калия (железосинеродистый калий, феррицианид калия, гексацианоферрат калия) комплексное соединение трёхвале … Википедия
Калия гексацианоферроат — Гексацианоферрат (III) калия (красная кровяная соль) Гексацианоферрат(III) калия (железосинеродистый калий, феррицианид калия, гексацианоферрат калия) комплексное соединение трёхвалентного железа K3[Fe(CN)6]. Содержание 1 Тривиальные названия … Википедия
Калия гексацианоферриат — Жёлтая кровяная соль Гексацианоферрат(II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферриат калия) комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O. Содержание … Википедия
Гексацианоферрат калия — Гексацианоферрат калия кровяная соль Гексацианоферрат(II) калия (жёлтая кровяная соль) Гексацианоферрат(III) калия (красная кровяная соль) … Википедия
Калия гексацианоферрат — Гексацианоферрат калия кровяная соль Гексацианоферрат(II) калия (жёлтая кровяная соль) Гексацианоферрат(III) калия (красная кровяная соль) … Википедия
Калия гексацианоферраты — Гексацианоферрат калия кровяная соль Гексацианоферрат(II) калия (жёлтая кровяная соль) Гексацианоферрат(III) калия (красная кровяная соль) … Википедия
калия гексацианоферрат(III) — kalio heksacianoferatas(III) statusas T sritis chemija formulė K₃[Fe(CN)₆] atitikmenys: angl. ferric potassium cyanide; potassium ferricyanide; potassium hexacyanoferrate; red potassium prussiate; red prussiate of potash rus. калия… … Chemijos terminų aiškinamasis žodynas
калия гексацианоферрат(II) — kalio heksacianoferatas(II) statusas T sritis chemija formulė K₄[Fe(CN)₆] atitikmenys: angl. ferrous potassium cyanide; yellow prussiate of potash; potassium ferrocyanide; potassium hexacyanoferrate(II) rus. желтая кровяная соль; калия… … Chemijos terminų aiškinamasis žodynas
Гексацианоферрат(III) калия
| Гексацианоферрат | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | Гексацианоферрат(III) калия |
| Традиционные названия | красная кровяная соль, красное синькали |
| Хим. формула | K3[Fe(CN)6] |
| Физические свойства | |
| Состояние | тёмно-красные (ярко-оранжевые) кристаллы |
| Молярная масса | 329,25 г/моль |
| Плотность | 1,845 г/см³ |
| Термические свойства | |
| Мол. теплоёмк. | 316,3 Дж/(моль·К) |
| Энтальпия образования | −173,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 40,8 г/100 г (15,6 °C) |
| Классификация | |
| Рег. номер CAS | 13746-66-2 |
| PubChem | 26250 |
| Рег. номер EINECS | 237-323-3 |
| SMILES | |
| RTECS | LJ8225000 |
| ChEBI | 30060 |
| ChemSpider | 19957218 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
| Стандартная энергия Гиббса образования ΔG | −51,9 кДж/моль |
| Стандартная энтропия образования S | 420,1 Дж/моль·K |
Гексацианоферра́т(III) ка́лия (железосинеро́дистый ка́лий) — неорганическое комплексное соединение трёхвалентного железа с химической формулой K3[Fe(CN)6].
Синонимы: феррициани́д ка́лия, гексацианоферриа́т ка́лия, соль Гмелина, красная кровяная соль.
Содержание
История и происхождение названия
В 1822 году немецким химиком Леопольдом Гмелином соединение было приготовлено путём окисления «жёлтой кровяной соли». Этот факт, а также красный цвет кристаллов, обусловили происхождение традиционного названия «красная кровяная соль».
Свойства
Выглядит как тёмно-красные кристаллы с моноклинной решеткой, имеет плотность 1,845 г/моль, хорошо растворим в воде: 40,8 г/100 г (15,6 °C), 58,7 г/100 г (37,8 °C). Водный раствор зеленовато-жёлтого цвета. В этаноле нерастворим.
Гексацианоферрат(III) калия — очень сильный окислитель, особенно в щелочной среде. Окисляет сероводород до серы, иодоводород до иода, оксид свинца(II) до оксида свинца(IV), аммиак до азота и солей аммония, вольфрам до WO4 2− :
W + 6 K 3 [ F e ( C N ) 6 ] + 8 K O H → 6 K 4 [ F e ( C N ) 6 ] + K 2 W O 4 + 4 H 2 O <\displaystyle <\mathsf
На свету происходят следующие обратимые реакции:
K 3 [ F e ( C N ) 6 ] + H 2 O ⇄ K 2 [ F e ( H 2 O ) ( C N ) 5 ] + K C N <\displaystyle <\mathsf 
С солями Fe 2+ образует темно-синий осадок турнбулевой сини. Уравнение реакции в ионной форме:
4 F e 2 + + 3 [ F e ( C N ) 6 ] 3 − → F e 4 I I I [ F e I I ( C N ) 6 ] 3 <\displaystyle <\mathsf <4Fe^<2+>+3[Fe(CN)_<6>]^<3->\rightarrow Fe_<4>^
С концентрированной серной кислотой реагирует с образованием моноксида углерода:
2 K 3 [ F e ( C N ) 6 ] + 11 H 2 S O 4 + 13 H 2 O → 3 K 2 S O 4 + 6 ( N H 4 ) 3 S O 4 + 2 F e S O 4 + 11 C O ↑ + C O 2 ↑ <\displaystyle <\mathsf <2K_<3>[Fe(CN)_<6>]+11H_<2>SO_<4>+13H_<2>O\rightarrow 3K_<2>SO_<4>+6(NH_<4>)_<3>SO_<4>+2FeSO_<4>+11CO<\uparrow >+CO_<2><\uparrow >>>>
Реагирует с перекисью бария (эта реакция может использоваться для количественного определения BaO2):
B a O 2 + 2 K 3 [ F e ( C N ) 6 ] → K 6 B a [ F e ( C N ) 6 ] 2 + O 2 ↑ <\displaystyle <\mathsf
При взаимодействии с кислотами выделяет весьма токсичный цианистый водород:
K 3 [ F e ( C N ) 6 ] + 6 H C l → 3 K C l + F e C l 3 + 6 H C N ↑ <\displaystyle <\mathsf
Интересно то, что из гексацианоферрата(III) калия можно получить гексацианоферрат(II) калия с помощью перекиси водорода в щелочной среде:
2 K 3 [ F e ( C N ) 6 ] + H 2 O 2 + 2 K O H → 2 K 4 [ F e ( C N ) 6 ] + 2 H 2 O + O 2 ↑ <\displaystyle <\mathsf <2K_<3>[Fe(CN)_<6>]+H_<2>O_<2>+2KOH<\xrightarrow <>>\ 2K_<4>[Fe(CN)_<6>]+2H_<2>O+O_<2><\uparrow >>>>
Однако в нейтральной среде эта реакция протекает в обратную сторону.
Получение
Получают гексацианоферрат(III) калия окислением гексацианоферрата(II) калия K4[Fe(CN)6] хлором в солянокислой среде, бромом или другими сильными окислителями, например, перманганатом калия.
Применение
В почвоведении используют для качественного определения оглеения (солей двухвалентного железа). Химическая реакция описана выше.
Безопасность
Это вещество может раздражать глаза и кожу, является токсичным. В кислой среде может выделяться циановодород и угарный газ. Например, в случае концентрированной серной кислоты разложение идет с образованием монооксида углерода:
2 K 3 [ F e ( C N ) 6 ] + 11 H 2 S O 4 + 13 H 2 O → 3 K 2 S O 4 + 6 ( N H 4 ) 3 S O 4 + 2 F e S O 4 + 11 C O ↑ + C O 2 ↑ <\displaystyle <\mathsf <2K_<3>[Fe(CN)_<6>]+11H_<2>SO_<4>+13H_<2>O\rightarrow 3K_<2>SO_<4>+6(NH_<4>)_<3>SO_<4>+2FeSO_<4>+11CO<\uparrow >+CO_<2><\uparrow >>>>
Но в разбавленной серной кислоте, при падении концентрации ниже 80 %, доминирующей становится реакция с образованием циановодорода:
2 K 3 [ F e ( C N ) 6 ] + 6 H 2 S O 4 → 3 K 2 S O 4 + F e 2 ( S O 4 ) 3 + 12 H C N ↑ <\displaystyle <\mathsf <2K_<3>[Fe(CN)_<6>]+6H_<2>SO_<4>\rightarrow 3K_<2>SO_<4>+Fe_<2>(SO_<4>)_<3>+12HCN<\uparrow >>>>
Мнемонические правила
Для того, чтобы запомнить формулу красной кровяной соли K3[Fe(CN)6] и не перепутать её с формулой желтой кровяной соли K4[Fe(CN)6], существует несколько мнемонических правил:
Калия гексацианоферрат что это
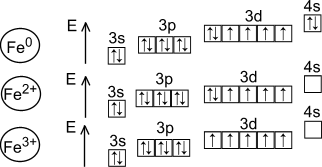
Железо – второй по распространенности элемент-металл в земной коре. На его долю приходится порядка 5,08 % по массе. Железо относится к группе переходных металлов, занимая место в 8 группе 4-го периода ПСХЭ [1]. У данного элемента идет заполнение предвнешнего d-подуровня по схеме (см. рисунок 1). Также на рисунке представлены электронные конфигурации внешних и предвнешних слоев катионов Fe2+ и Fe3+.
Рисунок 1 – электронная конфигурация предвнешнего и внешнего уровней железа
Такое электронное строение позволяет металлу активно вступать в реакции комплексообразования [1]. Одними из распространенных в химической практике соединений железа являются его комплексы с CN– (цианид-ионом), более известные как гексацианоферрат (II) калия (желтая кровяная соль) и гексацианоферрат (III) калия (красная кровяная соль). Данные комплексные частицы достаточно устойчивы: Кнест ([Fe(CN)6]4-) = 10-24 Кнест ([Fe(CN)6]3-) = 10-31 [2].
Первые упоминания пигмента «Берлинская лазурь» датируются началом 18 века. Он был получен путем добавления солей железа (II) к желтой кровяной соли с сопутствующим окислением ионов Fe2+ (см. формула 1) [3].
Также было установлено, что в результате реакции Fe2+ с красной кровяной солью образуется соединение, по цвету очень похожее на «Берлинскую лазурь» (см. формула 2). Оно получило название «Турнбулева синь» [3].
Описанные выше реакции (см. формула 1, 2) применяются в аналитической химии для качественного определения солей двух- и трехвалентного железа.
Вплоть до 20 века считалось, что «Берлинская лазурь» и «Турнбулева синь» – это два разных соединения, исходя из способов получения. Однако после измерения магнитных моментов было установлено, что в результате двух реакций (см. формула 1, 2) образуется в осадке вещество состава Fe4[Fe(CN)6]3. При добавлении в раствор красной кровяной соли ионов Fe2+ не происходит образования гипотетического соединения состава Fe3[Fe(CN)6]2, как это считалось раньше. В процессе данной реакции происходит перенос электрона от Fe2+ к [Fe(CN)6]3- (см. формула 3) [3].
Цель данной работы – выяснить и доказать наличие окислительно-восстановительного процесса в реакции, в результате которой образуется «Берлинская лазурь», при помощи изменения соотношения концентраций редокс пар Fe2+/ Fe3+ и [Fe(CN)6]4-/[Fe(CN)6]3- в системе.
Каждая редокс пара характеризуется своим стандартным электродным потенциалом (E0), измеренным относительно электрода сравнения. Электрический потенциал (E) зависит от количества электронов, участвующих в реакции; температуры; концентрации компонентов. Все виды зависимости можно изобразить в виде уравнения Нернста, которое имеет следующий вид (см. формула 4) [4]:
где Е0 – стандартный электродный потенциал; R – универсальная газовая постоянная; T – абсолютная температура окружающей среды; F – постоянная Фарадея; n – число электронов, участвующих в полуреакции; [Ox] – равновесная концентрация окисленной формы; [Red] – равновесная концентрация восстановленной формы.
В окислительно-восстановительной реакции участвуют две редокс пары. Степень протекания и направление реакции определяются разностью электродных потенциалов окислителя и восстановителя: ΔЕ=Еок-Ев. Если данная величина положительна, то реакция идет в прямом направлении, если же она отрицательна – в обратном. При нулевом значении устанавливается динамическое равновесие [4].
Степень протекания оценивается при помощи следующего выражения (см. формула 5) [4]:
где ΔЕ0 – стандартная ЭДС реакции; R – универсальная газовая постоянная; T – абсолютная температура окружающей среды; F – постоянная Фарадея; n – число электронов, участвующих в полуреакции; К – термодинамическая константа равновесия реакции.
Если разность ΔЕ больше 0,6 В, то данную ОВР можно считать практически «необратимой»: она идёт до конца и при достижении равновесия можно обнаружить только конечные продукты, независимо от начальных концентраций [4].
В конкретной задаче ox: Fe3+, [Fe(CN)6]3- ; red: Fe2+, [Fe(CN)6]4-. Используя табличные значения E0, выяснил, что E0 (Fe2+/ Fe3+) = 0,771 В и E0 ([Fe(CN)6]4-/[Fe(CN)6]3-) = 0,36 В [5].
Согласно уравнению (см. формула 3), Fe2+ – восстановитель, [Fe(CN)6]3- – окислитель. ΔЕ0=0,36–0,771=-0,411 0
Выпадение темно-синего осадка
Согласно вычисленным электродным потенциалам (Е) при помощи уравнения Нернста (см. формула 4), ни в одном случае течение реакции (см. формула 3) в прямом направлении невозможно, что и было доказано в ходе эксперимента. Из вышеизложенного можно сделать вывод, что в реакции (см. формула 3) происходит окислительно-восстановительный процесс с образованием в осадке «Берлинской лазури».
Окислительно-восстановительная реакция (см. формула 3) протекает практически мгновенно, обратную реакцию возможно осуществить в вакууме при Т = 573 К (300 оС) [3].
Данный эксперимент не ставит под сомнение использование гексацианоферрата (III) калия (красной кровяной соли) как реагента при определении ионов Fe2+, так как течение реакции (см. формула 3) возможно при концентрации Fe3+ не более 2,4*10-4 М. При смешении растворов Fe3+ и красной кровяной соли образуется осадок (см. формула 9):
Установить истинное строение «Турнбулевой сини» удалось при помощи гамма-резонансной (мёссбауэровской) спектроскопии. В данном опыте специально были получены осадки, меченные изотопом Fe57 (мёссбауэровский изотоп). В результате было установлено, что в различных цианидах железа атомы Fe (II)окружены шестью атомами углерода, а в ближайшем соседстве с атомами Fe (III)находятся только атомы азота. Это означает, что шесть цианидных ионов в красителе связаны всегда с атомами железа (II), то есть правильна формула 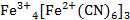
Таким образом, можно с уверенностью сказать, что при реакции солей Fe2+ с гексацианоферратом (III) калия (красной кровяной солью) образуется осадок гексацианоферрата (II) железа (III), то есть «Берлинская лазурь».