каломельный электрод для чего применяют
Каломельный электрод



Электроды сравнения и измерения
Основным электродом сравнения, как мы говорили, является водородный электрод. Однако этот электрод очень чувствителен к изменению условий среды, что сильно усложняет работу с ним. Поэтому на практике для определения потенциала некоторого электрода, этот электрод соединяют в электро химический элемент не с водородным, а с другим электродом сравнения, потенциал которого точно известен по отношению к водородному электроду. В качестве таких электродов сравнения обычно используют каломельный или хлорсеребряный электрод.
Электрод второго рода, в котором паста из ртути и каломели (Hg2Cl2) помещена в раствор КСl. Схематически каломельный электрод можно записать так:
На электроде протекает реакция
Потенциал такого электрода определяется уравнением:
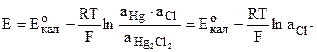
т.к. n=1; аHg=1; аHg2Cl2=1 или при 25 о С Е=0,2678-0,058.
Таким образом, каломельный электрод является электродом, обратимым по ионам хлора, в котором ионы хлора поступают от твердого хлорида ртути. Обычно применяют каломельные электроды с содержанием 0,1 н КСl или 1,0 н. Их потенциалы при 25 о С соответственно равны 0,3337; 0,2801 В.
Каломельный электрод
Потенциал каломельного электрода
Уравнение окислительно-восстановительного процесса, протекающего в каломельном электроде, имеет вид
Уравнение Нернста для него может быть записано следующим образом:
Здесь 

С учётом этого уравнение Нернста может быть записано следующим образом:
Потенциал каломельного электрода зависит, таким образом, только от температуры и активности хлорид-ионов. На практике обычно используется насыщенный раствор KCl; в этом случае потенциал насыщенного каломельного электрода зависит только от температуры и составляет 0.2412 В при 25 °C.
Достоинством насыщенных каломельных электродов является хорошая воспроизводимость потенциала. Работоспособны при температурах до 80 °C; при более высоких температурах начинается разложение каломели. Ввиду токсичности ртути, содержащейся в каломельных электродах, в настоящее время они применяются сравнительно редко.
См. также
Литература
Полезное
Смотреть что такое «Каломельный электрод» в других словарях:
каломельный электрод — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN mercury mercurous chloride electrodecalomel half cellcalomel… … Справочник технического переводчика
каломельный электрод — kalomelio elektrodas statusas T sritis chemija apibrėžtis Antrosios rūšies elektrodas. formulė Hg|Hg₂Cl₂,KCl atitikmenys: angl. calomel electrode rus. каломельный электрод … Chemijos terminų aiškinamasis žodynas
каломельный электрод — каломельный полуэлемент … Cловарь химических синонимов I
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД — электрод сравнения, изготовленный с использованием ртути Hg, каломели Hg2Cl2 и вод. р ра хлорида калия КС1. Потенциал насыщенного (по КС1) К. э при 25 0С равен 0,2412 В … Естествознание. Энциклопедический словарь
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД — см. Электроды сравнения … Химическая энциклопедия
каломельный электрод сравнения — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN calomel reference electrode … Справочник технического переводчика
ртутное дно, хлорсеребряный электрод, насыщенный каломельный электрод — – различные виды электродов сравнения. В зависимости от типа электрода сравнения изменяется потенциал пика на вольтамперограмме. Словарь по аналитической химии [3] … Химические термины
насыщенный каломельный электрод — см. ртутное дно, хлорсеребряный электрод, насыщенный каломельный электрод … Химические термины
насыщенный каломельный электрод — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999] Тематики электротехника, основные понятия EN saturated calomel electrode … Справочник технического переводчика
нормальный каломельный электрод — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999] Тематики электротехника, основные понятия EN normal calomel electrode … Справочник технического переводчика
Каломельный электроды и стеклянный электроды для приборов
Каломельный электроды и стеклянный электроды для приборов
Потенциал стеклянного электрода представляет собой разность потенциалов на обеих сторонах стеклянной мембраны. Он зависит только от активности ионов водорода в растворе и в широкой области pH не зависит от присутствия в растворе других ионов.
Преимущества стеклянного электрода таковы: наблюдаемые э.д.с., измеренные по отношению к электроду сравнения, не подвержены влиянию присутствующих окислителей или восстановителей; электрод можно применять в окрашенных, мутных или коллоидных растворах; время установления равновесного потенциала измеряется долей минуты; точные результаты могут быть получены при пользовании им в незабуференных растворах, так как ток, проходящий через цепь, крайне незначителен; измерение pH можно проводить в небольшом объеме жидкости.
Стеклянные электроды, обладающие высокой избирательностью (селективностью) по отношению к каким-либо ионам, называют электродами с электродной функцией по данному виду ионов. Изменяя состав стекла, из которого изготовляется нижняя часть электрода, получают ионоселективные солевые мембранные индикаторные электроды, избирательно реагирующие на изменение активности катионов (К+, Na+, Ag+, NH4+ и др.).
При изготовлении анионоселективных электродов в твердый материал, который запрессовывают в нижнюю часть стеклянной трубки, вводят нерастворимое соединение, содержащее ионы, которые нужно определять (F-, Cl-, Br-, I-, S2-).
11.2. Химические источники тока и электроды. Часть 2
Стеклянный электрод до известной степени аналогичен водородному электроду. В поверхностном слое стеклянной мембраны происходит замена ионов Li+ и Cs+ на ионы НзО+. Обмен ионами идет до установления некоторого равновесия, состояние которого зависит от концентрации ионов НзО+. Поэтому стеклянная мембрана функционирует как электрод, обратимый по отношению к ионам оксония.
Хранят стеклянные электроды в чистой воде. Высушенные Мембраны теряют свои свойства.
Потенциал хингидронного электрода меняется с изменением концентрации ионов НзО+ точно так же, как и потенциал водородного электрода. Воспроизводимость показаний хингидрон-ного электрода составляет ±0,01 В, а значение стандартного потенциала для 25 o C равно φ° = 0,69976 В.
Электрохимический процесс у сурьмяного электрода определяется уравнением
11.3. Измерения водородного показателя
логарифм термодинамической активности он ионов Н3О в

(11.5)
Для разбавленных водных растворов в пределах значений рН =1-14 допускают, что
рис. 283. Схемы измерений значений рН стеклянным электродом в одном сосуде (а) и в двух, объединенных солевым мостиком (б)
Значение рН определяют путем погружения в исследуемый раствор (рис. 283) одного из электродов (чаще всего стеклянный) вместе с вспомогательным каломельным или хлорсеребряным электродами (см. ниже). Электроды 2 и 3 соединяют с чувствительным милливольтметром (рН-метром) 1 со сложной электронной системой измерения напряжения между электродами.
Электронные схемы рН-метров непрерывно совершенствуются, а выпускаемые различными фирмами приборы такого типа весьма многочисленны. Описание устройств и приемов работы с ними всегда есть в паспорте прибора. Кроме того, рассмотрению электронных схем и их достоинств посвяшены специальные монографии. Поэтому в этой книге устройства рН-метров не описаны. Заметим только, что для измерения напряжения между электродами чаше всего применяют компенсационный метод с милливольтметром / в качестве нуль-инструмента.
Шкала большинства рН-метров отградуирована в единицах рН. Прибор снабжен температурным компенсатором, поскольку напряжение измерительной ячейки 5 зависит от температуры, контролируемой термометром 4. Перед работой стеклянный электрод калибруют по двум стандартным буферным растворам с точным значением рН, выбранным так, чтобы значение рН исследуемого раствора находилось между ними.
В каждый буферный раствор погружают стеклянный и каломельный электроды и соответствующей рукояткой рН-метра приводят положение стрелки прибора к значению рН буферного раствора. Температура буферного раствора Не должна отличаться от температуры исследуемого раствора. Стеклянный электрод калибруют строго перед началом работы, так как с течением времени егo потенциал изменяется. Перед очередным измерением электроды тщательно gромывают чистой водой, осторожно высушивают кусочком фильтровальной бумаги и тотчас же погружают в исследуемый раствор.
Пасту получают растиранием в ступке Hg2Cl2 и Hg в растворе КС1. После получения смеси ее промывают тем раствором хлорида калия, которым будут заполнять сосуд 3. Раствор КСl перед заполнением сосуда некоторое время взбалтывают с пастой, чтобы он был насыщен.
В ртуть 5 вводят трубку 1 (рис. 284,д) с впаянной в дно платиновой проволокой, а внутрь ее наливают немного ртути, в которую опускают медную проволоку 8, соединяющую электрод с рН-метром. Платиновая проволока 7, выступающая из трубки 1, должна быть полностью погружена в ртуть 5 на дне сосуда 3.
Чтобы приготовить такой раствор 3 г агар-агара кипятят в 100 мл чистой воды, добавив к ней 26,1 г KCI (раствор с концентрацией 3,5 моль/л).
Harpевание продолжают до тех пор, пока раствор, не станет прозрачным (отсутствие мелких пузырьков воздуха). Еще теплый раствор вводят в мостик при помоши пипетки или всасыванием через резиновую трубку. После охлаждения раствор агар-агара превращается в гель, обладающий высокой электропроводностью и достаточно прочно удерживающийся в мостике без каких-либо тампонов.
При хранении концы мостика погружают в насыщенный раствор KCI, поскольку гель у концов трубки высыхает, мостик нужно будет заполнять вновь.
При отсутствии агар-агара солевой мостик заполняют одним водным раствором KCl(3,5 моль/л). В этом случае концы мостика закрывают фильтровальной бумагой, прочно спрессованной в трубочку. Такой мостик пригоден в течение нескольких недель.
Значения стандарного (по отношению в водородному электроду) потенциала каломельного электрода при 25 °С для 0,1; 3,5 моль/л и насыщенного раствора КС1 равны соответственно 0,3356; 0,2501 и 0,2444 В.
Хлорсеребряный электрод, как и каломельный, применяют в качестве контактного в стеклянных электродах и внешнего стандартного электрода сравнения с постоянным значением электродного потенциала. Хлорсеребряный электрод дает хорошо воспроизводимые значения φ0 и довольно прост в изготовлении.
Такой слой наносят, набивая пастой Ag2O платиновую спираль диаметром 2 мм и длиной 5-7 мм. впаянную в стеклянную трубку 1 (рис. 285,6). Затем трубку помешают в тигельную печь (см. рис. 122), нагретую до 500 °С и выдерживают там 10 мин, пока паста не станет белой (Ag2O превращается в Ag). После этого электрод как анод подвергают обработке в 1 М водном растворе НС1 в течение 45 мин при силе тока 10 мА. Катодом служит платиновая проволока.
| Все вопросы, касающиеся данной модели вы можете уточнить у наших менеджеров по тел. +7 (495) 649-64-44 |
| Все вопросы, касающиеся данной модели вы можете уточнить у наших менеджеров по тел. +7 (495) 649-64-44 |