кампестерол и ситостерол выше нормы у ребенка что это
Клинико-диагностическое значение метода масс-спектрометрии микробных маркеров при рецидивирующем течении хронического фарингита
Статья посвящена применению нового метода диагностики — масс-спектрометрии микробных маркеров при хроническом фарингите (ХФ) рецидивирующего течения. Данный метод основан на количественном определении маркеров микроорганизмов: жирных кислот, альдегидов, с
The article covers the new method of diagnostics — microbial markers mass spectrometry in chronic pharyngitis (CPH) with recurrent course. This method is based on quantitative definition of microorganism markers: fatty acids, aldehydes, alcohols and sterols directly in the clinical material (throat smears) in CPH. The technology allows to define, by the level of microbial markers, concentration of 57 microorganisms in the clinical material, within 3 hours after it gets to the laboratory.
Хронический фарингит (ХФ) — социально значимая проблема: до 5% трудоспособного населения РФ и более 70% пациентов, обращающихся к оториноларингологам, страдают ХФ [1]. Жалобы на постоянные боли, першение в зеве, ощущение слизи, «комка в горле», длительный приступообразный кашель, нарушение сна беспокоят пациентов в течение многих лет. Лечение у оториноларингологов и иммунологов часто дает временный эффект, в связи с чем у лиц с ХФ значительно снижено качество жизни [2].
В настоящее время основными этиологическими факторами при ХФ являются: Streptococcus группы А, С и G, Staphylococcus spp., Streptococcus pneumoniae, Chlamydia trachomatis, Moraxella catarrhalis, Candida spp., грамотрицательные бактерии [3–5]. При обострении ХФ имеют значение вирусы (адено-, рино-, герпесвирусы).
Лечение ХФ включает местные антисептики и анестетики, иммунотерапию (Имудон, Полиоксидоний, Ликопид, лизаты бактерий, др.), по показаниям применяется системная антибактериальная терапия. Однако комплексная терапия в большом числе случаев оказывает временный эффект — рецидивирующее течение ХФ отмечается у более 40% пациентов [6].
Материалы и методы исследования
В настоящей работе впервые при ХФ рецидивирующего течения применили новый метод диагностики — масс-спектрометрию микробных маркеров (МСММ). Данный метод основан на количественном определении маркеров микроорганизмов: жирных кислот, альдегидов, спиртов и стеринов непосредственно в клиническом материале (мазке из зева) при ХФ. Технология позволяет определять по уровню микробных маркеров концентрацию 57 микроорганизмов (10 5 клеток/грамм) в клиническом материале через три часа после его поступления в лабораторию [7, 8]. По содержанию маркеров далее, с помощью математических методов, производится пересчет их уровня на количество микробных клеток на грамм биоматериала.
По результатам проведенного исследования выдается заключение в виде таблицы, включающей следующие показатели: общее содержание микроорганизмов, суммарный уровень токсинов, содержание полезного вещества — плазмалогена, наличие (или отсутствие) 57 микроорганизмов и их концентрация. Проводится сравнение показателя пациента с нормативными значениями (повышение значения более чем в 2 раза считается значимым отклонением от нормы).
В зеве при ХФ с помощью МСММ определяли следующие микроорганизмы:
Метод имеет разрешение для диагностического использования с 2010 г. (разрешение на применение новой медицинской технологии ФС № 2010/038 от 24 февраля 2010 г. выдано Федеральной службой по надзору в сфере здравоохранения и социального развития). Несмотря на большие клинические возможности МСММ, его применение в практической медицине затруднено из-за «сложности клинической трактовки результатов». В связи с этим целью настоящей работы является разработка интерпретации данных МСММ при ХФ.
МСММ позволяет оценивать суммарное содержание микроорганизмов, уровни эндотоксина, плазмалогена.
Суммарное содержание микроорганизмов значительно повышается при неблагоприятном состоянии слизистых носоглотки, в том числе при снижении местного иммунитета (при этом могут быть местно снижены: активность фагоцитов, продукция секреторного иммуноглобулина А, др.), что характерно для пациентов с ХФ, условно-патогенная микрофлора увеличивается в количестве и приобретает патогенные свойства.
Эндотоксин представляет собой липополисахарид (ЛПС), который вырабатывается в основном грамотрицательными микроорганизмами, клостридиями (C. tetani) и др., вызывает симптомы интоксикации [9].
Плазмалоген — это альдегидогенный липид, который вырабатывается кишечной микробиотой в норме: эубактериями, бифидобактериями, пропионобактериями, клостридиями (они составляют более половины колонизации кишечной стенки) [10]. Плазмалоген защищает от окисления ненасыщенные жирные кислоты, регулирует высвобождение из клеток холестерина. Максимальное его количество обнаружено в миелине нервных клеток, сердечной мышце, почках, сперме [11], в значимых — патогенных, условно-патогенных микроорганизмах (микробах, грибах, вирусах).
Клиническая характеристика пациентов
Проведено обследование 62 пациентов с ХФ (мазок из задней стенки глотки, зева, метод МСММ). Среди обследованных лиц: мужчин было 18, женщин — 44. Возраст пациентов колебался от 25 до 63 лет, средний возраст — 39,7 года.
Длительность ХФ колебалась от 4 до 29 лет, средняя продолжительность болезни составила 16,3 года. Все пациенты отмечали рецидивирующее течение ХФ, они неоднократно проходили лечение у оториноларингологов, иммунологов.
Катаральная форма ХФ отмечена у 40% лиц, атрофическая — у 10%, гиперпластическая — у 50% лиц. 80% пациентов имели лимфаденопатию шейных лимфоузлов.
Сопутствующие заболевания: у 10% больных имела место герпесвирусная инфекция (лабиальная форма), у 5% лиц — хроническая Эпштейна–Барр-вирусная инфекция (перенесли инфекционный мононуклеоз, в крови отмечался повышенный уровень IgG к капсидному, ядерному антигенам вируса Эпштейна–Барр, на момент исследования в зеве методом полимеразной цепной реакции — вирус Эпштейна–Барр не выявлялся), у 70% — хронический тонзиллит (из них 20% имели гиперплазию миндалин), 20% лиц перенесли тонзилэктомию, частые острые респираторные вирусные инфекции — 25% лиц, у 20% — хронический синусит, у 10% — хронический гайморит, 5% имели хронический стоматит (рецидивирующее течение). В обследованную группу не включены пациенты с системными заболеваниями (которые могут возникать при осложненном течении ХФ, хронического тонзиллита). У большей части обследованных имели место несколько сопутствующих заболеваний.
Все пациенты с ХФ в период проведения обследования МСММ имели жалобы на боль, першение в горле, стекание слизи по задней стенке глотки.
Результаты и обсуждение
У обследованных пациентов (n = 62) определяли следующие показатели:
1. Определяли суммарное содержание микроорганизмов (рис. 1) в мазке из зева методом МСММ. Как следует из рис., у 85% пациентов данный показатель увеличен:
2. Оценивали уровень эндотоксина. Как следует из рис. 2, у 87% пациентов с ХФ увеличено содержание эндотоксина в мазке из зева:
3. Определяли количество плазмалогена у пациентов с ХФ (рис. 3). Как следует из полученных результатов, продукция плазмалогена снижена у 71% пациентов с ХФ:
4. Проведено выявление в зеве у лиц с рецидивирующим течением ХФ методом масс-спектрометрии микроорганизмов, которые в норме не встречаются или встречаются в количествах до 80 × 10 5 клеток на 1 грамм. К ним относятся:
На рис. 4 представлены частота встречаемости данных микроорганизмов (в виде процента лиц с повышенным содержанием данных микроорганизмов) и степень их повышения.
5. Проведено определение содержания маркеров условно-патогенных микроорганизмов, которые в зеве в норме встречаются в достаточно большом количестве (от 100 до 900 × 10 5 на 1 грамм). У лиц с ХФ их уровень значительно увеличивается (рис. 5) [12, 13]. Как следует из рис. 5, основными микроорганизмами из данной группы при ХФ являются: Streptococcus spp., Staphylococcus aureus, Bacteroides fragilis, Clostridium spp. (группа C. tetani), Eubacterium spp., Eggerthella lenta, Nocardia spp.
6. Проведена оценка уровня вирусов группы герпеса — цитомегаловируса и герпеса (рис. 6, 7).
По результатам анализа (рис. 6) было установлено, что содержание маркеров цитомегаловируса (метод МСММ) превышает норму у 79% пациентов:
У пациентов с ХФ наблюдается увеличение уровня Herpes spp. (рис. 7). Повышение содержания маркеров герпеса обнаружено у 45% пациентов с ХФ:
Показатель вируса Эпштейна-Барр превышен у 8% пациентов с ХФ по сравнению с нормой.
7. Определяли содержание грибковых маркеров в зеве при ХФ: Aspergillus spp., Candida spp., кампестерол, ситостерол (микроскопические грибы).
Повышение уровня грибковых маркеров Aspergillus spp. обнаружено у 47% пациентов:
Повышение уровня Candida spp. выявлено у 45% пациентов:
8. Выявлена общая закономерность у всех обследованных пациентов с рецидивирующим течением ХФ (n = 62):
8.1. Повышено содержание грамотрицательных бактерий (Kingella spp. и др.), в связи с этим можно предположить, что пациенты с ХФ находятся в группе повышенного риска развития осложненного течения уже имеющихся инфекционно-воспалительных процессов [14] в урогенитальной области, появления урогенитальных заболеваний при наследственной предрасположенности, неблагоприятных условиях (переохлаждение, дисфункции яичников, риск заболеваний, передающихся половым путем, др.).
8.2. Увеличено содержание кампилобактера (это микроорганизм, который встречается при заболеваниях желудка, при гастроэзофагальных нарушениях), данное наблюдение подтверждают описанные в литературе данные о том, что в патогенезе рецидивирующего ХФ имеют значение хронические гастриты и «гастроэзофагальные нарушения» [15].
Заключение и выводы
1. Метод масс-спектрометрии микробных маркеров (57 микроорганизмов) в мазке из зева у пациентов с рецидивирующим течением ХФ может быть рекомендован как дополнительный к основным методам диагностики (посевы, полимеразная цепная реакция из зева) в сложных клинических случаях и при неэффективности терапии.
2. Новыми критериями эффективности терапии при ХФ может являться нормализация:
3. При анализе результатов МСММ из зева при ХФ клиническое значение имеет:
4. Новый метод диагностики МСММ позволяет разработать более эффективную терапию при ХФ у конкретного пациента с учетом возможности выявления «микст-микрофлоры»: бактериальной (патогенной, условно-патогенной — в большом количестве), грибковой, вирусной в одном исследовании из одного образца в течение 3 часов.
5. Учитывая, что у всех пациентов с рецидивирующим течением ХФ увеличен уровень маркеров кампилобактера и грамотрицательных микроорганизмов, рекомендуется проведение:
6. Тактика лечения пациентов с рецидивирующей формой ХФ, прошедших обследование — масс-спектрометрию по 57 микробным маркерам, при выявлении «микст-инфекции» основывается, в зависимости от полученных результатов, на применении:
Литература
* ФГБОУ ВО ОГУ им. И. С. Тургенева, Орел
** ГБУЗ МО МОНИКИ им. М. Ф. Владимирского, Москва
*** ФГБОУ ВО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
**** ГК Медицинский центр «XXI век», Москва
Клинико-диагностическое значение метода масс-спектрометрии микробных маркеров при рецидивирующем течении хронического фарингита/ И. А. Снимщикова, Б. В. Агафонов, А. В. Симонова, В. В. Пчелякова, А. В. Гострый
Для цитирования: Лечащий врач № 7/2018; Номера страниц в выпуске: 58-62
Теги: боль в горле, першение, кашель, воспаление
Современные представления о грибковой патологии пищеварительного тракта
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже известные варианты болезни и описываются редкие и новые нозологические формы.
Грибы, являясь нормальными комменсалами желудочно-кишечного тракта (ЖКТ), становятся патогенными при определенных условиях. Это касается в основном дрожжеподобных грибов Candida spp., виды и даже штаммы которых различаются по факторам агрессии, способности к адгезии и инвазии [15].
Candida albicans — наиболее частый возбудитель кандидоза ЖКТ. Однако в последние годы большую роль играют Candida non-albicans (C. krusei, C. tropicalis, C. kefyr, C. glabrata, C. parapsilosis); у лиц с иммунодефицитом их пропорция составляет более 50%, при «относительно нормальном» иммунитете — 15%.
Дрожжеподобный гриб Cryptococcus neoformans в патологии ЖКТ как этиологический фактор играет незначительную роль. Он чаще поражает нервную систему и, диссеминируя из первичного очага, вовлекает гастроинтестинальный тракт. Описаны единичные случаи (чаще посмертно) криптококкового эзофагита, стоматита, терминального илеита, колита, холецистита, панкреатита. Как правило, они относились к ВИЧ-серопозитивным больным, а также к пациентам, страдающим гипергаммаглобулинемией Е с рецидивирующими абсцессами печени и перианальной зоны.
Грибы Aspergillus spp. редко вызывают болезнь ЖКТ, только в случаях стойкой нейтропении, кахексии и при других отягощающих состояниях.
Грибы класса Zygomycetes могут привести к развитию интестинального зигомикоза, который, как правило, ассоциирован с амебиазом, голоданием, диабетическим кетоацидозом, почечным гемодиализом. Penicillium spp. и Geotrichum поражают ЖКТ также редко.
ЖКТ покрыт слизистой оболочкой, состоящей из двух компонентов — поверхностного скользкого, слизистого слоя, по которому микроорганизмы легко продвигаются вдоль всего ЖКТ, и более глубокого плотного гликопротеинового слоя с остатками сиаловой кислоты, который формирует физиологический барьер. Адгезия и последующая инвазия грибов через этот плотный слой возможны только благодаря продукции грибами протеолитических «ферментов инвазии»: коагулазы, каталазы, козеиназы, фосфолипазы, а также фибриллярных протеиновых комплексов и эндотоксинов [15].
При физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, а с другой — факторы патогенности грибов.
Устойчивость организма зависит от принадлежности к группам риска и состояния иммунной системы.
Перечислим факторы риска развития грибковых инфекций ЖКТ.
Важным компонентом защиты от инвазии ЖКТ является иммунная система, ассоциированная с кишечником. Клеточная часть этой системы включает в себя интраэпителиальные лимфоциты, которые препятствуют дисперсии возбудителя через lamina propria и агрегации в пейеровых бляшках. В-лимфоциты кишечника участвуют в продукции секреторных IgA и IgM, которые уменьшают способность грибов к адгезии.
Т-клетки здорового организма продуцируют защитный интерферон, усиливают фагоцитоз, активируют Т-цитотоксические лимфоциты. СД4 и СД8 укрепляют местный иммунитет в ЖКТ. Причем оказалось, что цитотоксичность СД8 играет более существенную роль в предотвращении заболевания, чем предполагали раньше.
В защите важны также макрофагальный и нейтрофильный фагоцитоз, препятствующие диссеминации грибковой, особенно кандидозной инфекции.
У ВИЧ-пациентов и больных с нейтропенией, у которых фагоцитоз резко подавлен, местная инвазия и диссеминация инфекции наступают очень быстро. Известно, что нейтрофилы хотя и не могут полностью защитить слизистую оболочку ЖКТ от «атаки» грибов, но благодаря собственной «киллерной» субстанции через специфический механизм запускают активацию комплемента, который усиливает фагоцитоз. Следует отметить, что фагоцитоз особенно важен при кандидозной инфекции, но «не работает» в тканях против капсулированных криптококков и большинства мицелиальных грибов.
Облигатные микроорганизмы желудка и кишечника (аэробные лактобациллы, анаэробные бифидум-бактерии, нормальная кишечная палочка и др.) также играют защитную роль. Применение антибиотиков убивает, наряду с патогенными, и эти «полезные» бактерии, открывая на слизистой оболочке рецепторы адгезии для грибов [2].
Нельзя не упомянуть также о Helicobacter pylori, который довольно часто обитает в желудке, вызывает гастрит, язвенную болезнь, а иногда оказывает канцерогенное воздействие. В свою очередь, лечение хеликобактериоза антибиотиками приводит к активации грибов Candida и кандидозу желудка [1]. Ассоциации грибов с Helicobacter pylori и другими бактериями в ЖКТ встречаются нередко, что требует продуманного адекватного подхода к тактике лечения.
В желудке могут также присутствовать Saccharomyces cerevisiae и некоторые виды Candida, способные сбраживать и ферментировать до винного спирта сахара, попадающие с пищей в желудок. Этот феномен называется синдромом «пивоваренного завода» [14].
Вирулентность грибов, патогенные факторы, как и полисахариды (маннаны), плазмокоагулаза, эндотоксины, липиды, глюкоконъюгаты, влияют на развитие заболевания. Даже от внутривидовых способностей грибов зависит, разовьются ли в каждом конкретном случае кандиданосительство или болезнь [13]. Например, серотип В Candida albicans считается более вирулентным и наиболее распространенным возбудителем орофарингеального кандидоза у ВИЧ-инфицированных больных, также он поражает генитоуринарную систему и нередко выделяется из зева у гомосексуалистов.
Диагностика
Тщательное изучение анамнеза, выявление факторов риска, хронических заболеваний ЖКТ, патогномоничных клинических симптомов играют большую роль в своевременности установления диагноза.
В последние годы за счет эндоскопических технологий расширились возможности диагностики грибкового эзофагита и гастрита. При эзофагогастродуоденоскопии обращают внимание на гиперемию и изъязвления слизистой, наличие белых налетов и «пленок», сужение просвета пищевода, скопление слизи. Во время этой процедуры в обязательном порядке следует брать материал для микробиологического исследования, так как не всегда этиология этих проявлений грибковая. Причем информативность исследования налетов выше, чем биоптатов (95% по сравнению с 39%).
Особенно перспективны видеоинформационные эндоскопические исследования с цифровой регистрацией и анализом изображения. Четкое разграничение неизмененных и патологических тканей, анализ гистохимических процессов в слизистой оболочке пищеварительного тракта возможны с помощью эндоскопической спектроскопии и флюоресцентной эндоскопии. Видео- и колоноскопия, хромоэндоскопия на фоне «лекарственного» сна по технологии «Диантек» имеют высокое качество исследования, безболезненность манипуляций и отсутствие стресса и страха у пациентов.
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить трехмерное изображение, магнитно-резонансное исследование — имеют большое будущее [3].
Изучение гастродуоденальной моторики с помощью сцинтиграфии и электрогастрографии также важно для диагностики и назначения дополнительных лекарственных средств, так как нарушение двигательной функции желудка, «застой» в ЖКТ создают условия для размножения грибов и бактерий. Колоноскопия дает возможность оценить состояние слизистой кишечника, наличие белого налета, язвенных дефектов и т. д. В перспективе в гастроэнтерологии будут внедряться методы, в основе которых лежат новые научно-практические исследования: иммуноферментный анализ фекальных антигенов, ПЦР и даже генетическое тестирование [3].
Еще одним достаточно информативным методом в гастроэнтерологии является рентгенография пищевода, желудка и кишечника. Она дает возможность выявить дефекты наполнения (депо бария), изъязвления, деформацию, конвергенцию складок, изменения контуров и глубины перистальтики, сужение или расширение пищеводной трубки. С помощью рентгенографии желудка можно оценить его моторику, своевременность эвакуации пищевого комка, что важно для понимания патогенеза заболевания.
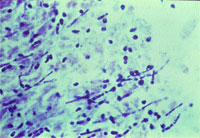 |
| Рисунок 1. Кандидозный эзофагит. Почкующиеся клетки и псевдогифы грибов Candida albicans на эзофагеальной язве |
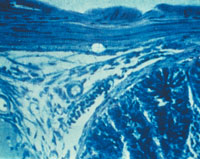 |
| Рисунок 2. Кандидозный энтерит. Утолщенные ворсинки и дефект слизистой тонкой кишки; псевдогифы грибов Candida |
Лабораторное подтверждение грибкового заболевания ЖКТ возможно при микроскопировании и/или культуральном исследовании смывов со слизистых оболочек полости рта и пищевода, содержимого желудка и кишечника, патологических «пленок», налетов и др. Количественная оценка грибов в биосубстратах должна проводиться в сопоставлении с клинической симптоматикой, с учетом наличия фоновых заболеваний, микст-инфекции и т. д. Например, обнаружение на слизистых единичных колоний Candida не является основанием для постановки диагноза «кандидоз» у иммунокомпетентных пациентов.
В кале диагностическую значимость приобретает количество колоний (более 10 5 –10 6 ). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, так как это является одним из лабораторных признаков, подтверждающих диагноз кандидоза.
Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому–Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ (рис. 1, 2).
Кандидоз
Это наиболее распространенная грибковая оппортунистическая висцеральная патология. Агрессивные свойства грибов Candidа проявляются в их способности через стадию адгезии и инвазии поражать слизистые оболочки любых органов, в том числе и ЖКТ. Причем «атаке» подвергается чаще всего многослойный плоский эпителий полости рта и пищевода, реже — однослойный цилиндрический эпителий кишечника. Поэтому, как правило, в верхних отделах ЖКТ происходит инвазия грибов Candidа, а в отделах, расположенных ниже желудка, — колонизация. В то же время в кишечнике даже на стадии адгезии могут наблюдаться клинические симптомы — проявления неинвазивного кандидоза [10].
Язвенные дефекты пищевода, желудка и кишечника поддерживают грибковую колонизацию вплоть до инвазии. Желудочно-кишечный кандидоз нередко приводит к кандидемии.
Классификация кандидоза
I. Орофарингеальный кандидоз.
II. Кандидозный эзофагит.
III. Кандидоз желудка.
V. Кандидозный проктосигмоидит.
VI. Перианальный кандидоз.
VII. Секреторная диарея, ассоциированная с кандидозом.
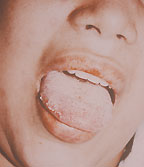 |
| Рисунок 3. Кандидозный глоссит. Типичные белые налеты и эрозии на воспаленной инфильтрированной слизистой |
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная занимает 1-е место (рис. 3).
О кандидозе полости рта упоминал еще Гиппократ, а впервые описал его хирург Лангенберк в 1839 г.
Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам.
В дальнейшем недостаточная секреция IgA и постепенное снижение антимикробного иммунитета, переданного от матери, приводят к высокой заболеваемости. Патогномоничный синдром — белые творожистые налеты на слизистой полости рта, так называемая «молочница» [16].
Кандидоз ассоциирован также с ношением протезов. При этом развивается атрофический кандидоз, огромное количество грибов скапливается в щечных складках на фоне красного точечного воспаления слизистой; инвазия, как правило, отсутствует.
Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации — до 4%, при диссеминированном карциноматозе — от 2,8 до 6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при «сплошных» исследованиях населения в 1–7% случаев [5, 17]. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют четыре типа — от легкого отека, гиперемии, единичных белых налетов
С. А. Бурова, доктор медицинских наук, профессор
Национальная академия микологии, ГКБ № 81, Москва
.gif)
.gif)
.gif)
.gif)
_575.gif)