кардиодепрессивный эффект что это
Бета-адреноблокаторы III поколения в лечении сердечно-сосудистых заболеваний
Современную кардиологию невозможно представить без препаратов группы бета-адреноблокаторов, которых в настоящее время известно более 30 наименований.
Современную кардиологию невозможно представить без препаратов группы бета-адреноблокаторов, которых в настоящее время известно более 30 наименований. Необходимость включения бета-адреноблокаторов в программу лечения сердечно-сосудистых заболеваний (ССЗ) очевидна: за последние 50 лет кардиологической клинической практики бета-адреноблокаторы заняли прочные позиции в профилактике осложнений и в фармакотерапии артериальной гипертонии (АГ), ишемической болезни сердца (ИБС), хронической сердечной недостаточности (ХСН), метаболическом синдроме (МС), а также при некоторых формах тахиаритмий. Традиционно в неосложненных случаях медикаментозное лечение АГ начинают с бета-адреноблокаторов и диуретиков, снижающих риск развития инфаркта миокарда (ИМ), нарушения мозгового кровообращения и внезапной кардиогенной смерти.
Концепция опосредованного действия лекарственных средств через рецепторы тканей различных органов была предложена N.?Langly в 1905 г., а в 1906 г. H.?Dale подтвердил ее в практике.
В 90-е годы было установлено, что бета-адренорецепторы подразделяются на три подтипа:
Способность блокировать влияние медиаторов на бета1-адренорецепторы миокарда и ослабление влияния катехоламинов на мембранную аденилатциклазу кардиомиоцитов с уменьшением образования циклического аденозинмонофосфата (цАМФ) определяют основные кардиотерапевтические эффекты бета-адреноблокаторов.
Антиишемический эффект бета-адреноблокаторов объясняется снижением потребности миокарда в кислороде, вследствие уменьшения частоты сердечных сокращений (ЧСС) и силы сердечных сокращений, возникающих при блокировании бета-адренорецепторов миокарда.
Бета-блокаторы одновременно обеспечивают улучшение перфузии миокарда за счет уменьшения конечного диастолического давления в левом желудочке (ЛЖ) и увеличения градиента давления, определяющего коронарную перфузию во время диастолы, длительность которой увеличивается в результате урежения ритма сердечной деятельности.
Антиаритмическое действие бета-адреноблокаторов, основанное на их способности уменьшать адренергическое влияние на сердце, приводит к:
Бета-адреноблокаторы повышают порог возникновения фибрилляции желудочков у больных острым ИМ и могут рассматриваться как средства профилактики фатальных аритмий в остром периоде ИМ.
Гипотензивное действие бета-адреноблокаторов обусловлено:
Препараты из группы бета-адреноблокаторов отличаются по наличию или отсутствию кардиоселективности, внутренней симпатической активности, мембраностабилизирующим, вазодилятирующим свойствам, растворимости в липидах и воде, влиянию на агрегацию тромбоцитов, а также по продолжительности действия.
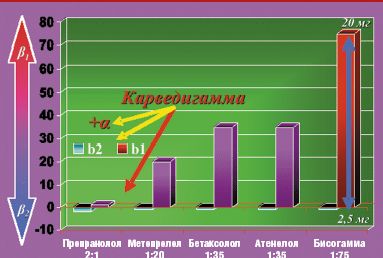
Влияние на бета2-адренорецепторы определяет значительную часть побочных эффектов и противопоказаний к их применению (бронхоспазм, сужение периферических сосудов). Особенностью кардиоселективных бета-адреноблокаторов по сравнению с неселективными является большое сродство к бета1-рецепторам сердца, чем к бета2-адренорецепторам. Поэтому при использовании в небольших и средних дозах эти препараты оказывают менее выраженное влияние на гладкую мускулатуру бронхов и периферических артерий. Следует учитывать, что степень кардиоселективности неодинакова у различных препаратов. Индекс ci/бета1 к ci/бета2, характеризующий степень кардиоселективности, составляет 1,8:1 для неселективного пропранолола, 1:35 — для атенолола и бетаксолола, 1:20 — для метопролола, 1:75 — для бисопролола (Бисогамма). Однако следует помнить, что селективность дозозависима, она снижается с повышением дозы препарата (рис. 1).
В настоящее время клиницисты выделяют три поколения препаратов с бета-блокирующим эффектом.
I поколение — неселективные бета1- и бета2-адреноблокаторы (пропранолол, надолол), которые наряду с отрицательными ино-, хроно- и дромотропными эффектами обладают способностью повышать тонус гладкой мускулатуры бронхов, сосудистой стенки, миометрия, что существенно ограничивает их использование в клинической практике.
II поколение — кардиоселективные бета1-адреноблокаторы (метопролол, бисопролол), благодаря высокой селективности в отношении бета1-адренорецепторов миокарда обладают более благоприятной переносимостью при длительном применении и убедительной доказательной базой долгосрочного прогноза жизни при лечении АГ, ИБС и ХСН.
В середине 1980-х годов на мировом фармацевтическом рынке появились бета-адреноблокаторы III поколения с низкой селективностью к бета1, 2-адренорецепторам, но с сочетанной блокадой альфа-адренорецепторов.
Препараты III поколения — целипролол, буциндолол, карведилол (его дженерический аналог с брендовым названием Карведигамма®) обладают дополнительными вазодилятирующими свойствами за счет блокады альфа-адренорецепторов, без внутренней симпатомиметической активности.
В 1982–1983 годах в научной медицинской литературе появились первые сообщения о клиническом опыте применения карведилола при лечении ССЗ.
Ряд авторов выявили протективное действие бета-адреноблокаторов III поколения на клеточные мембраны. Это объясняется, во-первых, ингибированием процессов перекисного окисления липидов (ПОЛ) мембран и антиоксидантным действием бета-блокаторов и, во-вторых, снижением влияния катехоламинов на бета-рецепторы. Некоторые авторы связывают мембранстабилизирующее действие бета-блокаторов с изменением проводимости натрия через них и ингибированием ПОЛ.
Указанные дополнительные свойства расширяют перспективы применения данных лекарственных средств, поскольку нивелируют характерное для первых двух поколений отрицательное влияние на сократительную функцию миокарда, углеводный и липидный обмен и в то же время обеспечивают улучшение перфузии тканей, позитивное влияние на показатели гемостаза и уровень оксидативных процессов в организме.
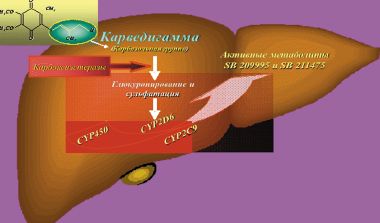
Карведилол метаболизируется в печени (глюкуронирование и сульфатация) с помощью ферментной системы цитохрома Р450, с использованием семейства ферментов — CYP2D6 и CYP2C9. Антиоксидантное действие карведилола и его метаболитов обусловлено наличием в молекулах карбазольной группы (рис. 2).
Метаболиты карведилола — SB 211475, SB 209995 угнетают ПОЛ в 40–100 раз активнее, чем сам препарат, а витамин Е — примерно в 1000 раз.
Применение карведилола (Карведигаммы®) при лечении ИБС
Согласно результатам целого ряда завершенных многоцентровых исследований, бета-адреноблокаторы оказывают выраженный антиишемический эффект. Необходимо отметить, что антиишемическая активность бета-адреноблокаторов соизмерима с активностью антагонистов кальция и нитратов, но, в отличие от этих групп, бета-адреноблокаторы не только улучшают качество, но и увеличивают продолжительность жизни пациентов с ИБС. Согласно результатам метаанализа 27 многоцентровых исследований, в которых приняло участие более 27 тыс. человек, селективные бета-адреноблокаторы без внутренней симпатомиметической активности у больных с острым коронарным синдромом в анамнезе снижают риск развития повторного ИМ и смертность от инфаркта на 20% [1].
Однако не только селективные бета-адреноблокаторы положительно влияют на характер течения и прогноз у пациентов с ИБС. Неселективный бета-адреноблокатор карведилол также продемонстрировал очень хорошую эффективность у больных со стабильной стенокардией. Высокая антиишемическая эффективность данного препарата объясняется наличием дополнительной альфа1-блокирующей активности, способствующей дилятации коронарных сосудов и коллатералей постстенотической области, а значит — улучшению перфузии миокарда. Кроме того, карведилол обладает доказанным антиоксидантным эффектом, связанным с захватом свободных радикалов, высвобождающихся в период ишемии, что обусловливает его дополнительное кардиопротекторное действие. Одновременно карведилол блокирует апоптоз (программируемая смерть) кардиомиоцитов в зоне ишемии, сохраняя объем функционирующего миокарда. Как было показано, метаболит карведилола (ВМ 910228) обладает меньшим бета-блокирующим эффектом, но является активным антиоксидантом, блокируя перекисное окисление липидов, «отлавливая» активные свободные радикалы OH–. Этот дериват сохраняет инотропный ответ кардиомиоцитов на Ca++, внутриклеточная концентрация которого в кардиомиоците регулируется Ca++-насосом саркоплазматического ретикулума. Поэтому карведилол оказывается более эффективным в лечении ишемии миокарда через ингибирование повреждающего действия свободных радикалов на липиды мембран субклеточных структур кардиомиоцитов [2].
Благодаря этим уникальным фармакологическим свойствам, карведилол может превосходить традиционные бета1-селективные адреноблокаторы в плане улучшения перфузии миокарда и способствовать сохранению систолической функции у больных ИБС. Как показано Das Gupta et al., у больных с дисфункцией ЛЖ и сердечной недостаточностью, развившейся вследствие ИБС, монотерапия карведилолом снижала давление наполнения, а также увеличивала фракцию выброса (ФВ) ЛЖ и улучшала показатели гемодинамики, при этом не сопровождаясь развитием брадикардии [3].
Согласно результатам клинических исследований у больных хронической стабильной стенокардией, карведилол снижает ЧСС в покое и при физической нагрузке, а также увеличивает ФВ в покое. Сравнительное исследование карведилола и верапамила, в котором принимало участие 313 пациентов, показало, что, по сравнению с верапамилом, карведилол в большей степени уменьшает ЧСС, систолическое АД и произведение ЧСС ´ АД при максимально переносимой физической нагрузке. Более того, карведилол обладает более благоприятным профилем переносимости [4].
Важно, что карведилол, по-видимому, более эффективен при лечении стенокардии, чем обычные бета1-адреноблокаторы. Так, в ходе 3-месячного рандомизированного многоцентрового двойного слепого исследования карведилол напрямую сравнивали с метопрололом у 364 пациентов со стабильной хронической стенокардией. Они принимали карведилол по 25–50 мг два раза в сутки или метопролол по 50–100 мг два раза в сутки [5]. В то время как оба препарата продемонстрировали хорошее антиангинальное и противоишемическое действие, карведилол более значительно увеличивал время до депрессии сегмента ST на 1 мм при физической нагрузке, чем метопролол. Переносимость карведилола была очень хорошей, и, что важно, при увеличении дозы карведилола не произошло заметных изменений типов нежелательных явлений.
Примечательно, что карведилол, не обладающий, в отличие от других бета-адреноблокаторов, кардиодепрессивным действием, улучшает качество и продолжительность жизни пациентов с острым ИМ (CHAPS) [6] и постинфарктной ишемической дисфункцией ЛЖ (CAPRICORN) [7]. Многообещающие данные были получены в ходе исследования Carvedilol Heart Attack Pilot Study (CHAPS) — пилотного исследования влияния карведилола на развитие ИМ. Это было первое рандомизированное исследование, в котором сравнивали карведилол с плацебо у 151 больного после острого ИМ. Лечение начинали в течение 24 часов с момента появления болей в грудной клетке, а дозу препарата увеличивали до 25 мг два раза в сутки. Главными конечными точками исследования были функция ЛЖ и безопасность препарата. Больных наблюдали в течение 6 месяцев с момента начала заболевания. Согласно полученным данным, частота развития серьезных кардиальных событий уменьшилась на 49%.
Полученные в ходе исследования CHAPS эхографические данные 49 пациентов со сниженной ФВ ЛЖ (
А. М. Шилов*, доктор медицинских наук, профессор
М. В. Мельник*, доктор медицинских наук, профессор
А. Ш. Авшалумов**
*ММА им. И. М. Сеченова, Москва
**Клиника Московского института кибернетической медицины, Москва
Кардиодепрессия при тяжелом остром панкреатите: механизмы развития и возможные подходы к лечению. Обзор литературы
Для корреспонденции: Андреенков Вячеслав Сергеевич — ординатор, Институт высшего и дополнительного профессионального образования, Москва; e-mail: slav-and@yandex.ru
Для цитирования: Ершов А.В., Андреенков В.С., Манасова З.Ш. Кардиодепрессия при тяжелом остром панкреатите: механизмы развития и возможные подходы к лечению. Обзор литературы. Вестник интенсивной терапии им. А.И. Салтанова. 2020;1:66–74. DOI: 10.21320/1818-474X-2020-1-66-74
Реферат
Кардиодепрессия, известная также как миокардиальная депрессия, является одним из характерных осложнений тяжелого острого панкреатита. В обзоре изложены современные взгляды на механизм развития этого феномена; обсуждено место термина «фактор депрессии миокарда» на текущей стадии изучения этой проблемы; выявлены патогенетические факторы миокардиальной депрессии, требующие дальнейшего изучения. Была предпринята попытка рассмотреть кардиодепрессию как явление, вовлекающее целостную сердечно-сосудистую систему, а не только сердце. Каждый патогенетический фактор рассмотрен с точки зрения значимости в прогрессировании заболевания и возможности его коррекции.
Ключевые слова: острый панкреатит, миокард, гемодинамика, шок, цитокины, трипсин, гиповолемия, электролиты
Поступила: 28.11.2019
Принята к печати: 02.03.2020
Острый панкреатит (ОП) — заболевание, характеризующееся одновременно высокой заболеваемостью (34 случая заболевания на 100 000 населения в год) и летальностью (15 % в группе тяжелого панкреатита) [1, 2]. Причины смерти при тяжелом ОП комплексные: развитие синдрома системной воспалительной реакции, коагулопатии, шока и в итоге — полиорганной недостаточности. Ключевым фактором развития полиорганной недостаточности являются нарушения сердечно-сосудистой системы, в том числе миокардиальная депрессия (МД) [3]. Этот феномен может стать одной из мишеней лечения шока, что требует детального изучения патогенетических факторов МД при ОП.
История изучения феномена: «фактор депрессии миокарда»
Характерный для ОП феномен угнетения сократительной и метаболической активности миокарда, известный также как кардиодепрессия (КД) или МД, вызвал пристальное внимание в начале 80-х гг. прошлого века [4–6]. Однако, несмотря на многочисленные исследования этой проблемы, единой концепции патогенеза нарушения сократимости миокарда при ОП в настоящее время не разработано [3]. Первые крупные исследования, посвященные этой проблеме, объединяли патогенетические факторы, воздействующие на миокард под общим термином «фактор депрессии миокарда» [6].
Термин «фактор депрессии миокарда» был введен в 1947 г. и первоначально был применен к геморрагическому шоку [7]. Более поздние исследования ссылаются на него при объяснении причин КД при сепсисе, ОП и ряде других заболеваний [3]. Обычно под этим названием кроется субстанция, циркулирующая в крови и вызывающая КД при действии на миокард [3, 8]. Несмотря на длительный период изучения, структура этого вещества или смеси веществ остается неизвестной, а точки приложения его неясны [9–11].
Вопрос о том, что может скрываться под этим «фактором», заслуживает отдельной дискуссии. Известно, что этот «фактор» циркулирует в крови при ряде критических состояний. Это подтверждается тем, что плазма крови больного животного, перелитая здоровому, вызывает у последнего МД [6]. В связи с этим маловероятно, что нарушения автономной нервной системы, гиповолемия и интраабдоминальная гипертензия являются этим фактором. Известно также, что «фактор миокардиальной депрессии» имеет высокую биологическую активность даже в минимальных дозах [8], что делает электролитные нарушения не подходящими под это определение.
На наш взгляд, под таким названием может скрываться уже известное соединение. Исходя из описания, «фактором депрессии миокарда», выделяющимся в результате ОП, могут быть те же соединения, которые циркулируют в крови при сепсисе: цитокины или бактериальные эндотоксины [7]. При этом не исключена роль ряда других соединений, ответственных за КД при сепсисе [12]. Дополнительной субстанцией, подходящей под описание «фактора депрессии миокарда» при ОП, являются панкреатогенные ферменты [3].
Цитокины и бактериальные эндотоксины: острый панкреатит и сепсис
Действие на миокард цитокинов является наиболее изученным патогенетическим фактором МД. В ответ на ферментативное повреждение поджелудочной железы активируется секреция иммунными клетками провоспалительных цитокинов [13]. При выходе их в системный кровоток происходит как прямое, так и опосредованное повреждение миокарда.
Прямое действие циркулирующих в плазме цитокинов на миокард хорошо изучено. Однако большинство исследований в этой области относится к модели сепсиса, что не позволяет полностью перенести их результаты на ОП. Вместе с тем сепсис и тяжелый ОП имеют ряд общих звеньев патогенеза и похожий профиль гемодинамических нарушений [3], из чего логично предположить, что цитокины могут иметь сходное действие на миокард при этих двух заболеваниях. Поэтому далее речь пойдет об опосредованной цитокинами КД не только при ОП, но и при сепсисе.
Данные о действии цитокинов на миокард при сепсисе противоречивы. В результате ряда исследований было показано, что провоспалительные цитокины могут вызывать гемодинамические нарушения. Фактор некроза опухоли альфа и интерлейкин-1, являясь центральным звеном в активации системного воспаления, вызывают значительные гемодинамические нарушения в модели сепсиса. Ряд исследований подтверждает роль интерлейкинов в МД при сепсисе [9, 12]. Одно из исследований гемодинамических показателей при тяжелом ОП подтверждает гипотезу о действии цитокинов на миокард при сепсисе и тяжелом ОП: концентрация интерлейкина-6 по его результатам имеет корреляцию с гемодинамическими нарушениями при деструктивном панкреатите [3]. Удаление из плазмы цитокинов при ОП путем гемосорбции в результате ряда экспериментов приводило к быстрому улучшению состояния пациента и стабилизации гемодинамики [14–17], что может свидетельствовать об их важной роли в патогенезе КД.
Группой исследователей предположено, что действие цитокинов на миокард должно приводить к диастолической дисфункции сердца [18]. Профиль нарушений функции миокарда при ОП подтверждает высказанное предположение [18–19]. Таким образом, последствия выделения в системный кровоток цитокинов на миокард требуют дальнейшего изучения.
Опосредованное цитокинами системное воспаление обладает непрямым повреждающим действием на миокард, реализующимся через несколько механизмов. Так, в ответ на системное воспаление при ОП ряд цитокинов вырабатывается в самом миокарде, что вызывает его дегенеративные и воспалительные изменения [20, 22]. Другим механизмом опосредованной КД является действие цитокинов на эндотелий сосудов. В одном из исследований показано, что в результате такого воздействия развивается диффузное нарушение микроциркуляции [23], что также может оказывать кардиодепрессивный эффект.
Системное воспаление приводит также к ряду изменений системы гемостаза: активации свертывающей и нарушению работы противосвертывающей системы крови, торможению фибринолиза и повышенной агрегации тромбоцитов [24, 25]. Результатом этого является гиперкоагуляция, которая может вызывать тромбоз коронарных артерий [26]. С целью коррекции микроциркуляторных нарушений и профилактики тромбозов при тяжелом ОП рядом авторов предложено использование препаратов гепарина. Проведенные исследования этого метода лечения подтверждают его эффективность, что связывают с улучшением микроциркуляции за счет профилактики образования микротромбов и противовоспалительным действием гепарина [24, 26–29].
На выделении цитокинов сходство сепсиса и тяжелого ОП не заканчивается. В результате ОП происходит нарушение барьерной функции кишечника. Это приводит к попаданию в кровь бактериальных эндотоксинов [30–32], что является одним из общих патогенетических факторов развития этих состояний. Вероятно, механизм действия эндотоксинов при ОП также сходен с таковым при сепсисе: эндотоксины, действуя на Toll-подобные рецепторы, вызывают активацию ядерного фактора каппа-би (NFκB), что приводит к усилению воспаления и МД [7, 9, 12]. Доказательством роли бактериальных эндотоксинов при ОП может быть изменение гемодинамики, по ряду параметров похожее на таковое при сепсисе [3, 33].
Наличие в крови пациентов с ОП субстанций, вызывающих МД, таких как цитокины и бактериальные эндотоксины, позволяет использовать их в качестве мишеней для предотвращения и купирования КД. Как было упомянуто выше, способом воздействия на цитокины и бактериальные эндотоксины являются методы экстракорпорального очищения крови, и в первую очередь — гемофильтрация, гемосорбция и плазмаферез. Данные исследований подтверждают, что очищение крови путем гемофильтрации способно снизить концентрацию провоспалительных цитокинов и активность эндотоксина [34, 35]. Метаанализ исследований, посвященных эффективности применения высокообъемной гемофильтрации, показал достоверное улучшение ряда показателей при ОП, в том числе снижение летальности и уменьшение оценки по шкале APACHE II [36]. Другой метод очищения крови, гемосорбция, также показывает положительный результат при применении в целях сорбции цитокинов при ОП [14–17, 37]. Отечественными учеными также показана эффективность плазмафереза при инфицированном панкреонекрозе [38]. Однако эффективность и гемофильтрации, и гемосорбции, и плазмафереза при ОП имеет очень скудную доказательную базу, что не позволяет рекомендовать их как обязательный элемент лечения тяжелого ОП и указывает на необходимость проведения крупных рандомизированных исследований [39, 40].
Протеолитические ферменты: цель терапии?
В системный кровоток, помимо цитокинов и бактериальных эндотоксинов, при тяжелом ОП попадают протеолитические ферменты поджелудочной железы, что является результатом разрушения микро- и макроструктуры ее ткани [13]. Среди панкреатических ферментов наиболее изучено действие на миокард трипсина. В эксперименте он и другие протеолитические ферменты вызывают фокальный некроз скелетной и сердечной мускулатуры, мембранодеструкцию кардиомиоцитов. Деструктивные эффекты протеолитических ферментов на миокард подтверждаются также повышением концентрации аспартатаминотрансферазы в перфузате в ходе эксперимента на изолированном сердце [10]. Эти эффекты трипсина и других ферментов могут быть как непосредственным следствием протеолитической активности, так и опосредоваться активацией воспалительного ответа нейтрофилами [41–43]. Следствием их активации является высвобождение реактивных форм кислорода, в результате которого повышается проницаемость мембран митохондрий и снижается выработка аденозинтрифосфата [44]. Этот механизм универсален и действует на все органы и ткани, в том числе и на миокард. Действие трипсина опосредуется также нарушением микроциркуляции в результате активации системы комплемента, свертывающей и фибринолитической систем крови. В условиях такого нарушения, потенцированного действием иных повреждающих факторов, создаются предпосылки для активации свободнорадикального окисления и перекисного окисления липидов [10, 24]. Активация трипсином рецептора, активируемого протеазами-2 (PAR2), в эксперименте приводит к развитию гипотензии (за счет снижения тонуса сфинктеров артериол) и усиливает воспаление [45]. Последнее может объяснить связь повышения концентрации этого фермента с нарушениями гемостаза [24].
Важность концентрации активированных ферментов для диагностики ОП бесспорна: повышение концентрации амилазы и липазы фигурирует во всех современных рекомендациях по диагностике и лечению ОП [2]. Однако роль ферментов поджелудочной железы в развитии гемодинамических нарушений и развитии МД часто оценивается как минимальная [46]. Это мнение имеет основание: ингибиторы сериновых протеаз, по данным ряда метаанализов, не показали своей клинической эффективности [47]. Вместе с тем возможным методом лечения гиперферментемии может стать плазмаферез [48], однако доказательная база этого метода минимальна и противоречива. Таким образом, панкреатогенные ферменты являются важной составляющей для диагностики ОП, но доказавших свою эффективность способов лечебного воздействия на них нет.
Пути связи сердца и поджелудочной железы
Обычно исследователи рассматривали передачу гуморальных факторов, вызывающих депрессию миокарда, только через системный кровоток. Однако гуморальные факторы, выделяющиеся при ОП из поджелудочной железы, могут попадать в системный кровоток не напрямую, а через лимфатическую систему, тем самым минуя инактивацию в печени, о чем постулирует гипотеза «кишечник–лимфа» [49, 50]. Одной из тканей, которые должны быть подвержены влиянию такой лимфы, является миокард: он первым встречается на пути оттока лимфы в системный кровоток. Это предположение подтверждается исследованием, в ходе которого был смоделирован ОП. Особенностью модели стало исключение гипотензии как фактора КД. В результате такого ОП наблюдалось снижение сердечного выброса, сократимости и расслабления желудочков. Более того, лигирование грудного протока предотвращало появление подобных изменений. Гистологически в миокарде после такого эксперимента был обнаружен отек, что, по мнению авторов, и могло послужить причиной КД [51].
Другим путем передачи гуморальных факторов, вызывающих КД, является паракринный. Исходя из этого выдвинуто предположение, что воспаление, начавшееся в поджелудочной железе, может передаваться трансдиафрагмально на миокард, вызывая его повреждение. Эти данные подтверждаются преимущественной локализацией ишемических изменений в миокарде на электрокардиограмме при ОП на нижней стенке [41].
Путь передачи веществ, вызывающих МД, через лимфу имеет клиническое значение: существует метод экстракорпоральной детоксикации, воздействующий на лимфу, — лимфосорбция [52]. Применение этого способа детоксикации представляется патофизиологически обоснованным, однако высокая травматичность доступа к грудному лимфатическому протоку и слабая доказательная база препятствуют внедрению метода в практику [50].
Электролитные нарушения
Патогенез ОП тесно связан также с электролитными нарушениями. Причины таких нарушений ясны не до конца. Однако известно, что типичными для ОП являются нарушения электролитного состава в виде гипокальциемии, гипофосфатемии, гипо- или гиперкалиемии, гипомагниемии [3, 41, 27, 53]. Механизм развития гипокальциемии на ранних стадиях ОП достоверно неизвестен, однако предложено несколько гипотез, объясняющих развитие этого явления: связывание ионизированого кальция свободными жирными кислотами, выделяющимися при аутолизе мезентериальной клетчатки панкреатическими ферментами; развитие транзиторного гипопаратиреоидизма и гипомагниемии [53]. Гипокальциемия приводит к повышению проницаемости мембран кардиомиоцитов для ионов натрия, что вызывает прогрессирующую деполяризацию и может вызывать повреждение миокарда [42, 46]. Снижение трансмембранного потока ионов кальция при гипокальциемии вызывает снижение сократимости миокарда [53]. Потенциальный механизм развития гипомагниемии при ОП — реакция омыления между свободным магнием плазмы и липидами некротизированной мезентериальной клетчатки, в результате чего свободный магний оказывается связанным [54]. Механизмы повреждения миокарда при гипомагниемии множественны. Гипомагниемия может вызывать повреждение миокарда за счет коронарного вазоспазма [41, 43]. Кроме того, синусовая тахикардия, вызванная этим электролитным нарушением, способна усугублять ишемию миокарда, вызванную иными причинами [19, 55]. Увеличение интервала QT на электрокардиограмме, характерное для гипомагниемии, может косвенно свидетельствовать о нарушении диастолического расслабления миокарда, что характерно для МД при ОП, однако это утверждение требует дальнейших исследований [54, 56]. Гипофосфатемия может угнетать сократимость миокарда при помощи ряда механизмов, и в первую очередь — за счет замедления синтеза аденозинтрифосфата [57]. Случаи тяжелой гипофосфатемии описаны для ОП, связанного с хроническим алкоголизмом. Вместе с тем значимая гипофосфатемия в отсутствие алкоголизма редка [58].
Электролитные нарушения, приводящие к КД, могут также иметь не системный, а локальный характер. Так, причиной КД при ОП может являться повреждение ионных насосов, ответственных за выведение ионов кальция из саркоплазматического ретикулума, и, таким образом, расслабление миокарда [19]. Следствием этого должно быть нарушение диастолического расслабления миокарда, что подтверждается как в эксперименте, так и клинически [18, 19, 43].
Миокардиальная депрессия в условиях целостного организма
Во многих исследованиях, приведенных выше, сердце рассматривается как изолированная система, при действии на которую определенных гуморальных факторов происходят морфологические и гемодинамические нарушения. Однако многие расстройства гемодинамики при ОП появляются на фоне интактного миокарда. Это создало предпосылки для изучения МД не как явления, в которое вовлечен только миокард, но как явления, в которое вовлечена вся сердечно-сосудистая система. К наиболее изученным из таких явлений относятся гипотензия, гиповолемия, интраабдоминальная гипертензия и активация блуждающего нерва.
Системным явлением, ярко отражающимся как на системной гемодинамике, так и на функциональных свойствах миокарда, является гиповолемия. Гиповолемия при ОП связана с секвестрацией жидкости «в третье пространство», внешними потерями (рвота и диарея) и повышением капиллярной проницаемости на фоне системного воспаления [59–61]. Одним из ключевых факторов, вызывающих депрессию миокарда при ОП, может быть гипотензия, связанная c гиповолемией, следствием чего является ишемия миокарда [10, 18, 42]. Объем и состав используемых инфузионных сред при тяжелом ОП — одна из самых дискутабельных тем, касающихся лечения этого заболевания [3, 60, 62–64]. Результаты исследований в этой области имеют очень противоречивый характер, что связано в первую очередь с отличиями в дизайне экспериментов. На наш взгляд, рекомендации Всемирного общества неотложной хирургии наиболее точно отражают требования к инфузионной терапии при ОП: объем инфузии должен быть выбран индивидуально с целью поддержания адекватной перфузии тканей (которая определяется как клиническими, так и лабораторными признаками), а средой выбора являются изотонические сбалансированные кристаллоиды [2].
Другое характерное для ОП явление — интраабдоминальная гипертензия — также влечет за собой нарушение гемодинамики. Она способна вызывать снижение сердечного выброса, артериального давления и органной перфузии. Эти эффекты опосредованы через снижение венозного возврата и увеличение постнагрузки на левый желудочек [65, 66]. Существует ряд методов контроля внутрибрюшного давления. Наиболее простой способ — это снижение объема инфузионных сред, доз седативных и вазоактивных препаратов [2]. В ряде исследований показано, что интраабдоминальное давление может быть снижено применением гемофильтрации, что объясняется удалением избытка жидкости и снижением концентрации цитокинов [67, 68]. Кроме того, снижения внутрибрюшного давления можно добиться чрескожным дренированием жидкостных образований, нередко осложняющих тяжелый ОП. Миорелаксация и хирургическая декомпрессия рассматриваются как способ снижения внутрибрюшного давления в случае неэффективности других методов [2, 66].
Еще одно явление, вовлекающее сердечно-сосудистую систему и характерное для ОП, — стимуляция блуждающего нерва. Она может приводить к повреждению миокарда как в результате прямого, так и непрямого (уменьшение коронарного кровотока и усиление секреции трипсина) воздействия [42, 43, 46]. Вместе с тем в ряде исследований стимуляция блуждающего нерва имеет протекторное влияние на миокард [69]. Таким образом, суммарное влияние стимуляции блуждающего нерва остается неясным.
Заключение
За последние годы было открыто и изучено множество механизмов МД. В связи с появлением новых диагностических методик стало возможным изучение миокардиальной экспрессии цитокинов и действия на миокард бактериальных эндотоксинов. Благодаря новым данным в области патогенеза КД термин «фактор миокардиальной депрессии» можно считать «собирательным понятием», объединяющим эффекты ряда неспецифических веществ. Однако вклад того или иного механизма в кардиальную депрессию остается неизученным. Результаты этих исследований зачастую противоречивы и требуют дополнительных экспериментов и клинических исследований. Как мы указали в обзоре, ряд патогенетических факторов может рассматриваться как цель для интенсивной терапии тяжелого ОП, однако доказательная база методов, направленных на эти факторы, минимальна. Методы патогенетической терапии КД представлены на рис. 1 [2, 14, 13, 17, 28, 32, 37, 50, 51, 63, 65].
Рис. 1. Патогенез кардиодепресии при остром панкреатите и потенциальные методы ее коррекции
ИП — ингибиторы протеаз; ПЖ — поджелудочная железа; ПФ — протеолитические ферменты.
Несмотря на совершенствование методов лечения, ОП остается заболеванием с высокой летальностью, весомый вклад в которую вносит кардиодепрессия. Это требует дальнейшего изучения патогенеза миокардиальной депрессии с целью дальнейшего поиска возможностей по ее предотвращению.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
ORCID авторов
Ершов А.В. — 0000-0001-5758-8552
Андреенков В.С. — 0000-0002-4388-6601
Манасова З.Ш. — 0000-0002-3003-4362
Литература
Petrov M.S., Yadav D. Global epidemiology and holistic prevention of pancreatitis. Nat Rev Gastroenterol Hepatol. 2019; 16(3): 175–184. DOI: 10.1038/s41575-018-0087-5
Leppäniemi A., Tolonen M., Tarasconi A., et al. 2019 WSES guidelines for the management of severe acute pancreatitis. World J Emerg Surg. 2019; 14(1): 17–27. DOI: 10.1186/s13017-019-0247-0
Yegneswaran B., Kostis J.B., Pitchumoni C.S. Cardiovascular manifestations of acute pancreatitis. J Crit Care. 2011; 26(2): 225.e11–225.e18. DOI: 10.1016/j.jcrc.2010.10.013
Lee W.K., Frasca M., Lee C., et al. Depression of myocardial function during acute pancreatitis. Circ Shock. 1981; 8(3): 369–374
Bradley III E.L., Hall J.R., Lutz J., et al. Hemodynamic consequences of severe pancreatitis. Ann Surg. 1983; 198(2): 130–133. DOI: 10.1097/00000658-198308000-00002
Pitchumoni C.S., Agarwal N., Jain N.K. Systemic Complications of Acute Pancreatitis. Am J Gastroenterol. 1988; 83(6): 597–606. DOI: 10.1111/j.1572-0241.1988.tb02431.x
Fernandes Jr. C.J., De Assuncao M.S.C. Myocardial dysfunction in sepsis: A large, unsolved puzzle. Crit Care Res Pract. 2012; 2012: 1–9. DOI: 10.1155/2012/896430
Parrillo J.E., Burch C., Shelhamer J.H., et al. A circulating myocardial depressant substance in humans with septic shock. Septic shock patients with a reduced ejection fraction have a circulating factor that depresses in vitro myocardial cell performance. J Clin Invest. 1985; 76(4): 1539–1553. DOI: 10.1172/JCI112135
Antonucci E., Fiaccadori E., Donadello K., et al. Myocardial depression in sepsis: From pathogenesis to clinical manifestations and treatment. J Crit Care. 2014; 29(4): 500–511. DOI:10.1016/j.jcrc.2014.03.028
Buğdacı M.S., Tüzün A., Koca H., et al. QT interval changes and reversibility of QT dispersion in patients with acute pancreatitis. Turk J Gastroenterol. 2014; 25: 59–62. DOI: 10.5152/tjg.2014.4960
Lv X., Wang H. Pathophysiology of sepsis-induced myocardial dysfunction. Mil med res. 2016; 3(1): 30–40. DOI: 10.1186/s40779-016-0099-9
Garg P.K., Singh V.P. Organ Failure Due to Systemic Injury in Acute Pancreatitis. Gastroenterology. 2019; 156(7): 2008–2023. DOI: 10.1053/j.gastro.2018.12.041
Bonavia A., Groff A., Karamchandani K., et al. Clinical utility of extracorporeal cytokine hemoadsorption therapy: A literature review. Blood Purif. 2018; 46(4): 337–349. DOI: 10.1159/000492379
Huber W., Algül H., Lahmer T., et al. Pancreatitis cytosorbents (CytoSorb) inflammatory cytokine removal: A Prospective Study (PACIFIC). Medicine (Baltimore). 2019; 98(4): e13044. DOI: 10.1097/MD.0000000000013044
Tomescu D., Popescu M., David C., et al. Clinical effects of hemoadsorption with CytoSorb® in patients with severe acute pancreatitis: A case series. Int J Artif Organs. 2019; 42(4): 190–193. DOI: 10.1177/0391398818823762
Thandassery R.B., Choudhary N., Bahl A., et al. Characterization of cardiac dysfunction by echocardiography in early severe acute pancreatitis. Pancreas. 2017; 46(5): 626–630. DOI: 10.1097/MPA.0000000000000820
Meyer A., Kubrusly M.S., Salemi V.M., et al. Severe acute pancreatitis: A possible role of intramyocardial cytokine production. J Pancreas. 2014; 15(3): 237–242. DOI: 10.6092/1590–8577/2171
Landesberg G., Levin P.D., Gilon D., et al. Myocardial dysfunction in severe sepsis and septic shock: No correlation with inflammatory cytokines in real-life clinical setting. Chest. 2015; 148(1): 93–102. DOI: 10.1378/chest.14-2259
Amaral R.C., Barbeiro D.F., Koike M.K., et al. Cytokine and chemokine levels in the heart tissue of aged rats following severe acute pancreatitis. Eur J Inflamm. 2017; 15(2): 102–106. DOI: 10.1177/1721727X17712398
Tomkötter L., Erbes J., Trepte C., et al. The Effects of Pancreatic Microcirculatory Disturbances on Histopathologic Tissue Damage and the Outcome in Severe Acute Pancreatitis. Pancreas. 2016; 45(2): 248–253. DOI: 10.1097/MPA.0000000000000440
Dumnicka P., Maduzia D., Ceranowicz P., et al. The interplay between inflammation, coagulation and endothelial injury in the early phase of acute pancreatitis: Clinical implications. Int J Mol Sci. 2017; 18(2). DOI: 10.3390/ijms18020354
Sanghvi S., Waqar F., Effat M. Coronary thrombosis in acute pancreatitis. J Thromb Thrombolysis. 2019; 47(1): 157–161. DOI: 10.1007/s11239-018-1741-z
Adeel M.Y., Clarke J.-D., Shetty S., et al. Severe hypocalcemia mimicking acute inferior ST-segment elevation myocardial infarction. Oxf Med Case Rep. 2018; 12: 438–441. DOI: 10.1093/omcr/omy103
Kambhampati S., Park W., Habtezion A. Pharmacologic therapy for acute pancreatitis. World J Gastroenterol. 2014; 20(45): 16868–16880. DOI: 10.3748/wjg.v20.i45.16868
Tozlu M., Kayar Y., Ince AT., et al. Low molecular weight heparin treatment of acute moderate and severe pancreatitis: A randomized, controlled, open-label study. Turk J Gastroenterol. 2019; 30(1): 81–87. DOI: 10.5152/tjg.2018.18583
Shen Q.-X., Xu G.-X., Shen M-H. Effect of early enteral nutrition (EN) on endotoxin in serum and intestinal permeability in patients with severe acute pancreatitis. Eur Rev Med Pharmacol Sci. 2017; 21(11): 2764–2768.
Xu H., Zeng Y. Mechanism of gut barrier failure associated with severe acute pancreatitis. World Chin J Dig. 2016; 24(17): 2661–2666. DOI: 10.11569/wcjd.v24.i17.2661
Schietroma M., Pessia B., Carlei F., et al. Intestinal permeability and systemic endotoxemia in patients with acute pancreatitis. Ann Ital Chir. 2016; 87(2): 138–144.
Wilkman E., Kaukonen K.-M., Pettilä V., et al. Early hemodynamic variables and outcome in severe acute pancreatitis: A retrospective single-center cohort study. Pancreas. 2013; 42(2): 272–278. DOI: 10.1097/MPA.0b013e318264c9f7
Liu C., Li M., Cao S., et al. Effects of HV-CRRT on PCT, TNF-α, IL-4, IL-6, IL-8 and IL-10 in patients with pancreatitis complicated by acute renal failure. Exp Ther Med. 2017; 14(4): 3093–3097. DOI: 10.3892/etm.2017.4843
Dai S.R., Li Z., Zhang J.B. Serum interleukin 17 as an early prognostic biomarker of severe acute pancreatitis receiving continuous blood purification. Int J Artif Organs 2015; 38(4): 192–198. DOI: 10.5301/ijao.5000406
Hu Y., Xiong W., Li C., et al. Continuous blood purification for severe acute pancreatitis: A systematic review and meta-analysis. Medicine (Baltimore). 2019; 98(12): e14873. DOI: 10.1097/MD.0000000000014873
Atan R., Crosbie D., Bellomo R. Techniques of extracorporeal cytokine removal: A systematic review of the literature on animal experimental studies. Int J Artif Organs. 2013; 36(3): 149–158. DOI:10.5301/ijao.5000128
Cheng Y., Gong J., Ding X., et al. Continuous veno-venous hemofiltration for severe acute pancreatitis. Cochrane Database Syst Rev. 2018; 2018(2). DOI: 10.1002/14651858.CD012959
De Waele E., Malbrain M.L.N.G., Spapen H.D. How to deal with severe acute pancreatitis in the critically ill. Curr Opin Crit Care. 2019; 25(2): 150–156. DOI: 10.1097/MCC.0000000000000596
Yu E.S., Lange J.J., Broor A., et al. Acute pancreatitis masquerading as inferior wall myocardial infarction: A review. Case Rep Gastroenterol. 2019; 13(2): 321–335. DOI: 10.1159/000501197
Kumar A.V., Mohan Reddy G., Anirudh Kumar A. Acute pancreatitis complicated by acute myocardial infarction — A rare association. Indian Heart J. 2013; 65(4): 474–477. DOI: 10.1016/j.ihj.2013.06.009
Prasada R., Dhaka N., Bahl A., et al. Prevalence of cardiovascular dysfunction and its association with outcome in patients with acute pancreatitis. Indian J Gastroenterol. 2018; 37(2): 113–119. DOI: 10.1007/s12664-018-0826-0
Singh P., Garg P.K. Pathophysiological mechanisms in acute pancreatitis: Current understanding. Indian J Gastroenterol. 2016; 35(3): 153–166. DOI: 10.1007/s12664-016-0647-y
Heuberger D.M., Schuepbach R.A. Protease-activated receptors (PARs): mechanisms of action and potential therapeutic modulators in PAR-driven inflammatory diseases. Thrombosis J. 2019; 17(1). DOI:10.1186/s12959-019-0194-8
Antonelli D., Rozner E., Turgeman Y. Unusual electrocardiographic changes during acute pancreatitis. Cor Vasa. 2017; 59(5): e446–e449. DOI: 10.1016/j.crvasa.2016.07.001
Seta T., Noguchi Y., Shikata S., et al. Treatment of acute pancreatitis with protease inhibitors administered through intravenous infusion: An updated systematic review and meta-analysis. BMC Gastroenterol. 2014; 14(1). DOI: 10.1186/1471-230X-14-102
Deitch E.A. Gut lymph and lymphatics: A source of factors leading to organ injury and dysfunction. Ann New York Acad Sci. 2010; 1207: E103–E111. DOI: 10.1111/j.1749-6632.2010.05713.x
Windsor J.A., Escott A., Brown L., et al. Novel strategies for the treatment of acute pancreatitis based on the determinants of severity. J Gastroenterol Hepatol. 2017; 32(11): 1796–1803. DOI: 10.1111/jgh.13784
Shanbhag S.T., Choong B., Petrov M., et al. Acute pancreatitis conditioned mesenteric lymph causes cardiac dysfunction in rats independent of hypotension. Surgery. 2018; 163(5): 1097–1105. DOI: 10.1016/j.surg.2017.12.013
Ahmed A., Azim A., Gurjar M., et al. Hypocalcemia in acute pancreatitis revisited. Indian J Crit Care Med. 2016; 20(3): 173–177. DOI: 10.4103/0972-5229.178182
Huang L., Ma B.W., He F., et al. Electrocardiographic, cardiac enzymes, and magnesium in patients with severe acute pancreatitis. Gastroenterol Nurs. 2012; 35(4): 256–260. DOI: 10.1097/SGA.0b013e31826092a6
Agus Z.S. Mechanisms and causes of hypomagnesemia. Curr Opin Nephrol Hypertens. 2016; 25(4): 301–307. DOI: 10.1097/MNH.0000000000000238
Birda C.L., Kumar S., Bhalla A., et al. Prevalence and prognostic significance of prolonged QTc interval in emergency medical patients: A prospective observational study. Intl J Crit Illn Inj Sci. 2018; 8(1): 28–35. DOI: 10.4103/IJCIIS.IJCIIS_59_17
Ariyoshi N., Nogi M., Ando A., et al. Cardiovascular consequences of hypophosphatemia. Panminerva Med. 2017; 59(3): 230–240. DOI: 10.23736/S0031-0808.17.03331-6
Rizos E., Alexandrides G., Elisaf M.S. Severe hypophosphatemia in a patient with acute pancreatitis. J Pancreas. 2000; 1(4): 204–207. DOI: 10.6092/1590-8577/377
Braha J., Tenner S. Fluid collections and pseudocysts as a complication of acute pancreatitis. Gastrointest Endosc Clin North Am. 2018; 28(2): 123–130. DOI: 10.1016/j.giec.2017.11.001
De-Madaria E., Garg P.K. Fluid therapy in acute pancreatitis — Aggressive or adequate? Time for reappraisal. Pancreatology. 2014; 14(6): 433–435. DOI: 10.1016/j.pan.2014.09.008
Türkvatan A., Erden A., Seçil M., et al. Fluid collections associated with acute pancreatitis: A pictorial essay. Can Assoc Radiol J. 2014; 65(3): 260–266. DOI: 10.1016/j.carj.2013.08.003
Köksal A.S., Parlak E. Fluid resuscitation in acute pancreatitis. Turk J Gastroenterol. 2017; 28(4): 322–323. DOI: 10.5152/tjg.2017.17324
Trikudanathan G., Vege S.S. Current concepts of the role of abdominal compartment syndrome in acute pancreatitis — An opportunity or merely an epiphenomenon. Pancreatology. 2014; 14(4): 238–243. DOI: 10.1016/j.pan.2014.06.002
Mifkovic A., Skultety J., Sykora P., et al. Intra-abdominal hypertension and acute pancreatitis. Bratislava Med J. 2013; 114(3): 166–171. DOI: 10.4149/BLL_2013_036
Xu J., Tian X., Zhang C., et al. Management of abdominal compartment syndrome in severe acute pancreatitis patients with early continuous veno-venous hemofiltration. Hepato-Gastroenterology. 2013; 60(127): 1749–1752. DOI: 10.5754/hge13351
Xu J.-M., Yang H.-D., Tian X.-P. Effects of early hemofiltration on organ function and intra-abdominal pressure in severe acute pancreatitis patients with abdominal compartment syndrome. Clin Nephrol. 2019; 92(5): 243–249. DOI: 10.5414/CN109435
Nuntaphum W., Pongkan W., Wongjaikam S., et al. Vagus nerve stimulation exerts cardioprotection against myocardial ischemia/reperfusion injury predominantly through its efferent vagal fibers. Basic Res Cardiol 2018; 113(4): 22. DOI: 10.1007/s00395-018-0683-0