карнитон или элькар что лучше
Коррекция функциональных изменений сердечно-сосудистой системы препаратом L-карнитина у детей и подростков с сочетанной патологией
В современных условиях недостаточное потребление микронутриентов, воздействие на организм, особенно растущий, гипоксии различного генеза формируют высокий риск нарушений возрастного развития и повышенной заболеваемости у детей
В современных условиях недостаточное потребление микронутриентов, воздействие на организм, особенно растущий, гипоксии различного генеза формируют высокий риск нарушений возрастного развития и повышенной заболеваемости у детей [24]. Особое место среди этих патофизиологических факторов занимает тканевая гипоксия, возникающая в результате нарушения процессов биологического окисления, ключевые этапы которого происходят в митохондриях [1, 14, 15, 19, 20]. Митохондриальные нарушения полиморфны и могут иметь различные варианты и степень клинической выраженности: от минимальных до грубых, угрожающих жизни изменений. Результатом тканевой гипоксии являются нарушения синтеза АТФ, транспорта энергии от места продукции к эффекторным структурам клеток, нарушение утилизации энергии АТФ [8, 11, 20, 21].
Многочисленные клинические исследования, проведенные в последние годы, свидетельствуют о том, что относительная недостаточность энергетического фона может наблюдаться и у практически здоровых лиц. При этом скрытые нарушения клеточной энергетики могут быстро декомпенсироваться, приводя к снижению активности ферментов митохондриальной дыхательной цепи, вследствие чего возникает широкий спектр метаболических функциональных нарушений, в том числе со стороны нервной и сердечно-сосудистой систем [2, 3, 16, 22, 23]. Поэтому в настоящее время в лечении различных патологических состояний у детей большое значение придается метаболической терапии. В связи с этим важен поиск и создание безопасных и эффективных лекарственных средств комплексного воздействия на обмен веществ. К таким препаратам относят карнитин — низкомолекулярное соединение, производное аминомасляной кислоты, содержащееся во всех органах, особенно в больших количествах в тканях с необходимостью высокого энергетического обеспечения — мышцах, миокарде, мозге, печени, почках [1, 2, 6, 10, 11, 20]. Существуют две изомерные формы карнитина: D- и L-изомеры. В тканях млекопитающих присутствует только L-изомер, выполняющий в организме несколько функций: энергетическую (участвует в катаболизме липидов с образованием большого количества АТФ, модулируя внутриклеточный гомеостаз кофермента А с образованием свободного коэнзима А) и дезинтоксикационную (выводит из организма в виде ацилкарнитина соединения, обладающие мембранотоксическим и ингибирующим активность некоторых ферментов действием).
По данным многих клинических исследований, основными клиническими признаками дефицита L-карнитина являются быстрая утомляемость и снижение работоспособности; мышечная слабость, гипотония и гипотрофия, отставание физического развития; задержка психомоторного развития, снижение школьной успеваемости, сонливость или раздражительность; нарушение функции сердца вплоть до кардиомиопатии; увеличение размеров печени и нарушение ее функции [8, 9, 14–19].
Потребность в L-карнитине индивидуальна, а при умственных, физических и эмоциональных нагрузках повышается в 4–20 раз. Обычный пищевой рацион, включающий продукты животного происхождения, покрывает потребность в L-карнитине лишь на 25%, поэтому очевидна необходимость использования дополнительных источников L-карнитина для обеспечения оптимальной физиологической потребности.
В настоящее время появился новый источник L-карнитина — биологически активная добавка к пище Карнитон, зарегистрированная Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека. В состав препарата Карнитон аминокислота карнитин входит в форме L-карнитина тартрата, который наиболее полно усваивается организмом; в 1 мл препарата содержится 500 мг L-карнитина.
Целью данной работы явилась оценка эффективности влияния применения препарата Карнитон на состояние сердечно-сосудистой системы у детей и подростков с сочетанной соматической патологией в период реабилитации после частых респираторных заболеваний.
Работа осуществлялась под руководством сотрудников кафедры педиатрии МГМСУ на базе детского кардиологического санатория «Быково» МВД России.
В несравнительное исследование был включен 71 ребенок от 9 до 14 лет (34 мальчика и 37 девочек), находившийся в санатории в период с ноября 2009 года по январь 2010 года. Критериями отбора явились наличие жалоб вегетативного характера, изменения на стандартной электрокардиограмме (ЭКГ), эхокардиографии (ЭХО-КГ). Всем детям в течение 30 дней в первую половину дня назначался препарат Карнитон в возрастной дозе. В период лечения другие энерготропные и кардиотрофические препараты не назначались. С целью коррекции вегетативных изменений применялась немедикаментозная терапия (режим, прогулки, лечебная физкультура; физиотерапевтическое лечение, включающее массаж и водные процедуры). Нами не было зафиксировано ни одного случая аллергической реакции, непереносимости или отказа от приема препарата Карнитон. Назначение энерготропной терапии в первой половине дня было обусловлено возбуждающим нервную систему действием, что может вызывать трудности засыпания при вечернем приеме [6, 17, 20, 22].
Эффективность терапии препаратом Карнитон оценена по данным опроса детей, результатам стандартной ЭКГ и ЭХО-КГ после курса лечения. Статистический анализ результатов проведен стандартными методами. Степень достоверности количественных показателей оценивалась по t-критерию Стьюдента. Статистически значимыми считали различия при величине p ≤ 0,05.
Обследование включало физикальный осмотр, анализ генеалогического анамнеза, клинико-анамнестических данных, общеклинические исследования, стандартную ЭКГ, ЭХО-КГ с оценкой результатов в соответствии с нормативными показателями, применяемыми в педиатрии [4]. Оценка умственной работоспособности проводилась по методике Э. Крепелина, физическая работоспособность — по пробе с дозированной физической нагрузкой.
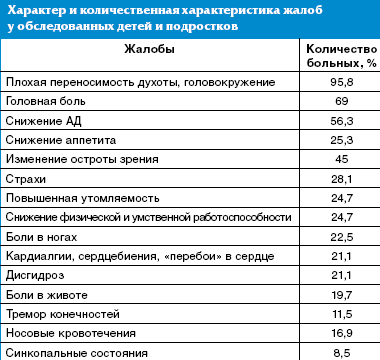
Характер жалоб у детей и подростков носил неспецифический характер, при этом наиболее часто отмечались головокружения и плохая переносимость духоты (95,8% детей), головная боль (69%), снижение артериального давления (АД) — у 56,3% пациентов. У каждого четвертого ребенка отмечались снижение аппетита, повышенная утомляемость со снижением физической и умственной работоспособности, у каждого пятого — или повышенная утомляемость, и/или кардиалгии, и/или дисгидроз, что расценивалось как проявление перманентного течения синдрома вегетативно-сосудистой дистонии (табл.).
Отмечены жалобы на нарушения сна, ночные страхи — у 28,1% пациентов, боли в ногах (22,5%), носовые кровотечения — у 16,9% обследованных. Особое внимание обращалось на детей с вегетативными пароксизмами в анамнезе, симптомами которых были боли в животе, тремор конечностей, синкопальные состояния. Всем детям с синкопальными состояниями ранее проводилось электроэнцефалографическое исследование, и было исключено органическое поражение головного мозга.
При физикальном осмотре патология опорно-двигательного аппарата в виде нарушения осанки, в том числе рахитически измененная (килевидная) грудная клетка (4,2% детей), выявлена у 98,7% больных. Снижение массы тела до 10-го центиля отмечено у 30% детей, избыточная масса — у 7%. При аускультации у 84% пациентов выслушивался низкотембровый систолический шум на верхушке и в V-точке. В процессе обследования исключена органическая патология сердечно-сосудистой, нервной систем. Анализ анамнестических, клинико-инструментальных данных свидетельствовал о том, что изменения сердечно-сосудистой системы носили вторичный характер, обусловленный нарушением вегетативной регуляции, наличием очагов хронической инфекции в носоглотке, полости рта, нарушением двигательного режима, что было выявлено практически у всех обследованных детей. Среди сопутствующих заболеваний наиболее часто встречались миопия (45%), аллергические заболевания, в том числе бронхиальная астма (22,5%), реже отмечались хронический гастродуоденит (6%), хронические запоры (4%).
При стартовом обследовании стандартной ЭКГ изменения зарегистрированы у всех детей. В 71,8% случаев отмечено вертикальное, а в 15,5% — горизонтальное расположение электрической оси сердца. У большинства детей (56,3%) выявлены нарушения автоматизма сердца в виде синусовой брадикардии (45%), эктопического ритма (14%), синусовой тахикардии (9,9%). Нарушения возбудимости сердца зарегистрированы у 45% пациентов, нарушения проводимости в виде атриовентрикулярной блокады (АВБ) I степени отмечены у 4,2%. Эти данные свидетельствуют о выраженных влияниях парасимпатического отдела на сердечно-сосудистую систему у обследованных детей и подростков, что согласуется с характером жалоб, предъявляемых пациентами.
После курса лечения препаратом Карнитон было отмечено статистически значимое (p
Т. И. Рычкова*, кандидат медицинских наук, доцент
И. П. Остроухова*, кандидат медицинских наук
С. А. Яцков**
Л. К. Акулова**
Т. М. Васильева*
* МГМСУ, Москва
** Детский кардиологический санаторий «Быково» МВД России, Московская область
Применение L-карнитина в общей врачебной практике
Опубликовано в журнале:
«Терапевтический архив», 1, 2019, с. 114-120.
Ж.М. Сизова, Е.В. Ших, А.А. Махова
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет), Москва, Россия
Аннотация
В обзоре представлены результаты целого ряда экспериментальных и клинических исследований, доказывающих перспективность применения L-карнитина в клинике внутренних болезней. Дополнительный прием L-карнитина за счет антиоксидантных и антиги-поксантных свойств в дополнение к основной этиопатогенетической терапии назначается кардиологами, нефрологами, неврологами, геронтологами. Ранее проведенные нами экспериментальные исследования показали отсутствие влияния L-карнитина на активность системы Р450 CYP 3А4, что снижает вероятность возникновения межлекарственного взаимодействия на уровне метаболизма лекарственных препаратов, метаболизирующихся Р450 3А4. При использовании L-карнитина в составе комплексной фармакотерапии, препарат обладает повышенным профилем безопасности у коморбидных пациентов, принимающих L-карнитин.
Ключевые слова: L-карнитин, Р450 CYP 3А4, хроническая сердечная недостаточность, инфаркт миокарда, хроническая почечная недостаточность, межлекарственное взаимодействие, антиоксидант, антигипоксант.
Significance of L-carnitine in internal medicine
Zh.M. Sizova, E.V. Shikh, A.A. Makhova
I.M. Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation (Sechenov University), Moscow, Russia
The review presents the results of a number of experimental and clinical studies proving the prospects of using L-carnitine in the clinic of internal diseases. Due to the antioxidant and antihypoxant properties, the additional use of L-carnitine in addition to the main etiopatho-genetic therapy is prescribed by cardiologists, nephrologists, neurologists, gerontologists. Experimental studies we conducted earlier showed no effect of L-carnitine on the activity of the P450 CYP 3A4 system, which reduces the likelihood of drug-drug interaction at the level of metabolism of drugs metabolized by P450 3A4. When using L-carnitine as part of complex pharmacotherapy, the drug has an increased safety profile in comorbid patients taking L-carnitine.
Keywords: L-carnitine, P450 CYP 3А4, chronic heart failure, myocardial infarction, chronic renal failure, inter-drug interaction, antioxidant, antihypoxant.
В настоящее время фокус клинической медицины смещается в сторону персонализированной медицины, основу которой составляют повышение эффективности и безопасности лекарственной терапии за счет индивидуализации. При назначении комбинированной фармакотерапии особое внимание уделяется вопросам взаимодействия лекарственных средств (ЛС) [1].
Витамины и витаминоподобные вещества являются жизненно необходимыми органическими соединениями, участвующими в основных биохимических процессах в организме человека, и широко применяются в клинической практике, чаще в составе комбинированной терапии для лечения и коррекции целого ряда патологических состояний. Однако, как правило, врачами не учитывается возможное влияние витаминов и витаминоподобных веществ на активность изоферментов цитохрома, метаболизирующих ЛС, что, как было показано в целом ряде исследований, может приводить к изменениям фармакологического ответа на лекарственную терапию [1,2].
У здоровых людей гомеостаз L-карнитина поддерживается посредством многостадийного эндогенного биосинтеза L-карнитина из аминокислот лизина и метионина, его абсорбции из пищи и дальнейшей элиминации и реабсорбции почками. Хотя биодоступность L-карнитина из пищи довольно высока, при пероральном приеме биологически активных веществ (БАД), содержащих L-карнитин, абсорбция его составляет 14-18% от общей дозы [3- 5]. Поиск соединений L-карнитина с более высокой биодоступностью привел к разработке ацетилированной формы L-карнитина, биодоступность которой при пероральном приеме выше, чем у L-карнитина [6]. Так, в частности, показано, что прием L-карнитина в дозе 2,0 г/сут в течение 50 дней увеличивает плазменный уровень L-карнитина на 43% [3].
В норме большая часть L-карнитина реабсорбируется почками, в связи с чем экскреция его обычно низкая. Однако некоторые состояния (диета с повышенным содержанием белка и жиров, беременность) способствуют снижению реабсорбции L-карнитина и, соответственно, приводят к увеличению его экскреции и уменьшению содержания в организме [7].
У здоровых людей без нарушений обмена веществ, как правило, синтезируется достаточное количество L-карни-тина, даже у строгих вегетарианцев (веганов) не обнаруживаются признаки дефицита L-карнитина [3, 9]. Однако младенцы, особенно недоношенные, рождаются с низкими запасами L-карнитина, что ставит их в группу риска по дефициту карнитина, учитывая высокие темпы роста в данной возрастной группе.
Вторичный дефицит карнитина
Вторичный дефицит L-карнитина может быть результатом генетических или приобретенных состояний. Наследственные причины включают генетические дефекты в обмене аминокислот (например, пропионовой кислоты) и дефекты в липидном обмене (например, дефицит ацил-КоА-дегидрогеназы средней цепи) [13]. Такие генетические нарушения могут приводить к накоплению органических кислот, которые впоследствии удаляются из организма в форме ацилкарнитиновых эфиров с мочой, что может привести к системному истощению L-карнитина [3]. Системное снижение обеспеченности L-карнитином может также возникать при нарушениях его реабсорбции почками, как, например, при синдроме Фанкони (врожденная или приобретенная диффузная дисфункция проксимальных извитых почечных канальцев). Одним из примеров исключительно приобретенного дефицита L-карнитина является хроническое применение пивалат-конъюгирован-ных антибиотиков. Пивалат представляет собой жирную кислоту с разветвленной цепью, которая метаболизируется с образованием эфира ацил-КоА, который в свою очередь при помощи специфических ферментов переносится на L-карнитин и затем выводится с мочой в виде пивалоильного эфира L-карнитина. Ежедневные потери L-карнитина по такому метаболическому пути могут в 10 раз превышать ежедневное поступление L-карнитина, приводя к системному снижению запасов L-карнитина [11]. Кроме того, пациенты с почечной недостаточностью, которые находятся на гемодиализе, подвергаются риску вторичного дефицита L-карнитина, поскольку гемодиализ удаляет L-карнитин из крови [14].
Независимо от этиологии, вторичный дефицит L-карни-тина характеризуется клинически низкими концентрациями свободного L-карнитина в плазме (менее 20 мкмоль/л) и повышенным соотношением ацилкарнитин/свободный L-кар-нитин (более 0,4) [13]. Вторичные дефициты встречаются чаще, чем первичные формы дефицита L-карнитина.
Связь L-карнитина с процессом старения
Известно, что c возрастом угасает митохондриальная функция и увеличивается производство митохондриальных окислителей. Установлено, что уровень L-карнитина в тканях с возрастом у людей и животных также снижается [16]. В одном из исследований доказано, что кормление ацетил-L-карнитином пожилых крыс (ALCAR) повышает уровень L-карнитина в тканях, а также нивелирует ряд возрастных изменений в функционировании митохондрий печени, митохондрий в скелетной и сердечной мышцах 17. Исследования показали, что добавление в рацион питания пожилым крысам ALCAR приводит к снижению окислительного стресса и улучшению когнитивных функций [20, 21].
Сердечно-сосудистые заболевания
L-карнитин в составе комплексной фармакотерапии острого коронарного синдрома (ОКС). Применение L-кар-нитина в составе комплексной терапии сразу после диагностики инфаркта миокарда (ИМ) улучшало клинические результаты в нескольких небольших клинических исследованиях. В одном из исследований половина из 160 мужчин и женщин с диагнозом ИМ рандомизированы для приема 4 г/сут перорального L-карнитина в дополнение к стандартной фармакологической терапии. После одного года лечения смертность оказалась значительно ниже в группе дополнительного приема L-карнитина по сравнению с контрольной группой (1,2% против 12,5%), а приступы стенокардии были статистически значимо менее частыми [22].
В контролируемом клиническом исследовании у 96 пациентов с сердечной недостаточностью применение внутривенного L-карнитина (5 г болюсно с последующим введением 10 г/сут в течение 3 дней) после ИМ позволило достигнуть более выраженного снижения уровня таких маркеров повреждения сердечной мышцы, как креатинкиназа-МБ и тропонин-I [23].
В рандомизированном двойном слепом плацебо-контро-лируемом исследовании 60 мужчинам и женщинам с диагнозом острого ИМ назначался либо внутривенный L-кар-нитин (6 г/сут) в течение 7 дней, затем перорально 3 г/сут в течение 3 мес либо плацебо [24]. Через 3 мес смертность между двумя группами не различалась. В более крупном плацебо-контролируемом исследовании с участием 472 пациентов, которым проводили терапию в отделении интенсивной терапии в течение 24 ч после первичного ИМ: случайным образом назначали либо внутривенную терапию L-карнитином (9 г/сут) в течение 5 дней, а затем пероральный L-карнитин (6 г/сут) в течение 12 мес либо плацебо. Обе группы также получали стандартную комплексную терапию [25, 26]. Несмотря на отсутствие значительных различий в смертности или частоте формирования хронической сердечной недостаточности (ХСН), объем левого желудочка (ЛЖ) был значительно ниже в группе, получавшей L-карнитин, в конце одного года наблюдения, что свидетельствует о том, что терапия L-карнитином может ограничивать неблагоприятные исходы острого ИМ на сердечной мышце. На основании этих данных проведено рандомизированное плацебо-контролируемое исследование у 2330 пациентов с острым ИМ.
Недавно показано, что L-карнитин в фармакологических концентрациях обладает антиокислительной активностью и способен дозозависимым образом снижать системный окислительный стресс у пациентов с постинфарктным кардиосклерозом. Добавление L-карнитина (Элькар раствор для внутривенного и внутримышечного введения 100 мг/мл) в образцы крови этих пациентов значимо снижало спонтанное и индуцированное химическим агентом образование радикалов кислорода предактивированными фагоцитами крови [33].
Добавление L-карнитина к стандартной комплексной терапии сердечной недостаточности изучено в нескольких клинических исследованиях. Рандомизированное плацебо-контролируемое исследование у 70 пациентов с сердечной недостаточностью показало, что трехлетняя выживаемость была значительно выше в группе, получавшей L-карнитин перорально в дозе 2 г/сут, по сравнению с группой, получавшей плацебо [34]. Для оценки эффективности применения L-карнитина при лечении пациентов с ХСН проведен мета-анализ рандомизированных контролируемых исследований (РКИ) [35]. В исследование включены результаты 17 РКИ с участием 1625 пациентов с ХСН. Применение L-карнитина в лечении ХСН связано со значительным улучшением общей эффективности [отношение шансов (ОIII)=3,47; р ЛИТЕРАТУРА/REFERENCES
Элькар в практике педиатра
Фармакология
Е.Николаева, доктор медицинских наук, Московский НИИ педиатрии и детской хирургии Росздрава
Карнитин относится к незаменимым витаминоподобным веществам. В 1905 г. П.З. Кримбергом и В.С. Гулевичем он был впервые выделен из экстракта мышечной ткани. Основные метаболические функции карнитина связаны с процессами преобразования биологической энергии, поэтому в особенно больших количествах он содержится в тканях, нуждающихся в высоком энергетическом обеспечении, — скелетных мышцах, миокарде сердца, головном мозге, печени и почках.
Карнитин обеспечивает перенос жирных кислот в митохондрии, где происходит их окисление и высвобождение ацетил-КоА – субстрата для цикла Кребса. Карнитин осуществляет модуляцию внутриклеточного гомеостаза кофермента А в матриксе митохондрий, таким образом регулируя интенсивность биоэнергетического метаболизма. Исключительно важна (его) роль карнитина в детоксикации и выведении из тканей избытка уксусной и ряда других органических кислот, накапливающихся в ходе окислительно-восстановительных превращений. Кроме того, карнитин участвует в процессах гликолиза, синтеза жирных кислот, обмена кетоновых тел и холина [5]. У взрослых потребность организма в карнитине, составляющая 200—500 мг/сут, удовлетворяется за счет эндогенного его образования не более чем на 10—25% Синтез карнитина осуществляется главным образом клетками печени (в меньшей степени — почек) путем трансформации двух аминокислот: лизина и метионина. Источником аминокислот служат белки пищевых продуктов, а также собственные протеины мышечной ткани. В синтезе карнитина участвуют витамины С,В3, В6,В12, фолиевая кислота и железо.
Отмечено, что потребность в карнитине резко возрастает при стрессе, физических, умственных и эмоциональных перегрузках, интеркуррентных заболеваниях, недостаточном питании, а также в период беременности и лактации. Именно в ситуациях высокого расходования энергетических ресурсов, требующих повышенного катаболизма, становится очевидным исключительное значение для организма карнитинзависимых биологических процессов.
У детей, особенно раннего возраста, эндогенный синтез карнитина крайне ограничен, причем на активность эндогенного образования влияет функциональное состояние печени и почек, а выведение карнитина из организма значительно усиливается при интеркуррентных заболеваниях, дисфункции почечных канальцев, расстройствах деятельности желудочно-кишечного тракта. Обычный пищевой рацион далеко не полностью обеспечивает потребность в карнитине [1].
Таким образом, недостаточность эндогенного синтеза карнитина и его поступления с пищевыми продуктами создают возможность для развития дефицита этого вещества в организме, особенно при состояниях, способствующих повышенному выведению и нарушению всасывания. В результате нередко развивается недостаточность карнитина с ее многообразными системными проявлениями.
Главными органами-мишенями служат скелетные мышцы и миокард, во вторую очередь страдают клетки головного мозга, печень и почки. Основные признаки дефицита L-карнитина являются следствием развивающихся нарушений энергетического обмена и метаболизма липидов и связанных с этим расстройств других видов обмена веществ (быстрая утомляемость, мышечная слабость, гипотония, отставание физического и психомоторного развития, снижение успеваемости, сонливость или раздражительность, нарушение функции сердца и печени). Все это обусловливает необходимость использования дополнительных источников карнитина для лечения и профилактики его недостаточности карнитина в организме.
Существуют две изомерные формы карнитина: D- и L-стереоизомеры.
Установлено, что в тканях млекопитающих присутствует только L-стереоизомер, и именно он биологически эффективен. В настоящее время в большинстве стран мира используют только препараты на основе L-карнитина. Сведений о каких-либо значительных побочных эффектах их применения нет.
D-изомер карнитина — синтетического происхождения; в изолированном виде он не используется, однако имеются лекарственные формы на основе рацемической смеси D,L-карнитинов. Экспериментальные исследования с чистыми изомерами показали, что D-карнитин — не просто неэффективное или биологически инертное вещество, а потенциально токсичное соединение, которое негативно влияет на биосинтез в печени, конкурентно ингибирует процессы усвоения L-карнитина и нарушает его проникновение в миокард, мышечную ткань и почки [6].
Эффективность элькара при различных заболеваниях у детей, изучалась в ведущих медицинских учреждениях страны — Московском НИИ педиатрии и детской хирургии Росздрава, Научном центре здоровья детей РАМН, Российском государственном медицинском университете, Тверской государственной медицинской академии, Волгоградском государственном медицинском университете и др.
В МНИИ педиатрии и детской хирургии элькар уже в течение 5 лет применяется при лечении наследственных заболеваний (в том числе сердечно-сосудистой системы и врожденной патологии), для коррекции развития детей раннего возраста, в психоневрологии, при радиационном риске и т.д.
На фоне длительного лечения элькаром (в суточной дозе 30—50 мг на 1 кг массы тела; в течение 4 мес) у 35 детей с митохондриальными заболеваниями отмечено достоверное улучшение клинического статуса: снижение утомляемости, повышение мышечного тонуса и силы мышц, улучшение походки и координации движений, повышение умственной работоспособности. При этом зарегистрированы снижение уровня лактата и пирувата в крови, улучшение перекисного окисления липидов. У 11 больных с доказанным низким уровнем общего карнитина в крови отмечено достоверное его повышение после приема элькара в течение 3 нед. Ликвидация недостаточности карнитина при митохондриальных заболеваниях — важное средство борьбы с лактат-ацидозом и коррекции энергетического дефицита. В период лечения элькаром ухудшения состояния детей(;) не зафиксировано; у пациентов с митохондриальным синдромом MELAS отсутствовали инсультоподобные приступы. Длительное лечение элькаром (в суточной дозе 50—100 мг/кг; в течение 4 мес) 12 детей с органическими ацидемиями способствовало стабилизации их общего состояния (улучшение аппетита, купирование приступов тошноты и рвоты, повышение мышечного тонуса, нормализация метаболических показателей). После 3-недельного приема элькара у 6 детей с резко пониженным уровнем карнитина в крови он достоверно повысился, преодолев нижнюю границу нормы. Одновременно произошло достоверное снижение ранее повышенного уровня лактата в крови и уменьшилась патологическая почечная экскреция органических кислот.
Использование элькара (суточная доза 20—30 мг/кг; в течение 3 мес) у 36 детей с синдромами Марфана и Элерса—Данло привело к повышению толерантности к физической нагрузке, уменьшению частоты и интенсивности головной боли, увеличению мышечной силы и тонуса. У всех больных с доказанным дефицитом карнитина (23 ребенка с синдромом Элерса—Данло и 8 — с синдромом Марфана) после терапии элькаром в течение 3 нед его содержание в крови увеличилось [4].
При лечении 30 больных с синдромом Ретта (элькар в суточной дозе 30—50 мг/кг; в течение 3 мес) установлено (оценка с помощью балльной шкалы) достоверное снижение выраженности большинства клинических показателей: уменьшились проявления аутизма, повысилась психическая активность и социализация поведения, активизировалась речевая деятельность, улучшились эмоциональные реакции, целенаправленные движения рук и мышечный тонус, появились новые моторные навыки (ходьба, сидение и др.).
После применения элькара (суточная доза 20—30 мг/кг; в течение 3 мес) у всех 50 пациентов с туберозным склерозом отмечены повышение двигательной и общей психической активности, общего фона настроения и параметров устойчивости внимания. У детей школьного возраста улучшались качество оперативной памяти, концентрация, распределение и переключение внимания.
Использование элькара (суточная доза 20 мг/кг : в течение 2 мес — 3 курса в год) у 30 детей с резким дефицитом длины тела, страдающих моногенными синдромами (Нунан, Рассела—Сильвера, Рубинштейна—Тейби и др.), способствовало увеличению скорости роста, достоверному улучшению переносимости физической нагрузки, уменьшению функциональных изменений ЦНС.
Анализ эффективности элькара при выхаживании 87 недоношенных детей и новорожденных с последствиями родовой травмы продемонстрировал, что после 1,5-месячного курса (суточная доза 50 – 100 мг/кг в 3 равных приема перед едой) у всех детей улучшился аппетит, произошла заметная прибавка массы тела, повысилась двигательная активность, улучшилась реакция захвата предметов, значительно активизировалась познавательная деятельность, появилась реакция на музыкальные звуки.
Препараты L-карнитина входят в число основных лекарственных средств, назначаемых в комплексной терапии при заболеваниях сердца, особенно при кардиомиопатиях у детей. Эффективность использования сердечной мышцей жирных кислот в качестве источника энергии тесно связана с уровнем L-карнитина в миокарде. Как показали наблюдения, прием элькара заметно улучшил сократимость сердечной мышцы у 65 детей с кардиомиопатией различной природы (дилатационной, гипертрофической, на фоне первичных митохондриальных синдромов); стойко уменьшилась выраженность симптомов сердечной недостаточности, сократились размеры сердца, более благоприятным стал отдаленный прогноз [5].
В Тверской государственной медицинской академии проанализирована эффективность элькара у 15 детей, страдавших диабетической кардиомиопатией. Его назначали дополнительно к общепринятой метаболической терапии — с целью нормализации метаболических процессов в миокардиоцитах и улучшения выработки энергии в форме АТФ (30 мг/кг в сутки в 2—3 приема в течение 3—4 нед). В результате проведенного лечения у больных нормализовалась диастолическая функция левого желудочка. По данным допплер-эхокардиографии, улучшились скоростные показатели трансмитрального диастолического потока, уменьшилась ригидность миокарда в фазу диастолы. Кроме того, отмечен переход от гипокинетического типа гемодинамики к эукинетическому, что проявлялось увеличением конечного диастолического и ударного индексов, снижением общего периферического сопротивления сосудов. У 11 детей, не получавших элькар в составе кардиометаболической терапии, достоверной положительной динамики показателей трансмитрального диастолического потока и центральной гемодинамики не отмечалось [1].
Сотрудниками Волгоградского государственного медицинского университета проведено динамическое клинико-биохимическое исследование 24 детей в возрасте от 4 до 32 дней жизни, находившихся на лечении в отделении патологии новорожденных по поводу патологической гипербилирубинемии. Комплекс консервативной терапии, помимо внутривенной инфузии растворов глюкозы, эссенциале, энтерального приема витаминов В2, Е, метионина, фенобарбитала и др., дополнительно включал элькар в суточной дозе 50—150 мг/кг (в 2 приема; длительность курса лечения от 14 до 28 дней). Группой сравнения служили 10 новорожденных, получавших то же лечение, за исключением элькара. Исследование показало, что применение элькара в комплексной консервативной терапии неонатальной желтухи способствует ускорению темпов регресса симптомов желтухи, достоверному снижению уровня непрямого билирубина и повышению коэффициента снижения билирубина [3].
В научном Центре здоровья детей РАМН элькар использовался для лечения 170 детей разного возраста (от первых месяцев жизни до 18 лет) с перинатальным неблагополучием в анамнезе и различным исходом патологии нервной системы. При назначении элькара ориентировались на средние возрастные дозы; длительность курсов лечения составляла 1—3 мес.
Клинические эффекты элькара отмечены в сенсорной, двигательной, вегетативной сферах и психическом реагировании при различных патологических состояниях нервной системы. Действие препарата более отчетливо проявилось в ведущем звене нарушения развития (в частности, отмечены улучшение регуляторных процессов у детей с расторможенностью, повышение эмоциональной устойчивости и коммуникативной функции при аутизме) [1].
Таким образом, многочисленные и разносторонние исследования убедительно доказали эффективность элькара для лечения и профилактики различных заболеваний у детей, начиная с самого раннего возраста.