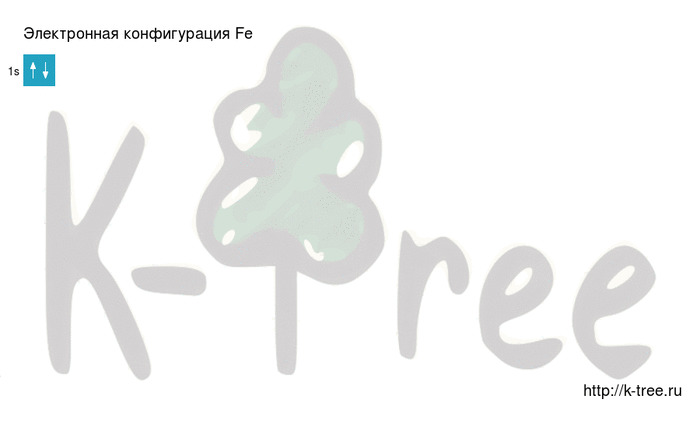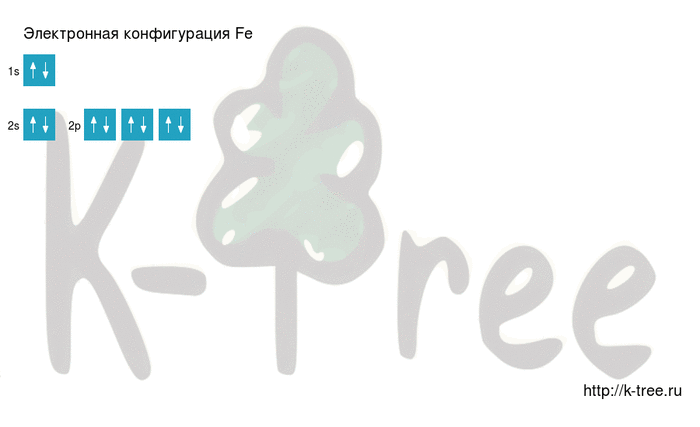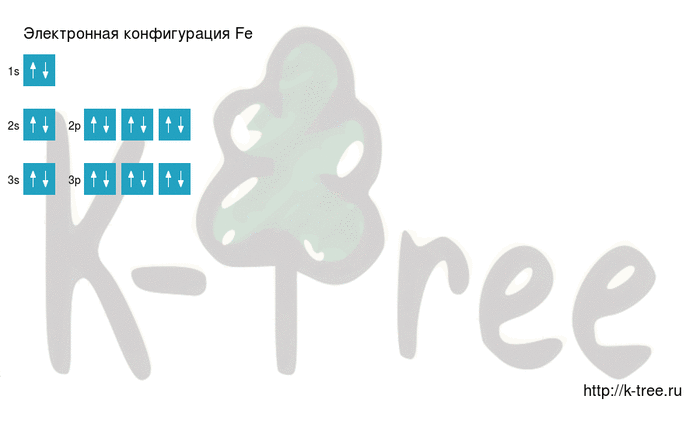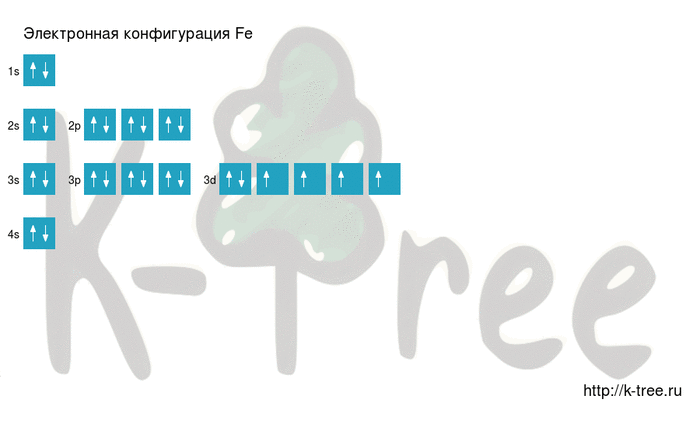катион железа имеет 5 неспаренных электронов чему равен заряд катиона
Железо Fe
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
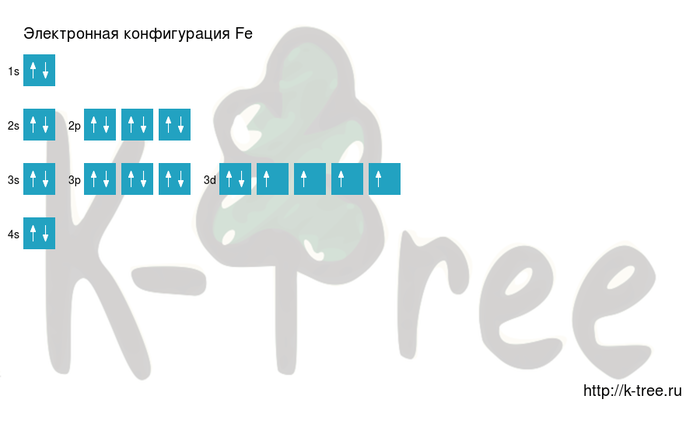
Электронная схема железа
Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Короткая запись:
Fe: [Ar]4s 2 3d 6
Порядок заполнения оболочек атома железа (Fe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Железо имеет 26 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации, для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Катион железа имеет 5 неспаренных электронов чему равен заряд катиона
У каких из указанных элементов двухзарядный катион не имеет в основном состоянии неспаренных электронов? Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из приведённого списка выберите три элемента, которые находятся в одном периоде, и расположите их в порядке уменьшения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
В списке 3 элемента, располагающиеся в одном периоде: магний, алюминий и фосфор. ЭО уменьшается при движении по периоду справа налево, следовательно, фосфор самый электроотрицательный, а магний наоборот.
Из приведённого списка выберите два элемента, которые в соединениях могут иметь степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Из приведённого списка степень окисления +3 могут иметь алюминий и фосфор.
Определим количество валентных электронов в двухзарядных катионах каждого из элементов, а также их состояние:
1. — одна пара и 2 неспаренных электрона;
2. — один неспаренный электрон;
3. — не имеет неспаренных электронов;
4. — одна пара и 1 неспаренный электрон;
5. — 5 пар электронов, не имеет неспаренных электронов.
Катион железа имеет 5 неспаренных электронов чему равен заряд катиона
Олеся,
Задача 80
определить степень окисления, электронную конфигурацию и тип гибридизации атомных орбиталей комплексообразователей, пространственную структуру комплексных ионов : [Au(CN)2]–, [Zn(OH)4]2-, [Co(NH3)6]3+, объяснить их магнитные свойства.
Гульназ,
Задача 81
Составить координационную формулу комплексного соединения, в состав которого входят ионы: K(+), Cl(-), Hg(2+). Известно, что на 2 г ртути приходится 0,04 моля ионов хлора.
Дать распределение электронов по орбиталям комплексообразователя, указать тип гибридизации, определить геометрическую форму и магнитные свойства комплексного иона.
Ksenia,
Задача 82
Определите заряд комплексного иона, комплексообразователя и координационное число в соединениях:
а) K3[Co(NO2)6]; б) [Pt(NH3)4Cl2]Cl2.
Напишите выражение константы нестойкости комплексного иона первого комплексного соединения. В соответствии с номенклатурой назовите вышеприведенные комплексные соединения.
Анна,
Задача 84
В рамках теории кристаллического поля сравнить характеристики комплексов [Co(NH3)6]3+ и [CoF6]3- (тип гибридизации центрального иона, форма комплекса, магнитный момент, энергия стабилизации кристаллическим полем, возможность искажения структуры).
Решение:
Все равно придется воспользоваться сначала МВС, чтобы определить гибридизацию центр. иона и форму компл. иона, т.к. ТКП этим не занимается, она вообще игнорирует связь центр. иона с лигандами, принимая их за точечные заряды (крист. поле).
Электронная формула атома кобальта – [Ne] 3s2 3p6 3d7 4s2 4р0 4d0
Cхема валентных подуровней: 3d[↑↓][↑↓][↑][↑][↑] 4s[↑↓] 4p[][][] 4d[][][][][]
При образовании трехзарядного иона атом кобальта теряет два 4s- и один 3d-электрон:
3d[↑↓][↑][↑][↑][↑] 4s[] 4p[][][] 4d[][][][][]
После определения гибр. и формы можно продолжить с ТКП.
В комплексном ионе [CoF6]3– лиганды F− создают слабое кристаллическое поле, Р > ∆ (см. таблицу), и 3d-электроны центрального атома размещаются на dε- и dγ-орбиталях без дополнительного спаривания. Комплекс является высокоспиновым, содержит четыре неспаренных электрона, поэтому он парамагнитен.
В образовании комплекса [Co(NH3)6]3+ участвует более сильный лиганд. Параметр расщепления становится больше энергии спаривания (∆ > P), и все шесть 3d-электронов Со3+ заселяют энергетически более выгодные dε-орбитали сначала по одному, а потом по второму электрону. Низкоспиновый комплекс [Co(NH3)6]3+ не содержит неспаренных электронов и поэтому диамагнитен.
Эффективный магнитный момент (парамагнитный момент) комплекса рассчитывают по ф-ле µ=√(n(n+2))µв (где n-число неспар. e-, µB – магнетон Бора).
Для [Co(NH3)6]3+ µ=0 (n=0), для [CoF6]3- µ=√(4(4+2))µв = 4,90µв.
Катион железа имеет 5 неспаренных электронов чему равен заряд катиона
Какие из указанных элементов образуют ион с зарядом +1, не имеющий неспаренных электронов в основном состоянии? Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из приведённого списка выберите три металла и расположите их в порядке уменьшения основных свойств высшего гидроксида. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
В списке элементов 3 металла: натрий, марганец и медь. Их высшие гидроксиды: гидроксид натрия (сильное основание), гидроксид меди (слабое основание) и марганцевая кислота.
Из приведённого списка выберите два элемента, которые в соединениях могут иметь степень окисления +7. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Чтобы элемент имел степень окисления +7, у него должно быть 7 валентных электронов. В данном случае это марганец и хлор.
Рассмотрим число валентных электронов в однозарядном ионе каждого из элементов:
1. — 0 электронов;
2. — 4 (2 спаренных и 2 неспаренных);
3. — 6 (6 неспаренных);
4. — 10 (5 пар);
5. — 6 (2 пары и 2 неспаренных).
Железо Fe
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Короткая запись:
Fe: [Ar]4s 2 3d 6
Порядок заполнения оболочек атома железа (Fe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Железо имеет 26 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации, для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева