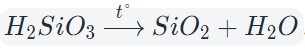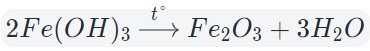кислотный оксид что это
Кислотные оксиды

Всего получено оценок: 1209.
Всего получено оценок: 1209.
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
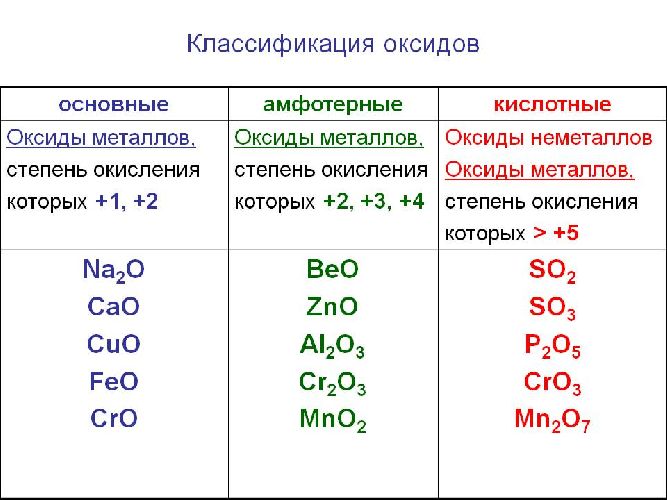
Основные свойства кислотных оксидов
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Оксиды
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Виды оксидов
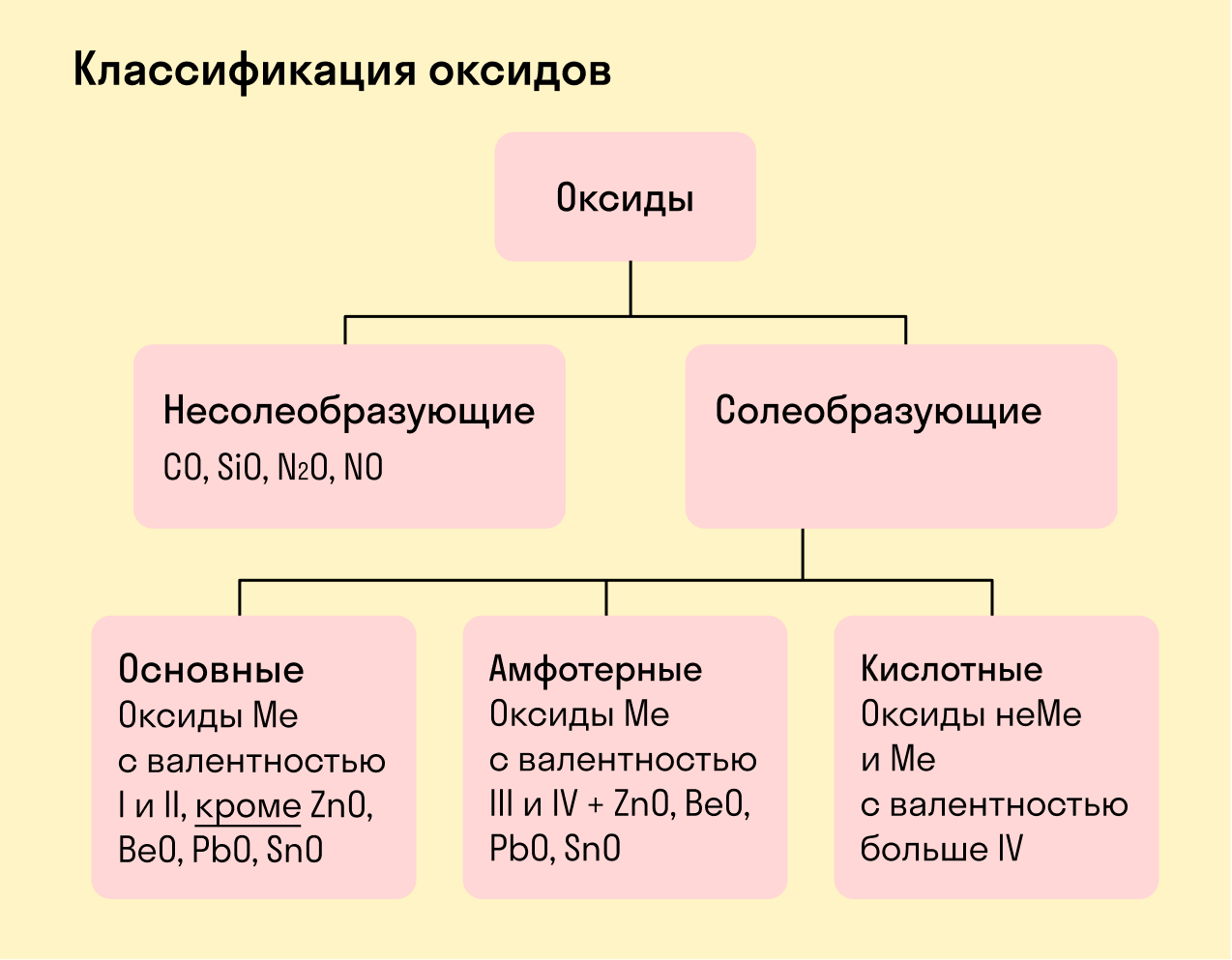
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
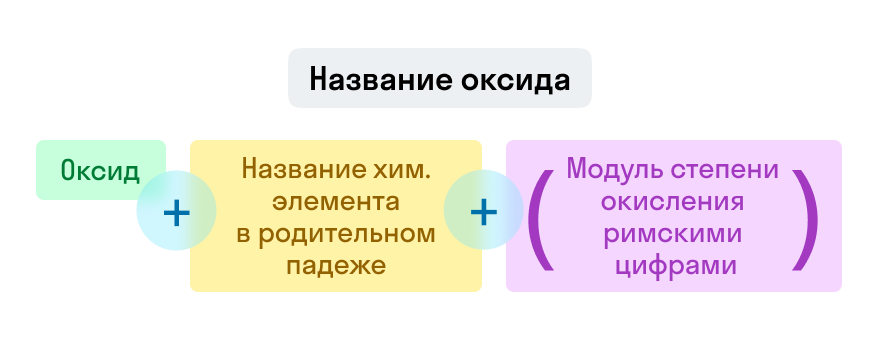
Названия оксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Кислотные оксиды
Кислотные оксиды (ангидриды) – оксиды, проявляющие кислотные свойства и образующие соответствующие кислородсодержащие кислоты. Образованы типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют степень окисления от IV до VII. Они могут взаимодействовать с некоторыми основными и амфотерными оксидами, например: с оксидом кальция CaO, оксидом натрия Na2О, оксидом цинка ZnO, либо с оксидом алюминия Al2O3 (амфотерный оксид).
Характерные реакции
Кислотные оксиды могут реагировать с:
2) с водой (практически все кислотные оксиды при взаимодействии с водой (реакция гидратации) образуют соответствующие им кислотные гидроксиды (кислородосодержащие кислоты). Например, при растворении оксида серы (VI) в воде образуется серная кислота:
Кислотные оксиды могут быть получены из соответствующей кислоты:
Примеры
См. также
Полезное
Смотреть что такое «Кислотные оксиды» в других словарях:
Оксиды металлов — это соединения металлов с кислородом. Многие из них могут соединяться с одной или несколькими молекулами воды с образованием гидроксидов. Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые… … Официальная терминология
Оксиды — Оксид (окисел, окись) бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй… … Википедия
Кислотные дожди — Скульптура, пострадавшая от кислотного дождя Кислотный дождь все виды метеорологических осадков дождь, снег, град, туман, дождь со снегом, при котором наблюдается понижение pH дождевых осадков из за загрязнений воздуха кислотными оксидами (обычно … Википедия
кислотные осадки — дождь, снег или дождь со снегом, имеющие повышенную кислотность. Кислотные осадки возникают главным образом из за выбросов оксидов серы и азота в атмосферу при сжигании ископаемого топлива (угля, нефти и природного газа). Растворяясь в… … Географическая энциклопедия
оксиды — Соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (наприме, Na2О, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды подразделяют на… … Справочник технического переводчика
ОКСИДЫ — хим. соединения элементов с кислородом (устаревшее название окислы); один из важнейших классов хим. веществ. О. образуются чаще всего при непосредственном окислении простых и сложных веществ. Напр. при окислении углеводородов образуются О.… … Большая политехническая энциклопедия
КИСЛОТНЫЕ ДОЖДИ — (кислые дожди), характеризуются повышенным содержанием кислот (в основном серной); водородный показатель pH Современная энциклопедия
ОКСИДЫ — соединения элементов с кислородом. В О. степень окисления атома кислорода Ч2. К О. относятся все соед. элементов с кислородом, кроме содержащих атомы О, соединенные друг с другом (пероксиды, надпероксиды, озо ниды), и соед. фтора с кислородом… … Химическая энциклопедия
КИСЛОТНЫЕ ОСАДКИ — дождь, снег или дождь со снегом, имеющие повышенную кислотность. Кислотные осадки возникают главным образом из за выбросов оксидов серы и азота в атмосферу при сжигании ископаемого топлива (угля, нефти и природного газа). Растворяясь в… … Энциклопедия Кольера
Оксиды — [oxides] соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (например, Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды… … Энциклопедический словарь по металлургии
Химические свойства кислотных оксидов
1. Кислотные оксиды взаимодействуют с основными оксидами и основаниями с образованием солей.
При этом действует правило — хотя бы одному из оксидов должен соответствовать сильный гидроксид (кислота или щелочь).
Кислотные оксиды сильных и растворимых кислот взаимодействуют с любыми основными оксидами и основаниями:
Кислотные оксиды нерастворимых в воде и неустойчивых или летучих кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами. При этом возможно образование кислых и основных солей, в зависимости от соотношения и состава реагентов.
CuO + CO2 ≠
2. Кислотные оксиды взаимодействуют с водой с образованием кислот.
Исключение — оксид кремния, которому соответствует нерастворимая кремниевая кислота. Оксиды, которым соответствуют неустойчивые кислоты, как правило, реагируют с водой обратимо и в очень малой степени.
3. Кислотные оксиды взаимодействуют с амфотерными оксидами и гидроксидами с образованием соли или соли и воды.
Обратите внимание — с амфотерными оксидами и гидроксидами взаимодействуют, как правило, только оксиды сильных или средних кислот!
А вот оксид углерода (IV), которому соответствует слабая угольная кислота, с оксидом алюминия и гидроксидом алюминия уже не взаимодействует:
4. Кислотные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
5. Кислотные оксиды способны проявлять окислительные свойства.
Как правило, оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3 и др.). Сильные окислительные свойства проявляют и некоторые элементы с промежуточной степенью окисления (NO2 и др.).
6. Восстановительные свойства.
Восстановительные свойства, как правило, проявляют оксиды элементов в промежуточной степени окисления (CO, NO, SO2 и др.). При этом они окисляются до высшей или ближайшей устойчивой степени окисления.
Кислотные оксиды – список с примерами и формулами
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
Рис. 1. Виды оксидов.
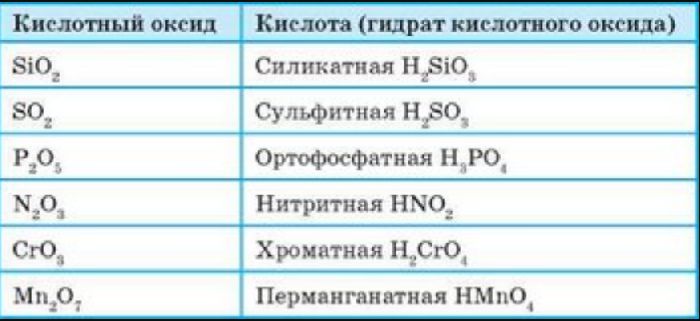
Основные свойства кислотных оксидов
Рис. 2. Кислотные оксиды с соответствующими кислотами.
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |
Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.