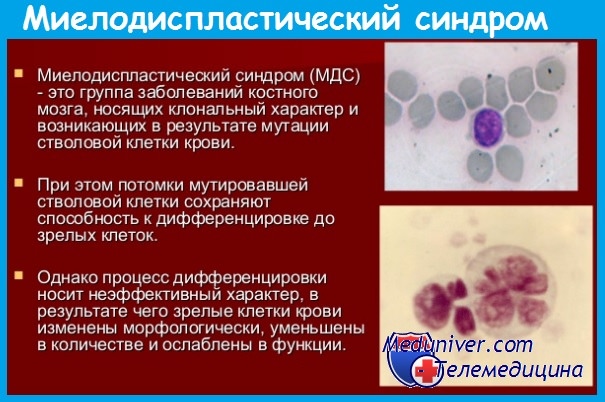
клональные заболевания что это
Клональные заболевания что это
При миелодиспластических синдромах, как и при лейкозах, клоновый характер кроветворения подтверждается обнаружением во всех клетках крови одного типа изофермента глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) у женщин, гетерозиготных по этому энзиму; в то время как гемопоэтические элементы у них содержат только один тип Г-6Ф-Д, в остальных клетках, в частности в фибробластах, определяются оба типа энзима.
Клоновый характер кроветворения подтверждается и цитогенетическими исследованиями, в том числе методом FISH (флюоресцентной гибридизацией in situ), позволяющим обнаруживать хромосомные аберрации в клетках как в метафазе, так и в интерфазе, методом RFLP (оценкой случайной ингибиции одной из Х-хромосом), а также исследованием онкогенов, включая их точечные мутации и реаранжировки (перестройки и утраты).
Имеются доказательства того, что первично при миелодиспластических синдромах (МДС) поражается стволовая кроветворная клетка. Это положение подтверждается выявлением изофермента А Г-6ФД у женщин, гетерозиготных по этому энзиму, с диагнозом «рефрактерная анемия с кольцевыми сидеробластами», не только в клетках миелоидного, но и лимфоидного ростков кроветворения.
Другим доказательством служит обнаружение одинаковых хромосомных аберраций в клетках миелоидной линии, В-лимфоцитах и стволовых клетках. Например, делеция 5q (5q-) была выявлена методом FISH не только в клетках миелоидной направленности дифференцировки, но и в лимфоидных клетках с про-В-иммунофенотипом (CD34+, CD19+), а также в стволовых клетках (CD34+, CD38).
Молекулярно-биологические методы исследования указывают на наличие мутации гена NRAS в гранулоцитах, моноцитах, Т- и В-лимфоцитах, а также генов, расположенных на хромосоме X лимфоцитов и кодирующих гипоксантинфосфорибозилтрансферазу (HPRT), а также фосфоглицераткиназу (PGK). Исследования полиморфизма гена, расположенного на хромосоме X, кодирующего рецептор андрогена у человека (HUMARA), также подтвердили вовлечение в клоновый процесс лимфоцитов.
Кроме того, о поражении стволовой клетки свидетельствует возможность трансформации заболевания не только в острый миелоидный, но и, крайне редко, — в острый лимфобластный лейкоз, преимущественно В-клеточной направленности дифференцировки. Описано несколько случаев ОЛЛ с характерными иммунологическими (TdT+, CD19+, CD10+) и цитогенетическими маркерами — t(4;11) или Ph’+(p190bcr-abl).
Кроме того, J. F. Leseve и соавт. описали два случая рефрактерной анемии с избытком бластов без трансформации в острый лейкоз с наличием хромосомы Ph’ и белка p190bcr-abl. В обзоре, опубликованном Т. J. Hamblin, указывается на 14 наблюдений билинейного и 7 — бифенотипического острого лейкоза, развившихся из миелодиспластического синдрома.
Однако существуют данные, указывающие на возможность первичного поражения при миелодиспластических синдромах (МДС) не стволовой клетки, а раннего миелоидного предшественника. Это предположение подтверждают исследования клеток крови и костного мозга больных миелодиспластическими синдромами (МДС), имеющих хромосомные аберрации, выявленные методами FISH и ПЦР (полимеразная цепная реакция). Например, по данным некоторых авторов, трисомия хромосомы 8 (+8) и моносомия хромосомы 7 (-7) были выявлены в клетках миелоидного ростка кроветворения, но отсутствовали в лимфоцитах.
Высказывается мнение, что описанные нарушения кариотипа, возможно, появляются на более позднем этапе болезни в результате дополнительных мутаций в миелоидном субклоне. Тем не менее современные методы исследования позволяют более убедительно говорить о происхождения патологического клона из стволовой клетки, что постулируется классификацией ВОЗ в отношении всех вариантов миелодиспластических синдромов (МДС).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Атеросклероз может провоцировать развитие клонального гемопоэза
Исследователи предложили рассматривать это нарушение кроветворения как следствие хронического воспаления при атеросклерозе
Множество исследований отметили связь между клональным гемопоэзом и атеросклерозом и сердечно-сосудистыми заболеваниями. Эта удивительная ассоциация вызвает большой интерес со стороны клиницистов и исследователей.
Сердечно-сосудистые заболевания являются основной причиной заболеваемости и смертности в большинстве стран. Они представляют собой серьезную проблему для общественного здравоохранения. Исследователи задались вопросом, способствует ли клональный гемопоэз формированию атеросклеротических бляшек. Это также заставило задуматься о возможности предотвращения сердечно-сосудистых заболеваний посредством влияния на гемопоэз.
Доктор Камила Наксерова, ведущий автор исследования, сказала: «Пациенты с атеросклерозом, по сути, переживают «ускорение времени» клеточного деления в организме. Это связано с тем, что скорость, с которой генетические изменения возникают и распространяются по кроветворной системе, определяется частотой деления стволовых клеток. Другими словами, атеросклероз ускоряет «старение» крови».
Наксерова отмечает, что полученные результаты потенциально могут быть хорошей новостью для пациентов с клональным гематопоэзом, так как в некоторых случаях он может быть относительно безобидным признаком сверхактивной системы кроветворения, а не самостоятельным заболеванием.
Уникальность проведенной работы заключается в том, что междисциплинарная команда исследователей включила математическое моделирование, чтобы предложить новую парадигму в области патогенеза атеросклероза, и дополнительно прояснила взаимосвязь между сердечно-сосудистыми заболеваниями и клональным гематопоэзом.
Хронические миелопролиферативные заболевания
Хронические миелопролиферативные заболевания — это группа патологий, при которых происходит неконтролируемый рост кровяных клеток. Нарушение вызвано генетическими мутациями.
Акции
Запись на консультацию со скидкой 10%.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
ХМПЗ (хроническое миелопролиферативное заболевание) — это группа патологических состояний организма, течение которых характеризуется неконтролируемым ростом клеток крови. Данное нарушение возникает в результате генетических мутаций. К ХМПЗ относят эозинофильный и нейтрофильный рак крови, миелолейкоз, эритремию, сублейкемический миелоз и хроническое миелопролиферативное заболевание эссенциальная тромбоцитемия.
Распространенность ХМПЗ невысокая. Обычно заболевает не более 1 человека на 100 000 населения. Точные причины развития данной патологии неизвестны. В ряде случаев имеется связь с наличием в анамнезе пациента других онкологических заболеваний, при лечении которых использовалась лучевая терапия и цитостатики.
Чаще всего заболевание диагностируют у людей среднего (от 40 лет) и пожилого возраста. У всех видов ХМПЗ есть общие характеристики, а именно:
Эффективность терапии хронической миелопролиферативной болезни зависит от вида патологии и ее стадии.
Классификация хронических миелопролиферативных заболеваний
Выделяют следующие виды ХМПЗ:
Все ХМПЗ характеризуется отсутствием диспластических изменений в костном мозге и кровяных клетках на начальных этапах заболевания.
Помимо вышеперечисленных видов в современной онкологии отдельно выделяют группу с миелоидной дисплазией, которая занимает промежуточное положение между ХМПЗ и миелодиспластическим синдромом.
Классификация ХМПЗ с миелодисплазией:
Причины и факторы риска развития ХМПЗ
МПЗ относятся к группе клональных заболеваний. Патологические изменения в организме при таких болезнях начинаются с одного либо нескольких сбоев в ДНК всего лишь одной стволовой клетки костного мозга.
По мере накопления патологически измененных клеток крови состояние пациента начинает ухудшаться. В большинстве случаев причина, по которой произошел запуск патологического процесса в костном мозге, остается неизвестной.
К факторам, которые могут спровоцировать развитие болезни, относят ошибки при делении клеток, факторы внешней среды, вредные привычки и так далее. ХМПЗ не относятся к наследственным заболеваниям, хотя зарегистрированы случаи возникновения истинной полицитемии, эссенциальной тромбоцитемии у членов одной семьи. Причиной развития ХМПЗ являются приобретенные генетические мутации, которые возникают во время жизни пациента.
Одним из основных факторов риска при миелопролиферативных патологиях является возраст больного. После 70 лет увеличивается клональное кроветворение, что повышает риск развития ХМПЗ в 11-13 раз.
Симптомы
Клинические проявления хронических миелопролиферативных заболеваний крови не специфичны, поэтому необходима тщательная дифференциальная диагностика с другими патологиями. На начальном этапе, когда опухолевая масса небольшая, у пациентов наблюдается умеренный лейкоцитоз.
Клинически заболевание может проявляться следующими симптомами:
При истинной полицитемии у пациентов повышается уровень гемоглобина в крови, что проявляется сильным покраснением кожи лица, которое многие ошибочно принимают за проявление алкоголизма. Кроме этого, одним из характерных симптомов данного заболевания ХМПЗ является кожный зуд, возникающий при контакте с водой. Одним из самых опасных состояний при ХМПЗ является тромбоцитоз (склонность к образованию тромбов). Это резко повышает риск закупорки крупных сосудов, что приводит к развитию инсультов, инфарктов и угрожает не только здоровью, но и жизни пациента.
Течение ХМПЗ хроническое. При отсутствии лечения болезнь со временем прогрессирует с возможным развитием острого миелолейкоза, миелодиспластического синдрома. Кроме этого наблюдается прогрессирующее увеличение размеров селезенки.
Диагностика хронической миелопролиферативной болезни
Основными методами диагностики ХМПЗ являются лабораторные методы исследования и биопсия.
Лабораторные методики
Биопсия
Взятие образцов костного мозга и последующее их исследование под микроскопом проводятся в большинстве случаев. При помощи данных методик проводят дифференциальную диагностику ХМПЗ от миелодиспластического синдрома. При проведении гистологии образцов костного мозга обнаруживают повышенное содержание паренхиматозных клеток. Миелофиброз диагностируют путем окрашивания образцов ткани ретикулином.
Пациенты с установленными диагнозами остаются под наблюдением гематолога пожизненно.
Методы лечения ХМПЗ
Для лечения хронических миелопролиферативных заболеваний часто применяют цитостатики. Препараты из этой группы обладают способностью воздействовать на конкретный гематологический росток, что позволяет уменьшить скорость патологического деления клеток крови.
Кроме этого, для лечения ХМПЗ могут использоваться препараты, которые снижают негативные последствия полицитемии (глюкокортикостероиды, средства для разжижения крови, противотромботические соединения и ряд других). С их помощью можно убрать повышенную вязкость крови, которая является следствием усиленного размножения кровяных клеток, снять общее воспаление, предотвратить тромбообразование.
Крайне важно при терапии ХМПЗ остановить аномальное увеличение селезенки. Для этого используют лучевую терапию. Если лечение не дает эффекта, то проводят операцию по удалению селезенки.
Кроме этого, для каждого вида ХМПЗ существуют свои специфические методы терапии. Например, при эозинофильном лейкозе показан прием антигистаминных средств, которые снижают проявления аллергии. При истинной полицитемии одним из вариантов терапии является кровопускание. При тромбоцитемии больным назначают антикоагулянты.
Если ХМПЗ диагностируют у молодых людей (что бывает редко), то возможно проведение радикального лечения, которое включает в себя пересадку стволовых клеток и приводит к полному выздоровлению. К сожалению, большинство пожилых людей в силу возраста не могут перенести эту операцию.
Прогноз при ХМПЗ крови
При хроническом миелопролиферативном лейкозе в течение 3-5 лет идет хроническое развитие заболевания. Затем наступает акселерированная фаза, которая переходит в бластный криз. После этого прогноз выживаемости — от нескольких месяцев до года.
Выживаемость при хронических миелопролиферативных болезнях при грамотной своевременно начатой терапии составляет около 20 лет. Если лечение не проводится, то пациент умирает в течение полутора лет. При этом с каждым месяцем повышается риск развития тромбоэмболий, что еще более ухудшает прогноз. Запущенная стадия заболеваний проявляется снижением уровня эритроцитов, что сопровождается усилением спленомегалии и изменениями в костном мозге.
Профилактика ХМПЗ
Эффективной специфической профилактики не существует. Для снижения вероятности развития ХМПЗ необходимо соблюдать следующие рекомендации:
Клональные заболевания что это
 |  |











 Фундаментальные исследования
Фундаментальные исследования