клостридии в кишечнике у ребенка чем лечить
Клостридиозы у детей
Клостридиозы — острые инфекционные заболевания человека и животных, которые вызваны клостридиями.
Клостридиозы классифицируют по механизму возникновения на травматические и энтеральные. К энтеральным относят: клостридиоз диффициле, клостридиоз перфрингенс, ботулизм. К травматическим относят газовую гангрену и столбняк. Ниже будут рассмотрены клостридиоз диффициле и клостридиоз перфрингенс.
Клостридиоз перфрингенс – острое заболевание инфекционной природы с энтеральным путем заражения, которое проявляется синдромом гастроэнтерита или энтероколита и инфекционным токсикозом, а в более редких случаях и некротическим энтеритом или сепсисом.
Клостридиоз диффициле – острое заболевание инфекционной природы (путь заражения также энтеральный), которое вызывается антибиотикоиндуцированными штаммами клостридий диффициле и проявляется диарейным синдромом с развитием псевдомембранозного колита и инфекционным токсикозом.
Что провоцирует / Причины Клостридиозов у детей:
Человек может заразиться только некоторыми представителями клостридий 2-й и 4-й групп, которые приводят к энтеральным клостридиозам, а также возбудителем столбняка и возбудителями газовой гангрены. Данные бактерии вырабатывают специфические активные экзотоксины.
Клостридии «проживают» в естественной среде в кишечниках животных и человека. Они могут там находиться длительное время и размножаться, но при этом к болезням не приводят. С каловыми массами клостридии попадают во внешнюю среду, в основном в землю. Там они могут «жить» долгий срок в виде спор.
Клостридии перфрингенс длительное время считали возбудителем лишь газовой гангрены. Но в середине прошлого столетия наши связь между данными бактериями и пищевыми токсикоинфекциями.
Клостридии перфрингенс представляю собой короткие полиморфные палочки, которые не имеют жгутиков. Могут образовывать субтерминально расположенные споры. Относятся к строгим анаэробам. Их делят на шесть типов в зависимости от способности производить экзотоксины и ферменты: А, В, С, D, Е, F.
Чаще всего детский кишечный клостридиоз спровоцирован клостридиями перфрингенс типа А, в более редких случаях – типами С и F.
Патогенез (что происходит?) во время Клостридиозов у детей:
Клостридиоз перфрингенс попадает в организме в ЖКТ (желудочно-кишечный тракт) вместе с зараженной едой. Далее они следуют в тонкий кишечник, там размножаются, приводя к развитию воспалительного процесса. Через эпителиальный слой кишечника ребенка они попадают в близлежащие ткани и кровь. Так заболевание переходит в тяжелую септическую форму (но не во всех случаях).
Клостридии перфрингенс продуцируют экзоэнтеротоксины, имеющие цитолитические и некротические свойства, что и определяет основные симптомы, которые проявляются в ходе заболевания.
В кишечнике, многих органах и системах (даже в ЦНС) экзотоксины клостридии перфрингенс приводят к функциональным и структурным изменениям. Может развиться токсикоз и эксикоз. К диарее приводит местный воспалительный процесс в кишечнике ребенка.
Патоморфология клостридиоза перфрингенс. Во время болезни максимальные структурные изменения случаются в тонкой или толстой (реже) кишке. У умерших фиксируют отечность слизистой оболочки кишечника, ее гиперемированность, множественные кровоизлияния, стазы, в более редких случаях и некрозы.
Клостридиоз диффициле начинается лишь во время или по окончанию применения антибиотиков широкого спектра действия, в особенности цефамизина, ампициллина, линкомицина и клиндамицина. Это происходит по причине подавления антибиотиками естественной флоры кишечника, вследствие чего клостридии диффициле могут колонизировать кишечник, размножаясь там и образовывая токсины.
Некоторые антибиотики приводят к энтеротоксинообразованию у бактерий. Помимо этого, нормальная кишечная флора у детей и взрослых производит бета-лактамазу — фермент, разрушающий бета-лактамное кольцо бета-лактамов, чем инактивируется действие антибиотика в кишечнике.
Симптомы Клостридиозов у детей:
Инкубационный период клостридиоза перфрингенс составляет от 6 до 24 часов. Это довольно короткий срок. Болезнь имеет острое начало. Проявляются такие симптомы:
С самого начала клостридиоза перфрингенс стул становится жидкой консистенции, частота дефекации повышается. Стул энтеритный или энтероколитный. Болезнь протекает относительно легко, выздоровление наступает на 3-4 сутки после начала.
Кишечный клостридиоза перфрингенс протекает иногда в тяжелых формах – по типу некротического энтероколита или энтерита. Такой форме болезни подвержены ослабленные дети с длительными дисфункциями желудочно-кишечного тракта; дети, которые пролечили антибиотиками широкого спектра действия; дети с кишечным дисбактериозом. Болезнь начинается по типу острого гастроэнтерита. Появляются боли в животе, частая рвота с наличием крови, стул обильный водянистый или пенистый (дефекация от 15 до 20 раз за сутки). В стуле может наблюдаться примесь крови или слизи. От старших детей поступают жалобы на разбитость и общую слабость, головокружения, боли в животе (могут быть постоянными или схваткообразными). Далее начинается обезвоживание организма ребенка, «падает» артериальное давление. Фиксируют увеличение печени и селезенки, парез кишечника (резкое вздутие живота).
Если болезнь прогрессирует и не вылечена вовремя, может случиться летальный исход вследствие нарушения сердечно-сосудистой деятельности. У ослабленных детей и грудничков инфекция может генерализироваться, развивается сепсис.
Кишечный клостридиоз диффициле в большинстве случаев по симптомам аналогичен псевдомембранозному колиту, в более редких случаях – некротическому энтероколиту или диарейному синдрому. Заболевания псевдомембранозным колитом характерны для грудничков, новорожденных и дошкольников.
Псевдомембранозиый колит появляется, как правило, через неделю-10 дней после начала приема антибиотиков. Болезнь начинается остро – поднимается температура, появляются срыгивания или повторная рвота, боли в животе и диарея. Малыши отказываются от еды, родители могут заметить вздутие живота и снижение массы тела.
Кожа приобретает бледно-серый оттенок, на коже живота часто видна сеть застойных вен. Стул становится жидким, водянистым, наблюдаются примеси слизи и крови (не всегда). В некоторых случаях большая часть стула представляет собой густую белесоватую слизь и обрывки фибринозных наложений. Иногда стул гнойный, с кровянистыми примесями. Для некоторых случаев характерно кишечное кровотечение, что часто приводит к летальному исходу.
Болезнь протекает у новорожденных (в особенности – у недоношенных) тяжело. Наблюдают профузный понос, обезвоживание, расстройство периферического кровообращения или расстройство кровообращения по типу коллапса без диареи.
Если есть изъязвление пораженных участков слизистой оболочки кишечника, могут фиксировать перформацию кишечника и каловый перитонит. При этом состояние ребенка тяжелые, кожа окрашивается в серый оттенок, дыхание поверхностное, резко выражен парез кишечника, наблюдаются гиподинамия и гипорефлексия, заостренность черт лица больного ребенка. Не исключена отечность гениталий. Если лечение не начато вовремя, есть вероятность летального исхода.
Клостридии диффициле, помимо некротических энтероколитов, псевдомембранозных колитов и кишечного сепсиса могут приводить к более легким болезням ЖКТ, которые протекают схоже с энтеритами и энтероколитами, особенностей не имеют.
Диагностика Клостридиозов у детей:
Кишечный клостридиоз перфрингенс диагностируют при помощи эпидемиологических и клинико-лабораторных данных в сумме. Для заболевания характерны острое начало, быстро развитие клинических проявлений – диареи, рвоты, повышения температуры, интоксикации или нейротоксикоза и т. д. Симптомы ярче всего выражены на 1-2 день после начала заболевания. Так же быстро «сходят на нет», как и появляются.
Такие симптомы характерны не только для данного заболевания, потому проводят лабораторную диагностику. Используют экспресс-методы (РНГА и ИФА) для обнаружения в фекалиях больного ребенка энтеротоксина. У выделенных штаммов клостридий определяют энтеротоксигенность.
В крови у больных с кишечным клостридиозом перфрингенс наблюдают умеренный лейкоцитоз и палочко-ядерный сдвиг.
Для диагностики кишечного клостридиоза диффициле необходимы сведения анамнеза о терапии антибиотиками, а также инструментальные и клинические показатели. Проводится комплекс лабораторных исследований для обнаружения в фекалиях больного ребенка специфических токсинов (энтеро- и цитотоксина) и возбудителя.
Селективное выделение клостридии диффициле проводят с помощью циклосерин-цефокситин-фруктозного агара. В последнее время диагностику энтероклостридиоза диффициле проводят с помощью высокочувствительных методов ИФА и РЛА.
Доказать клостридиоз диффициле с помощью только обнаружения возбудителя и его токсинов в кале или другом биоматериале от больного нельзя. Потому что данные микроорганизмы и токсины могут быть и у здорового человека, в основном у недавно рожденных и детей до 6 месяцев.
Лечение Клостридиозов у детей:
Лечебные мероприятия при кишечном клостридиозе перфрингенс аналогичны таковым при других бактериальных диареях. Назначают этиотропную терапию, учитывая чувствительность обнаруженных штаммов клостридий к антибиотикам. Врачи рекомендуют использовать для лечения энтеральные формы антибиотиков, к примеру, азитромицин, амоксиклав, цефалоспорины 3-го поколения и т. д.
Комплексная терапия включает бактерийные препараты, такие как бификол или бифидумбактерин, а также другие препараты для нормализации биоценоза кишечника. Бактерийные препараты служат для прекращения колонизации кишечника клостридиями. При особо тяжелых формах заболевания, если установлен тип возбудителя, для лечения могут применять антитоксическую сыворотку в дозе 5000—10000 АЕ внутримышечно по методу Безредки или энтерально.
Под этиотропной терапией антибиотикоиндуцированного кишечного клостридиоза диффициле подразумевают введение парентеральных аминогликозидов, метронидазола, цефалоспоринов.
После окончания приема антибиотиков следует назначить ребенку прием бактерийных препаратов (к примеру, линекса, бифидумбактерина, лактобактерина и пр). Это поможет нормализовать биоценоз в кишечнике.
Лечат клостридий диффициле также ферментными препаратами, например, фесталом, креоном и т. д., витаминами (в особенности – группой В). Необходима симптоматическая и патогенетическая терапия. Если есть соответствующие показания, применяют инфузионную терапию, чтобы нормализовать баланс жидкости в организме ребенка, провести дезинтоксикацию и парентеральное питание. Применяют антигистаминные препараты, а при тяжелых формах кортикостероиды и специфические антитоксические сыворотки.
Профилактика Клостридиозов у детей:
Самые важные профилактические меры заключаются в:
— строгом соблюдении санитарно-гигиенических норм приготовления, хранения и сбыта пищевых продуктов;
— активном выявлении носителей клостридий среди работников пищеблоков и детских учреждений;
— своевременной изоляции и лечении зараженных клостридиями детей и взрослых;
— санитарно-просветительной работе среди населения о правильном уходе за детьми и их кормлении;
— кратновременном хранении продуктов и термической обработке.
Профилактические меры при кишечном клостридиозе диффициле должны быть направлены, прежде всего, на предупреждение антибиотикоиндуцированности как важнейшего фактора заболевания этим клостридиозом.
Не следует использовать как профилактическое или лечебное средство антибактериальные лекарства широкого спектра действия длительными курсами.
Чтобы избежать колонизации кишечника клостридиями, необходимо вовремя лечить кишечный дисбактериоз и проводить его профилактику. В стационарах, особенно в отделениях для новорожденных, следует обеспечивать необходимый санитарно-гигиенический режим, правильную дезинфекцию инструментария, посуды, белья и т. д.
Обработка предметов проводится с помощью хлориндиоксида или его аналогов, имеющих бактерицидные и спороцидные свойства, влияющие на клостридий.
К каким докторам следует обращаться если у Вас Клостридиозы у детей:
Clostridium difficile
Разговор о клостридиях был бы неполным без самого внутрибольничного представителя оных — Clostridium difficile.
Автор: Трубачева Е.С., врач – клинический фармаколог
Разговор о клостридиях был бы неполным без самого внутрибольничного представителя оных — Clostridium difficile. К тому же сейчас самый подходящий случай о нем вспомнить, так как всевозможные схемы, в том числе и антибактериальной терапии, в лечении вирусных пневмоний, вызванных SARS-CoV-2, в перепрофилированных больницах могли еще сильнее натренировать внутрибольничную микрофлору, в состав которой и входит вышеупомянутая клостридия.
В настоящее время токсигенные штаммы C.difficile рассматриваются как однозначные возбудители внутрибольничных инфекций. То есть вызываемый ими псевдомембранозный колит является заболеванием, связанным с оказанием медицинской помощи, то есть ятрогенным. А все мы знаем, как Следственный Комитет к этому относится и, что самое главное, останавливаться не собирается (согласно последнему интервью председателя СК А. Бастрыкина). Поэтому необходимо максимально подробно разораться, как данное заболевание вызывается, что его провоцирует и как этого если не избежать, то максимально эффективно пролечить. Об этом и будет нынешний разговор.
Микробиологические аспекты
C.difficile, как и остальные клинически значимые клостридии, является строгим анаэробом. Основным поражающим фактором для нее, так же как и для остальных клостридий, являются токсины, и так же, как и другие клостридии, C.difficile умеет образовывать споры. Заболевание, вызываемое токсигенной C.difficile, именуется псевдомембранозным колитом.
Теперь отметим частности:
Эпидемиологические аспекты
Основным источником токсигенных C.difficile является либо больной, либо здоровый носитель. Путь распространения — фекально-оральный либо контактный. Так как споры C.difficile благополучно сохраняются до 180 суток, то некоторые вспышки могут происходить без видимо определяемого источника — достаточно плохо убранных туалетных помещений стационаров, а также давно или неправильно обработанных матрасов. Кроме того, если вдруг в отделении оказался бессимптомный носитель C.difficile из числа медицинского персонала, а остальные не особенно привыкли мыть руки, то эти самые споры будет разносить каждый второй сотрудник уже не отделения, а всей больницы — на руках, халатах, смартфонах, рассаживая ее по столам, перилам и клавиатурам, совершенно бессимптомно для себя, но с катастрофическими последствиями для больных.
Почему именно стационары? Потому что именно здесь используется самое большое количество антибактериальных препаратов, в том числе не всегда обоснованно, и C.difficile может получить селективное преимущество ввиду уменьшения количества бактерий-антагонистов, ранее сдерживавших ее размножение и токсиновыделение.
В каких отделениях чаще всего возможны случаи (или даже целые вспышки) псевдомебранозных колитов?
Поэтому если ваш пациент в течение недавнего прошлого оказывался по какой-либо причине в одном из таких отделений, то надо иметь в виду риск возможного носительства токсигенных C.difficile и развития ПМК в случае назначения антибиотиков.
Какие антибиотики чаще всего провоцируют рост количества тоскигенных C.difficile и развитие псевдомембранозного колита?
Проще говоря, то, что выбивает из толстой кишки основных конкурентов C.difficile, то и обеспечивает высокие риски развития ПМК. Но, помимо антибиотиков, ПМК провоцируют и цитостатические препараты, такие, как, например, препараты платины и метотрексат.
Какие пациенты подвергаются риску заражения токсигенной C.difficile и развитию ПМК? Чаще всего это изначально тяжелые пациенты с ожогами, после операций на толстом кишечнике, пациенты с почечной недостаточностью и любые пациенты, находящиеся в отделениях реанимации и интенсивной терапии. А пациенты с ВИЧ почему-то показывают статистику, аналогичную основной популяции — не больше и не меньше.
Исходя из всего сказанного, главным в деле сдерживания C.difficile является профилактика, краеугольным камнем которой стоит эпидемиологический надзор. Только тотальная чистота рук, туалетных комнат, как у пациентов, так и персонала, а также строжайшее выполнение требований СанПина, особенно в лечебных учреждениях, уже столкнувшихся с этим зверем, способна предотвратить новые случаи. Напомню, что летальность при псевдомембранозном колите — более 50%, а при развившемся токсическом мегаколоне — 100%.
Клинические аспекты
Основная проблема, связанная с C.difficile, — это ее диагностика. С одной стороны, все просто — давно есть коммерческие тест-системы, позволяющие проведение экспресс-тестов для обнаружения токсинов, с другой — ну и кто, положа руку на сердце, хоть раз в живую их видел? Автор за 15 лет работы не видела ни разу. Микробиологическая же диагностика требует наличия в лаборатории не только анаэробного анализатора, но еще и специально обученного бактериолога. И где всю эту роскошь взять? Вот и приходится практическому врачу ставить диагноз исходя из клинических проявлений, не забывая о дифдиагностике с другими возможными инфекционными заболевания толстого и тонкого кишечника (про которые мы уже написали в более ранних статьях: см. здесь, здесь и здесь). Кроме того необходимо думать о внутрибольничных кишечных инфекциях, которые тоже никто не отменял (хотя и давно не видел).
При этом нужно помнить и об антибиотик-ассоциированных диареях, ничего общего с ПМК и C.difficile не имеющими и объясняющимися исключительно фармакодинамикой назначенных препаратов. Например, диарея, связанная с приемом амоксициллина/клавуланата вызвана тем, что метаболиты оного стимулируют моторику толстой кишки, или макролиды, действующие на мотилиновые рецепторы и вызывающие точно такую же диарею. А уж когда эти два препарата назначены в комбинации, как любят делать в амбулаторной практике, то антибиотик-ассоциированная диарея не прилетит только к самым стойким пациентам. Кстати, если до сих пор не предупреждаете пациентов об этом чрезвычайно слабительном эффекте — то начинайте. Но, повторимся, к C.difficile это все не имеет совершенно никакого отношения. Почти всегда амбулаторные состояния решаются заменой препарата на что-то менее агрессивное в отношении кишечника и пересмотром сопутствующей терапии (например, там могут оказаться еще и НПВС, которые тоже способны провоцировать диарею).
Чем же диарея при инфицировании C.difficile отличается от всего остального? Четкой связью с госпитализацией и началом приема антибиотиков, особенно если пациент за пару месяцев до попадания к нам в руки побывал на госпитализации в ранее указанных отделениях. Если на третий день после назначения, например, цефтриаксона у такого пациента развилась диарея, тут же должен прозвучать тревожный звоночек. Если есть доступ к экспресс-тестам — определить наличие токсинов, если нет, то сразу отменять антибиотик. Если необходимость в антибактериальной терапии все еще существует, менять его на препарат из безопасного перечня. Бета-лактамы не назначать! Никакие! До выяснения происходящего с пациентом. За самим пациентом в это время (сутки, максимум двое) необходимо очень внимательно наблюдать и ни в коем случае не назначать никаких препаратов, снижающих моторику кишечника.
Если смена антибактериального препарата ничего в состоянии пациента не изменила, количество эпизодов диареи тоже нарастает или начинает пальпироваться напряженная толстая кишка, то речь может идти уже о псевдомембранозном колите, подтвердить который можно эндоскопическими методами, где в заключении будет указано наличие характерных псевдомембран на отдельных участках или всем протяжении толстой кишки, доступной к осмотру.
Чем и как лечить?
В чем преимущество метронидазола? Он не вызывает селекции резистентных штаммов энтерококков (об энтерококках мы рассуждали здесь), более доступен и в разы дешевле даже самого дешевого ванкомицина. При этом в связи с бесконтрольным его использованием на любой случай диареи образовал уже довольно приличный пул штаммов C.difficile, к нему устойчивых, поэтому метронидазол не стоит назначать пациентам, у которых уже наблюдались эпизоды внутрибольничных диарей, им же леченные, так как не факт, что перед вами не окажется пациент с уже перенесенным эпизодом ПМК, которому вегетативные C.difficile выбили, а споры устойчивых форм именно сейчас дождались своего часа.
Clostridium difficile-инфекция у детей
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Р ациональная антибиотикотерапия является одной из важнейших составляющих в лечении детей с различными инфекционно–воспалительными заболеваниями. Однако широкое и не всегда обоснованное применение антибиотиков в педиатрической практике нередко приводит к развитию разнообразных осложнений (аллергические и токсические реакции, дисбактериозы и др.) [8,12]. Особое место среди антибиотико–индуцированных осложнений занимают дисбактериозы кишечника, которые могут сопровождаться суперинфекцией и клинически значимой активацией условно–патогенных энтеробактерий с развитием колитов и энтероколитов. При этом В.Ф. Учайкин и А.А. Новокшенов (1999) подчеркивают, что до 20% всех антибиотико–ассоциированных диарей и 90–100% псевдомембранозных колитов обусловлено Clostridium difficile–инфекцией [9].
Clostridium difficile–инфекция (клостридиоз диффициле) – острая, антропонозная, анаэробная инфекция с энтеральным путем заражения, характеризующаяся различной степенью выраженности клинических проявлений – от бессимптомного бактерионосительства и легких диарей до тяжелых форм заболевания в виде псевдомембранозного колита.
Этиология. Возбудитель клостридиоза диффициле – Clostridium difficile – строго анаэробная, спорообразующая, грамположительная бацилла [7]. Вегетативные формы Clostridium difficile обладают способностью продуцировать экзотоксины, среди которых идентифицированы повреждающие кишечную стенку энтеротоксин (токсин А) и цитотоксин (токсин В) [7,11,16]. Установлено, что токсин А, стимулируя гуанилатциклазу, повышает секрецию жидкости в просвет кишечника и способствует развитию диареи. Токсин В обладает выраженным цитопатогенным действием. Предполагают, что ингибируя процессы синтеза белка в энтеро– и колоноцитах, токсин В нарушает функции их клеточных мембран. Это приводит к потере калия и развитию электролитных нарушений. Споры Clostridium difficile проявляют высокую устойчивость к факторам внешней среды и стандартным дезсредствам, а вегетативные формы резистентны к большинству антибиотиков (природные и полусинтетические пенициллины, ингибитор–защищенные пенициллины, цефалоспорины, линкозамиды и др.) [5,7,11,14].
Эпидемиология. Clostridium difficile часто обнаруживаются в окружающей среде и могут быть изолированы из почвы [7,9,12]. Основной механизм передачи инфекции – фекально–оральный. Источником инфекции является человек (чаще – пациенты, получающие антибиотики широкого спектра действия, и дети). Установлено, что частота контаминации кишечника Clostridium difficile у здоровых новорожденных и младенцев может составлять более 50%, тогда как у детей старше 2 лет, а также у здоровых взрослых уровень инфицированности не превышает 5% [3,9,12]. В то же время у взрослых, находящихся на лечении в различных стационарах, частота носительства Clostridium difficile значительно выше и может достигать 10–20% [4,5]. При этом отмечено, что трансмиссия вегетативных форм Clostridium difficile от инфицированных (дети, медицинский персонал, лица, осуществляющие уход за больными и сами пациенты) к здоровым лицам осуществляется через такие факторы передачи, как руки и предметы ухода. Кроме этого, установлена возможность широкого контаминирования Clostridium difficile различных внутригоспитальных объектов (постельные принадлежности, мебель, душевые, туалеты и др.) [3–6]. Бытовая передача Clostridium difficile с участием различных факторов создает серьезный риск развития внутрибольничной инфекции, особенно у пациентов, получающих массивную антибактериальную терапию. Контингентами риска по развитию тяжелых форм нозокомиальной Clostridium difficile–инфекции являются и дети раннего возраста (ослабленные), а также пациенты, длительно находящиеся в стационаре [3,9,12].
Установлено, что основным фактором риска по развитию тяжелых форм заболевания является антибиотикотерапия. При этом В.А. Малов и соавт. (1999) подчеркивают, что даже однократный прием антибиотика широкого спектра действия, независимо от дозы и способа введения, может привести к развитию диареи и псевдомембранозного колита, обусловленных Clostridium difficile [6]. К факторам риска также относят повторные очистительные клизмы, длительное использование назогастрального зонда, оперативные вмешательства на органах желудочно–кишечного тракта и продолжительное пребывание пациентов в стационаре [2–6,12]. В то же время установлено, что диарея и колит, обусловленные Clostridium difficile, могут развиваться не только в стационаре, но и в амбулаторных условиях при использовании антибиотиков широкого спектра действия, особенно у ослабленных пациентов и детей раннего возраста [15].
Патогенез и патоморфология. В основе патогенеза клинически манифестных форм Clostridium difficile–инфекции – антибиотико–ассоциированной диареи и псевдомембранозного колита – лежит снижение колонизационной резистентности кишечника. Под действием антибиотиков и других повреждающих факторов нарушается интестинальный микробный пейзаж. Значительное угнетение при этом анаэробной части нормальной микрофлоры кишечника сопровождается возникновением благоприятных условий для размножения Clostridium difficile и перехода её в токсинобразующую форму. При этом основными факторами патогенности Clostridium difficile являются токсины А и В, приводящие к повреждению стенки кишечника, в то время как непосредственно сам возбудитель не обладает инвазивными свойствами и не оказывает цитотоксического воздействия на слизистые кишечника [5,7,11,16].
При легких вариантах Clostridium difficile–ассоциированной диареи морфологическая картина характеризуется умеренной гиперемией и незначительным отеком слизистой кишечника, тогда как при тяжелых – отмечаются выраженные воспалительные изменения. При развитии наиболее тяжелой формы заболевания (псевдомембранозный колит) на фоне резко выраженных воспалительно–геморрагических изменений слизистой кишечника обнаруживают небольшие по размеру (чаще – до 2–5 мм, реже – до 20 мм и более в диаметре) возвышающиеся желтоватые бляшки, плотно связанные с подлежащими тканями. Бляшки образованы скоплением фибрина, муцина и клеток, участвующих в воспалении. Сливаясь, бляшки образуют псевдомембраны. В отдельных случаях слизистая может быть покрыта толстым слоем фибринозно–пленчатых наложений на значительном протяжении кишечника. Пленки, при расплавлении, могут отторгаться, обнажая изъязвленную поверхность кишечной стенки [1,2,9,17].
Клинические проявления. Клостридиум диффициле–инфекция может протекать в виде асимптоматического бактерионосительства, особенно у новорожденных и детей первого года жизни, или нетяжелой диареи («антибиотико–ассоциированная диарея»), а также приводить к развитию псевдомембранозного колита.
Значительное распространение (более 50%) асимптоматического бактерионосительства Clostridium difficile у новорожденных детей и младенцев и крайне низкая частота развития у них манифестных форм инфекции объясняется, по–видимому, особенностями строения клеточной мембраны кишечного эпителия. Предполагается, что у детей раннего возраста эпителиальные клетки слизистых оболочек кишечника не имеют рецепторов к токсинам Clostridium difficile. Вероятно, что в формировании транзиторной резистентности к данной инфекции имеет значение и наличие у детей первого полугодия жизни материнских антиклостридиальных антител, полученных трансплацентарно [5,6,9].
Clostridium difficile–ассоциированная диарея у детей часто характеризуется клиническими симптомами нетяжелого колита или энтероколита и обычно протекает без лихорадки и интоксикации. При этом возможно появление болей в животе, но чаще болезненность со стороны кишечника выявляется лишь при его пальпации. Отмечается легкое или умеренное учащение дефекации, как правило, не приводящее к выраженным водно–электролитным нарушениям [9,12].
Клинические проявления псевдомембранозного колита у детей обычно развиваются остро и характеризуются отказом от еды, лихорадкой, интоксикацией, диареей, срыгиванием, вздутием и болями в животе спастического характера (абдоминальные колики), болезненной пальпацией живота по ходу толстого кишечника [9,12]. Стул частый, в каловых массах – примесь слизи и крови (реже). Иногда бoльшая часть испражнений представлена густой белесоватой слизью и обрывками фибринозных наложений. В случаях резко выраженного учащения стула развивается эксикоз с нарушениями кровообращения, значительно реже отмечается коллапс без предшествующей диареи. Течение псевдомембранозного колита может осложниться кишечным кровотечением, перфорацией и развитием перитонита [6,9,12]. Поэтому для своевременного выявления этих грозных осложнений за пациентами с тяжелыми формами клостридиоза диффициле должно проводиться совместное наблюдение педиатра и хирурга.
Крайне тяжелые и летальные случаи Clostridium difficile–инфекции в большинстве случаев отмечаются у детей с выраженной нейтропенией на фоне лейкемии, у младенцев с болезнью Гиршпрунга и у пациентов с хроническими воспалительными заболеваниями кишечника (болезнь Крона, неспецифический язвенный колит) [12].
Описаны случаи рецидивирующего течения манифестных форм клостридиоза диффициле, при которых отмена этиотропной терапии или использование антибиотиков в последующие периоды жизни ребенка вновь сопровождались развитием колита. Причинами рецидивов при этом считают такие факторы, как неполная элиминация кишечника от Clostridium difficile и реинфекция [5,12].
Следует еще раз подчеркнуть, что хотя наиболее часто Clostridium difficile–ассоциированная диарея и псевдомембранозный колит возникают у детей, находящихся в стационаре и получающих антибиотики, но могут встречаться и у лиц, уже выписанных из больницы, или развиться спустя 1–2 недели после отмены антибактериальной терапии.
Нельзя забывать и о том, что в редких случаях клостридиоз диффициле возникает без предшествующей госпитализации, а использование антибиотиков в амбулаторных условиях также может сопровождаться развитием заболевания [12,15].
Диагностика. При подозрении на антибиотико–ассоциированную диарею и псевдомембранозный колит кал пациентов должен быть подвергнут исследованию на наличие Clostridium difficile и их токсинов. При этом основным лабораторным критерием диагностики данной инфекции является детекция токсинов Clostridium difficile в фекалиях. Для этого используются методы иммуно–ферментного анализа (ИФА) и цитотоксический тест на культурах клеток с использованием специфических антисывороток в реакции нейтрализации. При этом метод ИФА по специфичности и чувствительности уступает цитотоксическому тесту. Среди последних наибольшая чувствительность отмечена при детекции в культуре клеток токсина В. Поэтому «золотым стандартом» лабораторной диагностики Clostridium difficile–инфекции является цитотоксический тест, направленный на обнаружение токсина В. Метод латекс–агглютинации менее специфичен и чувствителен и поэтому в настоящее время используется все реже [5,12].
Следует отметить, что для этиологической расшифровки диареи у новорожденных и детей первых месяцев жизни выявление токсинов А и В не имеет диагностического значения. Это связано с транзиторной резистентностью детей данного возраста к токсинам Clostridium difficile, что и определяет минимальный риск развития у них манифестных форм заболевания [9].
Обнаружение при эндоскопическом обследовании толстого кишечника желтоватых бляшек, возвышающихся над «ломкой», легко травматизируемой, гиперемированной слизистой, а также наличие толстого слоя наложений и даже участки изъязвлений в крайне тяжелых случаях являются верифицирующими признаками псевдомембранозного колита и могут использоваться при проведении дифференциального диагноза [1,2,6,12,17].
При бактерионосительстве Clostridium difficile и легких вариантах антибиотико–ассоциированной диареи гемограмма, как правило, характеризуется нормальными показателями. При манифестных формах инфекции изменения в клиническом анализе крови носят неспецифический характер и характеризуются нейтрофильным лейкоцитозом, сдвигом лейкоцитарной формулы влево, а также ускорением СОЭ [6,9].
Лечение. Асимптоматическое бактерионосительство Clostridium difficile у здоровых детей не требует проведения терапевтических мероприятий.
При развитии манифестных форм инфекции, независимо от степени выраженности клинических проявлений, принципиальным положением является незамедлительная отмена используемых антибиотиков (табл. 1).
Вопрос о необходимости назначения этиотропной терапии в каждом конкретном случае должен решаться индивидуально с учетом возраста ребенка, тяжести заболевания и фоновых состояний. Так, при легких вариантах Clostridium difficile–ассоциированных диарей, развившихся у детей с благополучным преморбидным фоном, назначение этиотропного лечения не требуется. В то же время у детей раннего возраста, ослабленных, у пациентов с нейтропенией, тяжелыми хроническими заболеваниями и пороками развития (особенно ЖКТ) даже при легких формах инфекции назначение антиклостридиальных препаратов считается обоснованным. Абсолютными показаниями для этиотропной терапии являются тяжелые формы заболевания, продолжающаяся после отмены антибиотиков диарея, а также рецидив инфекции на фоне повторного приема антибиотиков (табл. 1).
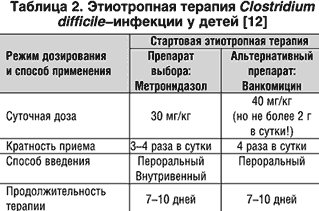
Clostridium difficile высокочувствительны к метронидазолу и ванкомицину (табл. 2). При этом стартовую этиотропную терапию клостридиоза диффициле в большинстве случаев начинают с введения метронидазола, который считается препаратом выбора. Ванкомицин является альтернативным антибиотиком для лечения данной инфекции и назначается как «препарат первой линии» лишь в тех случаях, когда введение метронидазола противопоказано (индивидуальная непереносимость, тяжелые поражения печени и нервной системы, выраженная лейкопения) [12].
Метронидазол для лечения Clostridium difficile–инфекции применяется в суточной дозе 30 мг/кг. Суточная доза вводится ребенку в 3–4 приема [12]. При этом метронидазол, в отличие от ванкомицина, может вводиться как перорально, так и парентерально – путем внутривенной инфузии. В тех случаях, когда у ребенка с клостридиозом диффициле выражены тошнота, срыгивания или рвота, стартовая этиотропная терапия должна начинаться с парентерального введения метронидазола. При купировании указанных симптомов и улучшении общего состояния целесообразно заменить внутривенное введение метронидазола на оральный его прием. При приеме внутрь препарат быстро и хорошо всасывается (биодоступность – 80–100%). Связывание с белками крови составляет 20%. При внутривенном введении достигаются высокие концентрации метронидазола во всех тканях организма [18]. Метаболизируясь в печени путем окисления и глюкуронизации, метронидазол экскретируется почками (до 80%) и кишечником (до 15%). Метронидазол замедляет метаболизм непрямых антикоагулянтов, что приводит к усилению их эффекта и может способствовать развитию геморрагических осложнений. Терапевтический эффект метронидазола могут уменьшить индукторы печеночного метаболизма (барбитураты, противосудорожные препараты, рифампицин). В то же время препараты, ингибирующие микросомальные ферменты гепатоцитов (циметидин), снижают метаболизм метронидазола, что может привести к повышению его содержания в организме [18].
Ванкомицин – антибиотик из группы гликопептидов – также обладает выраженным бактерицидным действием на Clostridium difficile. Однако при клостридиозе диффициле его рекомендовано использовать, как «препарат второй линии», когда отсутствует клинический эффект от стартовой терапии, либо в качестве альтернативного антибиотика у детей с противопоказаниями к применению метронидазола. Ограничения к широкому использованию ванкомицина объясняются попыткой снизить риск развития устойчивости к нему грамположительной флоры, в первую очередь стафилококков и энтерококков. Это связано с тем, что ванкомицин в настоящее время является одним из немногих антибактериальных препаратов, эффективных при инфекциях, вызванных метициллин–резистентными штаммами стафилококка. В случаях необходимости применения ванкомицина при клостридиозе диффициле используется только оральный способ его введения. При приеме внутрь препарат практически не всасывается из кишечника и почти целиком выделяется с калом [18]. Суточная доза ванкомицина при Clostridium difficile–инфекции составляет 40 мг/кг, распределенная в 3–4 приема. При этом в сутки ребенок не должен получать более 2 г препарата. Продолжительность терапии – 7–10 дней [12].
Особое внимание необходимо обратить на то, что при пероральном введении этиотропных лекарственных средств недопустимо одновременно применять энтеросорбенты (холестирамин, активированный уголь и др.). Это объясняется возможным уменьшением терапевтического эффекта антибиотиков из–за их связывания с энтеросорбентами в просвете кишечника [6,12]. В целом использование энтеросорбентов может быть оправдано лишь при легких вариантах Clostridium difficile–ассоциированной диареи, когда нет показаний для назначения этиотропных лекарственных средств или в тех случаях тяжело протекающего заболевания, когда метронидазол вводится парентерально.
По показаниям при тяжелых формах клостридиоза диффициле проводится также по–синдромная терапия, направленная на нормализацию выявленных изменений гомеостаза (водно–электролитный дисбаланс, токсикоз, гемодинамические нарушения, геморрагический синдром и др.) [9]. При тяжелых вариантах инфекции обсуждается также возможность применения внутривенных иммуноглобулинов [6]. Обоснованием для этого явилось обнаружение антитоксинов А и В (антитела к экзотоксинам Clostridium difficile) в препаратах нормального человеческого иммуноглобулина для внутривенного введения. При этом В.А. Малов и соавт. (1999) подчеркивают, что включение внутривенных иммуноглобулинов в комплексную терапию тяжелых форм клостридиоза диффициле сопровождалось быстрым прекращением диареи, купированием болей в животе и нормализацией температуры тела.
Особо следует отметить, что при тяжелых формах Clostridium difficile–ассоциированной диареи и псевдомембранозном колите нельзя использовать препараты, уменьшающие моторику кишечника [12, 18].
После отмены антимикробных препаратов детям, перенесшим Clostridium difficile–инфекцию, для полной санации кишечника от спор возбудителя целесообразно провести курсовое лечение пробиотиками (бифидимбактерин и др.) [2,6,9].
Профилактика клостридиоза диффициле заключается в строгом соблюдении правил личной гигиены, а также в неукоснительном выполнении всех требований по соблюдению санитарно–противоэпидемического режима лечебных учреждений. Нельзя также недооценивать и такой фактор в профилактике Clostridium difficile–инфекции, как уменьшение частоты бесконтрольного и необоснованного использования антибиотиков. Таким образом, основными резервами снижения заболеваемости у детей клостридиозом диффициле являются улучшение санитарной культуры населения в целом и повышение профессионализма медицинских работников.
1. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. – М.: Триада–Х, 1998.
2. Ерохин И.А., Шляпников С.А., Лебедев В.Ф., Иванов Г.А. Псевдомембранозный колит и «кишечный сепсис» – следствие дисбактериоза, вызванного Clostridium difficile.// Вестник хирургии им. И.И. Грекова Т. 156, №2, 1997. – С. 108–111.
3. Клостридиозы. // Профилактика внутрибольничных инфекций. Руководство для врачей под ред. проф. Е.П.Ковалевой, проф. Н.А.Семиной. – М.: Рарогъ, 1993. – С. 55–59.
4. Ковалева Е.П., Семина Н.А., Семененко Т.А., Галкин В.В. Справочник госпитального эпидемиолога. – М.: Хризостом, 1999. – С. 136–139.
5. Малов В.А., Бондаренко В.М., Пак С.Г. Роль Clostridium difficile в патологии человека.//Журн.микробиол.–1996.–№1.–С.91–96.
6. Малов В. А., Пак С. Г., Беликов Д. В.// Лечащий врач. 1999. – 2–3.
7. Медицинская микробиология./ Под ред. В.И.Покровского, О.К.Поздеева. – М: ГЭОТАР МЕДИЦИНА, 1999.
8. Планельес Х.Х., Харитонова А.М. Побочные явления при антибиотикотерапии бактериальных инфекций. – М.: Медицина, 1976. – 430.
9. Учайкин В.Ф. Руководство по инфекционным заболеваниям у детей. – М.: Гэотар Медицина, 1998. – С. 492–494.
10. Фэкети Р. (Fekety R.), Дюпон Х.Л. (DuPont H.L.), Куперсток М. (Cooperstok M.) и др. Лечение колита, связанного с приемом антибиотиков. // Европейское руководство по клинической оценке противоинфекционных лекарственных средств/ Под ред. Т.Р.Бим (T.R.Beam) – Пер. с англ. под ред. академика РАМН А.Г.Чучалина и проф. Л.С.Страчунского. – Смоленск: Амипресс, 1996. – С. 302–306.
11. Bartlett J.G. Antibiotic–associated pseudomembranous colitis due to toxin producing clostridia. //N. Engl.J.Med. – 1978. – Vol.298. – P.531.
12. Clostridium difficile. // In Red Book: 2000. Report of the Committee on Infection Diseases. 25rd: American Academy of Pediatrics, 2000, P. 214–216.
13. Larson H.E., Prise A.B., Honour P. et al. Pseudomembranous colitis: present of clostridial toxin. // Lancet. – 1977. – P. 1312–1314.
14. Larson H.E., Prise A.B., Honour P. et al. Clostridium difficile and etiology pseudomembranous colitis. // Lancet. – 1978. – №1. – P. 1063–1066.
15. Mitchell D.K., Van R., Mason E.H. at al. Prospective study of toxigenic Clostridium difficilе children given amoxicillin/clavulanate for otitis media. // Pediatr. Inf. Dis. J. – 1996. – 15. – P. 514–519.
16. Mitchell T.J., Ketley J.M., Haslam S.C. et al. Effect of toxin A and B of Clostridium difficile on rabbit ileum and collon. // Gut. – 1986. – 27. – P. 78–85.
17. Prise A.B., Davies D.R.D. Pseudomembranous colitis. // J. Clin. Pathol. – 1977. –30. – P. 1–12.
18. The Pharmacological Basis of Therapeutics – Goodman &. Gilman’s. – 8th Ed.