коэффициент генри что это
Закон Генри в химии: формула, таблица константы для газов, формулировка закона
Содержание:
На границе раздела газа и жидкости образуется «поверхностный слой». Закон Генри рассматривает то, как двигаются молекулы жидкости и газа. Он основан на растворимости газов.
Парциальное давление
Общее давление равно 1 атм, или 760 мм.рт.ст., но в законе Генри используется парциальное давление. Например, в системе находится 10 молекул (5 молекул одного газа и 5 молекул другого газа). Чтобы найти парциальное давление, необходимо учитывать только 50 % от общего числа молекул. Т. о. парциальное давление равно 380 мм.рт.ст, т. к. учитывается только 50 % молекул.
Если в системе находится 8 молекул одного газа и 2 молекулы другого газа, то парциальное давление изменится. Для 8 молекул (80 % от общего числа молекул) парциальное давление составляет 680 мм.рт.ст. Т. о., если увеличивается число молекул, значит, увеличивается и парциальное давление.
Коэффициент пропорциональности, или константа Генри
Молекулы газа постоянно движутся, поэтому могут попадать в жидкость. Молекула, которая переместилась в жидкость, может также вернуться в газовую фазу. Множество молекул стремится перейти в газовую среду, т. к. в жидкости становится тесно. Это явление называется коэффициентом пропорциональности КН.
Коэффициент пропорциональности учитывает три фактора:
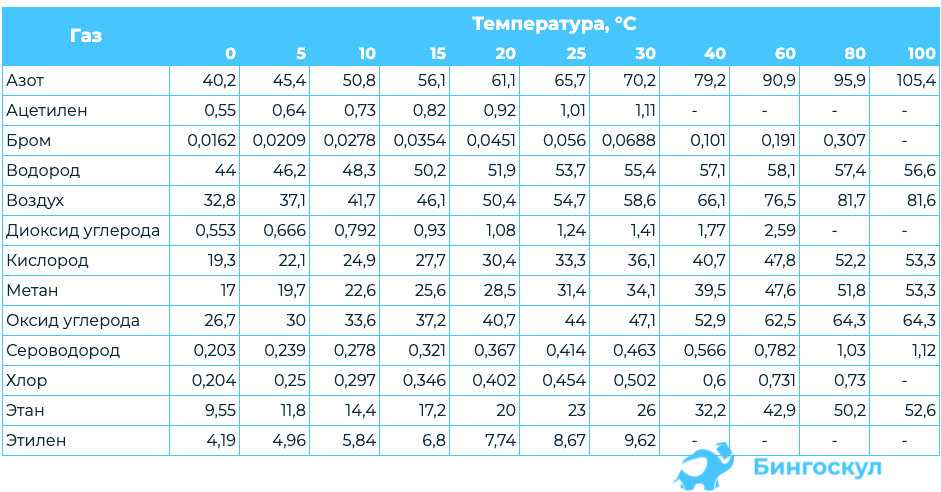
Коэффициент пропорциональности – это табличное значение. Он зависит от природы газа, растворителя и температуры. Константы Генри для газов представлены в таблице.
Закон Генри
Парциальное давление р указывает на вероятность попадания молекулы в жидкость, а коэффициент пропорциональности КН – на вероятность выхода молекулы. При наблюдении поверхностного слоя можно оценить количество поступивших в жидкость частиц и количество вышедших частиц. Также можно отметить количество молекул на поверхностном слое, т. е. концентрацию. Концентрацию можно найти с помощью закона Генри, формула которого:
С = КН * р, где
Закон Генри звучит следующим образом: «при постоянной температуре растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью».
Значение закона Генри
Закон Генри объясняет причины кесонной болезни. Также он обосновывает применение барокамеры. Барокамера применяется для лечения язв, ожогов, обморожений, последствий синдрома длительного сдавления.
Закон Генри
Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон описан английским химиком У. Генри в 1803 г.
Формула
Закон Генри записывается обычно следующим образом:



| Уравнение: |  |  |  |  |
| другие имена для k: |  | — | — |  |
| Размерность: |  |  |  |  |
Различные константы Генри могут быть преобразованы друг в друга, например
См. также
Публикации
Полезное
Смотреть что такое «Закон Генри» в других словарях:
ЗАКОН ГЕНРИ — ЗАКОН ГЕНРИ, закон физической химии, который гласит, что масса газа, растворенного в данном количестве жидкости прямо пропорциональна давлению газа над жидкостью, при постоянной температуре. Таким образом, чем больше давление газа, тем больше он… … Научно-технический энциклопедический словарь
закон Генри — – закон, устанавливающий прямо пропорциональную зависимость между растворимостью газа и его парциальным давлением над раствором. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
закон Генри — [Henry s law] при постоянной температуре растворимость газа (по массе) в данной жидкости прямо пропорцинально давлению этого газа над раствором. Он описан английским химиком У. Генри в 1803 г., хорошо соблюдается только для идеальных растворов и… … Энциклопедический словарь по металлургии
Закон Генри — ► Henry s law Объем газа, растворенного в единице объем жидкости, прямо пропорционален давлению, если температура остается постоянной, а жидкость и газ не действуют друг на друга химически. Коэффициент пропорциональности, входящий в уравнение… … Нефтегазовая микроэнциклопедия
Закон Генри — Дальтона — относится к растворимости газов в жидкости в зависимости от упругости этого газа, производящего давление на жидкость. Joseph Henry … Википедия
закон Генри о поглощении газов — Henrio dujų sugerties dėsnis statusas T sritis fizika atitikmenys: angl. Henry’s gas absorption law vok. Henrysches Gasabsorptionsgesetz, n rus. закон Генри о поглощении газов, m pranc. loi de Henry d’absorption des gaz, f … Fizikos terminų žodynas
закон генрі — закон Генри Henry s law *Henrysches Gesetz – маса m газу, розчиненого в рідині даного об єму, при сталій температурі пропорційна парціальному тиску р цього газу над розчином m = KГр, де КГ – константа Генрі, залежна від природи газу й темпера… … Гірничий енциклопедичний словник
Генри, Уильям (химик) — Уильям Генри (12 декабря 1774 2 сентября 1836) британский химик. Он был сыном Генри Томаса, родился в Манчестере, Англия[1] … Википедия
закон наименьшего сопротивления — [law of least resistance] при возможности перемещения точек деформируемого тела в разных направлениях каждая точка этого тела перемещается в направлении наименьшего сопротивления. Этот закон находит проявление, в частности, в принципе кратчайшей… … Энциклопедический словарь по металлургии
закон излучения Стефана — Больцмана — [Stefan Boltzmann radiation law] закон, устанавливающий пропорциональность 4 й степени абсолютной температуры T, полной объемной плотности ρ равновесного излучения (ρ = α • Т4, где α постоянная) и связанной с ней полной испускательной способности … Энциклопедический словарь по металлургии
Закон Генри
Из Википедии — свободной энциклопедии
Зако́н Ге́нри, Закон Генри — Дальтона — закон, по которому при постоянной температуре растворимость (концентрация) газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон описан английским химиком У. Генри в 1803 г.
Энциклопедичный YouTube
Субтитры
Предположим, вы смотрите на границу соприкосновения газа (я выделю её жёлтым) и жидкости, (отмечу её голубым). Жидкость, которую я собираюсь использовать в этом примере, — Н2О, или вода. Нас интересует, что происходит вот тут. Это ваше глазное яблоко, и вы смотрите, что происходит в поверхностном слое. Запишем, так как это важный момент. Вы смотрите на поверхностный слой воды. Вас интересует, как двигаются молекулы. Скажем, у вас есть несколько фиолетовых молекул и несколько зелёных молекул. По 4 молекулы каждого цвета, 50% фиолетовых и 50% зелёных. А здесь внизу у вас несколько молекул воды. Вот здесь я нарисую кислород, а также немного водорода. Это маленький водород на молекулах воды. Это Н2О. Всё это происходит в гигантской кружке воды. Это большая кружка воды. Фиолетовые и зелёные молекулы представляют какой-то вид молекул. Мы не знаем, какой это газ, просто какой-то гипотетический газ. С его помощью я хочу объяснить вам суть парциального давления. Мы знаем, что общее давление равно 1 атмосфере, или 760 мм рт. ст. Меня интересуют только зелёные молекулы, точнее их парциальное давление. Чтобы его рассчитать, я должен принять во внимание, что из 8 молекул 4 молекулы зелёного цвета, т. е. 50% зелёных молекул. Мне также известно, что общее давление составляет (напишу это тем же цветом) 760 мм рт. ст. А количество зелёных молекул, как я сказал, составляет 50%. Это означает, что парциальное давление зелёных молекул составляет половину от 760, т. е. 380. Это и есть парциальное давление зелёных молекул, я только что его узнал. Я мог бы всё немного усложнить. Что было бы, если бы я удалил эти 2 молекулы и заменил их зелёными молекулами? Теперь газ выглядит по-другому. У меня 6 зелёных молекул из 8. Каково теперь парциальное давление? Конечно, 6 из 8 означает, что процент стал другим. Поэтому у меня здесь и здесь новые цифры. Как я сказал, новое число — 75%. 75% умножить на 760 равно 570 мм рт. ст. Это моё новое парциальное давление. Я рассмотрел этот процесс, потому что хотел показать вам то, как можно понять парциальное давление, которое заключается в количестве молекул, в группе молекул. Если доля молекул увеличивается, то увеличивается и парциальное давление. Что именно происходит, когда появляется больше молекул? С точки зрения человека, который смотрит на поверхностный слой, это, конечно же, постоянно движущиеся во всех направлениях молекулы. Время от времени эти зелёные молекулы спускаются вниз, в жидкость. Они постоянно сталкиваются, случайно пара этих зелёных молекул может оказаться внизу, в поверхностном слое. Именно это и можно наблюдать. Возможно, это происходило бы намного чаще, если бы было больше зелёных молекул. Другими словами, более высокое парциальное давление приведёт к тому, что большее количество молекул фактически перейдёт из части кружки, заполненной газом, в часть кружки, заполненную водой. Не хочу повторяться, просто хочу подчеркнуть, что с увеличением парциального давления становится всё больше зелёных молекул, попадающих в жидкость. Попытайтесь сконцентрироваться на этой маленькой зелёной молекуле, которая находится вот здесь, вот в этом месте. Представим, что она только что попала в мир Н2О и пытается понять, что же ей теперь делать. Первое, что она может сделать, — это выпрыгнуть назад. Вы согласны, что она могла бы это сделать? Если она вошла в жидкую фазу, то она может вернуться в газообразное состояние. Множество молекул хотят это сделать, они хотят выйти из жидкости, так как в жидкости стало тесно. Она стала переполненной, и множеству молекул Н2О вокруг это совсем не нравится. Вы можете просто взглянуть в таблицу и выяснить, что это значение записывается как K с маленькой h. А эта К с маленькой h — постоянная. Это постоянное значение, которое указано в таблице. К с нижним индексом h учитывает такие вещи, как растворённое вещество, о котором мы говорим. Когда я говорю «растворённое вещество», в нашем примере я имею в виду эти зелёные молекулы. Но вообще-то это может быть и зелёная молекула, и фиолетовая, и синяя. Значит, постоянная учитывает растворённое вещество, а также растворитель. Будь это вода, или хозяйственное мыло, или этанол, или другая жидкость, которая могла бы нас заинтересовать. Также учитывается температура. Мы знаем, что молекулы, которые хотят выйти из воды, особенно те, которые предпочитают вернуться в газовое состояние, более охотно и в большем количестве делают это при повышении температуры. Помните, что при высокой температуре маленькие молекулы Н2О танцуют вокруг и трясутся, что позволяет им высвободиться и выйти. Итак, у нас есть 3 важных вопроса. Что такое растворённое вещество? Что является растворителем? И какова температура? Если вы знаете эти 3 вещи, то, как я уже сказал, вы можете взглянуть в таблицу, где указано значение Kh. То есть вы узнаете то, что показывает красная стрелка, — вероятность покидания молекулами поверхностного слоя. Как и раньше, когда мы говорили о попадании в жидкость, теперь поговорим о выходе из жидкости. Kh, значения которой вы можете найти в таблице, как я уже отметил, скажет вам о вероятности выхода молекул из жидкости. А парциальное давление говорит вам о вероятности попадания в жидкость. Теперь давайте вернёмся к человеку, который очень терпеливо наблюдает. Если вы посмотрите на поверхностный слой, вы действительно сможете проверить, сколько молекул входит и сколько молекул выходит. Вы также можете рассчитать концентрацию молекул в поверхностном слое. Примерно таким образом: давление, или парциальное давление, делённое на K с нижним индексом h равно концентрации. Я всё запишу. Вот здесь концентрация. О двух других мы уже говорили. P — это парциальное давление, которое указано здесь. Парциальное давление. К с нижним индексом h — постоянная, которая указана вот тут. Поэтому, если вы поделите эти 2 значения, то вычислите концентрацию, в данном примере — концентрацию зелёных молекул в поверхностном слое. Концентрацию зелёных молекул в поверхностном слое. О чём это говорит нам? Допустим, вы вычислили концентрацию зелёных молекул в поверхностном слое. Ну и что это значит? Это, друзья мои, формула, которая (не уверен, узнали ли вы) представляет собой закон Генри. Закон Генри. Человек по имени Уильям Генри (Генри — это на самом деле его фамилия) изобрёл эту замечательную формулу. Иногда её можно увидеть в другой форме. Вы можете видеть, что р равняется концентрации, умноженной на К с нижним индексом h. Всё зависит от того, как вы собираетесь её представить, но это одна и та же формула. По сути эта формула — замечательный способ увидеть молекулы, которые входят в жидкость, и молекулы, которые хотят выйти из жидкости. Фактически она даёт представление о концентрации молекул в поверхностном слое. Другими словами, существует взаимосвязь между парциальным давлением и концентрацией в жидкости. Это великолепный подход к пониманию всего процесса. Я надеюсь, что благодаря описанию К с нижним индексом h вы лучше поняли его значение.
Закон Генри
Масса газа, растворенного в жидкости, пропорциональна давлению газа над поверхностью жидкости.
Закон Генри описывает процесс растворения газа в жидкости. Что представляет собой жидкость, в которой растворен газ, мы знаем на примере газированных напитков — безалкогольных, слабоалкогольных, а по большим праздникам — шампанского. Во всех этих напитках растворена двуокись углерода (химическая формула CO2) — безвредный газ, используемый в пищевой промышленности по причине его хорошей растворимости в воде, а пенятся после открытия бутылки или банки все эти напитки по той причине, что растворенный газ начинает выделяться из жидкости в атмосферу, поскольку после открытия герметичного сосуда давление внутри падает.
Собственно, закон Генри констатирует достаточно простой факт: чем выше давление газа над поверхностью жидкости, тем труднее растворенному в ней газу высвободиться. И это совершенно логично с точки зрения молекулярно-кинетической теории, поскольку молекуле газа, чтобы вырваться на свободу с поверхности жидкости, нужно преодолеть энергию соударений с молекулами газа над поверхностью, а чем выше давление и, как следствие, число молекул в приграничной области, тем сложнее растворенной молекуле преодолеть этот барьер.
Закон Генри объясняет и другое свойство шипучих напитков — характерную пену, которая так и стремится выплеснуться наружу после того, как вы открыли бутылку газировки или (если повезет) шампанского. Чтобы закачать в напиток побольше газа, производители нарочно закупоривают бутылки и банки под большим приповерхностном давлении, а в шампанском оно и вовсе нагнетается само в процессе ферментации и естественного выделения двуокиси углерода внутри бутылки.
Когда вы дергаете за кольцо банки или открываете бутылку, углекислый газ, находящийся внутри под высоким давлением, производит характерный хлопок или шипение. Давление над поверхностью жидкости стремительно падает, уравниваясь с атмосферным давлением, и молекулы CO2 начинают беспрепятственно выделяться из напитка, в котором были растворены, в результате чего напиток пузырится и пенится. Рано или поздно растворенный углекислый газ выделится из жидкости практически весь, направленное к поверхности давление растворенного в жидкости CO2 сравняется с атмосферным, и напиток перестанет пениться и пузыриться. Вот почему шипучие напитки в откупоренном виде выдыхаются — и достаточно быстро.
Оказывается, физический смысл можно найти даже в банке газировки.
Английский химик и физик. Родился в семье владельца химической мануфактуры в г. Манчестер. Учился на медицинском факультете Эдинбургского университета, окончив его, работал в морге в Манчестере. Унаследовав семейную химическую мануфактуру, посвятил свободное время физико-химическим исследованиям. Помимо закона, названного его именем, Генри открыл химическую формулу аммиака и обнаружил различие между метаном и этиленом. Помимо исследований (на которые он потратил значительную часть семейного наследства) Генри оставил после себя учебник «Элементы экспериментальной химии» (Elements of Experimental Chemistry), признанный самым удачным учебником по химии первой половины XIX века. Близким другом и сотрудником Генри был другой видный ученый того времени Джон Дальтон (см. Закон Дальтона), а сын Уильяма Генри старшего Уильям Чарльз Генри (William Charles Henry) впоследствии написал первую и наиболее полную биографию друга своего отца.
Закон Генри уравнения, отклонения, приложения
Закон Генри устанавливает, что при постоянной температуре количество газа, растворенного в жидкости, прямо пропорционально его парциальному давлению на поверхности жидкости.
Он был постулирован в 1803 году английским физиком и химиком Уильямом Генри. Его закон также можно интерпретировать следующим образом: если давление на жидкость увеличивается, тем большее количество газа растворяется в ней.
Здесь газ рассматривается как раствор раствора. В отличие от твердого растворенного вещества, температура отрицательно влияет на его растворимость. Таким образом, при повышении температуры газ имеет тенденцию легче выходить из жидкости к поверхности.
Это связано с тем, что повышение температуры обеспечивает энергию газообразным молекулам, которые сталкиваются друг с другом, образуя пузырьки (верхнее изображение). Затем эти пузырьки преодолевают внешнее давление и выходят из жидкости.
Если внешнее давление очень высокое, а жидкость остается холодной, пузырьки будут растворяться, и только несколько газообразных молекул будут «преследовать» поверхность.
Уравнение закона Генри
Это можно выразить следующим уравнением:
Количество газообразных частиц, составляющих смесь, представлено N. Например, если на поверхности жидкости есть водяной пар и СО2, N равно 2.
отклонение
Для газов, плохо растворимых в жидкостях, решение приближается идеально, в соответствии с законом Генри для растворенного вещества.
Однако когда давление высокое, возникает отклонение от Генри, потому что раствор перестает вести себя как идеально разбавленный.
Что это значит? Что взаимодействия растворенного вещества и растворенного вещества начинают иметь свои собственные эффекты. Когда раствор сильно разбавлен, молекулы газа «исключительно» окружены растворителем, презирая возможные столкновения между собой..
Поэтому, когда раствор перестает быть идеально разбавленным, наблюдается потеря линейного поведения на графике PЯ против ХЯ.
В заключение к этому аспекту: закон Генри определяет давление пара растворенного вещества в идеальном разбавленном растворе. В отношении растворителя действует закон Рауля:
Растворимость газа в жидкости
Когда газ хорошо растворяется в жидкости, как сахар в воде, его невозможно отличить от окружающей среды, образуя гомогенный раствор. Другими словами: в жидкости не наблюдается пузырьков (или кристаллов сахара).
Однако эффективная сольватация газообразных молекул зависит от некоторых переменных, таких как: температура жидкости, давление, которое на нее влияет, и химическая природа этих молекул по сравнению с жидкостью..
Если внешнее давление очень высокое, шансы проникновения газа на поверхность жидкости возрастают. А с другой стороны, растворенным газообразным молекулам сложнее преодолеть падающее давление, чтобы добиться выхода наружу.
Если газожидкостная система находится в состоянии перемешивания (как это происходит в море и в воздушных насосах внутри резервуара), поглощение газа является предпочтительным.
И как природа растворителя влияет на поглощение газа? Если он полярный, как вода, он будет проявлять сродство к полярным растворам, то есть к тем газам, которые имеют постоянный дипольный момент. Хотя, если он неполярный, такой как углеводороды или жиры, он предпочтет неполярные газообразные молекулы
Например, аммиак3) является газом, который очень хорошо растворяется в воде благодаря взаимодействию водородных связей. Пока что водород (Н2), чья малая молекула неполярна, слабо взаимодействует с водой.
Также в зависимости от состояния процесса абсорбции газа в жидкости в них могут быть установлены следующие состояния:
ненасыщенный
Жидкость ненасыщенная, когда она способна растворять больше газа. Это потому, что внешнее давление больше, чем внутреннее давление жидкости.
насыщенный
Жидкость устанавливает баланс в растворимости газа, что означает, что газ выходит с той же скоростью, с которой он проникает в жидкость.
Это также можно увидеть следующим образом: если три молекулы газа попадут в воздух, три другие вернутся в жидкость одновременно.
перенасыщенный
Жидкость перенасыщена газом, когда ее внутреннее давление выше, чем внешнее давление. И, до минимального изменения в системе, он будет выпускать избыток растворенного газа, пока не восстановится равновесие.
приложений
— Закон Генри может быть применен для расчета поглощения инертных газов (азота, гелия, аргона и т. Д.) В различных тканях человеческого тела, и что вместе с теорией Холдейна являются основой таблиц декомпрессия.
— Важным применением является насыщение газа кровью. Когда кровь ненасыщена, газ растворяется в ней, пока она не насыщается и не прекращает больше растворяться. Как только это происходит, растворенный в крови газ попадает в воздух.
— Газификация безалкогольных напитков является примером применения закона Генри. Безалкогольные напитки имеют СО2 растворяется при высоком давлении, сохраняя тем самым каждый из объединенных компонентов, которые его составляют; а также, он сохраняет характерный вкус гораздо дольше.
Когда бутылка с газировкой открыта, давление на жидкость снижается, сбрасывая давление на месте.
Поскольку давление на жидкость теперь ниже, растворимость СО2 он спускается и уходит в атмосферу (это можно заметить при всплытии пузырьков снизу).
— Когда дайвер спускается на большую глубину, вдыхаемый азот не может вырваться, потому что внешнее давление препятствует ему, растворяясь в крови человека..
Когда дайвер быстро поднимается на поверхность, где внешнее давление становится ниже, азот начинает пузыриться в крови.
Это вызывает то, что известно как дискомфорт декомпрессии. Именно по этой причине дайверы должны медленно подниматься, чтобы азот выходил из крови медленнее.
— Изучение влияния снижения молекулярного кислорода (О2) растворены в крови и тканях альпинистов или практикующих специалистов, связанных с длительным пребыванием на больших высотах, а также у жителей достаточно высоких мест.
— Исследование и усовершенствование методов, используемых для предотвращения стихийных бедствий, которые могут быть вызваны присутствием растворенных газов в огромных водоемах, которые могут быть выброшены с применением силы.
примеров
Закон Генри применяется только тогда, когда молекулы находятся в равновесии. Вот несколько примеров:
— В растворе кислорода (O2) в крови эта молекула считается плохо растворимой в воде, хотя ее растворимость значительно возрастает из-за высокого содержания в ней гемоглобина. Таким образом, каждая молекула гемоглобина может связываться с четырьмя молекулами кислорода, которые выделяются в тканях для использования в обмене веществ..
— В 1986 году из озера Ньос (расположенного в Камеруне) внезапно было выброшено густое облако углекислого газа, которое задушило около 1700 человек и большое количество животных, что объясняется этим законом..
— Растворимость, которую определенный газ проявляет в жидком виде, обычно увеличивается с увеличением давления газа, хотя при определенных высоких давлениях существуют определенные исключения, такие как молекулы азота (N2).
— Закон Генри не применим, когда существует химическая реакция между веществом, действующим как растворенное вещество, и веществом, действующим как растворитель; Так обстоит дело с электролитами, такими как соляная кислота (HCl).