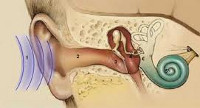
кохлеопатия что это такое
Неврит кохлеарный. Причины, симптомы и лечение
1. Общие сведения
Кохлеарный неврит – собирательный диагноз, обобщающий состояния тугоухости вследствие поражения слухового нерва; широко употребляются также (в одних случаях как синоним, в других – как обозначение осевого симптома) термины «нейросенсорная тугоухость» и «сенсоневральная тугоухость».
В отличие от абсолютного большинства диагнозов с окончанием на «-ит», кохлеарный неврит не подразумевает доминирующего этиопатогенетического значения инфекционно-воспалительных процессов. Некоторые авторы, определяя объем и содержание данного понятия, вообще настаивает на неинфекционном характере поражения; в других источниках вуалируется значение воспалительного фактора, и т.д. Вообще говоря, формулировка «кохлеарный неврит» относится к тем диагнозам, которые воспринимаются и интерпретируются (даже специалистами) больше на интуитивном, чем на рациональном уровне. Англоязычный термин «Auditory neuropathy» (слуховая невропатия) представляется несколько более удачным.
Так или иначе, тугоухость, обусловленная поражениями слуховых нейронных проводников, широко распространена: согласно современным данным, это наиболее частая причина частичной или полной утраты слуха. При этом эпидемиологические оценки, публикуемые в разных источниках, существенно расходятся. В первом приближении и с учетом сводок ВОЗ, общее количество тугоухих в мире составляет не менее 300 млн чел. По другим сведениям, этот показатель еще выше и достигает 10% населения земного шара, из которых фактическими инвалидами являются 125 миллионов человек (три четверти из них – жители беднейших стран). По России число социально-значимой тугоухости оценивается на уровне 13 млн чел, при этом как минимум миллион приходится на лиц детского и подросткового возраста.
Таким образом, частичная или полная утрата слуха – одна из глобальных проблем здравоохранения, и ее острота драматически усугубляется тем, что на сегодняшний день не существует подлинно эффективных способов лечения кохлеарного неврита как доминирующего этиопатогенетического фактора тугоухости.
2. Причины
Как видно из перечисленного, в большинстве случаев кохлеарный неврит носит приобретенный характер. Встречается, однако, и врожденная нейросенсорная тугоухость, обусловленная, как правило, наследственными факторами и выступающая одним из элементов того или иного хромосомного синдрома.
3. Симптомы и диагностика
Наиболее типичными проявлениями кохлеарного неврита, помимо собственно тугоухости, являются ощущения постоянного постороннего шума в голове и асимметричность снижения слуха. У некоторых больных отмечается также комплекс вестибулярных нарушений (головокружения, расстройства координации и равновесия, шаткость походки и т.п.).
Очевидно, что любая тугоухость, в т.ч. обусловленная кохлеарным невритом, является социально-значимой проблемой, поскольку приводит к нарушениям коммуникации и социального функционирования, требует применения слуховых аппаратов, во многих случаях ограничивает или исключает профессиональную пригодность, провоцирует развитие психологических расстройств депрессивного регистра.
Степень функциональной несостоятельности слухового анализатора устанавливается в серии аудиометрических, камертональных и других подобных проб. Производится отоскопия, микроотоскопия; назначаются также электрокохлеаграфия, вестибулометрические исследования, консультации (и соответствующие обследования) профильных специалистов, батарея лабораторных тестов.
4. Лечение
Эффективная этиотропная терапия возможна лишь в тех случаях, когда идентифицированы причины поражения нерва и когда эти причины носят обратимый характер. В разных ситуациях назначается неврологическое, антибиотическое, противовирусное, физиотерапевтическое лечение (роль и возможности последнего весьма велики и до настоящего времени исследованы недостаточно). В некоторых случаях слух восстанавливается после хирургической операции, устраняющей, например, фактор механического давления на нерв.
Согласно публикуемым сегодня данным, значительного улучшения или полного восстановления слуховой функции удается добиться примерно в 80% случаев. При неэффективности всех принимаемых мер подбирается слуховой аппарат; характеристики и дизайн современных высокотехнологичных цифровых моделей позволяют кардинально снизить психологические, социальные и профессиональные ограничения, обусловленные тугоухостью.
Кохлеарный неврит
Кохлеарный неврит — поражение слухового нерва, приводящее к понижению слуха и появлению постоянного шума в ухе. Кохлеарный неврит может быть вызван целым рядом факторов, обуславливающих поражение различных отделов слухового анализатора от звуковоспринимающих клеток внутреннего уха до слухового центра коры головного мозга. Клинически он проявляется снижением слуха и шумом в ухе, которые в некоторых случаях сопровождаются вестибулярными нарушениями. Диагностика кохлеарного неврита включает аудиометрию и другие методы исследования слуха, отоскопию, исследование вестибулярной функции, биохимические анализы, рентгенографию, КТ и МРТ. Лечение проводится сосудистыми препаратами, нейропротекторами, дезинтоксикационными растворами, физиотерапевтическими средствами. При значительном снижении слуха показано слухопротезирование. В отдельных случаях возможно применение хирургических методов лечения.
Общие сведения
По данным мировой статистики около 6% всех людей, населяющих земной шар, в той или иной степени страдают нарушениями слуха. Большая часть случаев снижения или потери слуха приходится на кохлеарный неврит. Заболевание также носит названия сенсоневральная или нейросенсорная тугоухость, неврит слухового нерва. Чаще оно имеет односторонний характер, реже отмечается двустороннее поражение слухового нерва. Кроме снижения слуха различной выраженности в 90% случаев кохлеарный неврит сопровождается шумом в ухе.
Классификация кохлеарного неврита
По причине возникновения кохлеарный неврит в отоларингологии классифицируют на врожденный и приобретенный. Последний также подразделяют на посттравматический, ишемический, постинфекционный, токсический, лучевой, аллергический, профессиональный. По времени появления кохлеарный неврит делят на прелингвальный — возникающий у детей до развития речи и постлингвальный — наступающий у пациентов с развитой речью.
По уровню поражения слухового анализатора кохлеарный неврит классифицируют на периферический, связанный в основном с нарушениями звуковосприятия во внутреннем ухе, и центральный — обусловленный патологическими процессами в слуховых структурах головного мозга.
В зависимости от давности заболевания выделяют 3 формы приобретенного кохлеарного неврита: острую (не более 1 месяца), подострую (от 1 до 3 месяцев) и хроническую (более 3 месяцев). По характеру течения различают обратимый, стабильный и прогрессирующий кохлеарный неврит.
По данным пороговой аудиометрии выделяют 4 степени тугоухости при кохлеарном неврите: легкую (I степень) с порогом воспринимаемых звуков в 26-40 дБ, умеренную (II степень) с порогом 41-55 дБ, умеренно тяжелую (III степень) — 56-70 дБ и тяжелую (IV степень) — 71-90 дБ, а также полную глухоту.
Причины врожденного кохлеарного неврита
Врожденный кохлеарный неврит может быть обусловлен патологией на генетическом уровне или нарушениями, произошедшими во время родов. Наследственный кохлеарный неврит чаще наблюдается в сочетании с другими генетическими нарушениями. К наследственным заболеваниям с аутосомно-доминантным путем передачи, в клинику которых входит кохлеарный неврит, относятся: синдром Ваарденбурга, синдром Стиклера, бранхиооторенальный синдром. Аутосомно-рецессивными заболеваниями, для которых характерен кохлеарный неврит, являются: синдром Ушера, синдром Пендреда, болезнь Рефсума, биотинидазная недостаточность. Кохлеарный неврит может наследоваться и как патология, сцепленная с Х-хромосомой. Например, при синдроме Альпорта, проявляющегося снижением слуха, прогрессирующим гломерулонефритом и различными нарушениями зрения.
Возникновение кохлеарного неврита в родах связано с родовой травмой или гипоксией плода, которая может развиться при дискоординированной родовой деятельности, преждевременных родах, затяжном течении родов по причине слабости родовой деятельности, узкого таза роженицы или тазового предлежания плода.
Причины приобретенного кохлеарного неврита
Приобретенный кохлеарный неврит в 30% случаев обусловлен инфекционными заболеваниями. В первую очередь это краснуха, эпидемический паротит, грипп, корь, ОРВИ, герпетическая инфекция, затем идут скарлатина, эпидемический менингит, сифилис, сыпной и брюшной тиф.
Около 10-15% кохлеарного неврита обусловлены токсическим поражением слухового нерва. К применяемым в медицине ототоксическим веществам относятся: антибиотики (неомицин, канамицин, гентамицин, стрептомицин и др.), цитостатики (циплатин, циклофосфамид), салицилаты, препараты хинина, диуретики, препараты для лечения аритмии. Причиной кохлеарного неврита могут стать интоксикации, вызванные мышьяком, солями тяжелых металлов, бензином, фосфором и пр. Токсический кохлеарный неврит может быть связан с профессиональной деятельностью. Также профессиональный характер имеют кохлеарные невриты, развивающиеся при хроническом воздействии шума и вибрации.
Возникновение кохлеарного неврита может быть вызвано нарушением его кровоснабжения в результате атеросклероза, тромбоза, гипертонической болезни, сосудистых нарушений в вертебро-базилярном бассейне при хронической ишемии головного мозга, последствиях перенесенного геморрагического или ишемического инсульта.
Посттравматический кохлеарный неврит связан с черепно-мозговой травмой, повреждением слухового нерва в ходе оперативных вмешательств, нарушением работы звуковоспринимающего аппарата в результате баротравмы уха и развившегося после нее аэроотита. В некоторых случаях появление кохлеарного неврита наблюдалось после акустической травмы, полученной при воздействии сильного звука (свистка, выстрела и т. п.).
К прочим факторам, провоцирующим возникновение кохлеарного неврита, относят аллергические реакции, невриному слухового нерва, гипопаратиреоз, сахарный диабет, серповидноклеточную анемию, воздействие радиации, болезнь Педжета, опухоли головного мозга. Развитие кохлеарного неврита может быть следствием процессов старения, происходящих в слуховом нерве у людей старше 60 лет.
Симптомы кохлеарного неврита
Клиника кохлеарного неврита в большинстве случаев складывается из двух основных симптомов: снижения слуха и постоянного шума в ухе. Характерно также нарушение латерализации звука. При одностороннем поражении отмечается смещение воспринимаемого звука ближе к здоровому уху, при двустороннем — к тому уху, которое лучше слышит.
Внезапно возникающий кохлеарный неврит характеризуется развивающимся в течение нескольких часов нарушением слуха, обычно носящим односторонний характер. В большинстве случаев пациент обнаруживает появившиеся проблемы со слухом после пробуждения от ночного сна. В других случаях острая форма кохлеарного неврита может развиваться в течении 2-3 суток. Острый кохлеарный неврит может переходить в подострую и хроническую форму. В течении хронического кохлеарного неврита выделяют 2 стадии: стабильную и прогрессирующую. Последняя проявляется усугублением нарушения слуха с течением времени и может привести к глухоте.
В некоторых случаях кохлеарного неврита тугоухость сопровождается различными вестибулярными симптомами: приступообразным головокружением, которое может протекать с тошнотой и рвотой; нарушением равновесия; неустойчивостью, усиливающейся при резком повороте головы; неуверенностью при ходьбе. Двусторонний кохлеарный неврит часто приводит к снижению эмоциональности и выразительности речи пациентов, является причиной их замкнутости и социальной дезадаптированности.
Диагностика кохлеарного неврита
Важное значение имеет не только установка диагноза кохлеарного неврита, но также определение причины и уровня поражения слухового анализатора, оценка степени и динамики снижения слуха. В ходе диагностических исследований отоларингологу необходимо исключить наличие других заболеваний, сопровождающихся понижением слуха (болезни Меньера, отита, отосклероза, инородного тела уха, лабиринтита).
Выявление понижения слуха проводится путем аудиометрии. Тональная пороговая аудиометрия позволяет определить степень тугоухости. При этом для кохлеарного неврита характерно отсутствие костно-воздушного интервала и нисходящий характер аудиограммы, свидетельствующий о нарушении восприятия преимущественно высоких тонов. Исследование латерализации звука проводится при помощи теста Вебера. При надпороговой аудиометрии определяется ускорение нарастания громкости. У маленьких детей основным способом выявления нарушения слуха является исследование слуховых вызванных потенциалов. Акустическая импедансометрия проводится для исключения нарушений слуха, вызванных патологией звукопроведения. Электрокохлеография дает возможность дифференцировать кохлеарный неврит от болезни Меньера. Для исключения заболеваний наружного уха и изменений со стороны барабанной перепонки проводится отоскопия и микроотоскопия.
Наряду с обследованием слухового анализатора пациентам с кохлеарным невритом назначают исследование вестибулярной функции: вестибулометрию, стабилографию, электронистагмографию, видеоокулографию, непрямую отолитометрию. Для диагностики причины возникновения кохлеарного неврита могут быть рекомендованы консультации смежных специалистов: отоневролога, невролога, офтальмолога, вестибулолога, эндокринолога, травматолога, нейрохирурга, генетика. С этой же целью проводятся дополнительные обследования: рентгенография черепа, КТ и МРТ головного мозга, УЗДГ сосудов головы и шеи, рентгенография позвоночника в шейном отделе, осмотр глазного дна (офтальмоскопия), исследование сахара крови и тиреоидных гормонов, биохимический анализ крови и мочи.
Лечение кохлеарного неврита
Основной задачей лечения острого кохлеарного неврита является восстановление слуха. Лечении хронической формы заболевания направлено на стабилизацию слуховой функции. Острый кохлеарный неврит и некоторые случаи прогрессирующего течения хронического кохлеарного неврита являются показанием к лечению в стационаре. Терапия кохлеарного неврита должна проводится совместно с коррекцией нарушений, которые могли стать его причиной. В первую очередь это устранение артериальной гипертензии и гормональной дисфункции, исключение воздействия ототоксических факторов (медикаментов и других веществ, шума, вибрации, радиоактивного излучения).
Медикаментозная терапия кохлеарного неврита проводится сосудорасширяющими препаратами, дезагрегантами, венотониками, нейропротекторами, дезинтоксикационными растворами. Комбинированную терапию пентоксифиллином, винпоцитином, пирацетамом, этилметилгидроксипиридином и церебролизином в первые 2 недели осуществляют путем внутривенных введений, затем переходят к внутримышечным инъекциям и приему препаратов внутрь. Хороший эффект при кохлеарном неврите дает использование в лечении препаратов гинкго билобы. В терапии внезапно возникшего кохлеарного неврита дополнительно используют глюкокортикоиды. Для купирования головокружений применяют гистаминоподобные препараты.
Положительный стимулирующий эффект оказывают физиотерапевтические методы лечения: рефлексотерапия (электропунктура, лазеропунктура, акупунктура), электростимуляция, фонофорез лекарственных препаратов, оксигенобаротерапия.
Двустороннее снижение слуха до 40 дБ затрудняет речевое общение пациента и является показанием к слухопротезированию. Прелингвальная форма кохлеарного неврита служит показанием к ношению слухового аппарата при слуховом пороге 25 дБ, поскольку доказано, что такая тугоухость вызывает нарушения в развитии речи у ребенка. С целью слухопротезирования при кохлеарном неврите могут применяться аналоговые, цифровые и линейные слуховые аппараты. Подбор и настройку аппарата осуществляет врач-слухопротезист.
Хирургическое лечение кохлеарного неврита проводится для осуществления стволовой или кохлеарной имплантации, удаления невриномы слухового нерва, гематомы или опухоли головного мозга. Необходимость хирургического лечения может быть обусловлена мучительным ушным шумом или приступами интенсивного головокружения. В таких случаях выполняют удаление звездчатого узла, резекцию барабанного сплетения или шейную симпатэктомию, при глухоте или тугоухости IV степени — деструктивные операции на улитке.
Прогноз кохлеарного неврита
В случае ранней диагностики острой формы заболевания полное восстановление слуха происходит у 50% пациентов, еще у 30-40% больных отмечается значительное улучшение слуховой функции. При хроническом кохлеарном неврите снижение слуха необратимо. Главной задачей является остановка прогрессирования тугоухости, после чего восстановление слуховой функции возможно путем кохлеарной имплантации или слухопротезирования.
Кохлеовестибулярные нарушения: подходы к диагностике и лечению
Опубликовано в журнале:
Вестник оториноларингологии, 5, 2011
Cochleovestibular disorders: approaches to diagnostics and treatment
O.V. ZAITSEVA
ФГУ НКЦ оториноларингологии ФМБА России (дир. — проф. Н.А. Дайхес), МОНИКИ им. М.Ф. Владимирского (дир. — член-корр. РАМН проф. Г.А. Оноприенко), Москва
Проведена оценка эффективности включения Мильгаммы и Мильгаммы композитум в схему лечения пациентов с кохлеовестибулярными нарушениями. В результате проведенного лечения у пациентов, получавших Мильгамму и Мильгамму композитум, вестибулярная компенсация (в том числе по данным постурографических показателей) достигалась в более короткие сроки — через 3—4 нед от начала лечения, тогда как у пациентов, не получавших эти препараты, — через 5 нед. Таким образом, можно рекомендовать применение Мильгаммы и Мильгаммы композитум в качестве нейротропных средств, дополняющих базовую терапию у пациентов с кохлеовестибулярными нарушениями для сокращения сроков достижения вестибулярной компенсации.
Ключевые слова: кохлеовестибулярные нарушения, головокружение, нарушения равновесия, сенсоневральная тугоухость, Мильгамма, Мильгамма композитум.
The aim of this work was to evaluate the efficacy of introduction of milgamma and milgamma compositum in the treatment of 52 patients with cochleovestibular disorders of different etiology. Thirteen patients enrolled in the study received standard therapy and 39 others were given its combination with milgamma preparations. Combined therapy with milgamma and milgamma compositum ensured faster vestibular compensation including posturographic characteristics than the standard treatment (within 3—4 weeks compared with 5 weeks in controls). The results of the study give reason to recommend milgamma and milgamma compositum as neurotropic medicines in addition to standard therapy for the management of the patients presenting with cochleovestibular disorders for the acceleration of the vestibular compensation.
Key words: cochleovestibular disorders, dizziness, balance disorder, sensorineural loss of hearing, milgamma, milgamma compositum.
Актуальность проблемы кохлеовестибулярных нарушений определяется в первую очередь высоким уровнем заболеваемости с преобладанием лиц наиболее активного и трудоспособного возраста [1—4]. Так, при опросе более 20 тыс. человек в возрасте от 18 до 64 лет выяснилось, что за последний месяц более 20% испытали головокружение, из них свыше 30% страдают головокружением на протяжении более 5 лет [5]. Около трети пациентов, обращающихся к оториноларингологам, высказывают жалобы на различные типы головокружения. В Российской Федерации число больных с кохлеовестибулярными нарушениями составляет 13—14 человек на 10 тыс. населения [6]. Следует отметить, что детальное вестибулометрическое исследование больных острой сенсоневральной тугоухостью в ряде случаев позволяет выявить нарушения функции лабиринта [2]. Установленная по результатам калорической и вращательной проб экспериментальная вестибулярная гипо- или гиперрефлексия, а также выявленная в ходе стабилометрического исследования статическая атаксия даже при отсутствии спонтанной вестибулярной симптоматики дает основания расценивать такое состояние больного, как кохлеовестибулярное нарушение [7]. Считается, что при сенсоневральной тугоухости наиболее часто регистрируется симптоматика, характерная для периферического вестибулярного синдрома угнетения [2].
Периферические вестибулярные расстройства возникают при поражении сенсорных элементов ампулярного аппарата и преддверия, вестибулярного ганглия и нервных проводников ствола мозга [8].
Периферическое вестибулярное головокружение — это чаще головокружение приступообразного характера различной интенсивности (от слабых до бурных атак), сопровождающееся спонтанным нистагмом — клоническим горизонтальным или горизонтально-ротаторным, разной интенсивности, степени, ассоциированным с гармоничным отклонением туловища и рук в сторону медленного компонента. Отмечается положительное влияние поворота головы (в сторону медленного компонента нистагма). Как правило, периферическое вестибулярное головокружение бывает односторонним и нередко сопровождается нарушением слуховой функции на пораженной стороне. Экспериментальные пробы выявляют угнетение функции вестибулярных рецепторов (кроме начального периода заболевания) [9].
Установление причины кохлеовестибулярного расстройства весьма важно, поскольку это обеспечивает возможность проведения патогенетически обоснованного лечения и выбора адекватной профилактической тактики.
Обследование пациентов с кохлеовестибулярными нарушениями должно быть детальным и всесторонним и обязательно включать обследование у отоневролога, позволяющее оценить функциональное состояние вестибулярного анализатора и уровень его поражения.
Расстройство функции равновесия (атаксия), являясь неотъемлемой частью кохлеовестибулярных нарушений, существенно ухудшает качество жизни: пациенты нередко оказываются неспособными без посторонней помощи передвигаться даже в пределах собственного жилища. Поэтому при оценке состояния вестибулярной функции большое внимание уделяется исследованию способности человека поддерживать вертикальное положение тела — функции равновесия, осуществляющейся посредством установочных рефлексов, которые удерживают центр массы тела в пределах проекции площади его опоры.
Одним из способов выявления атаксии является цифровая постурография. Применявшиеся ранее методики проведения стабилографического исследования предполагали проведение проб, часто мучительных для пациента: обследование на аппарате, конструкция которого предусматривала качательные движения в горизонтальной и сагиттальной плоскостях, которые регистрировались на ЭВМ, контроль спонтанных и поствращательных отклонений при помощи «пишущего стержня» и шкалы, прикрепленных к креслу Барани [10]. Позднее для выявления нарушений статокинетической устойчивости были предложены пробы, не сопровождающиеся вегетосенсорными проявлениями: медленные наклоны головы в сагиттальной и фронтальной плоскости, повороты головы вправо и влево с последующей ходьбой по прямой линии, а также алгоритм «пятка—носок», шагательная проба [11].
Использование современной аппаратуры значительно расширило диагностические возможности проведения статокинетических исследований, позволило проводить информативную качественную и количественную оценку функции равновесия. Современным вариантом позы Ромберга является проведение исследования на стабилометрической платформе, являющейся центром прибора, оценивающего функцию равновесия в количественном отношении [12]. Для дифференциальной диагностики различных нарушений функции равновесия используются нагрузочные функциональные пробы с одновременной постурографией: пробы с оптокинетической стимуляцией, с максимальным поворотом головы вправо и влево, с дозированной пороговой вращательной стимуляцией, с фиксацией взора [13].
Лечение пациентов с кохлеовестибулярными нарушениями должно быть незамедлительным и этиотропным и включать наряду с вестибулярной реабилитацией использование вазоактивных, антихолинергических, нейротропных препаратов (высокие дозы витаминов группы В) [6, 14]. Витамины группы B, прежде всего В1, В6 и В12, многие годы применяются в комплексном лечении заболеваний периферической нервной системы с целью улучшения обменных и усиления регенеративных процессов в нейроэпителии и замедления развития нейропатии [15].
Витамин В1 (тиамин) участвует в энергетических процессах в нервных клетках, в частности в цикле Кребса [16], и регенерации поврежденных нервных волокон [6, 17—19].
Витамин В6 (пиридоксин) является кофактором более чем для 100 ферментов, а благодаря способности регулировать метаболизм аминокислот нормализует белковый обмен [20, 21]. Кроме того, в последние годы доказано, что витамин В6 имеет антиоксидантное действие [22], участвует в синтезе катехоламинов, гистамина и гаммааминомасляной кислоты, увеличивает внутриклеточные запасы магния, также играющего важную роль в обменных процессах нервной системы.
Витамин В12 (цианокобаламин) играет важную роль в делении клеток, кроветворении, регуляции обмена липидов и аминокислот. Он участвует в важнейших биохимических процессах миелинизации нервных волокон [23].
В настоящее время оториноларингологи редко используют водорастворимые препараты витаминов В1, В6 и В12 для монотерапии, так как наиболее эффективным считается их комплексное применение [24]. Одним из наиболее эффективных современных инъекционных В-комплексов считается препарат Мильгамма («WÖRWAG PHARMA GmbH & Co. KG», Германия). Мильгамма представляет собой комбинацию синергично действующих нейротропных витаминов В1, В6 и В12. Каждая ампула препарата содержит по 100 мг тиамина гидрохлорида и пиридоксина гидрохлорида, 1000 мг цианокобаламина. Входящий в состав Мильгаммы местный анестетик лидокаин (20 мг) позволяет сделать инъекции практически безболезненными. Следует отметить, что Мильгамма имеет небольшой объем ампулы — всего 2 мл. Это повышает приверженность пациента терапии. Последовательное назначение Мильгаммы и Мильгаммы композитум при различных заболеваниях нервной системы способствует восстановлению функции нервных тканей при невропатиях различного происхождения [25, 26]. В частности, эффективность применения Мильгаммы при сенсоневральной тугоухости подтверждена проведенными в последние годы исследованиями [15, 27].
В период с января 2008 г. по май 2011 г. проведено консервативное лечение 52 пациентов в возрасте от 18 до 43 лет (23 женщины и 29 мужчин) с кохлеовестибулярными нарушениями. Причиной кохлеовестибулярных нарушений у 21 пациента явилась перенесенная острая респираторная вирусная инфекция, у 19 — стрессовый фактор, у 12 — подъем артериального давления. Всем пациентам проводилось комплексное аудиологическое и вестибулологическое исследование, включавшее исследование спонтанной отоневрологической симптоматики, оптокинетического нистагма (скорость движения стимула 15°/с, 30°/с и 45°/с), тесты плавного зрительного слежения, зрительных саккад, позиционный тест Дикса—Холлпайка, битермальный бинауральный калорический тест, вращательный тест с записью движения глаз на видеоокулографическом комплексе VNG Stad Alone Unit VO 25 («Heinemann Medizintechnik GmbH», Германия), исследование статики, координации на постурографическом комплексе Smart EquiTest Balans Master («NeuroCom», США), электрокохлеография на установке Viking Ques («Nicolet», США) и/или дегидратационный тест с ксилитом.
Повторная аудиометрия и вестибулометрия проводились сразу по окончании лечения и спустя 2 мес, цифровая постурография выполнялась еженедельно на протяжении курса лечения и также спустя 2 мес. Выраженность головокружения оценивали по критериям выраженности функциональных нарушений Международной классификации функций ВОЗ: 0 — нет (никаких, ничтожные), 1 — легкие (незначительные, слабые), 2 — умеренные (средние, значимые), 3 — тяжелые (высокие, интенсивные), 4 — абсолютные (полные) [29].
Дополнительные исследования включали: рентгенографию височных костей по Стенверсу, при необходимости магнитно-резонансную томографию головного мозга/внутренних слуховых проходов и мостомозжечковых углов; рентгенографию шейного отдела позвоночника, экстра- и транскраниальную допплерографию. Всем больным выполняли общеклинические анализы крови и мочи, биохимический анализ крови, коагулограмму.
Спонтанная вестибулярная симптоматика в виде координаторных нарушений зарегистрирована у 34 (65%) человек. Спонтанный нистагм выявлен у 12 (23%) пациентов — нистагм был горизонтальный, мелкоразмашистый, клонический, I степени. Вестибулярная гипо- или гиперрефлексия (по результатам калорической и вращательной проб) зарегистрирована у всех пациентов. Гипорефлексия проявлялась отсутствием или продолжительностью калорического нистагма не более 40 с. Продолжительность нистагма в среднем составила 18±4 с. При гиперрефлексии продолжительность калорического нистагма увеличивалась до 80—100 с и составила в среднем 91±6 с (без диссоциации). Выраженность головокружения на момент начала лечения пациенты оценивали в среднем на 2,8±0,5 балла по критериям выраженности функциональных нарушений Международной классификации функций ВОЗ.
При аудиологическом исследовании нарушение звуковосприятия зарегистрировано у всех пациентов, в том числе двустороннее — у 38. Эндолимфатический гидропс при проведении электрокохлеографии и/или дегидратационного теста (с ксилитом) ни у одного из пациентов не выявлен.
При проведении цифровой постурографии (тест чувствительной организации — Sensory organization test (SOT)) у всех пациентов зарегистрирована статическая атаксия за счет вестибулярной составляющей. SOT — современный вариант теста Ромберга, выполняемый в 6 этапов: с открытыми и закрытыми глазами на неподвижной платформе при неподвижном окружении, с открытыми глазами на неподвижной платформе при подвижном окружении, с открытыми и закрытыми глазами на подвижной платформе при неподвижном окружении и с открытыми глазами на подвижной платформе при подвижном окружении. Базовое лечение пациентам проводилось в соответствии со сложившимися стандартами оказания медицинской помощи (с учетом противопоказаний) и включало применение пентоксифиллина, пирацетама, винпоцетина, бетагистина в течение 6 нед. В течение 4—6 нед всем пациентам проводилась вестибулярная реабилитация на постурографическом комплексе Smart EquiTest Balans Master («NeuroCom», США) 3—5 раз в неделю по индивидуальной программе. 12 человек продолжали прием гипотензивных препаратов центрального действия и диуретиков, назначенных ранее кардиологом или терапевтом. 19 пациентов с кохлеовестибулярными нарушениями постстрессовой этиологии по рекомендации невролога получали антидепрессант растительного происхождения. Пациенты, перенесшие острую респираторную вирусную инфекцию (21 человек), в течение первых 3 дней получали парентеральную дезинтоксикационную терапию (реополиглюкин или раствор глюкозы 5%, аскорбиновая кислота 5%).
39 человек (19 женщин и 20 мужчин в возрасте от 18 до 43 лет) получали помимо базовой терапии препараты Мильгамма и Мильгамма композитум по схеме: Мильгамма внутримышечно №10, затем по 1 драже Мильгаммы композитум 3 раза в день в течение 6 нед.
13 пациентам (6 женщинам и 7 мужчинам в возрасте от 20 до 43 лет) Мильгамма и Мильгамма композитум не назначались в связи с индивидуальной непереносимостью витаминов В-группы; они получали только препараты базовой терапии.
Данные отоневрологического и аудиологического исследований у пациентов, получавших и не получавших препараты Мильгамма и Мильгамма композитум, были сравнимы.
Данные компьютерной постурографии с автоматическим расчетом показателей, в частности индекса вестибулярной устойчивости, измеряемого в процентах, — отношение суммарной амплитуды смещения центра тяжести к абсолютному центру платформы — у пациентов обеих групп, получавших препараты Мильгамма и Мильгамма композитум, были также сравнимы и достоверно (р
В результате проведенного лечения у всех пациентов при проведении контрольной постурографии на момент окончания курса зафиксировано уменьшение статической атаксии, что выразилось в достоверном (рОднако у пациентов, принимавших Мильгамму и Мильгамму композитум, нормализация постурографических показателей наступала в среднем на 2 нед раньше и индекс вестибулярной устойчивости по окончании лечения был достоверно (р
| Сроки обследования в процессе лечения | Базовое лечение (n=13) | Базовое лечение+Мильгамма и Мильгамма композитум (n=39) |
| До начала лечения | 49±7 | 47±10 |
| От начала лечения | ||
| через 1 нед | 53±8 | 60±7 |
| через 2 нед | 59±4 | 67±6 |
| через 3 нед | 64±5 | 72±6 |
| через 4 нед | 70±6 | 79±4 |
| через 5 нед | 72±3 | 83±6 |
| через 6 нед | 78±6 | 85±7 |
| Спустя 2 мес после лечения | 81±5 | 86±6 |
Как видно из таблицы, у пациентов, получавших Мильгамму и Мильгамму композитум, стойкая нормализация основного постурографического показателя — индекса вестибулярной устойчивости (норма ≥70), достигалась в более короткие сроки — через 3—4 нед от начала лечения, тогда как у пациентов, получавших только базовую терапию, — через 5 нед.
Выраженность головокружения на момент окончания лечения пациенты в среднем оценивали на 0,3±0,2 балла по критериям выраженности функциональных нарушений Международной классификации функций ВОЗ (достоверной разницы в оценке выраженности головокружения среди пациентов обеих групп не было). У всех пациентов к окончанию курса лечения зафиксирована компенсация вестибулярной функции в покое, сочетавшаяся с положительной динамикой показателей повторной вестибулометрии. Повторное аудиологическое исследование показало, что у получавших Мильгамму и Мильгамму композитум пациентов слух улучшился в среднем на 24±0,8 дБ, что достоверно (р
Нежелательных явлений (т.е. любых неблагоприятных медицинских явлений, наблюдаемых у использующего медицинский продукт пациента, которое может и не иметь причинно-следственной связи с данным видом лечения) ни у кого из пациентов, в том числе получавших сопутствующую терапию, зафиксировано не было, лечение все переносили хорошо. Со слов пациентов, ни у одного из них за весь период наблюдений эпизодов вращательного головокружения не возникало. Таким образом, можно рекомендовать применение Мильгаммы и Мильгаммы композитум в качестве нейротропных средств, дополняющих базовую терапию у пациентов с кохлеовестибулярными нарушениями для сокращения сроков достижения вестибулярной компенсации и улучшения слуховой функции.