компенсированный гипотиреоз что это такое
Что такое гипотиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., терапевта со стажем в 27 лет.
Определение болезни. Причины заболевания
Гипотиреоз — это заболевание эндокринной системы, возникающее из-за длительно низкого уровня тиреоидных гормонов, вырабатываемых щитовидной железой, и проблем с их воздействием на организм преимущественно на тканевом уровне.
Ежегодно на каждую тысячу человек приходится 0,6-3,5% заболевших гипотиреозом. [3] [6] [8] Данное нарушение может возникнуть в любом возрасте, но обычно оно возникает у пожилых людей старше 60 лет. [14] Среди новорождённых гипотиреоз встречается в одном случае из 4-5 тысяч.
К факторам риска относятся:
В 80% случаев гипотиреоз связан с поражением защитных сил организма, т. е. аутоиммунным тиреоидитом. Он является ведущей причиной первичного гипотиреоза у взрослых людей. [3]
Риск возникновения аутоиммунного тиреоидита зависит от возраста и пола пациента: у женщин в возрасте 40-50 лет он возникает в 10-15 раз чаще, чем у мужчин. [6] [9]
При аутоиммунном тиреоидите даже на фоне длительной ремиссии функциональное состояние щитовидной железы в разное время может значительно различаться. Так, с возрастом деструктивные изменения в щитовидной железе постепенно нарастают. Этот фактор, а также наличие тиреоидных аутоантител могут спровоцировать переход субклинического (скрытого) гипотиреоза, протекающего на фоне аутоиммунного тиреоидита, в явный. Частота таких случаев составляет около 5 % в год.
Симптомы гипотиреоза
Симптомы гипотиреоза крайне обманчивы, разнообразны и не всегда заметны. Их проявление зависит от степени выраженности заболевания.
К основным клиническим проявлениям относятся: [9] [11] [14]
Патогенез гипотиреоза
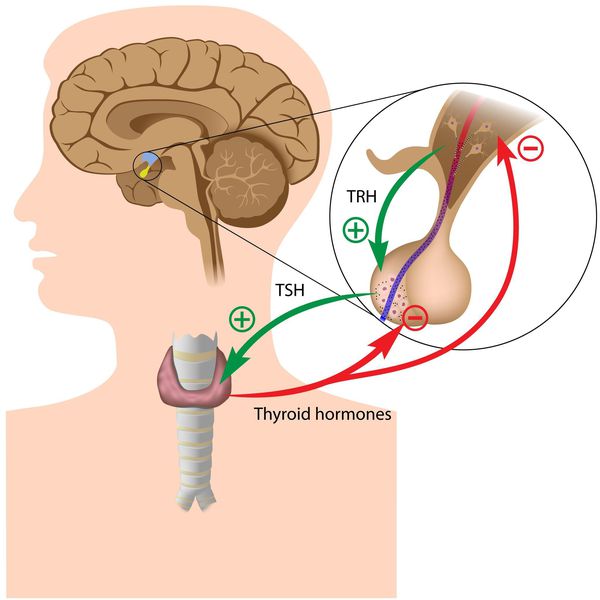
Тиреоидные гормоны, которые вырабатывает щитовидная железа, называются «трийодтиронин» (Т3) и «тироксин» (Т4). Они влияют практически на все процессы, протекающие в организме. Стимулирующее влияние на них оказывает тиреотропный гормон гипофиза (ТТГ).
Синтез тиреоидных гормонов начинается после того, как щитовидная железа захватывает йод. Он является регулятором гормоногенеза и размножения тиреоцитов — клеток эпителия щитовидной железы. Попав в тиреоциты, йодид окисляется до активной формы при помощи тиреопероксидазы — микросомального антигена, к которому образуются антитела, в частности при аутоиммунном тиреоидите. [4] [6] [7] Уровень поступления йода изменяет чувствительность тиреоцитов к воздействию ТТГ, которая усиливается при дефиците йода. [3] [6]
Исходя из этого механизма возникновения гормонов щитовидной железы, патогенетически гипотиреоз делится на три типа:
Первичный гипотиреоз возникает в 80-95% случаев и чаще всего обусловлен нарушениями общей структуры щитовидной железы, которые являются врождёнными или приобретёнными, а также сбоем секреторной функции её клеток.
Вторичный и третичный гипотиреоз возникают в 3-4% случаев. Они связаны с заболеваниями таких участков головного мозга, как аденогипофиз или гипоталамус в результате которых наблюдается стойкая нехватка гормонов щитовидной железы и нарушение секреции ТТГ гипофиза. [4] [6]
Периферический гипотиреоз развивается крайне редко — в 0-1% случаев. Основным фактором его возникновения является резистентность (сопротивляемость) тканей-мишеней (например, мозга, гипофиза, сердца, костей, печени) гормонам Т4 и Т3. [5] [6] [7]
В патогенезе аутоиммунных заболеваний щитовидной железы взаимодействуют генетические и средовые факторы. Однако точная роль тех и других не определена. Ведущее значение в гибели тиреоцитов при этих заболеваниях придают клеточным механизмам, т.е. цитотоксическим эффектам аутореактивных Т- лимфоцитов. [3] [5] Отсутствие при аутоиммунных поражениях щитовидной железы классических признаков гнойного воспаления (боли, отёка и других), обычно сопровождающих массивный некроз ткани, указывает в таких случаях на иной механизм гибели тиреоцитов. В последние годы установлено, что Т-лимфоциты способны вызывать гибель клеток-мишеней не только путём некроза, но в основном путём индукции их разрушения. [3] [5] [7] [9]
Классификация и стадии развития гипотиреоза
В Международной классификации болезней десятого пересмотра выделены две формы гипотиреоза:
Первичный гипотиреоз подразделят на три большие группы:
В последнее время разработана классификация первичного гипотиреоза, которая основывается на выраженности симптомов и результатах гормональных исследований (определяющий показатель — уровень ТТГ). В неё включают:
Осложнения гипотиреоза
Гипотиреоидная кома («спячка») — это угрожающее жизни состояние, которое чаще развивается у пожилых людей, которые долгое время не лечили тяжёлый гипотиреоз, который был у них довольно долгое время. [3] [5] [7] [9]
К основным провоцирующим факторам такого осложнения относят:
Но появление осложнений может вызвать не только отсутствие лечения, но и неграмотная медикаментозная терапия. Например, передозировка лекарствами может привести к избыточному синтезу гормонов щитовидной железы и патологиям со стороны сердечно-сосудистой системы. В связи с этим крайне важно соблюдать все рекомендации врача по лечению заболевания и ни в коем случае не лечиться самостоятельно.
Диагностика гипотиреоза
Диагностика гипотиреоза включает в себя подробный опрос пациента, осмотр и лабораторные исследования.
Так как симптомы гипотиреоза неспецифичны, он может скрываться под масками других заболеваний. Поэтому по проявлениям его иногда можно спутать с железодефицитной анемией, депрессией, аменореей, невритом и другими нарушениями. [15] [16] В связи с этим важную роль в определении гипотиреоза играют лабораторные исследования. Они показаны всем пациентам с нарушениями щитовидной железы и предполагают оценку уровня ТТГ и свободного Т4. [2] [12] Определение уровня Т3 в крови, как правило, не является информативным, так как при первичном гипотиреозе этот показатель находится в норме. [14]
На явное наличие гипотиреоза будет указывать высокий уровень ТТГ и низкий уровень свободного Т4 в крови. При субклиническом гипотиреозе уровень ТТГ также будет повышен, а уровень свободного Т4 будет находиться в пределах нормы.
После того как наличие гипотиреоза подтверждено, при помощи показателя ТТГ также определяется характер заболевания и наличие возможных осложнений. Уровень ТТГ также позволяет в значительном большинстве случаев оценить адекватность проводимой терапии: об этом будет свидетельствовать стойкий уровень ТТГ в крови в пределах нормы. [6] [7] [8]
В достаточно редких случаях проводят пробу с тиреолиберином для оценки аутоиммунных заболеваний щитовидной железы. [6] [9] [15]
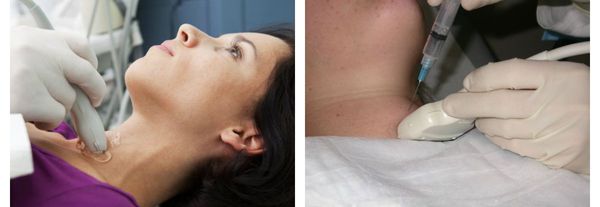
Дополнительные методы диагностики, такие как УЗИ щитовидной железы, сцинтиграфия или пункционная биопсия, используются для уточнения характера и степени выраженности заболевания. [6] [11] [12] [16]
Так как с возрастом учащаются случаи узлового зоба, выраженный шейный кифоз может смещать трахею кзади и вниз, что затрудняет пальпаторную оценку состояния щитовидной железы, в результате чего своевременная диагностика заболевания не проводится. [4] [5] [6] [7] [8]
В связи с тем, что гипотиреоз не всегда проявляет себя, среди населения принято проводить массовую диагностику данного заболевания — скрининг. Так, определение уровня ТТГ позволяет обнаружить первичный гипотиреоз у людей без каких-либо других его проявлений, а также у новорождённых (исследование проводится на 4-5 сутки жизни). При планировании беременности и на ранних её сроках также важно пройти исследование на гипотиреоз. [3] [5] [7] [9]
Лечение гипотиреоза
Цель лечения гипотиреоза — это поддержание уровня ТТГ в пределах 0,5-1,5 мМЕ/л.
Единственным методом лечения является пожизненная заместительная терапия. Начинать её стоит при уровне ТТГ более 10 мЕД/л, высоких титрах антител к ТПО и других показателях. Для этого предпочтительны препараты левотироксина натрия. Его применение противопоказано лишь в случае нелеченого тиреотоксикоза и недостаточности коры надпочечников, остром инфаркте миокарда, аллергии и индивидуальной непереносимости препарата. [16]
Обычно лечение проводится в условиях стационара. Показаниями к госпитализации пациентов с гипотиреозом служат:
Заместительная терапия первичного (манифестного) гипотиреоза показана пожизненно с назначением тироксина в средней дозе 1,6-1,8 мкг/кг. Пациентам с кардиальной патологией доза рассчитывается, исходят из расчёта 0,9 мкг/кг. Стоит отметить, что в связи с уменьшением метаболизма тиреоидных гормонов потребность в них с возрастом снижается. [5] [7] [9]
Дозы тироксина зависят от причин и патогенеза заболевания. Потребность в препарате у людей со спонтанным гипотиреозом выше, чем у пациентов с гипотиреозом, возникшим после хирургического лечения и применения радиоактивного йода.
Уровень ТТГ при диагностике гипотиреоза напрямую связан с оптимальной заместительной дозой тироксина: у большинства женщин она составляет 75-100 мкг, а у мужчин — до 150 мкг в день приёма.
Первый контроль уровня ТТГ после начатого лечения проводят через 2-3 месяца, затем один раз в шесть месяцев (при обязательном условии соблюдения пациентом схемы лечения). [6] [9] [13]
При субклиническом гипотиреозе существует риск развития манифестной формы заболевания со всеми характерными проявлениями. Так, явный гипотиреоз возникает у 20-50% пациентов в течение 4-8 лет, а присутствие антитиреоидных антител увеличивает риск до 80%. [8] [9] [10] Потому людям со скрытым гипотиреозом следует длительно наблюдаться у специалистов.
Проблемы при лечении гипотиреоза
Лечение тироксином безопасно, просто и сравнительно дешево. Но, несмотря на многолетний опыт его использования, при нём всё же могут возникать многие проблемы. Основная из них связана с несоблюдением пациента схемы лечения. Так, одновременное повышение уровней Т4 и ТТГ, по всей вероятности, будет указывать на то, что за несколько дней до визита к врачу пациент не выполнял его назначений.
Снижение эффективности установленной дозы тироксина часто связано с меньшим содержанием гормона в таблетках (например, в непатентованных препаратах) или взаимодействием лекарств при одновременном приёме других препаратов. [9] [13]
Недостаточность дозы также может быть связана с уменьшением всасывания тироксина, нарушением энтеропечёночного кровотока, ускорением кругооборота или выделением гормона с мочой, медленным снижением тиреоидной функции после лечения гипертиреоза.
Существуют и другие особенности и проблемы при лечении гипотиреоза. [6]
Лучшим критерием подбора дозы тироксина при аутоиммунном тиреоидите является исследование ТТГ и свободного Т4. При этом лечение нацелено на компенсацию гипотиреоза благодаря той же заместительной терапии и редукция зоба при помощи супрессивной терапии. [6] [9] Критериями эффективности лечения при этом будут служить:
Назначение препаратов тиреогормонов при аутоиммунном тиреоидите без нарушения функции щитовидной железы нецелесообразно, а операция может привести к состоянию, способному значительно ухудшить качество жизни пациента с возможностью развития тяжёлого гипотиреоза и инвалидизации. [9] [13]
Прогноз. Профилактика
Прогноз заболевания при своевременной диагностике и лечении благоприятный. [10] Осложнить его, особенно в отношении трудоспособности и состояния здоровья в целом, могут фибрилляция предсердий и выраженная сердечная недостаточность, развивающиеся на фоне тиреотоксикоза. [5]
В качестве неспецифической профилактики патологий щитовидной железы стоит проходить санаторно-курортное лечение по показаниям врача.
Доказано, что медикаментозная терапия при гипотиреозе становится более эффективной в сочетании с радоновыми процедурами, а азотные ванны, не содержащие радон, оказывают профилактическое воздействие. [1] [5] Благодаря этому удаётся добиться стойкости ремиссии заболевания.
Рекомендуется проведение до трёх курсов таких процедур с интервалом от 8 до 12 месяцев. Подбор схем лечения в санатории (в т.ч. медикаментозных), рациональное использование природных и климатических факторов определяют ближайший и отдалённый результат оздоровления.
Компенсированный гипотиреоз и прием статинов: симптомы поражения мышц и нарушения мышечного метаболизма
Полный текст:
Аннотация
Обоснование. В настоящее время не существуют однозначного мнения в отношении безопасности применения статинов у больных гипотиреозом. Исходя из некоторых новых данных, можно предположить, что гипотиреоз даже в состоянии компенсации может способствовать развитию мышечных поражений на фоне приема статинов. В рамках настоящего исследования проводилась проверка данной гипотезы, получившей свое подтверждение.
Цель: изучить характер нарушений мышечного метаболизма на фоне приема статинов при компенсированном гипотиреозе.
Методы. Одномоментное (поперечное) обсервационное исследование с включением 120 женщин, представленных тремя группами по 40 человек. Основная группа больных, принимавших статины на фоне гипотиреоза (1-я группа), сравнивалась с двумя группами контроля, включая принимавших статины без гипотиреоза (2-я группа) и не принимавших статины с гипотиреозом (3-я группа).
Результаты. У пациентов, принимающих статины на фоне компенсированного гипотиреоза, чаще возникают жалобы на мышечную боль, которые нередко ассоциируются с подъемом маркеров мышечного поражения, а также с наличием С-аллеля в гене SLCO1B1*5(c.521T>C). При компенсированном гипотиреозе относительная частота встречаемости болевого мышечного синдрома, ассоциированного с подъемом КФК, возрастает при уровне ТТГ выше 2,86 мЕд/л. Наличие у пациентов компенсированного гипотиреоза повышает возможность развития СПМ-СПС в 2,7 раза.
Заключение. Компенсированный гипотиреоз не является противопоказанием для статинотерапии. Однако наличие даже компенсированного гипотиреоза у пациентов, принимающих статины, увеличивает возможность развития симптомов поражения мышц, связанных с приемом статинов, и требует дополнительного мониторинга клинико-биохимических параметров мышечного метаболизма (особенно, уровня КФК).
Ключевые слова
Для цитирования:
Луговая Л.А., Некрасова Т.А., Стронгин Л.Г., Беляева Н.Г. Компенсированный гипотиреоз и прием статинов: симптомы поражения мышц и нарушения мышечного метаболизма. Проблемы Эндокринологии. 2019;65(6):408-416. https://doi.org/10.14341/probl10133
For citation:
Lugovaya L.A., Necrasova T.A., Strongin L.G., Belyaeva N.G. Compensated hypothyroidism and statin administration: the symptoms of muscle damage and muscle metabolism disorders. Problems of Endocrinology. 2019;65(6):408-416. (In Russ.) https://doi.org/10.14341/probl10133
Обоснование
Симптомы поражения мышц, связанные с приемом статинов (СПМ-СПС), занимают одно из лидирующих мест среди нежелательных реакций данного класса препаратов [1] и наблюдаются почти у трети больных [2, 3].
Среди факторов риска СПМ-СПС упоминается гипотиреоз, но данные о его роли неоднозначны: в большинстве работ изучали недиагностированный гипотиреоз [4–6], вопрос же о безопасности статинов при компенсированной тиреоидной недостаточности остается открытым.
В итоге одни рекомендации не содержат ограничений по приему статинов при гипотиреозе [7], по умолчанию позволяя назначать их без предварительной оценки компенсации, другие же, напротив, вводят такие ограничения, и тоже независимо от статуса компенсации (инструкция к розувастатину в дозировке более 40 мг).
О возможной акселерации пагубного влияния статинов на мышечную ткань в условиях гипотиреоза позволяют задуматься некоторые теоретические предпосылки. В первую очередь, это возможность кумуляции статинов за счет замедления метаболизма при тиреоидном дефиците [8]; патогенетическое сходство в механизмах воздействия на мышцы обоих факторов, включая митохондриальную дисфункцию [9, 10]; способность статинов ингибировать селенопротеины, необходимые для синтеза тиреоидных гормонов [11], что неоднократно описывалось в клинических разборах [12, 13].
Среди немногих исследований, так или иначе затрагивающих проблемы приема статинов при гипотиреозе, четыре работы говорят о повышении риска СПМ-СПС на фоне гипотиреоза в 1,57–1,7 раз [14–17]. В половине работ речь шла о высоких дозах статинов и недиагностированном гипотиреозе [16, 17]; часть из них были ретроспективными и не изучали маркеры мышечного поражения. Ни одно из исследований не подразумевало генотипирования по гену SLCO1B1*5 (c.521T>C), которое в современных условиях используют для прогнозирования СПМ-СПС (С-аллель в SLCO1B1*5 (c.521T>C), повышает риск СПМ-СПМ при генотипе ТС – в 4, а при генотипе СС – в 17 раз [18]).
Таким образом, до настоящего времени недостаточно изучен ряд вопросов, касающихся применения статинов в условиях гипотиреоза, включая оценку вероятности и путей развития СПМ-СПС на фоне невысоких доз статинов и компенсированного гипотиреоза, в их взаимосвязи с маркерами мышечного поражения и результатами генотипирования. Планирование и проведение подобных исследований имеет важное теоретическое значение и полезно с практической точки зрения, в свете прогнозирования осложнений и выбора оптимальной терапии для лиц с компенсированным гипотиреозом и показаниями к приему статинов.
Изучить характер нарушений мышечного метаболизма на фоне приема статинов при компенсированном гипотиреозе.
Методы
Дизайн исследования
Поведено одномоментное (поперечное) обсервационное одноцентровое контролируемое нерандомизированное исследование с включением 120 женщин, представленных тремя группами по 40 человек. Формирование групп происходило параллельно, до достижения запланированного количества пациентов, и подразумевало сплошной характер наблюдения. Основная группа больных, принимавших статины на фоне гипотиреоза (1-я группа), сравнивалась с двумя группами контроля, включая принимавших статины без гипотиреоза (2-я группа) и не принимавших статины с гипотиреозом (3-я группа).
Критерии соответствия
В исследование включали женщин с гипотиреозом в стадии медикаментозной компенсации продолжительностью не менее 6 мес, принимающих (1-я группа) или не принимающих статины (3-я группа), а также пациенток без гипотиреоза, принимающих статины (2-я группа). Компенсированным гипотиреоз считали при содержании тиреотропного гормона (ТТГ) в крови в диапазоне 0,5–5,0 мЕд/л. Больные принимали аторвастатин, симвастатин или розувастатин в невысоких дозировках в течение 6–24 мес, что в целом соответствует периоду возникновения СПМ-СПС [19].
Критериями исключениями были высокие дозы статинов (аторвастатин, симвастатин более 40 мг, розувастатин более 20 мг), гипотиреоз в стадии декомпенсации, сахарный диабет, наследственные миопатии в анамнезе, а также оперативные вмешательства и травмы в течение последних 6 мес.
Продолжительность исследования
Исследование начато в декабре 2015 г. и продолжалось до октября 2017 г. Группы больных набирались параллельно, с 2015 по 2017 г. В рамках поперечного исследования все пациентки обследовались однократно.
Описание медицинского вмешательства
Основой исследования было определение симптомов мышечного поражения с помощью стандартных опросников, а также биохимических маркеров мышечных нарушений и полиморфизма гена SLCO1B1*5 (c.521T>C) посредством забора образцов крови для проведения соответствующих манипуляций в клинической лаборатории.
Основной исход исследования
Оценивали характер мышечных симптомов, интенсивность мышечной боли и слабости, тиреоидный статус (ТТГ, свободная фракция тироксина (св.Т4)), содержание липидов в крови (общего холестерина (ХС), липопротеинов высокой плотности (ЛПВП), липопротеинов низкой плотности (ЛПНП), триглицеридов (ТГ)), маркеров мышечного поражения (активность креатинфосфокиназы (КФК), лактатдегидрогеназы (ЛДГ), концентрацию миоглобина крови), определяли генотип SLCO1B1*5 (c.521T>C).
Дополнительные исходы исследования
Исследованы особенности показателей мышечного метаболизма в зависимости от наличия гипотиреоза и/или терапии статинами, изучена взаимосвязь между развитием СПМ-СПС у больных гипотиреозом и степенью компенсации тиреоидной недостаточности. Определяли пороговое значение концентрации ТТГ, при превышении которого значительно увеличивается вероятность возникновения симптомов поражения мышц, связанных с подъемом КФК, у больных компенсированным гипотиреозом.
Методы регистрации исходов
Помимо проведения общеклинического обследования, включающего общий осмотр, сбор анамнеза, жалоб и пальпацию щитовидной железы у всех оценивали краткий опросник боли (КОБ) [20] и краткий опросник слабости (КОС) [21].
Проводилось исследование тиреоидного статуса, ряда биохимических показателей, генотипирование в клинико-диагностических лабораториях на базах кафедры эндокринологии и внутренних болезней ФГБОУ ВО «ПИМУ» Минздрава России.
Концентрацию ТТГ и св.Т4 определяли у всех больных с гипотиреозом (1-я и 3-я группы); во 2-й группе для исключения тиреоидной недостаточности оценивали содержание ТТГ. Исследование проводили иммунохемилюминисцентным иммуноферментным методом с реагентами Siemens Immulite 2000 Systems (Великобритания) на анализаторе Immlite 2000 TM (Великобритания).
Исследование липидного спектра (ХС, ЛПВП, ЛПНП, ТГ), а также определение ЛДГ проведены на автоматическом анализаторе Furuno-CA-180 (Япония) с реагентами DiaSys (Германия). Анализ креатинфосфокиназы (КФК) выполнен ферментативным способом на автоматическом анализаторе ВА 400 (Испания) с реагентами фирмы BioSystems (Испания). Титр миоглобина крови исследовали ручным способом в плашке с реагентами «ДС-ЭРИТРО-МИОГЛОБИН» (Россия).
Генотипирование по аллельному варианту гена SLCO1B1*5(c.521T>C) осуществляли путем полимеразной цепной реакции с флуоресцентной схемой обнаружения продуктов в режиме реального времени (Real Time) «SNP-ЭКСПРЕСС»-РВ. Для оценки полиморфизма использовали диагностический набор «Мутация SLCO1B1» ООО Научно-производственная фирма «Литех».
Этическая экспертиза
Исследование одобрено локальным этическим комитетом ГБОУ ВПО «НижГМА» Минздрава РФ (протокол №13 от 05.10.15).
Статистический анализ
Статистическая обработка данных проведена в программах Statistica 6.0 и MedCalc. Количественные данные описывались посредством среднего и его стандартного квадратичного отклонения (M±SD). Характер распределения в выборках оценивали с помощью критерия Колмогорова–Смирнова. По результатам проверки на нормальность распределение значений всех сравниваемых признаков во всех сравниваемых группах было нормальным. Сравнение количественных показателей двух независимых групп проводилось с использованием U-критерия Манна–Уитни; показателей трех независимых групп и более – с использованием H-критерия Краскела–Уоллеса. Качественные данные сравнивали с помощью метода Хи-квадрат и двустороннего точного критерия Фишера. Корреляционный анализ проводили методом Спирмена. Взаимосвязь описательных характеристик групп, а также уменьшение их числа осуществляли путем факторного анализа по методу главных компонент. Для определения связи концентрации ТТГ с клинико-лабораторными изменениями со стороны мышц использовали ROC-анализ. Относительный риск развития СПМ-СПС у пациентов при наличии компенсированного гипотиреоза считали с помощью таблиц сопряженности программы MedCalc. Порог статистической значимости измерений принимался как р 0,05): преобладал аутоиммунный тиреоидит (92,5 и 87,5% пациенток 1-й и 3-й групп), при небольших долях послеоперационного (5 и 12,5%) и кордарон-индуцированного гипотиреоза (2,5 и 0% больных). Во 2-й группе гипотиреоз исключали путем определения концентрации ТТГ, который в среднем составил 2,0±0,95 мЕд/л.
Назначение статинов и их дозирование в 1-й и 2-й группах проводилось лечащими врачами-кардиологами для вторичной профилактики сердечно-сосудистых заболеваний (ССЗ). Применяли аторвастатин (62,5 и 75,0% в 1-й и 2-й группе), симвастатин (7,5 и 5,0%) и розувастатин (30,0 и 20,0%); не различались дозы статинов и длительность их приема (12,3±6,9 мес и 11,1±8,6 мес, p>0,05 во всех случаях ).
Как видно из табл. 1, группы были сопоставимы по возрасту, индексу массы тела (ИМТ), частоте острых нарушений мозгового кровообращения (ОНМК) в анамнезе (р>0,05). Пациенты 1-й и 2-й групп не различались и по частоте ССЗ (р>0,05), но в 3-й группе реже отмечались ишемическая болезнь сердца (ИБС) (p 0,05).
Таблица 1. Клинико-анамнестическая характеристика исследуемых групп