короновирус если долго находится без маски кислорода что будет
Оксигенотерапия повреждает микробиом легких: новое звено патогенеза Covid-19
Несмотря на то, что легкие считаются относительно «чистыми и свободными» от бактерий, в них существует определенный баланс микробиоты, который может нарушаться при проведении оксигенотерапи
Одним из ключевых признаков Covid-19 является одышка, которая вызывается значительным снижением уровня кислорода в крови. Во время госпитализации такие пациенты получают оксигенотерапию для нормализации уровня кислорода.
Несмотря на то, что легкие считаются достаточно «чистыми и свободными» от бактерий, в них существует определенный баланс микробиоты. Новое исследование указывает на то, что оксигенотерапия может негативным образом воздействовать на этот баланс.
«Кислород в избыточном виде является токсином. Если поместить лабораторное животное в среду с 100% кислородом, то оно погибнет в течение 5 дней, при этом будут развиваться повреждения легких, схожих с таковыми при Covid-19 или легочной недостаточности другой этиологии», – рассуждают авторы исследования.
Пациенты в интенсивной терапии получают высокие дозы кислорода на протяжении длительного времени. Ученые решили исследовать, как при этом меняется состав и жизнедеятельность микроорганизмов легких. Различные бактерии достаточно слабо различаются в том, как они реагируют на высокие дозы кислорода.
Была проведена серия экспериментов на здоровых лабораторных мышах. Изменения оказались ровно такими, как предполагали ученые: кислород-толератные бактерии, такие как стафилококки, распространялись в этой среде куда активнее остальных.
Следующий вопрос заключался в том, какое из изменений происходит первым – повреждение легочной ткани или изменения микробиомных взаимоотношений? Оказалось, что микробиом реагировал на оксигенотерапию уже в течение первого дня, в то время как повреждения легких развивались только после 3 дня.
В последнем эксперименте ученые сравнили 2 группы генетически идентичных мышей, получавших оксигенотерапию: со стерильными легкими и с обычным легочным микробиомом. Первая группа не демонстрировала легочных повреждений, характерных для второй группы с естественной микрофлорой в легких.
Это исследование указывает на то, что в патогенезе легочных повреждений при Covid-19 у пациентов, получающих оксигенотерапию, по-видимому, определенную роль играет легочный микробиом.
Тем не менее, результаты использования антибиотиков оказались неожиданными: применение ванкомицина, обладающего эффективностью против грамположительных стафилококков, не повлияло на возникновение легочных повреждений, в отличие от цефтриаксона, направленного на грамотрицательные бактерии.
Авторы работы настаивают на том, чтобы на основании их данных не проводилось никаких изменений актуальных протоколов лечения, в особенности оксигенотерапии. Необходимо проведение рандомизированных контролируемых исследований для получения уверенных клинических рекомендаций.
Короновирус если долго находится без маски кислорода что будет
Пациент А., 49-ти лет, поступил в ФГБУ «НМИЦ Кардиологии» МЗ РФ Центр COVID-19 с жалобами на кашель с трудноотделяемой мокротой, одышку, нехватку воздуха, боль в груди, головную боль и повышение температуры до 39,4 о С, SpO2 93-94% на атмосферном воздухе. У пациента был положительный назофаренгеальный мазок на SARS-CoV-2.
В течение нескольких дней у пациента нарастала симптоматика дыхательной недостаточности, по данным компьютерной томографии увеличился процент поражения легких до 90% (КТ-4).
Пациент находился на антибактериальной терапии, антикоагулянтной терапии, специфической терапии: гидроксихлорохином, азитромицином, лопинавир-ритонавиром. В последующем, в связи с развитием цитокинового «шторма» больному вводился тоцилизумаб.
Пациент пробыл в блоке интенсивной терапии 6 дней и в дальнейшем учитывая стабилизацию клинического состояния – отсутствие необходимости в проведении респираторной поддержки с применением СРАР – терапии, пациент был переведен в отделение.
При контрольном КТ исследовании: выраженная положительная динамика в виде частичного разрешения вирусной пневмонии, новых участков инфильтрации в паренхиме легких не определяется. Средне-тяжелая степень, процент поражения легочной ткани – 50-60% (КТ2).
Учитывая стабилизацию состояния, отсутствие признаков дыхательной недостаточности и хорошее самочувствие, пациент был выписан из стационара.
Во время проведения СРАР – терапии врачами и медицинским персоналом применялись следующие защитные средства: респиратор FFP3, очки, щиток, костюм индивидуальной защиты влагонепроницаемый, перчатки (2-3 пары). За время использования пациентом СРАР – терапии и в течение 14 дней после ни один сотрудник не заболел, положительных назофаренгиальных мазков на SARS-CoV-2 так же зафиксировано не было.
После выписки пациент выразил благородность всему коллективу ФГБУ «НМИЦ кардиологии».
Полностью клинический пример планируется к публикации в журнале «Анестезиология и реаниматология», ссылка на номер будет размещена на сайте.
Случай предоставлен Литвиным Александром Юрьевичем и Елфимовой Евгенией Михайловной.
Респираторная поддержка при COVID-19
Время чтения: 9 мин.
В декабре 2020 года прошла первая «Респираторная школа» для врачей. Организовали школу фонд «Живи сейчас», он помогает людям с боковым-амиотрофиечским склерозом. В рамках школы лекцию об особенностях респираторной поддержки и ведения пациентов с COVID-19 прочитала Зульфия Сукмарова, к.м.н, кардиолог-аритмолог, врач функциональной диагностики госпиталя им П.В.Мандрыка.
Течение ОРДС и осложнения при COVID-19
Пандемия COVID-19 простимулировала два позитивных процесса. Во-первых, консолидировала врачебное сообщество, стали бурно развиваться междисциплинарные связи. Во-вторых — способствовала развитию респираторной школы. Думаю, если бы все врачи до пандемии имели представление о неинвазивной вентиляции легких (НИВЛ), мы пережили бы пандемию с меньшими потерями.
Задумывая Респираторную школу в апреле 2020 года, мы надеялись, что она будет благодатной почвой для расширения знаний по разным видам вентиляции легких, и эти знания пригодятся в работе с паллиативным, пульмонологическими пациентами, с пациентами с нарушениями дыхания во время сна и т. д. Чем больше врачей знают про неинвазивную вентиляцию, тем лучше для наших пациентов. Потому что COVID-19 — это частный случай дыхательной недостаточности, тогда как дыхательная недостаточность — огромная проблема, с ней сталкиваются врачи почти всех специальностей.
Респираторная школа фонда «Живи сейчас» / Alsfund.ru
Основные патологические изменения при COVID-19 происходят в дыхательной системе (острая вирусная пневмония, пневмонит, острый респираторный дистресс-синдром). Сейчас мы знаем, что ОРДС при COVID-19 нетипичный, как и тактика его ведения. По статистике 20% пациентов имеют тяжелую форму пневмонии и требуют госпитализации, а 25% из госпитализированных нуждаются в пребывании в отделении интенсивной терапии. Это как раз та часть пациентов, которая требует инвазивной стратегии вентиляции. Оставшиеся 75% – кандидаты для той или иной неинвазивной стратегии вентиляции.
Структура и частота осложнений у пациентов с COVID-19 следующая:
8% – острая дыхательная недостаточность по другой причине,
7-20% – острая сердечная недостаточность,
6-10% – вторичная инфекция,
14-53% – острая почечная недостаточность,
4-8% – септический шок.
У 33% пациентов, которые были в критическом состоянии, выявлялась кардиомиопатия, а у 71 % погибших был ДВС (диссеминированное внутрисосудистое свертывание).
Повреждения сердца при COVID-19
Как кардиолог, расскажу о повреждениях сердца при COVID-19.
Ранние повреждения сердца это:
8% – инфаркт миокарда как обострение коронарной болезни сердца атеросклеротической или стрессовой кардиомиопатии,
18% – наджелудочковые нарушения ритма сердца,
8% – желудочковые нарушения,
14% – острая остановка сердца.
Крайне редко бывает острое легочное сердце (вследствие ТЭЛА или ОСН). А вот выпотной перикардит в той или иной степени встречается очень часто.
Среди поздних повреждений:
2% – сердечная недостаточность.
Почти у всех переболевших даже в легкой форме наблюдается адгезивный перикардит (уплотнение плевры и перикарда), вызывающий дискомфорт в грудной клетке. Часто после COVID-19 на приёме у кардиолога обнаруживаются манифестация и ухудшение контроля гипертонии.
COVID-19 и повреждения легких
Теперь сконцентрируемся на лёгких. Основным морфологическим субстратом COVID-19 является диффузное альвеолярное повреждение, и даже при легком течении болезни у большинства пациентов на КТ видны инфильтративные изменения. Даже если пациенты малосимптомные и практически без жалоб, у 88% из них выявляются изменения на КТ, хотя бы маленькие. А вот вторичная бактериальная пневмония при COVID-19 встречается редко – примерно в 12% случаев (при других вирусных заболеваниях присоединение вторичной инфекции типично и встречается чаще).
Дыхательная недостаточность при COVID-19 чаще — первого типа (гипоксическая), но нас будет интересовать более редкая дыхательная недостаточность второго типа (гиперкапническая). Она реже встречается и еще реже диагностируется, ведь люди с лёгкой и средней степенью заболевания лечатся дома, где у них никто не берёт газ-анализ, а по пульсоксиметру они классифицируются чаще как гипоксические пациенты.
Особенности течения дыхательной недостаточности при COVID-19 таковы, что одышка возникает относительно поздно, в среднем через 6-6,5 дней после первых симптомов. Но если она уже возникла, до тяжёлого ОРДС проходит в среднем всего два с половиной дня.
Среди тех, кто находится в критическом состоянии, тяжёлая, острая гипоксическая дыхательная недостаточность является доминирующей находкой. Потребность в искусственной вентиляции лёгких у больных в критическом состоянии — от 30% до 100%. Такой большой разброс обусловлен тем, что в разных сообществах реаниматологов, в разных странах и клиниках — разный порог к интубации. Кстати, отмечу, что баротравмы развиваются нечасто, в 2% случаев, поэтому вентилировать неинвазивно — довольно безопасно даже в домашних условиях.
Факторы риска тяжелого течения COVID-19 уже всем известны. Это пожилой возраст, курение, ожирение, хронические заболевания легких, заболевание сердца и сосудов, диабет. Я их перечисляю только для того, чтобы подчеркнуть, что одновременно это факторы риска вентиляторной недостаточности и нарушений дыхания во время сна.
Я изучила рекомендации по НИВЛ общества интенсивной терапии, Китайского торакального общества, Австралийского и новозеландского общества интенсивной терапии, Всемирной организации здравоохранения, Центров США по контролю и профилактике заболеваний, национальных институтов, Немецкого общества пульмонологов. Лучше всего неинвазивная вентиляция развита в Германии. Там все врачи имеют представление о ней, понимают, когда и кому она показана. Кроме того, многие умеют сами налаживать систему.
Поговорим о госпитализированных пациентах.
Если нет показаний к инвазивной вентиляции, то рекомендуется прон-позиция столько времени, сколько пациент сможет ее переносить, и столько, сколько будет для него безопасно (без пролежней и так далее). Надо пациентов к этому мотивировать.
Следующий этап – низкопоточный кислород (1-6 л/мин), который есть в любом стационаре. Далее – высокопоточный кислород (6-20 л/мин) и, наконец, неинвазивная вентиляция.
Согласно немецким рекомендациям нужно опираться на газ-анализ, так как периферическая сатурация и оксигенация не всегда совпадают. У итальянцев описан случай, когда прибыл пациент с уровнем периферической сатурации 67%, но чувствовал себя относительно нормально – был в сознании, дышал, ухаживал за собой. Его не стали интубировать, и он неинвазивно пережил обострение. Поэтому мы в широком смысле опираемся на периферическую оксигенацию, но если есть возможность, контролируем через артериальную концентрацию.
И обязательно следим за частотой дыхания – это один из главных критериев. К тому же подавляющее большинство авторов говорит, что нужно избегать гипероксии, чтобы не подавлять дыхательный драйв.
При неэффективном достижении целей оксигенации переходим на неинвазивную вентиляцию или высокопоточный кислород . Признаки неэффективности низкопоточного кислорода (и на остальных ступенях тоже) – когда не снижается частота дыхания, показатели кислорода не растут до целевых цифр или снижаются, сохраняется работа вспомогательных мышц (обращаем внимание на шею!) или ухудшается гемодинамика.
Если динамика хуже, чем ожидалось, стоит задуматься: только ли в том дело, что кислорода подается недостаточно, вентиляция плохая? Или есть какая-то другая проблема (тромбоэмболия легочной артерии , инфаркт и т. д.)? Поэтому на этапе оценки эффективности стратегии имеет смысл задуматься о дообследовании.
Разные общества выбирали разные преимущественные стратегии при неэффективности обычной низкопоточной канюли. В Испании это высокопоточный кислород, в Италии – шлем CPAP, в США – высокопоточный кислород, в Португалии или то, или другое, в Соединенном Королевстве – CPAP, в Китае давали высокопоточный кислород, в Австралии и Новой Зеландии – тоже, а вот в Германии предпочитали шлем.
Система подачи высокопоточного кислорода состоит из концентратора, датчика кислорода, увлажнителя. Давление может достигать 60 литров в минуту, FiO2 можно увеличивать до 100%. В общих показаниях по высокопоточному кислороду – гипоксемия без гиперкапнии, ОРДС, острая гипоксемическая дыхательная недостаточность любого генеза (особенно после экстубации, т.к. высокопоточный кислород, в отличие от обычного, уменьшает риск реинтубации).
Есть очень интересное исследование, которое все время дополняется, обновляется: сравнение эффективности начальной стартовой терапии какой-то неинвазивной стратегии и ранней ИВЛ. Согласно большому китайскому исследованию на 548 пациентах, применение высокопоточного кислорода давало значительное уменьшение риска интубации и смерти при тяжелом ОРД.
Частота применения высокопоточного кислорода на настоящий момент в разных сообществах составляет 14-63%. Накапливаются уверенные данные о снижении риска или, как минимум, неувеличении риска при использовании высокопоточного кислорода. Это важно, так как мы часто боимся, что неинвазивная стратегия ухудшит прогноз.
Расскажу о неинвазивной вентиляции при дыхательной недостаточности на фоне вирусной пневмонии в предыдущие эпидемии. Рассмотрим три исследования. Первое – о гриппозной пневмонии с тяжелым ОРДС. Одиннадцати из двадцати пациентов при помощи неинвазивной вентиляции удалось избежать интубации. У девяти пациентов неинвазивная вентиляция не была успешной (но у большинства из них показатели PO2/FIO2 изначально были очень низкими).
Дальше – атипичная пневмония 2004 года. 77% пациентов благодаря НИВЛ избежали интубации и всех связанных с ней рисков и последствий. Затем эпидемия МЕRS. Было масштабное исследование четырнадцати клиник Саудовской Аравии. Они поставили себе целью попытаться вести этот синдром неинвазивно. Большая часть пациентов потом переходила на инвазивную вентиляцию, однако применение НИВЛ не увеличило 90-дневную летальность по сравнению с ранней ИВЛ.
Таким образом, было доказано, что инвазивная вентиляция эффективна в 70% случаев при ОРДС средней и легкой степени, а в отдельных случаях – и при тяжелой. Также неинвазивная вентиляция не ухудшает отдаленный прогноз по сравнению с первичной ИВЛ даже у пациентов с тяжелой степенью ОРДС.
Одно из исследований показало, что PO2 и FIO2 увеличиваются быстрее и лучше, если использовать неинвазивную вентиляцию вместе прон-позицией. Далее по убывающей: просто НИВ, высокопоточный кислород плюс прон-позиция, просто высокопоточный кислород. Это еще раз подчеркивает важность позиционирования.
Исследование, основанное на случаях 141 пациента, показало, что неинвазивная вентиляция снизила смертность по сравнению с инвазивной. С другой стороны, на инвазивную вентиляцию попадают люди в тяжелом состоянии, смертность в этой категории пациентов составляет до 80%, поэтому оценить эти данные корректно сложно. Но, согласно нескольким другим исследованиям, применение НИВЛ вместо раннего ИВЛ не ухудшало показатели смертности, что тоже важно. В целом пока нет окончательных данных по этому вопросу, но все больше авторов солидарны в том, что применение НИВЛ часто бывает более выигрышным.
Все рассмотренные авторы сходятся в том, что при легком течении болезни (PaO2/FiO2-200-300) показан высокопоточный кислород (ВПК) и прон-позиция (ПП), а при умеренном (PaO2/FiO2-100-200) предпочтительнее неинвазивная вентиляция (НИВ) и ПП. Сочетание ВПК с НИВЛ может быть лучшим вариантом.
О тактике при тяжелой степени ОРДС еще остается много вопросов. Некоторые исследователи рекомендуют раннюю эндотрахеальную ИВЛ, другие уверены, что даже при тяжелой форме заболевания и выраженной гипоксии все равно стоит пытаться использовать НИВЛ (естественно, с низким порогом к интубации и с четким отслеживанием эффективности).
Из этого обзора исследований можно сделать вывод о том, что из-за неоднородности клинической картины пневмонии и ОРДС при COVID-19 высоко оправдан индивидуальный несхематичный подход к вентиляции.
Оказалось, что новую коронавирусную инфекцию люди переносят очень по-разному. Например, поражение очаговое одинаковое, но у кого-то гипоксия, у кого-то нет. У одних пациентов очень выраженная одышка и перегрузка вентиляторной мускулатуры, а другие довольно спокойны. Это тоже определяет показания к вентиляции. Авторы говорят о том, что при тяжелом течении COVID-19 не всегда бывает ОРДС, а если он и развивается, то протекает нетипично, не ступенчато, поэтому не всегда типично отвечает на предложенную по схемам ОРДС-терапию.
Параметры НИВЛ при пневмонии COVID-19
Рекомендовано начинать с низких параметров:
В общем, это неагрессивные, маленькие цифры, которые даже во время бодрствования вполне себе переносимы.
Лучшие кандидаты для применения ранней неинвазивной стратегии — это пациенты с ХОБЛ, с гиперкапнической дыхательной недостаточностью любого генеза (нейромышечной, паллиативной, кардиогенным отеком легких, обострением астмы, после операций на грудной клетке и брюшной полости, пациенты с ожирением, иммуносупрессией). Для этой маски очень важен комплаенс, а если нет приверженности, пациент против, ажитирован, все остальное уже не имеет значения.
В исследованиях я нашла несколько интересных моментов. Пишут, что при развитии у этих пациентов дыхательной недостаточности (ДН) второго типа, гиперкапния, скорее всего, объясняется увеличением мертвого пространства. Также пишут, что если тяжелую гиперкапнию невозможно контролировать, несмотря на увеличение частоты дыхания до 35/ мин, то нужно увеличивать объем вентиляции (начинаем с 6 и можно увеличивать дальше, но не превышать PEEP более 15 и PРlat более 30 см Н2О, то есть вентиляция не должна быть слишком агрессивной).
Итак, мы смотрим за падением сатурации, всегда имея в виду, что она падает не только из-за неэффективности вентиляции, но и из-за того, что пациент снимал маску, из-за того, что в этот момент произошла аспирация, и по другим причинам. То есть не обязательно сразу грешить на неэффективность инвазивной вентиляции. Если PaO2/FiO2 значительно улучшаются, частота дыхания снижается при относительно низком используемом объеме, тогда принимаем решение продолжать НИВЛ, откладывая ИВЛ. Если сатурация сохраняется на уровне 90% или снижается и сохраняется тахипноэ при использовании максимального дыхательного объема, тогда рассматривается вопрос об интубации.
Почти все авторы практикуют комбинацию неинвазивной вентиляции с кислородотерапией. Во-первых, можно давать кислород вместо неинвазивной вентиляции, когда плохо переносится маска. В этом случае можно периодически ее снимать и предлагать пациенту канюлю или высокопоточный кислород. Во-вторых, в перерывах, когда нужно поговорить с пациентом, или покормить его и т.д. В-третьих, вместе с неинвазивной вентиляцией, когда нужно корректировать и то, и другое одновременно. Причем можно под маску поставить канюлю, а можно присоединить кислород к контуру. Допустимо использовать НИВЛ и кислород в комплексе, если при нахождении на неинвазивной вентиляции у пациента сохраняется сатурация менее 90% или напряжение кислорода менее 55 на максимально рекомендованных настройках.
Уже доказано, что среднее время на ИВЛ при COVID-19 значительно больше, чем при классическом ОРДС. И это отличает его от других описанных ранее ОРДС. При этом у большинства пациентов с COVID-19 наблюдается высокий респираторный драйв, т.е. одышка.
Она выражена иногда даже неадекватно гипоксемии: бывает, что одышка сильная, хотя сатурация неплохая. Это происходит в том числе из-за цитокинового шторма и прямых нейротропных эффектов этого вируса на дыхательный центр, вызывающих нейропатию. НИВЛ рекомендуется в том числе для того, чтобы после экстубации предотвратить повреждение легких. Порой в случае чрезмерных усилий на вдохе происходит перерастяжение легких из-за низкого внутриплеврального давления и высокого дыхательного объема, что может вызвать повреждение паренхимы, т.е. пациент сам себя повреждает.
Следующее – это защита диафрагмы. НИВЛ позволяет уменьшить слишком интенсивную работу мышц после экстубации, т.е. неконтролируемую одышку. Ведь если чрезмерная работа какое-то время сохраняется, возникает отек диафрагмы со снижением в последующем ее сократительной способности, из-за прямого разрушения саркомера. То есть из-за этой гиперактивности разрушается вещество мышцы. Это называется вентилятор-индуцированное повреждение диафрагмы, оно ведет к более длительному времени вентиляции и увеличению количества осложнений.
Применять НИВЛ следует с осторожностью, учитывая опасность аэрозолизации. Основные меры предосторожности: отбор пациентов:
Рекомендации по НИВЛ при COVID-19 в домашних условиях заключаются в том, что дома НИВЛ можно продолжать с соблюдением дистанцирования, с использованием бактериальных фильтров. Возможно потребуется коррекция режима: если у пациента исходно был ХОБЛ или тяжелое апноэ, вероятно, придется сделать терапию менее агрессивной. При поступлении в стационар при отсутствии условий нужно отменить НИВЛ (если это открытый контур, чтобы не подвергать риску соседей), а если условия есть, нужно продолжить НИВЛ в стационаре, по возможности, заменив на закрытый контур.
Поскольку легкие – основной “орган-мишень” вируса SARS-CoV-2, для более эффективного восстановления организма необходимо, в первую очередь, восстановление дыхательной функции. Физическая реабилитация здесь приобретает огромное значение.
Многие рекомендации по реабилитационному периоду основаны на международных рекомендациях по ХОБЛ (с некоторыми модификациями). Пациентам с сохраняющимися астеническими ощущениями особенно нужна реабилитация по восстановлению и мышечной силы, и дыхательной функции.
Много информации содержится в “Методических рекомендациях проведения легочной реабилитации у пациентов с новой коронавирусной инфекцией (COVID-19), внебольничной двухсторонней пневмонии. Версия 1 (11.07.2020)”. Там говорится о реабилитации респираторной функции, мышечной дисфункции и так далее. Во всем мире пристальное внимание сейчас уделяется нутритивной поддержке. Говорится и о реабилитации коморбидных состояний (психологической и медикаментозной).
Цели реабилитации, в первую очередь, облегчить одышку и снять тревогу и депрессию, а в долгосрочной перспективе – максимально сохранить функциональность, улучшить качество жизни и способствовать возвращению пациента в общество.
Методы легочной реабилитации улучшают жизнедеятельность, уменьшают одышку, улучшают качество жизни, сокращают продолжительность и количество госпитализаций, увеличивают толерантность к нагрузке, увеличивают выживаемость, увеличивают бронходилатационный эффект.
Направления респираторной реабилитации:
К.м.н. Зульфия Сукмарова.
Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Использовано стоковое изображение от Depositphotos.
Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии
Изучение летальности и факторов риска смерти больных с COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии (ОРИТ) лечебных учреждений Российской Федерации.
Материалы и методы
Ретроспективное исследование было выполнено в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых пациентов с COVID-19 на базе Первого МГМУ им. И.М. Сеченова. В исследование включали всех пациентов с известными исходами (смерть от любых причин или выздоровление) SARS-CoV-2 пневмонии, осложнившейся острым респираторным дистресс синдромом (ОРДС), которые были проконсультированы с 16 марта по 3 мая 2020 г. Факторы риска смерти анализировали с помощью многофакторной регрессионной модели Кокса.
В исследование были включены 1522 пациента, 864 (56,8%) мужчины и 658 (43,2%) женщин. Медиана возраста – 62 года. 922 (60,6%) больных находились в ОРИТ стационаров Москвы и Московской области, 600 (39,4%) – лечебных учреждений в 70 регионах Российской Федерации. У 995 (65,4%) больных диагноз SARS-CoV-2 инфекции был подтвержден с помощью ПЦР. Умерли 995 (65,4%) пациентов, выжили 527 (34,6%). Основными причинами смерти были ОРДС (93,2%), серКЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (3) дечно-сосудистые осложнения (3,7%) и тромбоэмболия легочной артерии (1,0%). Летальность была низкой у пациентов, находившихся на оксигенотерапии (10,1%), и значительно повышалась у больных, которых приходилось переводить на неинвазивную (36,8%) или инвазивную (76,5%) вентиляцию легких. Риск смерти увеличивался с возрастом и в возрастных группах старше 50 лет у мужчин был достоверно выше, чем у женщин. В однофакторных моделях заболеваниями, ассоциировавшимися с развитием летального исхода, были артериальная гипертония, ИБС, инсульт, фибрилляция предсердий, сахарный диабет 2 типа, ожирение и солидные опухоли, однако в многофакторной модели, построенной по всем признакам с коррекцией по полу и возрасту, статистическое значение сохранили только ИБС (отношение рисков [ОР] 1,257, 95% доверительный интервал [ДИ] 1,064-1,485, p=0,007), сахарный диабет 2 типа (ОР 1,300, 95% ДИ 1,131-1,494, p Заключение
Основными факторами риска смерти больных с COVID-19, переведенных в ОРИТ для респираторной поддержки, были тяжесть ОРДС, прежде всего необходимость в ИВЛ, пожилой возраст, мужской пол, а также ИБС, ожирение и сахарный диабет 2 типа.
Вдекабре 2019 г. в Китае началась вспышка инфекции, вызванной SARS-CoV-2 (severe acute respiratory syndrome coronavirus-2) и получившей название COVID-19 (Coronavirus disease 2019) [1]. В течение последующих 6 мес общее число подтвержденных случаев новой коронавирусной инфекции в мире превысило 18 млн и продолжает быстро увеличиваться, особенно в США, странах Южной Америки и Индии. Только в июле 2020 г. в мире было зарегистрировано более 7 млн новых случаев SARS-CoV-2 инфекции. Хотя санитарно-эпидемиологические меры, которые в том или ином объеме предпринимаются во всех странах, охваченных пандемией COVID-19, позволяют ограничить распространение инфекции, их неизбежное ослабление сопровождается новым ростом заболеваемости (“второй волной»). В связи с этим основные надежды в борьбе с пандемией связывают с вакцинацией. В настоящее время в различных странах, включая Россию, разрабатываются почти 200 вакцин-кандидатов против SARS-CoV-2 [2]. Недавно были опубликованы обнадеживающие результаты клинических исследований 1-2 фазы вакцин, разработанных в России, Великобри тании, США или Китае 6. В рандомизированном контролируемом исследовании у 1077 здоровых добровольцев в возрасте 18-55 лет однократное введение рекомбинантной векторной вакцины ChAdOx1, содержащей ген белка S( spike) SARS-CoV-2 (университет Оксфорда, Великобритания), вызывало образование нейтрализующих антител в достаточном титре в 91% случаев и Т-клеточный ответ в 100% [4]. Достигнутый эффект сохранялся через 56 дней. Вакцинация часто вызывала развитие местных и общих нежелательных реакций, однако они не были тяжелыми и обычно контролировались парацетамолом. В августе 2020 г. в Российской Федерации была зарегистрирована первая отечественная вакцина против SARS-CoV-2, которая состоит из двух рекомбинантных аденовирусных векторов, несущих ген белка S вируса SARS-CoV-2. В двух открытых неконтролируемых исследованиях 1/2 фазы у 76 здоровых добровольцев введение вакцины вызывало мощный гуморальный и клеточный ответ и хорошо переносилось [6]. Основными нежелательными явлениями были боль в месте инъекции (58%), повышение температуры тела (50%), головная боль (42%), астения (28%) и боль в мышцах и суставах (24%). Серьезных нежелательных явлений не зарегистрировали.
У большинства больных COVID-19 характеризуется легким или бессимптомным течением, однако у части пациентов наблюдается развитие вирусной пневмонии, которая может осложниться острым респираторным дистресс синдромом (ОРДС) и полиорганной недостаточностью [7]. В Китае доля пациентов, которым потребовался перевод в отделение реанимации и интенсивной терапии (ОРИТ) для респираторной поддержки, среди госпитализированных больных с COVID19 варьировалась от 5% до 32% [8,9], в Ломбардии (Италия) в ОРИТ были госпитализированы 9% из 17713 пациентов с подтвержденной SARS-CoV-2 инфекцией [10], а в Чикаго (США) – 6,1% из 8673 больных [11] По данным исследований, проводившихся в Китае и других странах, риск более тяжелого течения COVID-19 выше у людей старшего возраста, страдающих различными сопутствующими заболеваниями, прежде всего сердечно-сосудистыми, сахарным диабетом и ожирением 13. Сходные результаты были получены в нашем ретроспективном исследовании, в которое были включены более 1000 пациентов с тяжелой и крайней тяжелой SARS-CoV-2 пневмонией, госпитализированных в ОРИТ лечебных учреждений Российской Федерации для респираторной поддержки [17]. Около половины из них были в возрасте старше 60 лет, а более чем у 2/3 пациентов имелись различные сопутствующие заболевания, в том числе артериальная гипертония и другие сердечно-сосудистые болезни, сахарный диабет, ожирение и др. У каждого пятого больного с тяжелым течением COVID-19 наблюдалось раннее развитие септического шока, факторами риска которого были возраст старше 50 лет и наличие трех сопутствующих заболеваний [18]. Мы не анализировали летальность больных в российских ОРИТ, так как исследование проводилось вскоре после начала вспышки SARS-CoV2 инфекции в Российской Федерации, а исходы заболевания у большинства пациентов еще не были известны вследствие непродолжительного срока наблюдения. Необходимо отметить, что в регулярно публикуемые статистические показатели включают данные о летальности больных только с подтвержденной SARS-CoV-2 инфекцией, в то время как у значительной части госпитализированных пациентов со средне-тяжелым или тяжелым течением COVID-19 результаты полимеразной цепной реакции (ПЦР) оказываются отрицательными, а диагноз устанавливают на основании клинической картины, эпидемиологического анамнеза и данных компьютерной томографии (КТ) органов грудной клетки. В нашей когорте доля таких пациентов составила около 40% [17]. Соответственно, исследования, которые проводятся в обычной клинической практике, позволяют получить более точное представление об исходах COVID-19.
Целью настоящего ретроспективного исследования было изучение летальности и факторов риска смерти больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ лечебных учреждений Российской Федерации.
Материал и методы
Ретроспективное исследование было выполнено в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых на базе Первого МГМУ им. И.М. Сеченова. Анализировали заявки на консультацию больных с тяжелым течением COVID-19, поступавшие в центр по интернет из ОРИТ лечебных учреждений Москвы, Московской области и других регионов Российской Федерации. В исследование включали всех пациентов с COVID-19, которым потребовалась респираторная поддержка, независимо от результата ПЦР. Если результаты вирусологического исследования были отрицательными, сомнительными или отсутствовали, то диагноз устанавливали на основании клинических признаков острой респираторной инфекции, осложнившейся острой дыхательной недостаточностью, в сочетании с характерными данными компьютерной томографии (КТ) органов грудной клетки при отсутствии других этиологических факторов [19].
На основании полученных заявок оценивали демографические показатели, сопутствующие заболевания (артериальная гипертония, ишемическая болезнь сердца [ИБС], инсульт, фибрилляция предсердий, ожирение, сахарный диабет, бронхиальная астма, хроническая обструктивная болезнь легких [ХОБЛ], ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы, ВИЧ-инфекция), данные КТ легких, уровень респираторной поддержки (оксигенотерапия, неинвазивная вентиляция легких [НИВЛ], искусственная вентиляция легких [ИВЛ] без признаков септического шока, ИВЛ в сочетании с септическим шоком [полиорганная недостаточность и необходимость в вазопрессорной поддержке]). Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аорто-коронарное шунтирование) в анамнезе. Хроническую сердечную недостаточность не учитывали в связи с высокой вероятностью гипердиагностики этого состояния. Ожирение диагностировали на основании индекса массы тела: 2 – нормальная масса тела, 25,0-29,9 кг/м 2 – избыточная масса тела, 30,0-34,9 кг/м 2 – ожирение 1 степени, 35,039,9 кг/м 2 – 2 степени и ≥40,0 кг/м 2 – 3 степени. При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты. Степень выраженности изменений на КТ легких оценивали с учетом распространенности и характера поражения [17].
Исходы (смерть или выздоровление) определяли с помощью базы данных COVID-19, которая создана в Российской Федерации по решению Министерства здравоохранения. В эту базу данных включается информация о всех пациентах, у которых установлен диагноз COVID-19, в том числе вероятный. Если исход заболевания в базе данных не был зафиксирован, то запрашивали соответствующее лечебное учреждение. Пациентов, у которых продолжалась респираторная поддержка на момент анализа, в исследование не включали.
Статистический анализ. Описательный статистический анализ проводился с использованием программы IBM SPSS Statistics 22 (IBM Corporation, США). Нормальность распределения определяли с помощью критерия Шапиро-Уилка. Данные для количественных показателей представлены в виде среднего арифметического и стандартного отклонения (при нормальном распределении) или в виде медианы и межквартильного размаха (при отклонении распределения от нормального). Данные для качественных переменных представлены в виде абсолютных значений и доли в процентах. Медианы количественных показателей сравнивали с помощью U-критерия Манна-Уитни (при сравнении двух групп). Сравнение групп по качественным признакам проводилось с помощью критерия χ2-Пирсона (при количестве наблюдений в группе ≥10) и точного критерия Фишера (при количестве наблюдений в группе
Результаты
Демографические показатели. Федеральный дистанционный консультативный центр анестезиологии и реаниматологии для взрослых на базе Первого МГМУ им. И.М. Сеченова был создан по приказу Минздрава РФ 16 марта 2020 г. С этого времени в центр ежедневно поступает по 100-180 заявок на консультацию больных с диагнозом COVID-19, госпитализированных в ОРИТ. В целом на 16 августа 2020 г. в центре проконсультированы 11829 больных, в том числе 3100 из Москвы, 909 из Московской области и 7820 из других регионов Рос сийской Федерации. Из этой когорты были отобраны первые 1522 пациента с известными исходами, которые были проконсультированы до 3 мая 2020 г. Наблюдение за пациентами с момента госпитализации в инфекционный стационар до развития конечной точки (летальный исход или выписка из стационара) проводили до 7 июля 2020 г. Медиана длительности наблюдения составила 16 (9; 27) дней.
Доля мужчин среди обследованных больных несколько превышала долю женщин (табл. 1). Женщины были достоверно старше мужчин (средний возраст 64,4±13,4 и 59,1±13,8 лет, соответственно; р ТАБЛИЦА 1. Демографические и клинические показатели 1522 больных с тяжелым и крайне тяжелым течением COVID-19, госпитализированных в ОРИТ
Клиническая характеристика пациентов. У всех больных наблюдалась картина ОРДС в виде двусторонней полисегментарной пневмонии 3-4 стадии и острой дыхательной недостаточности, требовавшей респираторной поддержки. Примерно 80% больных были переведены на ИВЛ в связи с нарастающей острой дыхательной недостаточностью, которую не удавалось контролировать оксигенотерапией или НИВЛ. Почти у каждого пятого пациента отмечено развитие септического шока, характеризовавшегося полиорганной недостаточностью и необходимостью в вазопрессорной поддержке. Доля пациентов, находившихся на ИВЛ, в Москве и Московской области была выше (86,5% и 88,5%), чем в других регионах Российской Федерации (66,3%), а доля больных, которым потребовалась только оксигенотерапии, в московском регионе была, наоборот, в несколько раз ниже (4,9%, 8,2% и 24,7%, соответственно).
У большинства больных имелись различные сопутствующие заболевания. Чаще всего встречались артериальная гипертония (59,5%), сахарный диабет 2 типа (26,7%) и ожирение (26,0%), несколько реже – ИБС (15,4%), инсульт в анамнезе (7,4%), фибрилляция предсердий (10,6%) и ХОБЛ (5,1%). Частота других заболеваний, в том числе бронхиальной астмы, злокачественных новообразований, ревматических аутоиммунных заболеваний и ВИЧ-инфекций была низкой и не превышала 5%.
У 363 (23,9%) пациентов не были выявлены сопутствующие заболевания, у 395 (26,0%) – имелось по крайней мере одно заболевание, у 383 (25,3%) – два, у 379 (24,9%) – три и более.
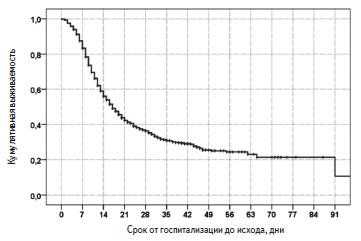
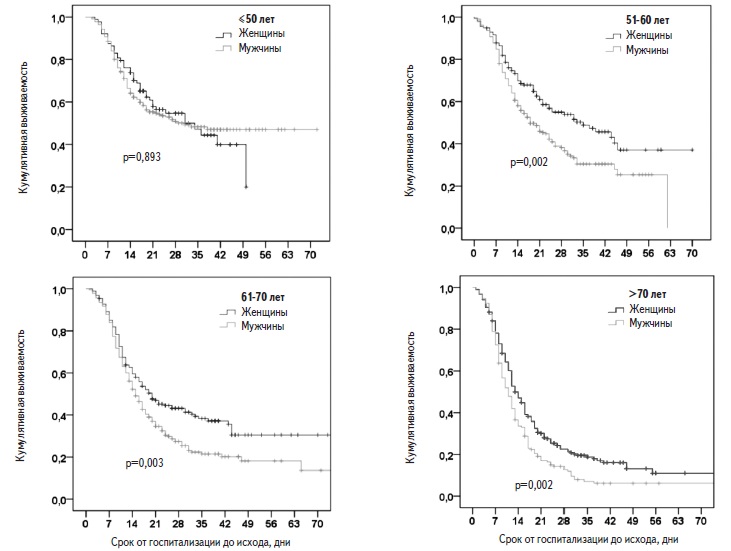
Выживаемость пациентов. За период наблюдения умерли 995 (65,4%) пациентов, выжили 527 (34,6%). Медиана выживаемости пациентов, рассчитанная методом Каплана-Майера, составила 17 (15,7; 18,2) дней (рис. 1). С момента госпитализации в стационар 14- и 28-дневная выживаемость пациентов равнялась 56,0% и 36,4%, соответственно. В Москве за период наблюдения умерли 551 (74,5%) из 740 человек, в Московской области – 143 (78,6%) из 182, в других регионах – 301 (50,2%) из 600.
Причины летального исхода включали в себя ОРДС (93,2%), сердечно-сосудистые осложнения (3,7%), тромбоэмболию легочной артерии (1,0%), осложнения онкологических заболеваний (0,9%), “септические» осложнения (0,7%), осложнения цирроза печени (0,3%), осложнения ВИЧ-инфекции (0,1%) и туберкулез (0,1%).
Летальность пациентов, находившихся на оксигенотерапии, составила 10,1% (20/199), НИВЛ – 36,8% (35/95), ИВЛ – 76,5% (940/1228). Самой высокой летальность была среди пациентов, у которых имелись признаки септического шока – 86,6% (246/284). Медиана длительности ИВЛ у умерших пациентов равнялась 6 (3; 12) дней, а медиана длительности ИВЛ до экстубации у выживших пациентов – 13 (7; 21) дней. Среди пациентов, у которых диагноз SARS-CoV-2 инфекции, был подтвержден и не был подтвержден с помощью ПЦР, летальность не отличалась – 63,5% и 68,9%, соответственно.
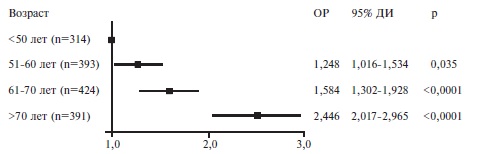
Факторы риска смерти. Пациенты, у которых наступил летальный исход, были старше выживших больных (табл. 2). В регрессионной модели Кокса риск смерти у пациентов старше 50 лет был достоверно выше, чем у больных более молодого возраста, и достигал максимума у пациентов старше 70 лет (рис. 2). Выживаемость в значительной степени зависела как от возраста, так и от пола. Среди пациентов старше 50 лет выживаемость у мужчин была достоверно ниже, чем у женщин, однако среди пациентов в возрасте ≤50 лет выживаемость не различалась у мужчин и женщин (рис. 3).
| Параметры | Выжившие (n=527) | Умершие (n=995) | p | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Возраст, лет; Me (IQR) | 56 (48; 64) | 65 (56; 74) | ТАБЛИЦА 3. Отношение рисков смерти, рассчитанное в регрессионной модели Кокса для сопутствующих заболеваний| Фактор | Исходная модель | Модель 1 | Модель 2 | ОР; 95% ДИ | p | ОР; 95% ДИ | p | ОР; 95% ДИ | p | Примечание: Исходная модель: однофакторный анализ; *анализ двух признаков совместно – пол и возраст; Модель 1: многофакторный анализ каждого признака по отдельности с коррекцией по полу и возрасту; Модель 2: многофакторный анализ по всем признакам с коррекцией по полу и возрасту | | |||||||||
| Пол (мужской) | 1,167; 1,029-1,324 | 0,016 | 1,358*; 1,194-1,545 | 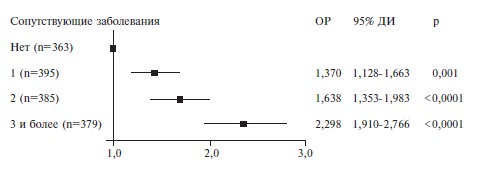 Рис. 4. Отношение рисков смерти пациентов в зависимости от числа сопутствующих заболеваний Рис. 4. Отношение рисков смерти пациентов в зависимости от числа сопутствующих заболеваний | |||||||||||||||||||
Лабораторные показатели. У умерших пациентов количество лейкоцитов, нейтрофилов и содержание глюкозы в крови были выше, чем у выживших больных, а количество тромбоцитов и сывороточное содержание альбумина оказалось ниже (табл. 4). В то же время концентрации С-реактивного белка (СРБ), фибриногена и D-димера достоверно не отличались между двумя группами. Частота острого повреждения почек (ОПП) была достоверно выше в группе умерших пациентов (26,7% и 8,5%, соответственно; p 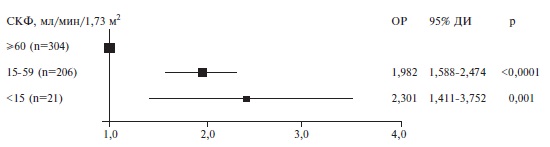
| Параметры | Все пациенты | Выжившие | Умершие | p | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Гемоглобин, г/л | 126 (110; 136), n=449 | 132 (119; 145), n=158 | 125 (110; 135), n=219 | 0,859 | ||||||||||||
| Лейкоциты, ×10 9 /л | 8,1 (5,6; 11,8), n=595 | 7,2 (5,0; 9,9), n=227 | 9,0 (6,3; 12,6), n=368 | 9 /л | 0,9 (0,6; 1,3), n=519 | 1,0 (0,6; 1,3), n=190 | 0,9 (0,6; 1,3), n=329 | 0,167 | ||||||||
| Нейтрофилы, ×10 9 /л | 6,2 (3,9; 8,8), n=351 | 5,3 (3,6; 7,6), n=139 | 6,9 (4,3; 9,3), n=212 | 0,001 | ||||||||||||
| Тромбоциты, ×10 9 /л | 235 (170; 293), n=371 | 191 (144; 268), n=198 | 180 (132; 244), n=304 | 0,050 | ||||||||||||
| Альбумин, г/л | 32,0 (27,9; 36,9), n=278 | 33,1 (28,8; 37,1), n=97 | 31,0 (27,0; 35,7), n=181 | 0,010 | ||||||||||||
| Глюкоза, ммоль/л | 7,3 (5,8; 9,9), n=436 | 6,9 (5,6; 8,5), n=164 | 7,7 (5,9; 10,8), n=272 | 0,001 | ||||||||||||
| СРБ max, мг/л | 131,0 (72,8; 209,0), n=218 | 117,5 (42,0; 207,0), n=86 | 133,5 (96,0; 212,0), n=132 | 0,231 | ||||||||||||
| Фибриноген, г/л | 5,1 (3,9; 7,2), n=234 | 5,1 (4,0; 7,3), n=100 | 5,3 (3,9; 7,1), n=134 | 0,866 | ||||||||||||
| Д-димер, нг/мл | 820 (384; 2348), n=95 | 727 (381; 1957), n=36 | 930 (426; 2682), n=59 | 0,485 | ||||||||||||
| Поражение почек, n (%) | 335/587 (57,1) | 83/210 (39,5) | 252/377 (66,8) | 2 | 64,6 (43,7; 84,0), n=531 | 76,7 (61,0; 92,4), n=197 | 57,0 (36,5; 77,4), n=334 | 2 | 59,0 (36,0; 80,8), n=510 | 75,3 (56,0; 89,4), n=193 | 46,9 (27,5; 72,2), n=317 | Поражение печени, n (%) | 283/1201 (23,6) | 85/433 (19,6) | 198/768 (25,8) | 0,090 |
| АЛТ max, ед/л | 41,1 (28,1; 73,0), n=515 | 43,0 (29,2; 76,0), n=194 | 40,0 (27,3; 69,0), n=321 | 0,320 | ||||||||||||
| АСТ max, ед/л | 56,0 (39,0; 93,0), n=500 | 53 (36,0; 83,5), n=189 | 58,0 (40,0; 101,7), n=311 | 0,040 | ||||||||||||
| Общий билирубин, мкмоль/л | 13 (9; 20), n=88 | 12 (8; 15), n=33 | 14 (9; 27), n=55 | 0,072 | ||||||||||||
| ЛДГ max, ед/л | 619 (418; 875), n=179 | 511,6 (375; 694), n=56 | 675 (495;994), n=123 | 0,003 |
Обсуждение
В нашем исследовании летальность у 1522 больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ лечебных учреждений Российской Федерации, составила 65,4%. В течение первых 14 дней после госпитализации в инфек ционный стационар умерли 44,0% больных, а в течение 28 дней – 63,6%. В качестве причины смерти у 93% больных был указан ОРДС. Летальность была низкой (10,1%) у пациентов, находившихся на оксигенотерапии, однако она значительно увеличивалась при прогрессирующем течении заболевании и достигала 76,8% у больных, которых приходилось переводить на ИВЛ. Самой высокой летальность (86,6%) была у пациентов с септическим шоком, характеризовавшися полиорганной недостаточностью и необходимостью в вазопрессорной поддержке. Следует отметить, что у больных с тяжелым течением COVID-19 именно вирус, а не вторичные бактериальные инфекции является ведущей причиной развития сепсиса и септического шока [20]. В пользу этого свидетельствуют раннее развитие септического шока у значительной части пациентов [18] и отрицательные результаты бактериологического исследования крови и выделений из нижних дыхательных путей более чем у 75% больных сепсисом, развившимся на фоне COVID-19 [21].
В исследованной когорте летальность больных, госпитализированных в ОРИТ, была практически одинаковой в Москве и Московской области (74,5% и 78,6%, соответственно) и существенно ниже (50,2%) в других регионах России. Вероятно, это объяснялось тем, что в Московском регионе, где было зарегистрировано максимальное число случаев SARS-CoV-2 инфекции, в ОРИТ переводили пациентов с наиболее тяжелым течением пневмонии, прежде всего нуждавшихся в ИВЛ. Так, частота ИВЛ у больных, поступивших в ОРИТ лечебных учреждений Москвы и Московской области, превышала 85%, в то время как в других регионах России только около 66% больных, переведенных в ОРИТ, нуждались в ИВЛ, а примерно 25% пациентов получали оксигенотерапию.
Для достоверного диагноза SARS-CoV-2 инфекции необходим положительный результат ПЦР, однако в исследованной когорте примерно у трети пациентов диагноз не удалось подтвердить с помощью вирусологического исследования. Тем не менее, во всех этих случаях наличие COVID-19 не вызывало сомнения и подтверждалось как клиническими данными (острая респираторная инфекция, осложнившаяся острой дыхательной недостаточностью, при отсутствии других возможных этиологических факторов), так и типичными результатами КТ органов грудной клетки (двусторонние зоны “матового стекла» ± зоны консолидации и ретикулярные изменения легких). Высокие чувствитель
ность и специфичность КТ органов грудной клетки в диагностике SARS-CoV-2 инфекции подтверждаются результатами исследований, проводившихся в других странах 22. Летальность больных с подтвержденным и неподтвержденным диагнозом SARS-CoV-2 инфекции в нашем исследовании была практически одинаковой.
Хотя пандемия COVID-19 продолжается уже более полугода, данные о летальности больных, которым потребовалась госпитализация в ОРИТ, остаются ограниченными. P. Quah и соавт. провели мета-анализ 15 исследований, в которых оценивали летальность у 3798 больных с COVID-19, поступивших в ОРИТ [25]. Эти исследования проводились в разных странах, в том числе в Китае, США, Италии, Испании, Германии, Дании и Великобритании. Большинство из них были небольшими и включали в себя не более 100 пациентов. В целом летальность составила всего 25,7%, однако более половины больных оставались в ОРИТ на момент публикации, поэтому очевидно, что приведенный показатель является заниженным и его не следует сравнивать с таковым в нашем исследовании, в которое включали только пациентов с известными исходами SARS-CoV-2 пневмонии. Например, в самом крупном итальянском исследовании, в которое были включены более 1500 больных с COVID-19, госпитализированных в ОРИТ, на момент анализа летальность равнялась 26%, однако 58% больных продолжали лечение в ОРИТ, и только 16% пациентов были выписаны [10]. В исследованной нами когорте летальность увеличилась с 44% через 14 дней до 63% через 28 дней. Необходимо также учитывать и различную частоту ИВЛ, которая варьировалась от 35,4% в китайских исследованиях до 89,3% в исследованиях, проведенных в США. В целом частота ИВЛ в исследованиях, включенных в мета-анализ, была ниже (70%), чем в российской когорте (около 80%). В другом мета-анализе были обобщены результаты 24 наблюдательных исследований в целом у 10150 пациентов с COVID-19, госпитализированных в ОРИТ в лечебных учреждениях Азии, Европы и Северной Америки [26]. Летальность варьировалась от 0 до 84,6% и в среднем составила 41,6%. Следует отметить, что только в 7 исследованиях исходы были известны у всех больных, причем только в одно из них было включено достаточно количество больных (n=371), в то время как в остальных оно варьировалось от 1 до 50 (в целом 80). В более крупном исследовании, проводившемся в НьюЙорке, летальность в ОРИТ достигла 78% [27]. Кроме того, авторы мета-анализа не оценивали тяжесть пациентов, поступивших в ОРИТ, в частности частоту ИВЛ.
В опубликованных ранее исследованиях также была выявлена ассоциация между сахарным диабетом и более тяжелым течением COVID-19. Например, в крупном американском исследовании (n=7162) частота сахарного диабета у пациентов, поступивших в ОРИТ, была в несколько раз выше, чем у больных, которым не потребовалась госпитализация [42]. Сходные данные были получены в другом американском исследовании [15]. В итальянском исследовании у 373 госпитализированных больных с COVID-19 сахарный диабет ассоциировался с достоверным увеличением риска летального исхода (относительный риск 1,56; 95% ДИ 1,05-2,02) [43].
ХОБЛ и бронхиальная астма в исследованной нами когорте больных с тяжелым течением COVID-19 встречались реже (5,1% и 2,3%, соответственно), чем в общей российской популяции [44]. Результаты метаанализа 6 исследований у 1558 больных COVID-19 показали, что ХОБЛ является независимым фактором риска прогрессирования SARS-CoV-2 инфекции [45]. В нашем исследовании частота ХОБЛ у умерших пациентов примерно в два раза превышала таковую у выживших. Тем не менее, роль этого заболевания как фактора риска смерти у пациентов, госпитализированных в ОРИТ, не была подтверждена при многофакторном анализе.
Низкая частота бронхиальной астмой у пациентов с COVID-19 была отмечена и в других исследованиях [46]. S. Lovinsky-Desir и соавт. показали, что наличие бронхиальной астмы у больных с COVID-19 не сопровождалось ухудшением прогноза независимо от возраста, наличия ожирения или других сопутствующих заболеваний [47]. В нашем исследовании частота бронхиальной астмы у умерших и выживших пациентов была одинаковой. Высказано предположение, что особенности иммунного ответа у пациентов с бронхиальной астмой или терапия ингаляционными глю ко кор ти костероидами могут препятствовать более тяжелому течению SARS-CoV-2 пневмонии [46,48], хотя благоприятный эффект последних вызывает сомнение. Бронхиальная астма часто асоциируется с увеличением количества эозинофилов, которые обладают как провоспалительными эффектами, так и иммунорегулирующей противовирусной активностью. Однако в настоящее время нет данных о том, что эозинофилы оказывают защитное действие или, наоборот, способствуют поражению легких при SARS-CoV-2 инфекции, хотя эозинопения позволяет предсказать более тяжелое течение заболевания [49]. В нашей когорте абсолютное число эозинофилов в крови было ниже 0,02 × 109/л у большинства больных, госпитализированных в ОРИТ, а случаев эозинофилии крови мы не зарегистрировали [50].
Частота других сопутствующих заболеваний, которые теоретически могут повысить риск смерти больных с тяжелым течением COVID-19, в том числе злокачественных опухолей, гемобластозов, ревматических аутоиммунных заболеваний (таких как ревматоидный артрит, системная красная волчанка и др.) и ВИЧинфекции, в исследованной когорте была низкой. У умерших пациентов частота солидных опухолей, диагностированных в течение последних 5 лет, в несколько раз превышала таковую у выживших больных (5,3% и 1,9%, соответственно), однако роль злокачественных новообразований как фактора риска смерти не была подтверждена при многофакторном регрессионном анализе Кокса. Частота аутоиммунных заболеваний, гемобластозов и ВИЧ-инфекции соответствовала таковой в общей популяции и была практически одинаковой у умерших и выживших пациентов.
Мы не анализировали прогностическое значение лабораторных показателей, так как подробные результаты анализов крови и мочи имелись далеко не во всех случаях. Следует отметить, что концентрации СРБ и Dдимера достоверно не отличались между группами выживших и умерших пациентов. Как и следовало ожидать, частота ОПП, которое служит одним из проявлений сепсиса и септического шока, была достоверно выше у умерших больных. В то же время разница частоты повреждения печени между двумя группами не достигла статистической значимости.
Заключение
В российских ОРИТ летальность больных SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержки, составила в среднем 65,4%. Летальность в значительной степени зависела от тяжести ОРДС и показаний к госпитализации в ОРИТ. Так, она была значительно выше у пациентов, которых переводили на ИВЛ, особенно при наличии признаков септического шока, и оказалась ниже в регионах Российской Федерации, где, в отличие от Москвы и Московской области, около четверти больных, поступивших в ОРИТ, не нуждались в НИВЛ или ИВЛ. Летальность у пациентов старше 50 лет, особенно мужчин, была выше, чем у больных более молодого возраста. По данным многофакторного анализа Кокса, факторами, ассоциировавшимися с более высоким риском смерти больных тяжелой SARS-CoV-2 пневмонией, осложнившейся ОРДС, были ИБС (инфаркт миокарда и/или вмешательства на коронарных артериях в анамнезе), ожирение (ИМТ≥35 кг/м 2 ) и сахарный диабет 2 типа.