койлинг левой вса что это
Патологическая извитость
Заболевания
О болезни
Значимая извитость магистральны артерий головы, равно как и их сужение, может приводить к дефициту кровоснабжения головного мозга, и так же, как в случае со стенозирующим атерослерозом, приводить к инсульту (острое нарушение кровоснабжения головного мозга). Формируются извитости вне зависимости от возраста, а так же это состояние не имеет прямой связи с атеросклерозом, и обсуловлены врожденной патологией (в стенке сосуда волокна эластического типа преобладают над коллагеновыми, тем самым приводя к деформации сосуда). Существует два типа патологической извитости:
— кинкинг (изгиб артерии под острым углом и сужение ее просвета в месте перегиба)
— койлинг (образование петли)
Соответственно, при данной патологии возникает препятствие току крови извне, однако, не изнутри, как это происходит при стенозирующем атеросклерозе брахиоцефальных артерий), а снаружи, обусловленное самой извитостью. Наиболее часто встречается патологическая извитость внутренней сонной артерии (ВСА) – примерно в 80%, а ведь именно она несет основной ток крови к головному мозгу. При нарушении поступления крови в мозг может наблюдаться ряд симптомов: упорные головные боли различной локализации, шум или звон в ушах, тяжесть в голове, мелькание «мушек» перед глазами, периодические нарушения координации, нарушения речи, обмороки.
Методы диагностики
Методы лечения
В случаях, когда выявляется извитость сонных артерий со значительным нарушением гемодинамики – принимается решение об операции. Суть операции заключается в расправлении сосуда, в этом случае его участок, подвергшийся стенозу укорачивается, чем восстанавливается проходимость артерии. Во время операции используется увеличительная оптика и микрохирургические инструменты, обязательным является проведение мониторинга за мозговым кровообращением (проведение транскраниальной доплерографии), артериальным давлением и ЭКГ. Профилактика тромбоэмболических осложнений осуществляется приемом антиагрегантов в до – и послеоперационном периоде.
Деформация сонных артерий
ДЕФОРМАЦИЯ СОННЫХ АРТЕРИЙ
Наиболее часто встречающаяся аномалия артерий головы и шеи. Эта аномалия уступает только атеросклеротическому поражению по своей распространенности. У детей с патологической извитостью ВСА выявляются фенотипические маркеры соединительнотканной дисплазии.
Термин «патологическая извитость» ВСА в нашей стране распространен для обозначения клинически значимых деформаций. В мире наибольшее распространение получила — ангиографическая классификация деформаций ВСА:
Tortuosity — извитость S-, С- или волнообразной формы, без острых углов и видимых нарушений кровотока. Это гемодинамически малозначимые, чаще врожденные аномалии.
Kinking — углообразование, перегиб, гемодинамически значимые извитости.
Сoiling — петлеобразование, гемодинамически значимые и малозначимые извитости. Как петли змеи.
УЗИ сосудов шеи может выявить следующие характеристики деформаций ВСА: форму деформаций, её локализацию (проксимальная, средняя, дистальная треть ВСА), величину угла деформации-острый, тупой, прямой; а также, что наиболее важно, гемодинамическую значимость извитости.
Принято считать, что гемодинамические нарушения в зоне патологической извитости ВСА обусловлены наличием септального стеноза. Важнейшим проявлением деформации является увеличение пиковой скорости кровотока, как и при стенозе, вызванном атеросклеротическим поражением. В качестве критерия гемодинамической значимости деформации ВСА используем ускорение пиковой скорости более 150 см/сек в месте деформации. Имеются несколько объективных сложностей при попытке определить пиковую скорость.
Исходя из всего этого, корректная регистрация скорости кровотока в зоне извитости ВСА невозможна из-за вышеперечисленных проблем. Гидродинамическая сущность деформации заключается в дезорганизации кровотока. Эту дезорганизацию кровотока в месте деформации ВСА независимо от угла сканирования адекватно отражает допплерография.
Изменения гемодинамики в зоне патологической извитости- увеличение скорости кровотока на 30% и более в извитой артерии, дезорганизация потока в зоне ангуляции в виде увеличения спектрального разрешения.
Локальные нарушения гемодинамики в зоне извитости — причина нарушения кровотока в интракраниальных артериях в виде снижения скорости кровотока в средней мозговой артерии на пораженной стороне.
Важное значение при патологической извитости ВСА может иметь эмболическое поражение ветвей мозговых артерий. Тромбообразованию и церебральной эмболии способствуют турбуленция кровотока в зоне деформации ВСА, дегенеративные изменения стенки ВСА с повреждением эндотелия, дисплазия соединительной ткани с нарушением тромбоцитарного гемостаза.
Дуплексное сканирование для выявления и оценки деформаций ВСА имеет очень важное значение. Поэтому разработана классификация этой патологии. Важнейшими признаками извитости являются гемодинамическая значимость — нарушение локальной и региональной гемодинамики.
УЗ-классификация деформаций ВСА:
1. Гемодинамически значимые деформации:
2. Гемодинамически незначимые деформации:
Критерии локальной гемодинамической значимости деформации ВСА:
Дезорганизация кровотока в зоне деформации — объективный показатель гемодинамической значимости патологической извитости ВСА. Важный показатель патологической извитости — острый угол деформации, при котором почти всегда регистрируется нарушение локальной гемодинамики.
Критерии региональной гемодинамической значимости деформации ВСА:
Редкие аномалии сонных артерий — аплазия, гипоплазия, низкая или высокая бифуркация, артериовенозные мальформации, аневризмы.
ДЕФОРМАЦИИ ПОЗВОНОЧНЫХ АРТЕРИЙ
Локализуются на экстракраниальном уровне, могут приводить к нарушению кровообращения в вертебробазилярном бассейне. Также как и при деформации ВСА, задачей УЗИ является оценка локализации, формы, гемодинамической значимости. По форме деформаций ПА различают С-образные и S-образные извитости. Локальную гемодинамическую значимость оценивают, как и в ВСА. По снижению и асимметрии кровотока в V 4-сегменте ПА оценивают региональную значимость.
ЭКСТРАВАЗАЛЬНОЕ ВОЗДЕЙСТВИЕ НА ПА
Возникает при патологии шейного отдела позвоночника. Это краниовертебральные аномалии, дисфиксационные нарушения, посттравматические деформации позвоночника, остеохондроз шейного отдела позвоночника. Эти процессы вызывают непосредственное сдавление ПА.
УЗИ-признаки экстравазального воздействия на ПА: локальное ускорение кровотока в месте компрессии, неравномерное положение поперечных отростков шейного отдела позвоночника. Доказательством экстравазального воздействия на ПА является положительная поворотная проба, при которой в сегменте V4 при интракраниальном исследовании происходит снижение скорости кровотока более 30%.
При гипоплазии ПА регистрируется высокорезистентный низкоскоростной спектр кровотока. А при спазме ПА, обусловленным экстравазальным воздействием на неё, нормальный спектр кровотока.
Аплазия ПА встречается крайне редко. Намного чаще выявляется гипоплазия.
© ООО «Клиника в Северном», 2021
имеются противопоказания, необходима консультация специалиста
Цветовое дуплексное сканирование в диагностике патологической извитости внутренних сонных артерий
УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Развитие ультразвуковой диагностики сосудистых заболеваний головного мозга изменило представление о распространенности и значимости патологической извитости (ПИ) сонных артерий в качестве причины нарушений мозгового кровообращения. Как причина нарушения мозгового кровообращения у взрослых патологическая извитость внутренних сонных артерий (ВСА) по распространенности уступает только атеросклеротическому их поражению.
Особенностью диагностики патологической извитости ВСА является возможность выявления при ультразвуковом стандартном обследовании.
В настоящее время не существует общепринятой терминологии для обозначения нарушения прямолинейности хода ВСА. В отечественной литературе наибольшее распространение получил термин «патологическая извитость сонных артерий», предложенный Е.В. Шмидтом в 1975 г. [1]. Такое обозначение нарушений прямолинейности хода ВСА имеет глубокую клиническую и патофизиологическую основу, поскольку характеризует различные варианты деформации ВСА с позиции их клинической значимости. Использование этого термина предусматривает не только обозначение нарушенной геометрии ВСА, но и значения неправильного хода ВСА в формировании расстройств мозговой гемодинамики с определенной клинической картиной.
Общепринятой классификации патологической извитости ВСА не существует. Наибольшее распространение получила классификация патологических форм ВСА, предложенная J. Weibel и W. Fields [2]. Авторы выделяют три типа деформации ВСА, обозначая их как извитость («tortuosity»), петлеобразование («coiling») и перегиб артерии («kinking»). Под извитостью («tortuosity») понимается S- или C-образная деформация ВСА (рис. 1, 2) без острых углов и видимых нарушений кровотока. Авторы считают этот тип деформации ВСА врожденным и гемодинамически незначимым.
Рис. 1. С-образная извитость внутренней сонной артерии (ВСА) в режиме цветного дуплексного сканирования (ЦДС).

Рис. 2. С-образная извитость ВСА в В-режиме (а) и ЦДС (б).
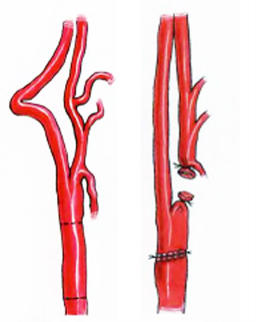
Петлеобразование («coiling») характеризуется врожденной круговой деформацией с образованием петли (рис. 3), которая может приводить к нарушению мозгового кровообращения.

Рис. 3. Петлеобразная извитость левой (а) и правой (б) ВСА в режиме ЦДС.
Под перегибом («kinking») понимается приобретенное, гемодинамически значимое углообразование ВСА со стенозированием ее просвета (рис. 4).

Рис. 4. Петлеобразная извитость ВСА с кинкингом в режиме ЦДС (а) и схематично (б).
Цветовое дуплексное сканирование (ЦДС) позволяет не только оценить форму извитой сонной артерии, но и детально охарактеризовать состояние гемодинамики. В соответствии с этим все виды нарушения прямолинейности хода ВСА могут быть подразделены на «гемодинамически значимые» и «гемодинамически незначимые».
Внедрение в клиническую практику современных ультразвуковых методов диагностики свидетельствует о высокой распространенности патологической извитости ВСА. По данным F. Koskas и соавт. [3], извитой ход сонных артерий встречается в 10-43% наблюдений у пациентов с нарушениями мозгового кровообращения. Важным представляется тот факт, что частота выявления патологической извитости ВСА у взрослых занимала второе место после атеросклероза сонных артерий. Исследование, проведенное В.П. Куликовым и соавт. [4] показало, что среди пациентов, у которых по результатам ЦДС была выявлена патологическая извитость сонных артерий, женщин было несколько больше (56,1%), чем мужчин (43,9%), чаще диагностировали патологическую извитость правой ВСА (42,3%) по сравнению с левой (25,1%), в 32,6% была выявлена двусторонняя извитость. Таким образом, было показано, что патологическая извитость ВСА является распространенной патологией не только у больных, но и в популяции.
В пользу врожденного генеза свидетельствуют обнаружение деформированных сонных артерий у пациентов молодого возраста при отсутствии атеросклеротического процесса в сосудах, частое двустороннее поражение сонных артерий.
В пользу приобретенного характера патологической деформации ВСА могут свидетельствовать большая частота выявления этой патологии с возрастом и зависимость выраженности изгиба сонной артерии от возраста и уровня артериального давления.
Патологическая извитость ВСА по клиническим проявлениям напоминает симптомы атеросклеротического стеноза ВСА и проявляется признаками нарушения мозгового кровообращения. Наиболее часто деформация сонных артерий сочетается с артериальной гипертонией и атеросклерозом. В целом клинические проявления патологической извитости ВСА малоспецифичны. Некоторую специфичность имеют локальные признаки патологической извитости, среди которых отмечают патологическую пульсацию на шее, признаки сдавления подъязычного, добавочного и блуждающего нервов.
Однако большинство симптомов и синдромов носят неспецифический характер. Наиболее часто при патологической извитости ВСА встречаются моторные нарушения, ухудшение зрения, головные боли, нарушение речи, головокружение, потеря сознания, шум и звон в ушах, боли в области шеи, эпилептиформные припадки.
Отсутствие специфических клинических признаков патологической извитости ВСА существенно затрудняет выявление этой патологии по результатам клинического обследования.
Выявление патологической извитости ВСА в связи с малоспецифичными клиническими ее проявлениями возможно только при помощи специализированных инструментальных методов диагностики. Учитывая ограничения для проведения рентгеноконтрастной ангиографии и магнитно-резонансной ангиографии, основным методом обнаружения деформации ВСА является ЦДС. Этот метод сочетает возможность визуализации сосудов и кровотока в них с исследованием характера и количественных параметров потока крови.
Типичная картина патологической извитости ВСА различной формы в режиме ЦДС показана на рис. 3-6. Метод ЦДС позволяет детально охарактеризовать форму извитости, ее локализацию и выявить дезорганизацию потока крови. Критериями локальной гемодинамической значимости патологической извитости ВСА являются: градиент пиковой систолической скорости кровотока между проксимальным и дистальным участками сосуда по отношению к месту извитости со снижением скорости в дистальном направлении на 20% и более; прирост пиковой скорости в месте ангуляции по сравнению с проксимальным участком ВСА на 30% и более; дезорганизация кровотока в зоне извитости, проявляющаяся увеличением спектрального расширения и нарушением паттерна кровотока в режиме цветового картирования; наличие асимметрии пиковой скорости кровотока в дистальном участке извитой артерии по сравнению с аналогичным участком неизмененной контралатеральной ВСА. Таким образом, из представленных выше данных следует, что одним из звеньев патогенеза нарушений мозгового кровообращения при патологической извитости ВСА является локальное нарушение гемодинамики в зоне извитости со снижением кровотока в дистальном направлении.
Рис. 5. Петлеобразная с кинкингом извитость от устья и высокорасположенная S-образная извитость ВСА в режиме ЦДС.
Кинкинг сосудов
Кинкинг сосудов – врождённый порок, характеризующийся удлинением, извитостью и перегибами дуги аорты и ее ветвей при патологическом строении стенки. Редкая аномалия сосудистой системы.
ВАЖНО: кинкинг сосудов в сочетании с аневризматически расширенной аортой вызывает нарушение кровотока в этих сосудах и кровоснабжения органов. Данная патология является показанием к хирургическому лечению.
20 февраля 2019 года в отделении реконструктивной хирургии и корня аорты (заведующий отделением – д.м.н. Мироненко В.А.) пациентке Д., 8 мес., с диагнозом:
Выраженное аневризматическое расширение восходящей аорты, дуги аорты. Недостаточность аортального клапана 2 степени. Кинкинг нисходящей грудной аорты. Кинкинг дуги аорты. Кинкинг брахиоцефальных артерий. Кроссинг ветвей легочной артерии. Состояние после операции резекции атипичной коарктации, кинкинга нисходящей грудной аорты с пластикой косым анастамозом конец в конец от 11.09.2018. Легочная гипертензия. Компрессия трахеи аневризматически расширенной аортой. Дыхательная недостаточность.
Ребёнок в удовлетворительном состоянии выписана под наблюдение детского кардиолога по месту жительства.
Хирург – Мироненко В.А.
 |
| Данные КТ с трёхмерной реконструкцией |
 |
 |
| Интраоперационные фото |
Пресс-служба ФГБУ «НМИЦ ССХ им. А. Н. Бакулева»
Минздрава России
Койлинг левой вса что это
ФГБНУ «РНЦХ им. акад. Б.В. Петровского», отделение хирургии сосудов, Москва, Россия; кафедра госпитальной хирургии Первого МГМУ им. И.М. Сеченова Минздрава России, Москва, Россия
ФГБНУ «РНЦХ им. акад. Б.В. Петровского», Москва, Россия
ФГБНУ «РНЦХ им. акад. Б.В. Петровского» Москва, Россия
ФГБНУ «РНЦХ им. акад. Б.В. Петровского», Москва, Россия
Патологическая извитость внутренней сонной артерии: клиника, диагностика и хирургическое лечение
Журнал: Кардиология и сердечно-сосудистая хирургия. 2016;9(1): 29-33
Гавриленко А. В., Абрамян А. В., Куклин А. В., Офосу Д. Патологическая извитость внутренней сонной артерии: клиника, диагностика и хирургическое лечение. Кардиология и сердечно-сосудистая хирургия. 2016;9(1):29-33.
Gavrilenko A V, Abramyan A V, Kuklin A V, Ofosu D. Internal carotid artery kinking. The clinic, diagnosis and surgical treatment. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2016;9(1):29-33.
https://doi.org/10.17116/kardio20169129-33
ФГБНУ «РНЦХ им. акад. Б.В. Петровского», отделение хирургии сосудов, Москва, Россия; кафедра госпитальной хирургии Первого МГМУ им. И.М. Сеченова Минздрава России, Москва, Россия
По эпидемиологическим данным, частота инсультов в различных регионах мира колеблется от 1 до 4 случаев на 1000 населения в год. В России этот показатель составляет до 3 случаев на 1000 населения в год, являясь одним из самых высоких в мире. Хорошо известно также, что инсульт занимает 3-е место после инфаркта миокарда (ИМ) и онкологических заболеваний среди причин смерти [5]. Среди всех видов инсультов преобладают ишемические поражения мозга. По данным международных мультицентровых исследований [9], соотношение ишемического и геморрагического инсультов составляет 5:1. В большинстве случаев (60-65%) в основе ишемического инсульта (ИИ) лежит экстракраниальная каротидная патология (ЭККП). Атеросклероз артерий каротидной системы является причиной ИИ у 80 этих больных [6, 14].
Патологическая извитость внутренней сонной артерии (ПИ ВСА) является второй по частоте причиной развития симптомов сосудисто-мозговой недостаточности (СМН), уступая лишь атеросклеротическому поражению брахицефальных артерий (БЦА) [12].
ВСА, как правило, имеют прямолинейный ход и эффективно осуществляют транспорт крови в дистальные отделы сосудистого русла. Тем не менее ВСА могут принимать изогнутую форму по причине неправильного эмбрионального развития или приобретенной патологии [22, 27].
Врожденные деформации сонных артерий (СА) чаще являются следствием дизэмбриогенеза. Нарушения формирования сосудистой стенки, возможно, генетически детерминированные, нередко сочетаются с извитостями позвоночных артерий, клапанными пороками (КП), врожденными аневризмами церебральных сосудов (АЦС) [10]. Такие изменения в участке ПИ являются ответной реакцией на механическую травматизацию, созданную аномальным кровотоком. В интиме отмечается неравномерное гиперплазирование и фиброзирование, пропитывание липидами с развитием атеросклеротического процесса на фоне нестабильности и конфигурационной аномалии кровотока [15].
По данным разных авторов [1, 2, 8, 13, 19, 29], в 15-40% случаев атеросклеротическое поражение ВСА сочетается с ее ПИ, что значительно повышает риск развития острых нарушений мозгового кровообращения (ОНМК).
Накоплен немалый опыт, но все еще существуют разногласия в определении оптимального алгоритма обследования и показаний к операции при ПИ ВСА [11].
Несмотря на очевидные успехи, достигнутые в реконструктивной хирургии экстракраниальных артерий (ЭКА), остается достаточно много нерешенных вопросов.
На сегодняшний день в мире не проведено ни одного многоцентрового рандомизированного исследования, которое бы позволило сформулировать единый стандарт обследования и лечения пациентов с ПИ ВСА. Поэтому вопрос о показаниях и выборе метода хирургического лечения до сих пор остается спорным и решается индивидуально каждым хирургом на основании накопленного опыта.
Материал и методы
Всем пациентам выполняли УЗ-сканирование брахицефальных ветвей (БЦВ) дуги аорты (ДА) с оценкой формы извитости и гемодинамическими показателями в зоне деформации артерии. При помощи цветового дуплексного сканирования (ЦДС) определяли форму извитости, расстояние от устья ВСА до начала изгиба, тип кровотока и его скоростные характеристики на всем протяжении С.А. Измерение показателя линейной скорости кровотока (ЛСК) проводили в 3 точках: в проксимальном сегменте по отношению к извитому участку артерии, в месте наиболее выраженной ангуляции и в дистальном сегменте по отношению к деформированному участку ВСА. Также определяли градиент скорости кровотока (отношение максимальной ЛСК на высоте изгиба к ЛСК до уровня деформации артерии).
Также выполняли транскраниальное допплерографическое (ТКДГ) мониторирование кровотока по средней мозговой артерии (СМА) в покое до оперативного вмешательства. Проводился интраоперационный мониторинг кровотока по СМА в течение всей операции для определения целесообразности использования временного внутрипросветного шунта (ВВШ). Показанием для его использования было снижение ЛСК по СМА менее 0,4 м/с или менее 50% от исходного показателя при проведении пробы на толерантность больного к пережатию ВСА во время операции [17].
При закрытых темпоральных акустических окнах приходилось прибегать к инвазивной процедуре определения ретроградного давления в ВСА (показанием для использования ВВШ было снижение ретроградного давления ниже 40 мм рт.ст.).
Для уточнения взаиморасположения СА, получения визуальных данных о пространственном расположении ПИ ВСА (по отношению к щитовидному хрящу, подъязычной кости, углу нижней челюсти), для определения степени и характера атеросклеротического поражения применяли диагностический метод мультиспиральной компьютерной томографии (МСКТ). Также проводили магнитно-резонансную томографию (МРТ) головного мозга (ГМ) с контрастированием интракраниальных артерий, позволявшую также адекватно оценить наличие ишемических очагов в ГМ и состояние виллизиева круга.
Любая конфигурационная аномалия сосуда (в данном случае ПИ ВСА) начинается с дегенеративных изменений в стенке сосуда. В связи с этим всем пациентам проводили послеоперационное патогистологическое исследование резецированных деформированных участков ВСА. Использовали методы окраски по Ван-Гизону, окраска резорцин-фуксином, окраска гематоксилином и эозином.
Все пациенты осмотрены кардиологом, неврологом с оценкой исходного неврологического статуса, а также по результатам проведенного ЦДС сосудов глаза консультированы офтальмологом.
Показаниями к хирургической коррекции деформации ВСА помимо наличия клиники СМН служила инструментально подтвержденная гемодинамически значимая ПИ ВСА. С целью определения компенсаторных возможностей ГМ методом ТКДГ определяли церебральный перфузионный резерв (ЦПР) ГМ. В 86% случаев коэффициент реактивности (КР) был менее 1. Критерием отбора пациентов с ПИ ВСА для хирургического лечения служил градиент скорости ЛСК более 2 и наличие турбулентного кровотока в участке извитости артерии, выявленные методом УЗДС. Асимптомные больные с доказанной гемодинамически значимой ПИ ВСА оперированы в качестве первого этапа перед реваскуляризацией артерий нижних конечностей (НК) по поводу хронической ишемии, и/или наличие эмбологенно опасной (изъязвленной) атеросклеротической бляшки (АСБ) служило показанием к операции. При выявлении стенотического поражения каротидной бифуркации оценивался характер бляшки, ее эмбологенность. Из 20 пациентов со стенозом и извитостью гетерогенная гипоэхогенная АСБ была выявлена у 2 (14%) больных, у 12 (86%) диагностирована гетерогенная гиперэхогенная АСБ, причем у 8 (67%) из них АСБ была неровная и изъязвленная.
В зависимости от метода выбора хирургической техники больные были разделены на 2 группы: 1-ю составили 36 (60%) пациентов, которым выполняли резекцию ВСА с низведением устья, во 2-й группе выполняли протезирование ВСА у 8 (13%) пациентов и ЭЭ с резекцией ПИ ВСА и низведением устья у 16 (27%) (табл. 1).



В результате хирургического лечения у 11 (100%) больных с глазным ишемическим синдромом (ГИС) 1-й группы отмечали купирование офтальмологической симптоматики, во 2-й группе регресса удалось добиться лишь у 4 (66%) пациентов (p 
При анализе непосредственных результатов проведенных операций достоверных отличий по динамике СМН и скоростных характеристик в реконструированной ВСА выявлено не было (p>0,05). Во 2-й группе показатель «инсульт+летальность от инсульта» был выше (р