койлоцитарная атипия клеток шейки матки что это
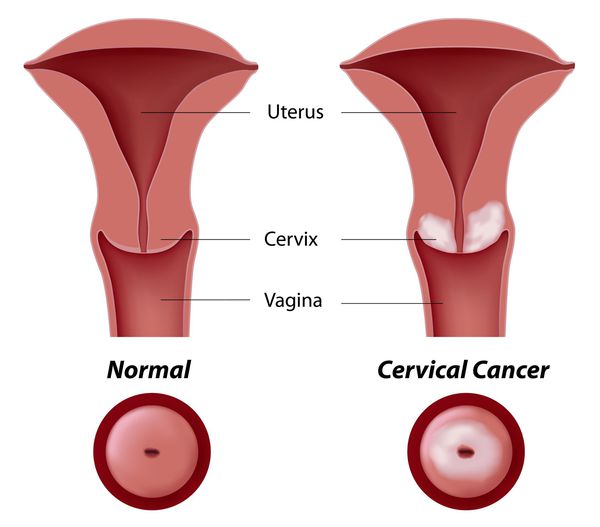
Рак и предрак шейки матки.
материал подготовлен врачом гинекологом-онкологом, к.м.н. Паяниди Ю.Г.
Вы можете сдать со скидкой в интернет-магазине
Следует отметить, что до настоящего времени продолжаются дискуссии относительно классификации дисплазии и преинвазивного рака шейки матки. Европейская Экспертная Группа, разрабатывающая Европейскую обобщенную обучающую программу, предложила следующую классификацию изменений эпителия шейки матки:
Параллельно Национальный Институт Рака в США разработал и предложил для практического применения классификацию, которая получила название «система Bethesda» (1989, 1991 гг.). Согласно этой классификации, выделяют следующие изменения эпителия шейки матки:
В нашей стране широкое распространение, как наиболее приемлемой для практического использования, получила Классификация патологических процессов шейки матки, предложенная И.А.Яковлевой и Б.Г.Кукутэ в 1977 г.
I. ФОНОВЫЕ ПРОЦЕССЫ
II. ПРЕДРАКОВЫЕ СОСТОЯНИЯ
III. РАК
ФОНОВЫЕ ЗАБОЛЕВАНИЯ
Наиболее частой патологией в группе дисгормональных процессов являются эндоцервикозы. По данным И.А.Яковлевой, с морфологической точки зрения они неоднотипны. Простая форма эндоцервикоза характеризуется наличием железистых структур без признаков их повышенного образования. Для пролиферирующих форм типично новообразование железистых структур, что свидетельствует о прогрессировании процесса. Для железистой псевдоэрозии характерно наличие в подлежащей строме железистых образований, вокруг которых нередко отмечается воспалительная инфильтрация. При папиллярной псевдоэрозии происходит разрастание стромы эпителия в виде сосочков, покрытых многорядным цилиндрическим эпителием. При эпидермизирующейся псевдоэрозии на фоне железистого эпителия участками встречается метапластический и многослойный плоский эпителий.
Наличие цилиндрического эпителия за границей наружного зева на влагалищной порции шейки матки еще Н.Hinselmann предложил назвать эктопией. Частота встречаемости последней составляет 10-15% от всех заболеваний эктоцервикса у женщин в возрасте моложе 30 лет. Различают посттравматическую, врожденную и дисгормональную эктопию. Посттравматическая эктопия возникает после травмы в родах или во время аборта. При врожденной или «физиологической» эктопии у девочек, девушек и молодых женщин стык цилиндрического и многослойного плоского эпителия может располагаться снаружи от наружного зева в 6-8% случаев (В.П.Козаченко). Некоторые авторы считают подобные изменения шейки матки вариантом нормы, не требующим какого-либо специального лечения. У женщин более старшего возраста такое расположение цилиндрического эпителия является следствием гормональных расстройств. Область замещения одного эпителия другим получила название «зоны трансформации» или «зоны превращения». Чаще всего эта зона наблюдается в возрасте 28-40 лет и требует пристального внимания врача, так как именно в ней, как правило, происходит формирование будущего атипического процесса. Эпидермизация данной зоны протекает длительно и под влиянием неблагоприятных факторов может нарушаться. Цилиндрический эпителий, обладая высокой регенеративной способностью, проникает вглубь ткани шейки матки и образует ветвящиеся ходы, которые в процессе эпидермизации могут перекрываться многослойным плоским эпителием, в результате чего образуются ретенционные кисты.
Папиллома представляет собой бородавчатое разрастание многослойного плоского эпителия с явлениями ороговения. Поверхность розовая или белесоватая, четко граничит с окружающими тканями. Кольпоскопическое исследование позволяет установить сосочковую структуру папилломы. В каждом сосочке определяется сосудистая петля красного цвета, причем при разрастании папилломы характер сосудистой сети не изменяется. Закономерное повторение сосудистого рисунка папилломы есть проявление адаптивной сосудистой гипертрофии. Нередко из-за частичного или полного ороговения поверхность становится белесоватой и сосудистый рисунок виден не так четко.
Среди воспалительных заболеваний шейки матки цервициты неспецифической этиологии наиболее распространены и составляют до 70% всех воспалительных процессов цервикального канала. Нередко они предшествуют или сопутствуют другим фоновым заболеваниям. Различают очаговый и диффузный неспецифический цервициты. Последний встречается наиболее часто. Поражая в основном женщин репродуктивного возраста, цервицит поддерживает фоновый или предраковый процесс, является относительным противопоказанием для проведения биопсий, фракционных диагностических выскабливанй, диатермокоагуляций и диатермоконизаций шейки матки, симулирует картины клеточной атипии при онкологических исследованиях. Заболевание характеризуется длительным и затяжным течением с частыми периодами обострений, трудно поддается медикаментозному лечению. Последнее связано с тем, что в хронической стадии воспаления микробный фактор утрачивает свою ведущую роль и поражение приобретает полисистемный характер. Это проявляется в виде сложной сосудисто-мезенхимальной реакции пораженной ткани.
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Т. А., гинеколога со стажем в 13 лет.
Определение болезни. Причины заболевания
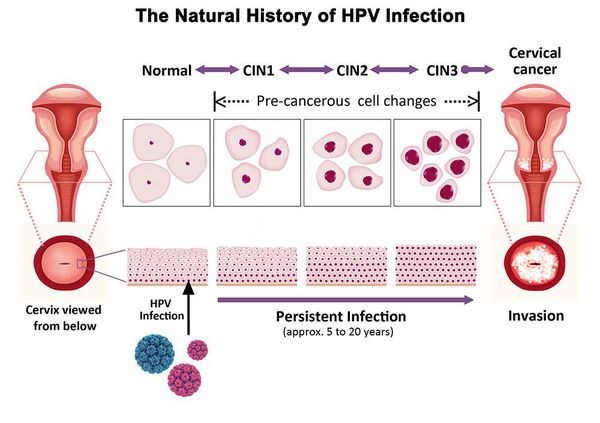
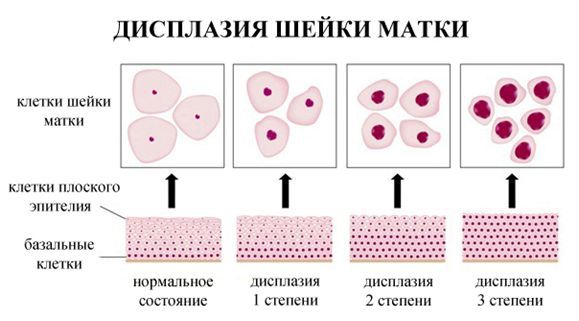
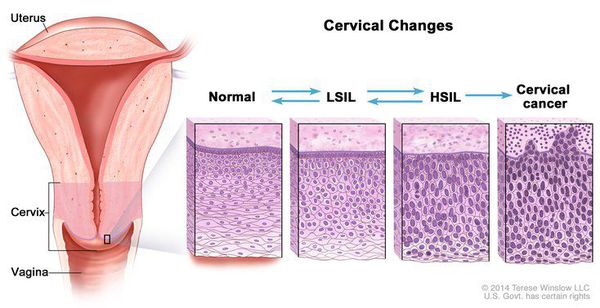
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Основной фактор развития дисплазии и рака шейки матки — папилломавирусная инфекция (ПВИ), причем длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
Кроме того, была выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
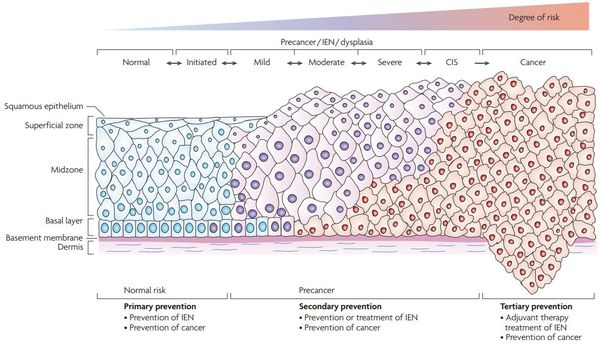
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
Классификация Папаниколау
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя шейки матки выделяют:
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
Осложнения дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
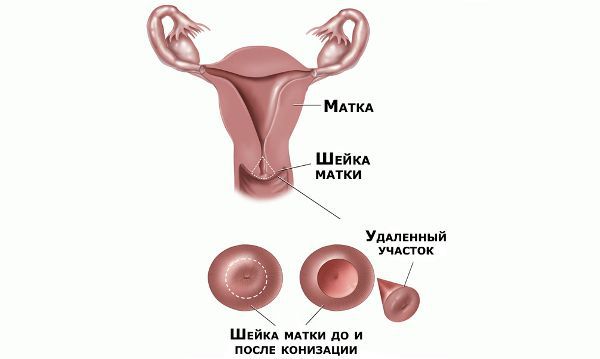
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
В России данная система включает последовательность действий:
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
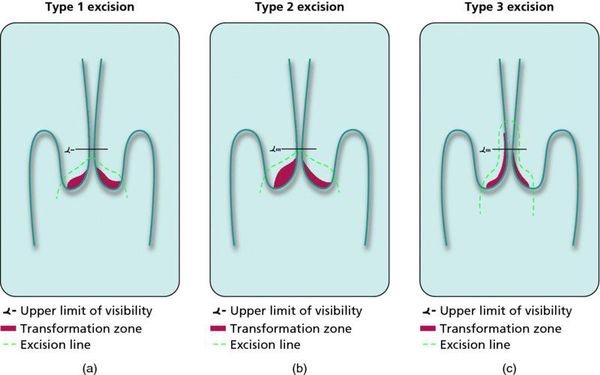
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии. При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
Прогноз. Профилактика
При своевременном выявлении и лечении дисплазии шейки матки прогноз благоприятный. Основным фактором развития и прогрессирования дисплазии шейки матки является длительное инфицирование канцерогенными типами ВПЧ. Для предупреждения заражения ВПЧ существуют профилактические вакцины «Церварикс» (защита от 16, 18 типов ВПЧ), «Гардасил» (профилактика инфицирования 6, 11, 16, 18 типами вируса), в декабре 2014 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило использование вакцины «Гардасил9», защищающей от инфицирования 9 типами ВПЧ (6, 11, 16, 18, 31, 33, 45, 52, 58). Однако на российском рынке данный продукт ещё не доступен. «Церварикс» зарегистрирована для вакцинации женщин от 10 до 25 лет; «Гардасил» показана к применению детям и подросткам в возрасте от 9 до 15 лет и женщинам от 16 до 45 лет.
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения», осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Комбинированная терапия заболеваний шейки матки, ассоциированных с вирусом папилломы человека
Папилломавирусная инфекция привлекла особое внимание в последнее время в связи с ролью этой группы вирусов в развитии рака. Доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки, было отмечено Нобелевско
Папилломавирусная инфекция привлекла особое внимание в последнее время в связи с ролью этой группы вирусов в развитии рака. Доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки, было отмечено Нобелевской премией по медицине 2008 года.
На сегодня известно более 200 типов ВПЧ. Вирусы, поражающие аногенитальную область, условно разделяют на две группы: высокого и низкого онкогенного риска. Клиническую значимость такого деления типов ВПЧ иллюстрирует табл. 1. Из нее видно, что злокачественные новообразования гениталий, а также дисплазии средней и тяжелой степени ассоциированы именно с ВПЧ высокого онкогенного риска (например, 16-й и 18-й типы). По данным Прилепской В. Н. и соавт. [1], в 58% случаев обнаружения ВПЧ у женщин с различной генитальной патологией присутствуют типы высокого онкогенного риска — 16 и 18.
Классификация
К ВПЧ-поражениям относят аногенитальные бородавки — остроконечные кондиломы, вульгарные бородавки, плоские кондиломы. Необходимо помнить, что различные виды бородавок (кондилом) — это лишь часть спектра поражений, вызванных ВПЧ. Существуют еще субклиническая и латентная формы инфекции, а также ВПЧ-ассоциированные заболевания — интраэпителиальные неоплазии (ИН) различных степеней. В частности, известно, что более чем у 60% женщин с аногенитальными бородавками имеется сопутствующая цервикальная ИН (CIN) в субклинической форме [2]. Помимо CIN с ВПЧ могут быть ассоциированы ИН вульвы (VIN), полового члена (PIN) и анальной области (AIN) [3].
В мировой практике используются различные классификации папилломавирусной инфекции и ассоциированных с ней заболеваний. Ориентировочная классификация представлена Handley J. et al. [4]:
ВПЧ-инфекция
1. Клинические формы (видимые невооруженным глазом или невидимые, но при наличии соответствующей симптоматики):
2. Субклинические формы (невидимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/или цитологическом или гистологическом исследовании):
3. Латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ).
Заболевания, ассоциированные с ВПЧ
Клинические и субклинические формы:
Кроме этого, в литературе при описании поражений шейки матки, ассоциированных с ВПЧ, применяют классификацию по Папаниколау — в зависимости от степени изменений в мазках выделяют 5 классов. ВОЗ рекомендует использовать Терминологическую систему Бетесда (TBS) — норма, ASC-US, LSIL, HSIL, карцинома. Однако TBS не исключает использование терминов CIN и «дисплазия». Для удобства понимания терминологии врачами и единообразия в определении подходов к диагностике и лечению патологии шейки матки в табл. 2 приведено соотношение терминов различных морфологических классификаций.
Эпидемиология
По оценкам Центра по контролю заболеваемости (CDC) в США ВПЧ инфицируются до 5,5 млн человек в год [5]. В Европе в год регистрируется 554 000 случаев, вызванных этими вирусами: в том числе цервикальных неоплазий легкой степени (CIN I), генитальных бородавок, цервикальных неоплазий средней и тяжелой степени (CIN II и III), рака шейки матки. Таким образом, в сутки по этой причине умирает до 40 человек [Gross et al., 2008]. По данным российских ученых папилломавирусная инфекция гениталий встречается у 44,3% женщин, обращающихся в гинекологические клиники [6].
Диагностика
Комплексная диагностика заболеваний, ассоциированных с ВПЧ, предполагает клинико-визуальный осмотр, кольпоскопическое исследование, тестирование на ВПЧ, использование цитологических и/или гистологических методов.
Лечение
Согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, лечение аногенитальных ВПЧ-поражений направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Именно такой подход приведен во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией (CDC, Европейских рекомендациях, рекомендациях ВОЗ). Такой подход представлен и в рекомендациях Российского общества дерматовенерологов и косметологов.
Как для лечения клинических проявлений ВПЧ-инфекции, так и ассоциированных с ней заболеваний (в первую очередь это касается CIN II и CIN III) применяют деструктивные методы — хирургические, физические (крио-, электро- или лазеротерапия, радиоволновая хирургия) и химические. При CIN I тактика может различаться в зависимости от величины поражения шейки матки, наличия другой патологии и возможностей самой пациентки [7]. При небольшом поражении чаще рекомендуют оставить женщину под наблюдением и периодически выполнять обследования — тесты на ВПЧ, кольпоскопию, цитологию. Очень важно при этом диагностировать и лечить воспалительные, дисгормональные и другие заболевания урогенитального тракта. Большую роль в определении тактики ведения больных в этих случаях имеет желание пациентки и ее возможность регулярного посещения врача для проведения обследования.
Более эффективным методом лечения при патологии шейки матки, ассоциированной с ВПЧ, является комбинация деструкции с адъювантной противовирусной и иммуномодулирующей терапией. Применение активаторов противовирусного иммунитета позволяет повысить эффективность лечения за счет снижения частоты рецидивов, а также воздействия непосредственно на репродукцию вируса.
Одним из немногих иммунотропных препаратов, в инструкции по применению которого указана терапия заболеваний, вызванных ВПЧ, является Изопринозин. Он также входит в Европейскую классификацию методов лечения аногенитальных бородавок [8]. В настоящее время накоплен огромный опыт применения Изопринозина, так как используется он с 70-х годов XX века и зарегистрирован в большинстве стран Европы.
Изопринозин (инозин пранобекс) — иммуномодулятор, стимулирующий противовирусную защиту организма. Препарат нормализует дефицит или дисфункцию клеточного иммунитета, индуцируя созревание и дифференцировку Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Препарат повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (ИЛ-2), регулирует экспрессию рецепторов ИЛ-2, существенно увеличивает секрецию эндогенного гамма-интерферона и уменьшает продукцию интерлейкина-4 в организме, а также усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов [9–14].
Помимо иммунотропного, Изопринозин обладает прямым противовирусным действием, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной РНК.
Таким образом, Изопринозин прямо и косвенно, обладая противовирусным действием и оказывая влияние на противовирусный иммунитет, способен подавлять репликацию ВПЧ и образование вирусных белков. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя переходу вируса из транзиторной в персистирующую форму, а также влияя на клиническую манифестацию инфекции.
Одним из показаний применения препарата являются инфекции, вызванные ВПЧ: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
При инфекциях, вызванных ВПЧ, Изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству в течение 14–28 дней или 5 дней в неделю последовательно в течение 1–2 недель в месяц в течение 3 месяцев.
В работе Забелева А. В. и соавт. [15] показано исчезновение атипичного эпителия после проведения курсов Изопринозина женщинам с ВПЧ-ассоциированными плоскоклеточными ИН низкой степени. Изопринозин назначали по 1 г 3 раза в сутки в течение 5 дней, 3 курса с интервалом 1 месяц.
Аналогичные результаты — улучшение морфологической картины эпителия вульвы — показаны в исследовании Sun Kuie Tay [16]. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, а в группе, принимавшей плацебо, — у 16,7% (рис. 1).
В другом исследовании при монотерапии Изопринозином по 3 г в сутки у 44 женщин с CIN I (длительность лечения 10 дней) и CIN II (длительность лечения 21 день) установлено, что выраженный клинический эффект наблюдался у 88,6% пациенток — полностью исчезало поражение эпителия экзоцервикса, что подтверждалось кольпоскопически и гистологически [17] (рис. 1).

.gif)
.gif)
.gif)
.gif)