красный фосфор что это
Фосфор (P, Phosphorus)
История фосфора
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень. Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня). Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.
Нахождение в природе
Фосфор содержится в морской воде и земной коре в основном в виде минералов, которых около 190 (самые важные – апатит и фосфорит). Входит в состав всех частей зелёных растений, белков, ДНК.
Физические и химические свойства
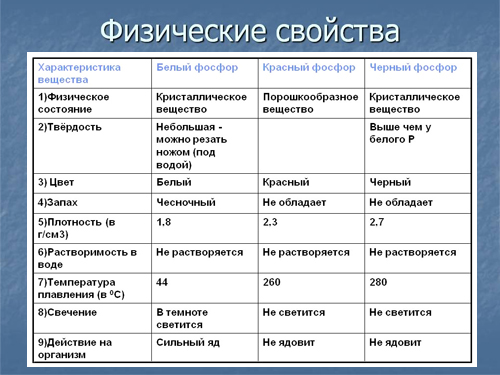
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.
Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Признаки нехватки фосфора
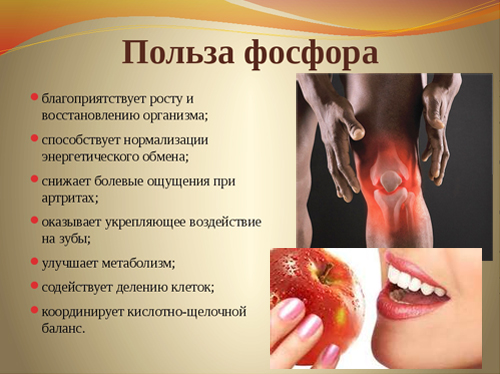
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.
Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.
Красный фосфор — стабильная и безопасная форма фосфора
Считается, что фосфор — это светящийся в темноте минерал, ядовитый и огнеопасный. Но это только часть правды об этом удивительном элементе. Фосфор бывает и иным, с прямо противоположными свойствами.
Что такое красный фосфор?
Фосфор может существовать в нескольких вариантах 
Красный фосфор представляет собой очень интересное вещество, естественный неорганический полимер с формулой (Р4)n и весьма сложной структурой из пирамидально связанных атомов.
Свойства красного фосфора в некоторой степени зависят от условий его получения. Изменяя температуру, свет и катализаторы, можно создавать виды красного фосфора с прогнозируемыми свойствами.
Первооткрывателем красного фосфора является австриец А.Шрёттер, который получил его, нагревая запаянную ампулу с белым фосфором и угарным газом при температуре +500 °С.
Свойства красного фосфора

Красный фосфор, в отличие от своего более известного «собрата», белого фосфора, является твердым веществом, не люминесцирует, практически ни в чем не растворим (ни в воде, ни в органических растворителях, ни в сероуглероде). Он не ядовит, самовоспламеняется на воздухе только при температуре +240-260 °С (на самом деле воспламеняется не сам красный фосфор, а его пары, которые после охлаждения превращаются в белый огнеопасный фосфор).
Плотность красного фосфора выше, чем у белого и равна 2,0 – 2,4 г/см3 (в зависимости от конкретной модификации).
На воздухе красный фосфор поглощает влагу, окисляется, превращаясь в оксид; продолжая впитывать влагу, переходит в густую фосфорную кислоту («отмокает»). Ввиду этого, реактив следует герметично укупоривать, лишая доступа к воздушной влаге. При нагревании красный фосфор не плавится, а возгоняется (испаряется). После конденсации пары вещества превращаются в белый фосфор.
Применение красного фосфора
Красный фосфор практически не токсичен и гораздо безопаснее 
Сам красный фосфор в основном применяется для изготовления спичек. Он входит в «тёрочную» смесь, которую наносят на коробок. Также его используют в смазочных материалах, в зажигательных составах, топливе, в производстве ламп накаливания.
Не знаете, где купить красный фосфор?
Купить красный фосфор и различные другие химреактивы можно в одном из крупнейших магазинов оборудования для лабораторий, «ПраймКемикалсГрупп». У нас доступные цены и удобная доставка по Москве и области, а квалифицированные менеджеры помогут сделать выбор.
Фосфор. Химия фосфора и его соединений
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Серная кислота также окисляет фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Или с гидроксидом кальция:
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Способы получения фосфидов
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Фосфид магния разлагается соляной кислотой:
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Еще пример : фосфористая кислота окисляется соединениями ртути (II):
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Фосфат кальция растворяется под действием серной кислоты:
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Фосфат кальция также восстанавливается алюминием при сплавлении:
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия: