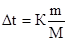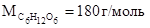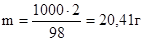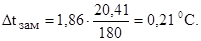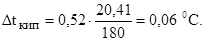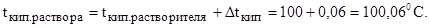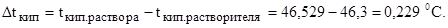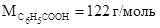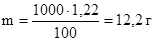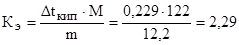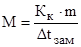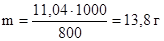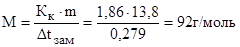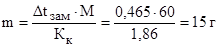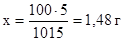криоскопическая постоянная воды составляет 1 86 что составляет
Задачи к разделу Коллигативные свойства растворов
Предлагаем ознакомиться с задачами к разделу Коллигативные свойства растворов.
Задача 1. Вычислить, сколько глицерина C3H5(OH)3 нужно растворить в 200 г воды, чтобы раствор замерзал при — 5°С. Криоскопическая постоянная воды 1,86 град.
Решение.
Молярная масса глицерина: М = (12×3)+(16×3)+(8×1) = 92 г/моль
Воспользуемся II законом Рауля:
ΔTкрист = K·m, где
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
где g – масса растворенного вещества,
G – масса растворителя.
Температура кристаллизации Ткрист чистой воды = 0 °С.
Значит понижение температуры кристаллизации
Таким образом, масса глицерина равна 49,5 г
Задача 2. Из скольких атомов состоит молекула иода в спиртовом растворе, если раствор 6,35 г йода в 100 г этанола кипит при 78,59 о С?
Решение.
где Е – эбулиоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
Найдем молярную массу растворенного вещества, используя справочные данные:
Ткип (этанола) = 78,39ºС
М = 1000·1,2·6,35/100·0,2 = 381 г/моль
Следовательно, молекула иода состоит из 3 атомов
Задача 3. Сколько граммов глюкозы С6Н12О6 было растворено в 0,5л воды, если температура кипения полученного раствора составила 102 0 С?
Решение.
где Е – эбулиоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
Найдем молярную массу растворенного вещества, используя справочные данные:
M(глюкоза) = 12·6+1·12+16·6 = 180 г/моль
G (воды) = V·ρ = 500 ·1= 500 г
g = 500·2·180/1000·0,516 = 348,8 г.
То есть масса глюкозы равна 348,8 г.
Задача 4. Чему равна температура замерзания раствора AlCl3 с молярной концентрацией эквивалента 0,3 моль/л, если его степень диссоциации равна 60%?
Из закона Рауля для сильных электролитов следует, что:
где i – изотонический коэффициент,
К – криоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
Используя справочные данные находим:
AlCl3 ↔ Al 3+ + 3Cl — n = 4 – всего 4 частицы
M(AlCl3) = 27+35,5·3 = 133,5 г/моль
G = 1000-13,35=986,65 г
Таким образом, Tкрист = 0-0,528= — 0,528 ºС
Задача 5. В каком количестве воды надо растворить 6,84 г глюкозы С6Н12О6, чтобы давление пара воды, равное при 65 о С 250 гПа, снизилось до 248 гПа?
Решение.
M(глюкоза) = 12·6+1·12+16·6 = 180 г/моль
Подставляем известные данные в уравнение:
Mр-ля = 1·2+16 = 18 г/моль
Значит, глюкозу надо растворить в 44,1 г. воды.
Задача 6. Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор кипит при 100,6 0 С.
Решение.
Из закона Рауля следует, что:
где Е – эбулиоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
В справочнике находим, что:
10%-ный раствор – это значит, что 10 г. неэлектролита растворили в 90 г. воды.
Подставляем все найденные данные в уравнение:
М = 1000·0,516·10/0,6·90 = 95,56 г/моль
Следовательно, М(неэлектролита) = 95,56 г/моль
Задача 7. Сколько воды надо прибавить к 2 л раствора сахара, чтобы понизить его осмотическое давление в 3 раза?
Решение.
Из уравнения Вант – Гоффа следует:
Поскольку R и T – величины постоянные, то осмотическое давление будет зависеть только от С.
При уменьшении π в з раза, С также уменьшится в 3 раза.
Предположим, что исходная молярная концентрация составляла:
После разбавления в 3 раза концентрация составила:
Найдем количество воды, необходимое для получения раствора с концентрацией равной 0,1667, составив уравнение:
С = n/V; 0,1667 = 1/(2+х); х = 4
Таким образом к раствору сахара необходимо прибавить 4 л воды.
Задача 8. Рассчитайте массовую долю хлорида натрия в физиологическом растворе, осмотическое давление которого при 25 о С составляет 762,7 кПа (α=1, ρ=1г/см 3 ).
Решение.
Хлорид натрия является сильным электролитом. Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
NaCl ↔ Na + + Cl — n = 2 – всего 2 частицы
M(NaCl) = 23+35,5 = 58,5 г/моль
m = 762,7· 1·58,5/2·8,31·298= 9 г.
m = V·ρ = 1000·1 = 1000 г.
Таким образом, массовая доля хлорида натрия в растворе равна 0,9 %
Криоскопическая постоянная воды составляет 1 86 что составляет
Ярослава,
Задача 80
Определить молекулярную массу полимера, если его 15%-й водный раствор имеет при температуре 20°С осмотическое давление 340 Па.
Решение:
Росм = См ∙ R ∙ T
См=1000ρω/М
Росм (кПа) = 1000ρ(г/мл)ωRТ/М
М=ρωRТ/Росм
Для расчета См нужна плотность раствора полимера. Если принять ее равной плотности воды 1 г/мл = 1000 г/л (что, конечно, далеко от действительности, но нет выбора), то получим:
М=1000 ∙ 0,15 ∙ 8,314 ∙ 293 / (340 ∙ 10⁻³) = 1,075 ∙ 10^6 г/моль
подробнее: http://www.xumuk.ru/colloidchem/154.html
Евгений,
Задача 81
При растворении 7,8 г бензола С6Н6 в 200 г циклогексана С6Н12 температура замерзания раствора понизилась на 10,10°С. Рассчитайте криоскопическую константу циклогексана.
Задача 82
При растворении 0,0048 кг глицерина в 0,025 кг воды температура замерзания раствора понизилась на 0,387°С. Определить молекулярную массу глицерина и вычислить осмотическое давление раствора при 25°С. Криоскопическая постоянная воды 1,86.
Решение:
Δtкр. = Kкр. ∙ Cm
Cm = Δtкр. / Kкр. = 0,83 / 1,86 = 0,446 моль/кг
Росм = См ∙ R ∙ T, но для перехода от моляльной к молярной концентрации нужно знать плотность раствора и молярную массу неэлектролита.
Елена,
Задача 84
Температура плавления нафталина 80,1С. Она понижается на 0,832С при растворении серы массой 3,122 г в нафталине массой 100г. Удельная теплота плавления нафталина равна 149,5 Дж/г. Найдите молекулярную формулу серы в нафталинном растворе.
Решение:
Т плавления = Т замерзания (кристаллизации), поэтому воспользуемся 2 з-ном Рауля: понижение температуры замерзания (или температуры плавления) раствора неэлектролита прямо пропорционально его моляльной концентрации:
ΔТкр = Ккр × Cm(серы)
Ккр – криоскопическая константа растворителя, которая может быть рассчитана по формуле: Ккр. = RT^2/1000Δh, где Δh – удельная теплота плавления, Дж/г.
Δh(нафталина) = 149,5 Дж/г
Ккр. = 8,31×(80,1+273,15)^2 / (1000×149,5) = 6,936 K∙кг/моль
Cm(серы) = ΔТ / Ккр. = 0,832 / 6,936 = 0,1199 моль/кг
Cm(серы) =m(серы)/ [M(серы)×m(нафталина, кг)]
M(серы) = m(серы) / [Cm(серы) × m(нафталина, кг)] = 3,122 / [0,1199 × 0,1] = 260,4 г/моль
M(серы) / А(S) = 260,4 / 32,07 = 8,11 ≈ 8 → S8
Немного высоковата молярная масса серы, если бы использовали уточненную Δh(нафталина) = 152 Дж/г, получили бы 256,1 г/моль, что ближе к истине (32,07 ∙ 8 = 256,6 г/моль)
Впрочем, и так нормально 🙂
http://www.kayelaby.npl.co.uk/chemistry/3_10/3_10_4.h..
Nadia,
Задача 85
Осмотическое давление водного раствора глицерина С3Н8О3 составляет при 0°С 567,3 кПа. Приняв плотность раствора равной единице, вычислить давление пара раствора при 0°С, если давление пара воды при той же температуре составляет 610,5 кПа
Ян,
Задача 86
При растворении 0,4 г некоторого вещества в 10 г воды температура замерзания раствора понижается на 1,24 градуса. Вычислите молекулярную массу растворенного вещества.
Решение:
Второй закон Рауля: понижение температуры замерзания (или повышение температуры кипения) раствора неэлектролита прямо пропорционально его моляльной концентрации:
Δt = Ккр ∙ Cm
Cm = Δt / Ккр
Криоскопическая константа воды Ккр = 1,86
Δt = 0,41°С
Cm = Δt / Ккр = 0,41 / 1,86 = 0,220 моль/кг воды
Cm = n(в-ва) / m(р-ля, кг) = 1000Cм / (1000ρ – Cм ∙ М)
0,220 = 1000Cм / (1200 – Cм ∙ 342)
Cм = 0,245 моль/л
Росм = См ∙ R ∙ T = 0,245 ∙ 8,314 ∙ 275 = 560,1 кПа
Аня,
Задача 88
Определите температуру кипения 3М раствора глюкозы (плотность раствора=1,08 г/мл);
k эбулиоскопическая=0,52.
Решение:
Второй закон Рауля: повышение температуры кипения (или понижение температуры замерзания) раствора неэлектролита прямо пропорционально его моляльной концентрации:
Δt = Кэб ∙ Cm
Cm = n(в-ва) / m(р-ля, кг) = 1000Cм / (1000ρ – Cм ∙ М)
Δt = Кэб ∙ Cm = Кэб ∙ 1000Cм / (1000ρ – Cм ∙ М) = 0,52 ∙ 3000 / (1080 – 3 ∙ 180) = 2,89°
t кип. = 100,00 + 2,89 = 102,89°
Маша,
Задача 89
Осмотическое давление глюкозы при 35°С составляет 795 кПа. Вычислите температуру замерзания водного раствора глюкозы. Плотнось раствора принять равной 1,1 г на мл.
Решение:
Росм = См ∙ R ∙ T
См = Росм / (R ∙ T) = 795 / (8,314 ∙ 308) = 0,310 моль/л
Второй закон Рауля: понижение температуры замерзания (или повышение температуры кипения) раствора неэлектролита прямо пропорционально его моляльной концентрации:
Δt = Ккр ∙ Cm
Криоскопическая константа воды Ккр = 1,86
Cm = n(в-ва) / m(р-ля, кг) = 1000Cм / (1000ρ – Cм ∙ М)
Δt = Ккр ∙ 1000Cм / (1000ρ – Cм ∙ М) = 1,86 ∙ 1000 ∙ 0,310/ (1100 – 0,310 ∙ 180)=0,55°
tкр. = 0 – 0,55 = –0,55°С
Дарья,
Задача 90
Вычислите молекулярную массу глюкозы, если давление водяного пара над раствором 27 г глюкозы в 108 г воды при 100°С равно 98775,3 Па.
Степан,
Задача 91
Определите моляльность раствора бинарного электролита, если его водный раствор замерзает при температуре –0,31 °С, а степень диссоциации равна 66,5 %.
Осмотическое давление раствора мочевины молярной концентрации 4 моль/л равно осмотическому давлению раствора AlCl3 концентрации
1,15 моль/л. Изотонический коэффициент для раствора AlCl3 равен:
Криоскопическая постоянная воды составляет 1 86 что составляет
При неполной диссоциации слабого электролита (укс. кислота) степень диссоциации α « 1, поэтому изотонический коэффициент i чуть выше 1, т.е. Росм укс. кислоты выше, чем сахаров, но ниже, чем NaCl.
Задача 22
В 300 мл водного раствора глюкозы содержится 10 г растворенного вещества. При какой температуре осмотическое давление этого раствора составит 500 кПа?
Решение:
Росм = См ∙ R ∙ T
Cм=n/V=m/(MV) = 10/(180∙0,3)
T=Росм / (См ∙ R) = 500 ∙ 180 ∙ 0,3 / (8,31 ∙ 10)= 324,9K=51,9 °С
Задача 23
Раствор, содержащий 8,5 г некоторого неэлектролита в 400 г воды, кипит при температуре 100,78 0С. Вычислите молярную массу растворенного вещества.
Решение:
Δt = Кэб ∙ Cm(в-ва)
Кэб воды = 0,52 (справ. табл.)
Δt = 100,78-100=0,78
отсюда моляльная конц-я в-ва:
Cm(в-ва) = Δt /Кэб = 0,78/ 0,52 = 1,5 моль/кг
Задача 24
Для повышения температуры кипения раствора на 1,040 С QUOTE необходимо, чтобы концентрация растворенного в нем неэлектролита составляла _______моль/кг.
А) 0,2 Б) 1 В) 2 Г) 0,5
Решение:
ΔТ кип. = Еэб. · Сm
Если раствор водный, тогда:
ΔТ кип. = ЕН2О · Сm; Сm = ΔТ кип. / ЕН2О = 1,040 / 0,52 = 2 моль/кг
Задача 25
При растворении 10,1 г KNO3 в 100 см3 воды температура замерзания понизилась на 3,01 °С. Определить кажущуюся степень диссоциации KNO3 в полученном растворе. Криоскопическая постоянная для воды равна 1,86.
Задача 26
Чему равно осмотическое давление раствора, содержащего 125 г сахарозы (С12Н22О11) в 2 литрах воды при температуре 15С?
Задача 27
Рассчитайте осмотическое давление 0,5М раствора глюкозы при 25 градусах С и раствора NaCl такой же концентрации.
Решение:
Для р-ра неэлектролита (глюкозы): Росм = См ∙ R ∙ T
Для р-ра электролита (NaCl): Росм = i ∙ См ∙ R ∙ T
т.е. вся разница в i.
Изотонический коэф-т i для NaCl в задаче не дан. Предположим, что соль диссоциирует полностью, т.е. степень диссоциации α = 1 (100%), тогда для NaCl k=2 и i=2
R = 8,31 кПа∙л/моль∙К
T = 273 + 25= 298K
Росм (глюкозы) = 0,5 ∙ 8,31∙ 298= 1238,2 кПа
Росм (NaCl) = 2 ∙ 0,5 ∙ 8,31∙ 298= 2476,4 кПа
Осмотическое давление Росм (NaCl) = 2Росм (глюкозы), т.к. в р-ре NaCl при α = 1 в 2 раза больше растворенных частиц, чем в р-ре глюкозы.
Задача 28
Какова ω (NaCl) в физиологическом растворе, если осмотическое давление раствора при 25C=762,7 кПа
Задача 29
Рассчитайте, какую массу хлорида натрия должен содержать каждый литр водного раствора, чтобы он был изотоничен раствору, содержащему в 1 л 9 г глюкозы при той же температуре.
Задача 30
При 65 0С давление насыщенного пара воды равно 2,5⋅104 Па. Давление насыщенного пара над раствором карбамида CO(NH2)2 с массовой долей 5% при той же температуре равно_____ кПа
100 г раствора содержат 5 г карбамида (М=60 г/моль) и 95 г воды (М=18 г/моль).
Количество воды в 100 г раствора:
n1 = 95/18 = 5,278 моль
Количество карбамида в 100 г раствора:
n2 = 5/60 = 0,083 моль
Мольная доля воды:
N1 = n1/(n1 + n2) = 5,278/(5,278 + 0,083) = 0,985
P0= 2,5⋅10^4 Па = 25 кПа
Следовательно:
P1 = 0,985 ∙ 25 = 24,625 кПа
Задача 31
Вычислите температуру кипения раствора,содержащего 0,5 моль растворенного вещества в 100 г ацетона (Е ацетона=1,5).Температура кипения ацетона 56 градусов цельсия.
Решение:
По закону Рауля, повышение температуры кипения раствора неэлектролита:
Δt кип. = Е ∙ Cm = Е ∙ n (раств. в-ва) / m(р-ля) = 1,5 ∙ 0,5 / 0,1 = 7,5°
Температура кипения раствора: tкип= tо + Δt кип. = 56 + 7,5 = 63,5 °C
Задача 32
Раствор,содержащий 0,6 г растворенного вещества в 40 г эфира, кипит при 36,13 градусов Цельсия. Температура кипения эфира 35,6 градусов Цельсия, эбулиоскопическая константа 2,12. Вычислите молярную массу растворенного вещества.
Решение:
Δt = Кэб ∙ Cm(в-ва)
Кэб =2,12
Δt = 36,13-35,6=0,53
отсюда моляльная конц-я растворенного в-ва:
Cm(в-ва) = Δt /Кэб = 0,53/ 2,12 = 0,25 моль/кг
Cm(в-ва) = n(в-ва) / m(эфира) = m(в-ва) / [M(в-ва) ∙ m(воды)]
m(эфира) = 0,04 кг
M(в-ва) = m(в-ва) / [Cm(в-ва) ∙ m(воды)] =
= 0,6 / (0,25 ∙ 0,04)= 60 г/моль
Решение:
Росм = См∙R∙T
См=Росм/(R∙T)=191,1/(8,31∙293)=0,079 моль/л,
т.о. 1 л раствора содержит 0,07845 моль гематина массой 5,0∙10=50,0 г
М = m/n = 50,0 / 0,079 = 633 г/моль
Задача 34
В растворе какого вещества осмотическое давление будет минимальным при одинаковой температуре и одинаковой молярной концентрации?
1) салицилат натрия, 2) салициловая кислота, 3) метилсалицилат.
Задача 35
Осмотическое давление раствора гемоглобина в воде, содержащего 124г/л при 17°C, равно 4,39 кПа. Рассчитать молекулярную массу гемоглобина.
Решение:
Росм = 4,39 кПа
Т = 17+273=290К
Росм = См ∙ R ∙ T
См = Росм / ( R ∙ T ) = 4,39 / ( 8,314 ∙ 290) = 0,001821 моль/л
т.е. 1 л р-ра содержит n=0,001821 моль гемоглобина, что составляет m=124 г.
М = m / n = 124 / 0,001821 = 68103 г/моль
Задача 37
Найти при 25°С осмотическое давление пара над 10% раствором NaCl плотностью 1,15 г/мл, если кажущаяся степень диссоциации соли в р-ре 85%.
Задача 38
Взято 42,0 г N2O4 в объеме 0,01835 м3 при 50 °С и давлении 946 гПа.
N2O4 диссоциирует по уравнению N2O4 = 2NO2.
Вычислить степень диссоциации и константу равновесия.
Константа равновесия Кр = р(NO2)² / р(N2O4) = [Р ∙ 2α/(1+α)]² / [Р ∙ (1-α)/(1+α)] =
= Р ∙ (2α)² / [(1-α)(1+α)] = 0,946 ∙ 10^5 ∙ (2 ∙ 0,42)² / [(1- 0,42)(1+0,42)] = 8,1 ∙ 10^4 н/м²
Можно выразить константу равновесия не через парциальные давления газов, а через их конц-и:
Кс = КрRT = 8,1 ∙ 10^4 ∙ 8,314 ∙ 323 = 2,18 ∙ 10^8 моль/м³
На всякий случай стоит проверить математику 🙂
Общие свойства растворов



К общим свойствам растворов относятся понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания, повышение температуры кипения и осмотическое давление.
Исследование свойств разбавленных растворов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном объеме данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля.
В общем виде зависимость повышения температуры кипения Dtкип. и понижения температуры замерзания Dtзам. разбавленных растворов от концентрации можно записать так:
Сm – моляльность вещества в растворе (моль/кг)
В этих уравнениях моляльную концентрацию можно заменить отношением массы растворенного вещества в 1000 г растворителя (m) к молярной массе этого вещества (М). Тогда
По этой формуле можно рассчитать молярную массу растворенного вещества.
Пример 1. Вычислите температуры кристаллизации и кипения водного раствора глюкозы с массовой долей С6Н12О6 2 %.
Решение. По закону Рауля: 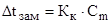
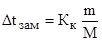
и 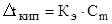
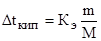
Для воды Кк = 1,86 и Кэ = 0,52
Молярная масса глюкозы
Исходя из понятия массовой доли растворенного вещества, выраженной в процентах: в 100 г раствора содержится 2 г глюкозы. Следовательно, масса растворителя будет равна: 100-2=98 г.
Найдем массу растворенного вещества в 1000 г растворителя (воды):
в 98 г воды содержится 2 г глюкозы
в 1000 г воды содержится m г глюкозы
Следовательно, понижение температуры замерзания раствора по формуле (1):
Так как 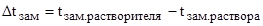
Повышение температуры кипения раствора равно по формуле (2):
Вода кипит при 100 ° С, следовательно, температура кипения этого раствора равна:
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529 0 С. Температура кипения сероуглерода 46,3 0 С. Вычислите эбулиоскопическую константу сероуглерода.
где Dtкип – повышение температуры кипения раствора равно:
Молярная масса бензойной кислоты
Найдем массу растворенного вещества в 1000 г растворителя:
в 100 г сероуглерода содержится 1,22 г бензойной кислоты
в 1000 г сероуглерода содержится m г бензойной кислоты
Из формулы (2) находим эбулиоскопическую константу:
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при t 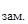
Решение. Из формулы (1) находим молярную массу:
Температура кристаллизации чистой воды 0 ° С, следовательно, понижение температуры кристаллизации (замерзания) равно:
Dt 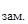
Криоскопическая константа для воды Кк = 1,86. Массу глицерина (m), приходящуюся на 1000 г воды найдем из пропорции:
в 800 г Н2О содержится 11,04 г глицерина
в 1000 г Н2О содержится m г глицерина
Подставляя в уравнение числовые значения Кк, m и Dt 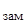
Пример 4. Вычислите массовую долю (в процентах) мочевины (NH2)2CO в водном растворе, зная, что раствор замерзает при температуре
tзам. раствора = –0,465 0 С.
Решение. Температура замерзания чистой воды 0 0 С, следовательно,
Dt 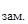
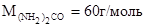
Общая масса раствора равна сумме масс растворенного вещества и растворителя: mраствора = 1000 + 15 = 1015 г.
Массовую долю мочевины в данном растворе находим из соотношения:
в 1015 г раствора содержится 15 г мочевины
в 100 г раствора содержится х г мочевины
Массовая доля мочевины в водном растворе составляет 1,48 %.
161. Раствор, содержащий 0,512 г вещества в 100 г бензола, кристаллизуется при 5,296 0 С. Температура кристаллизации бензола 5,5 0 С. Криоскопическая константа 5,1. Вычислите молярную массу растворенного вещества.
162. Вычислите массовую долю (в процентах) сахара С12Н22О11 в водном растворе, зная температуру кристаллизации этого раствора
163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды равна 1,86.
164. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714 0 С. Температура кипения бензола 80,2 0 С. Вычислите эбулиоскопическую константу бензола.
165.Вычислите массовую долю (в процентах) глицерина С3Н5(ОН)3 в водном растворе, зная, что этот раствор кипит при 100,39 0 С. Эбулиоскопическая константа воды 0,52.
166. Вычислите молярную массу вещества, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при
t 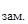
167. Вычислите температуру кипения раствора нафталина С10Н8 в бензоле с массовой долей С10Н8 5 %. Температура кипения бензола 80,2 ° С. Эбулиоскопическая константа бензола равна 2,57.
168. Раствор, содержащий 25,65 г некоторого вещества в 300 г воды, кристаллизуется при t 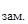
169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 3,56 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 0 С. Температура кристаллизации уксусной кислоты 16,65 0 С.
170. Равные массовые количества камфоры С10Н16О и нафталина С10Н8 растворены в одинаковых количествах бензола. Какой из этих растворов кипит при более высокой температуре?
171. Температура кристаллизации раствора, содержащего 66,3 г некоторого вещества в 500 г воды, равна t 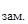
172. Сколько граммов анилина С6Н5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53 0 С. Эбулиоскопическая константа этилового эфира 2,12.
173. Вычислите температуру кристаллизации водного раствора этилового спирта с массовой долей С2Н5ОН 2 %. Криоскопическая константа воды 1,86.
174. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465 0 С? Криоскопическая константа воды 1,86.
175. Вычислите массовую долю (в процентах) глюкозы С6Н12О6 в водном растворе, зная, что этот раствор кипит при 100,26 0 С. Эбулиоскопическая константа воды 0,52.
176. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 0 С? Криоскопическая константа бензола 5,1.
177.Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26 0 С? Эбулиоскопическая константа воды 0,52.
178. При растворении 2,3 г некоторого вещества в 125 г воды температура кристаллизации понижается на 0,372 0 С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
179. Вычислите температуру кипения водного раствора пропилового спирта с массовой долей С3Н7ОН 15 %. Эбулиоскопическая константа воды 0,52.
180. Вычислите массовую долю (в процентах) метанола СН3ОН в водном растворе, температура кристаллизации которого tзам = –2,79 0 С. Криоскопическая константа воды 1,86.