криспи керлс что это
Молоко криспи
Случилось мне совершенно случайно в кондитерском магазине увидеть плитку шоколада с интригующим названием: «Коллекционный шоколад с молоком криспи». Что же это за зверь такой – криспи?
Во-первых, crispy в переводе с английского означает 1) хрусткий, хрустящий; 2) свежий. Во-вторых, в Красноярске существует бистро «Криспи», не имеющее отношения ни к молоку, ни к шоколаду, а, напротив, предлагающее кур-гриль.
Поиски в глобальной сети выявили еще и криспи – высушенные замораживанием (сублимированные) гранулы из фруктов и другого сырья. Про молоко и шоколад ничего обнаружить не удалось, поэтому за разъяснениями тайны молока криспи мне пришлось обратиться непосредственно к производителю загадочного шоколада. Ответ следующий: «Криспи в терминах пищевой промышленности означает нечто кристаллическое или гранулированное. В нашем случае молоко высушивается определенным образом с добавлением сахара, приобретая вкус карамели. В шоколаде эти высушенные кристаллики молока имеют вкус карамелизованного молока, а текстура шоколада получается не липкой, а слегка хрустящей. Эта рецептура в своем роде уникальна, так как подобного рецепта нет ни у одного российского производителя шоколада и шоколадных конфет». Кстати, ударение в слове падает на первый слог: криспи.
CRISPR для чайников, или Краткая справка по быстрому редактированию ДНК
Возможность изменять фрагменты ДНК всегда была святым Граалем биотехнологии и медицины. CRISPR позволяет делать это с невиданной ранее скоростью и эффективностью. Считайте, что биологи раньше работали на пишущей машинке, а благодаря CRISPR в одночасье пересели на MacBook. Не зря открытие этого метода в 2020 году удостоилось Нобелевской премии по химии.
Резка молекулы ДНК с помощью CRISPR-Cas9 (рис. Джанет Иваса)
Под катом — рассказ о появлении CRISPR, принципах работы и применении в настоящем и будущем. Да, вы все верно поняли, это про редактирование коров, синюю клубнику и арбузы размером со сливу с Aliexpress.
Эта статья — переработанная версия лекции Бориса Климовича, научного сотрудника Университетской клиники Тюбингена и Немецкого центра исследований рака (DKFZ), которая прошла в конце ноября при поддержке Точки кипения ЯрГУ.
Признание к CRISPR пришло в 2012 году — после публикации нобелевской работы. Но, как это обычно бывает в науке, открытие — не личная заслуга пары авторов. В этот раз участников событий было много, и началось все вовсе не с генетики.
Все началось с «грязекопателя»
Аббревиатура CRISPR появилась в конце 80-х в ходе исследований солончаков рядом с испанским городом Аликанте. Аспирант Франсиско Мохика изучал архебактерий, живущих в соленой воде, и наткнулся на странные палиндромные последовательности в их геноме.
Фрагменты длиной около 30 нуклеотидов повторялись много раз и отделялись друг от друга уникальными участками ДНК примерно такой же длины.
Упрощенно обнаруженная структура выглядела так:
На тот момент никто не понимал, зачем нужны эти структуры. Сошлись на том, что они необходимы для некой регуляции (стандартное «объяснение» в биологии, когда ничего не понятно). Структурам сначала дали название SRSR (Short Regularly Spaced Repeats), а потом переименовали в CRISPR (Clustered Regularly Interspaced Palindromic Repeats).
Продолжив работу в том же направлении, Мохика нашел похожие повторы у многих других бактерий. И эта закономерность привлекла внимание.
В 2002 году рядом с CRISPR-массивами у всех бактерий выявили похожие на них структуры — группу белок-кодирующих генов, которую назвали «очень оригинально» — CAS (CRISPR-Associated Genes).
Продвинуться дальше помог своего рода «генетический Google»: GenBank, куда ученые складируют все прочитанные последовательности ДНК. К началу 2000-х годов там накопилось уже достаточно информации, чтобы при помощи алгоритмов BLAST найти, в каких организмах встречаются похожие CRISPR-последовательности.
GenBank — открытая аннотированная база генетической информации. На июнь 2019 года в ней содержалась информация о 329 млрд пар оснований и 213 млн последовательностей. Источник — American Health Information Management Association
Поиск выявил интересную вещь: фрагменты CRISPR встречаются в ДНК бактериофагов — вирусов, которые инфицируют бактерии и убивают их. Получается, что бактерии хранят внутри себя фрагменты ДНК своих злейших врагов.
Так возникла ключевая догадка о том, что CRISPR — это иммунная память бактерий, сохраняющих информацию о вирусах, которыми болели.
Сформулировав эту теорию, Мохика сел писать статью, которую отправил в самый престижный биологический журнал — Nature. Статью отклонили. Затем он пытался ее пристроить в четыре других журнала, но успеха добился лишь через 18 месяцев.
Кстати, в этом он далеко не рекордсмен. В свое время работу Линн Маргулис, предложившую популярную нынче гипотезу симбиогенеза, отклоняли 15 раз! Можно сказать, что Мохика повезло. Его работу опубликовали быстрее, а идея нашла своих сторонников.
Основная функция CRISPR
Следующий шаг в развитии технологии сделал микробиолог Филипп Хорват. В своей докторской работе он исследовал закваски к эльзасской квашеной капусте, а если точнее — молочнокислые бактерии, которые ее квасят.
С появлением CRISPR закваска капусты стала беспроблемным делом (нет, саму капусту не трогали)
После докторской он ушел в молочную промышленность, где столкнулся с проблемой бактериофагов. Они сильно вредили заквасочным культурам, производители молочных продуктов несли огромные убытки. Ховарт искал способы сделать закваски устойчивыми к бактериофагам и наткнулся на работы о CRISPR. Исследуя эту тему, он доказал, что устойчивые к вирусам бактерии перенимают часть их ДНК.
Бактериальная клетка, которая перенесла инфекцию бактериофагом и не умерла, нарезает его геном на мелкую «вермишель», встраивает в CRISPR-массивы и передает эту информацию своим потомкам, которые становятся устойчивыми к бактериофагу.
Позже компанию, в которой работал Хорват, купила корпорация DuPont. А поскольку она производит примерно 40% заквасок для современной молочной промышленности, вы практически наверняка сталкивались с CRISPR в составе йогуртов, пиццы или сыра.
Работы Хорвата показали, что CRISPR-массивы — это действительно иммунная система бактерий.
Это работает так: кусочки ДНК бактериофагов сохраняются в ДНК бактерий в виде CRISPR-массивов. Затем они превращаются в РНК. В этом же куске генома у бактерий кодируется так называемая тракр-РНК (tracrRNA). Вместе они формируют guideRNA, или наводящую РНК, которая затем объединяется с белком Cas9.
Cas9 — это нуклеаза, фермент, который умеет резать ДНК. При помощи guideRNA этот фермент наводится на специфический сегмент в ДНК бактериофага, садится на него и разрезает, как ножницами, чем нарушает размножение вируса.
Нобелевская статья по редактированию генов
Когда две замечательные женщины-ученые Эммануэль Шарпантье и Дженнифер Даудна встретились на конференции в Коста-Рике, предназначение CRISPR уже было известно. Им пришла в голову смелая идея: приспособить эту систему для резки любой ДНК. Они объединили силы своих лабораторий и в 2012 году в журнале Science опубликовали результаты работы.
Иллюстрация из оригинальной статьи
Им удалось объединить две РНК в одну single guide RNA и показать, что механизм резки работает.
Тут надо пояснить, что резка — это и есть основной этап редактирования ДНК. А CRISPR — генетические ножницы. Все детали ниже.
За эту работу в 2020 году они получили Нобелевскую премию по химии.
Эммануэль Шарпантье и Дженнифер Даудна
Это событие уникально по двум параметрам.
Во-первых, это первая премия, которую получили две женщины без сопровождающей мужской компании.
Во-вторых, эта премия очень «быстрая». С момента публикации до ее присуждения прошло всего восемь лет.
Влияние технологии CRISPR проще всего проиллюстрировать, показав частоту упоминаний этой аббревиатуры в научной литературе, которая после 2012 года растет как на дрожжах.
Число упоминаний CRISPR в научной литературе
Второй показатель — количество патентов.
Эта статистика показывает, насколько все изменилось. Технологии редактирования генома предлагались и ранее, но ни одна из них не достигла такого успеха.
Как происходит редактирование ДНК
Первая нобелевская статья демонстрировала редактирование ДНК в пробирке. Перед учеными стояла амбициозная задача — повторить процесс в клетках человека. Фэн Чжан из MIT оптимизировал процесс, сделав его совместимым с живыми клетками, у которых есть ядра.
Фэн Чжан перенес технологию из пробирки в живые клетки
В 2013 году после публикации работы Чжана эта тема стала доминирующей. Появились сообщения о том, что отредактировали геном человека, мыши, дрожжей, ниматод, дрозофилы, резуховидки Таля, рыбки данио-рерио — всех имеющихся у биологов модельных объектов.
Важно понимать, что ДНК — это очень стабильная молекула. Ее можно кипятить или оставлять лежать в земле на сотни тысяч лет.
Самая старая секвенированная ДНК на сегодняшний день имеет возраст 1,7 млн лет.
Однако молекула ДНК очень чувствительна к разрывам. Если это случается, клетка запускает процесс починки ДНК. Он может идти двумя путями:
Не гомологичный вариант — когда место разрыва устраняется с дефектами. В результате в ДНК может появиться маленькая вставка или произойти потеря фрагмента. Генетический код — это типлеты, то есть три нуклеотида кодируют одну аминокислоту. Если вы вырезали два или вставили четыре нуклеотида, нарушится последовательность, кодирующая белок. Возникнет сдвиг рамки считывания, в результате которого ген фактически перестанет выполнять свою функцию, так как клетка не сможет использовать его информацию, чтобы синтезировать функциональный белок.
Сломать ген можно было и раньше, просто это довольно трудоемко: надо облучать гены радиацией, месяцами искать мутации. Благодаря CRISPR процесс стал гораздо проще.
Гомологичная рекомбинация. У всех животных в клетках как минимум две копии каждой хромосомы. Если возникает разрыв, клетка может использовать вторую хромосому и на ее основании достроить поврежденный участок — скопировать его в поврежденную хромосому. В этой ситуации клетку можно обмануть и подсунуть ей вместо второй хромосомы похожий фрагмент ДНК, но с мутацией. Тогда клетка починит разрыв, встроив в него то, что мы подсунули, — так называемую матрицу.
За счет прицельно вносимого разрыва, который делает CRISPR, появилась возможность очень просто и эффективно заменять фрагменты в геноме — вносить строго определенные мутации и чинить сломанные гены. Но есть проблема: репарация чаще всего проходит по не гомологичному пути. Существуют разные методы, позволяющие сдвинуть процесс в сторону гомологичной репликации, но пока они работают не очень хорошо.
Левая ветвь — не гомологичный вариант замены, приводящий к разрушению гена, правая — успешная починка подходящим фрагментом
Технологии редактирования генома существовали и ранее. Но они требовали сборки так называемых кастомных белков — под заказ. Для каждой операции нужно было собирать новый белок. Это занимало несколько недель и даже месяцев. Стоил каждый такой белок несколько тысяч евро. А CRISPR-реагенты стоят 10‒20 евро — в сотни раз меньше. Стало возможным проводить эксперименты гораздо быстрее и в огромных масштабах. Если вам в воскресенье пришла хорошая идея, то через неделю у вас уже будет клеточная линия с готовой мутацией, — и идею можно будет проверить.
Естественно, это подтолкнуло развитие биотехнологий и промышленности. Появились тысячи компаний, которые пытаются коммерциализировать CRISPR. Параллельно идет патентная война между MIT и Университетом Беркли, где работает Дженнифер Даудна.
Применение CRISPR-Cas9
Что можно сделать с помощью CRISPR? Можно сломать, починить, заменить практически любой ген в геноме. Факт: биологи любят ломать гены, чтобы выяснить, как они работают.
Можно сделать хромосомную перестройку. Это очень важно в онкологии, где ряд заболеваний вызывают хромосомные перестройки.
На следующем этапе технологию улучшили, лишив Cas-нуклеазу активности — сделали ее не режущей. Одновременно «пристегнули» к ней другие ферменты. В итоге она просто садится на строго определенный фрагмент ДНК и может его редактировать, не вызывая повреждений. Например, менять азотистые основания без внесения разрывов в ДНК, что очень важно для биомедицинских задач.
Ученые уже научились активировать или репрессировать работу гена — редактировать эпигеном. Известно, что некоторые гены в организме метилированные, кроме того, существуют специальные белки — гистоны, которые связаны с ДНК. Все это определяет, как ведет себя клетка. CRISPR позволяет влиять и на это.
Редактируем коров, собак и помидоры
Для чего еще используется подобное редактирование? Например, пятна у породы коров сделали из черно-белых серо-белыми. Считается, что так они лучше переносят жару.
Собакам породы бигль добавили мышц. Практический смысл этой, несомненно, большой работы мне неясен. Но работу выполняли китайцы. Возможно, у них свое представление о прекрасном.
Человеческих органов для пересадки всегда не хватает, поэтому пересаживают органы свиней. Но тут есть проблема: у них в геноме присутствует много спящих ретровирусов, которые после пересадки могут активироваться и угрожать здоровью пациента. У свинок на фото эти фрагменты в геноме инактивировали.
Еще пример: с помощью CRISPR отредактировали количество ветвлений на томатной ветке. А также размеры плодов. Все это на фото выше.
Отредактированных растений уже очень много. О масштабах можно судить по количеству публикаций в научных журналах.
Теперь вы знаете, откуда на Aliexpress семена синей клубники, черных помидоров и арбузов размером со сливу
Но в магазинах (по крайней мере в Европе) CRISPR-модифицированных продуктов нет. Это связано исключительно с осторожностью регулятора, на мой взгляд, излишней.
Раньше генетически модифицированные продукты в Европе запрещали, потому что не знали, что произойдет, если эти модифицированные растения попадут в дикую природу. Может быть, если генно-модифицированная кукуруза «ворвется» в леса, там вымрут все березы. Также не знали, как они повлияют на здоровье человека в долгосрочной перспективе, потому что при модификации использовали генетические элементы из других организмов.
CRISPR позволяет вносить мутации, не оставляя следов, поскольку внедряемые РНК и белок в клетке деградируют. От них ничего не остается, сохраняется только сама мутация. Фактически CRISPR делает то же самое, что происходит при селекции. Несмотря на это, суперосторожные регуляторы решили, что разрешать CRISPR пока не стоит.
Например, вывести засухоустойчивые или более продуктивные сорта растений, которые позволят использовать меньше пахотных земель, не применять пестициды или удобрения.
CRISPR в биомедицине
Самый волнующий вопрос — применение CRISPR в биомедицинских исследованиях для улучшения жизни больных людей (а может, и здоровых — в перспективе). Главная сложность тут — в доставке «генетических ножниц» в клетки человека. Допустим, нам нужно починить неработающий ген, который вызывает болезнь. Но чинить его надо в целом органе или даже во всем теле.
К примеру, мутацию, вызывающую диабет, надо чинить во всей поджелудочной железе. Это непросто, потому что клетки прекрасно себя защищают от вторжения чужеродной ДНК. Поэтому исследователи начали с тех вещей, которые можно из человека вынуть, отредактировать в пробирке, затем размножить и вернуть обратно, — с костного мозга и крови.
Здесь показано, как с помощью CRISPR лечат бета-талассемию и серповидноклеточную анемию.
Эти болезни вызваны двумя разными мутациями в гене бета-гемоглобина.
Больным бета-талассемией нужны частые переливания крови. У больных серповидноклеточной анемией эритроциты забивают сосуды. Качество жизни у них низкое, и есть риск ранней смерти.
Что в такой ситуации позволяет сделать CRISPR? У человека есть третий ген гемоглобина — фетальный гемоглобин, который активен только у эмбрионов до рождения. После рождения он выключается, работают взрослые альфа- и бета-гемоглобины. CRISPR позволяет включить ген фетального гемоглобина — выключив ген, который его контролирует.
У двух больных женщин забрали клетки костного мозга и при помощи вируса внедрили в них CRISPR-конструкцию, которая инактивировала ген BCL11A. В этих клетках заработал фетальный гемоглобин. Правильно отредактированные, отселектированные и размноженные клетки вернули пациентам обратно — пересадили им их же костный мозг. После этого пациентке с бета-талассемией, которой нужно было в среднем 16 переливаний крови в год, в течение года не понадобилось ни одной процедуры. То же произошло и с больной серповидноклеточной анемией — их реально вылечили.
Эти работы перешли на следующую стадию клинических испытаний — в ближайшее время этот метод может войти в повсеместную практику.
Следующее направление работы — терапия ВИЧ. Есть люди, которые не заражаются вирусом иммунодефицита человека за счет мутации в гене CCR5 — делеции в 32 нуклеотида. Если у человека обе копии гена мутированы, вирус просто не может проникнуть в их клетки.
У части пациентов на фоне ВИЧ развивается лимфобластный лейкоз (рак крови). Если другие методы терапии не помогают, больным лимфобластным лейкозом часто пересаживают костный мозг. В этом случае взяли костный мозг у донора, который подходил для лечения лейкемии.
Перед пересадкой клетки отредактировали с помощью CRISPR, выключив в них ген CCR5, — повторили мутацию, которая существует в природе. Пересадка вылечила пациента и от лейкоза, и от ВИЧ.
На мой взгляд, это одна из самых ярких демонстраций возможностей CRISPR.
CRISPR и этика
Говоря о ВИЧ, нельзя не вспомнить о самом нашумевшем случае использования CRISPR. Это история 2018 года. Виновник событий — Цзянькуй Хэ, китайский ученый, который провел эксперимент с редактированием человеческих эмбрионов.
За редактирование ДНК человека Цзянькуй Хэ получил три года тюрьмы
Он занимается ЭКО. Получив эмбрионы от пар, где отцы были инфицированы ВИЧ, он попытался с помощью CRISPR выключить в них ген CCR5. В результате эксперимента родилось трое внешне здоровых детей.
Однако произошло лишь частичное редактирование. У одной девочки первая копия гена получилась с 15-нуклеотидной делецией, чего оказалось недостаточно, чтобы ген перестал функционировать. А вторая копия гена — без изменений. В итоге никакой защиты девочка не получила. Со второй девочкой получилось лучше, но ген все равно остался частично функциональным.
Проблема этого эксперимента — в нарушении этических норм и законов. Как выяснилось, Цзянькуй Хэ фальсифицировал разрешение этической комиссии, которая не одобрила это исследование. Во всех странах у нормальных ученых это означает полный запрет, но он его проигнорировал. Кроме того, эксперимент был плохо подготовлен, исследователь не взвесил возможные риски. Редактирование толком не получилось, а последствия этих экспериментов могут проявить себя позже. CRISPR не обладает стопроцентной точностью, он может вносить мутации где-то еще в геноме. И где он их внесет, предсказать сложно.
Если бы все дети с ВИЧ умирали, это меняло бы дело. Но с современными препаратами ВИЧ-инфицированные матери рожают ВИЧ-негативных детей более чем в 90% случаев. Поэтому эксперимент был еще и бессмысленный.
Ни один ученый в мире не сомневался, что технически метод CRISPR позволяет редактировать эмбрионы, то есть научной новизны в этом эксперименте тоже не было. Но это надо было делать с соблюдением всех норм и другим уровнем подготовки. А главное, технология еще недостаточно созрела, чтобы со стопроцентной гарантией отредактировать только нужное место в геноме и ничего не сломать в остальных.
Гражданин Хэ подорвал веру в ученых, получив вал критики, почти полмиллиона долларов штрафа и три года лишения свободы.
Я думаю, до широкой практики редактирования человеческих эмбрионов нам далеко. Но, безусловно, когда-то мы к этому придем, и при помощи CRISPR будут лечить тяжелые наследственные заболевания.
Кому сейчас доступен CRISPR
Поработать с CRISPR могут «не только лишь все»©. В интернете за небольшие деньги можно купить набор, где есть все необходимое.
Некоторые экспериментируют прямо на собственной кухне
Если у вас есть мало-мальски оборудованная лаборатория для простейших молекулярно-биологических экспериментов, начать работать с CRISPR будет легко. И это действительно фантастический инструмент, который невероятно ускорил прогресс биомедицинской науки.
Вся эта история учит нас тому, что даже ковыряясь — буквально — в грязи, можно сделать невероятные открытия. Ну и еще тому, что наука интернациональна.
Нет никакой российской науки, немецкой науки, есть интернациональная наука.
Та же Эммануэль Шарпантье работала сначала в Нью-Йорке, потом в Мемфисе, в Вене, в Швеции, в Ганновере, а прямо сейчас работает в Берлине. Поэтому задача ученого — знать хотя бы один международный язык и пытаться развивать собственную мобильность — двигаться, искать связи и сотрудников, новых коллег. Шарпантье и Даудна встретились на конференции, заинтересовались общей проблемой и в итоге получили Нобелевскую премию. Кто знает, как бы сложилась история CRISPR, не будь этой встречи.
Просто о сложном: CRISPR/Cas
«Даже у таких мерзавцев есть ангел-хранитель. Ангел с золотыми волосами присматривает за ними» (Плохой, он же — Ангельские глазки, фильм «Хороший, плохой, злой»).
Авторы
Редакторы
Конкурс «био/мол/текст»-2016

В конкурсе участвовала только инфографика!
Текст написала Ольга Волкова.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Дмитрий Геннадиевич Калашников.
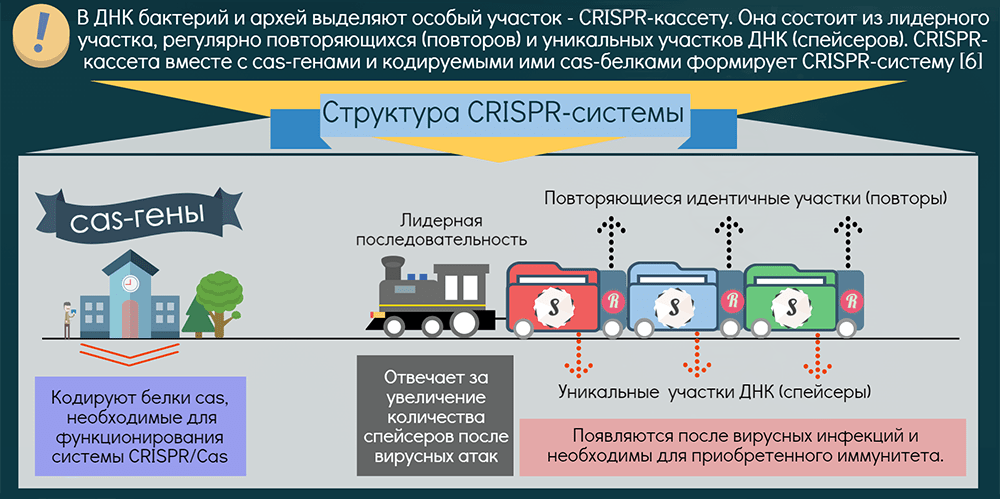
Как устроена иммунная система прокариот?
Системы CRISPR-Cas обнаружены почти у всех известных архей и половины бактерий. Чаще они находятся на хромосоме, реже — в составе фагов (вирусов бактерий) и других мобильных генетических элементов. Эти системы состоят из двух основных блоков: CRISPR-кассеты и прилегающего к ней кластера генов cas. Кассета — это блок прямых почти палиндромных («зеркальных», взаимокомплементарных последовательностей, способных складываться в шпильки) повторов размером 24–48 пар нуклеотидов. Эти повторы перемежаются спейсерами — уникальными вставками примерно такой же длины. Спейсеры идентичны различным участкам фагов и других мобильных элементов, когда-либо проникавших в эту клетку или ее предков. Число повторов в разных системах варьирует от единиц до сотен.
Таким образом, CRISPR можно считать коллекцией разделенных повторами «фотографий» нарушителей клеточных границ. Составляется эта коллекция простым заимствованием их кусочков, а чтобы противостоять новой инвазии этих же молекулярных агентов, коллекция должна регулярно «просматриваться» и обновляться. Для этой функции нужна лидерная последовательность, предшествующая череде повторов. Она богата «легкоплавкими» АТ-пáрами и содержит промотор, контролирующий транскрипцию CRISPR-кассеты («просмотр коллекции»).
К чему это приводит, можно узнать из конкурсной статьи о бактериофагах и вечной гонке вооружений в фаговом и бактериальном мирах: «Пожиратели бактерий: убийцы в роли спасителей» [11]. Кстати, там много интересных авторских электронных изображений фагов.
Для решения инженерных задач больше всего подходит система II типа, относящаяся ко II классу, — она самая простая. Именно ее эффекторный белок называется Cas9 — то самое обозначение, что фигурирует в современных системах редактирования генома.
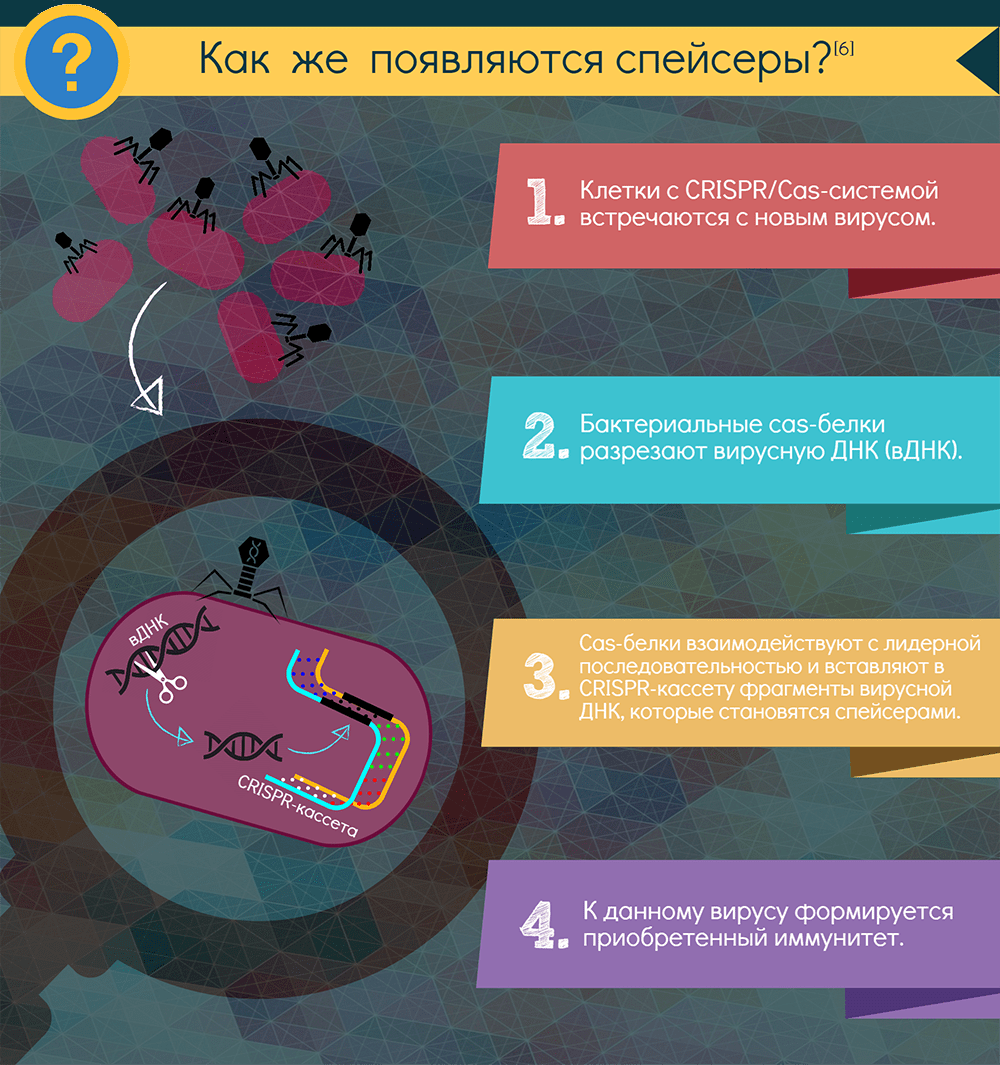
Как формируется CRISPR-опосредованный иммунитет?
Если в бактерию или архею, снабженную CRISPR-системой, проникает вирус, включается адаптационный функциональный модуль системы: специфические Cas-белки — у всех систем это как минимум Cas1 и Cas2 — вырезают из чужака понравившиеся фрагменты. Подобрать протоспейсер в некоторых случаях помогает и эффекторный белок. Белки выбирают участки рядом с особой последовательностью PAM (protospacer adjacent motif) — всего несколько нуклеотидов, но неодинаковых для разных CRISPR-систем. Затем эти же адаптационные белки встраивают фрагмент в CRISPR-кассету, всегда с одной стороны — у лидерной последовательности. Так образуется новый спейсер, а заодно с ним — и новый повтор. Весь этот процесс называют адаптацией, или приобретением, а по сути это — запоминание врага. Информацию обо всех запомнившихся врагах получает при делениях всё потомство клетки.
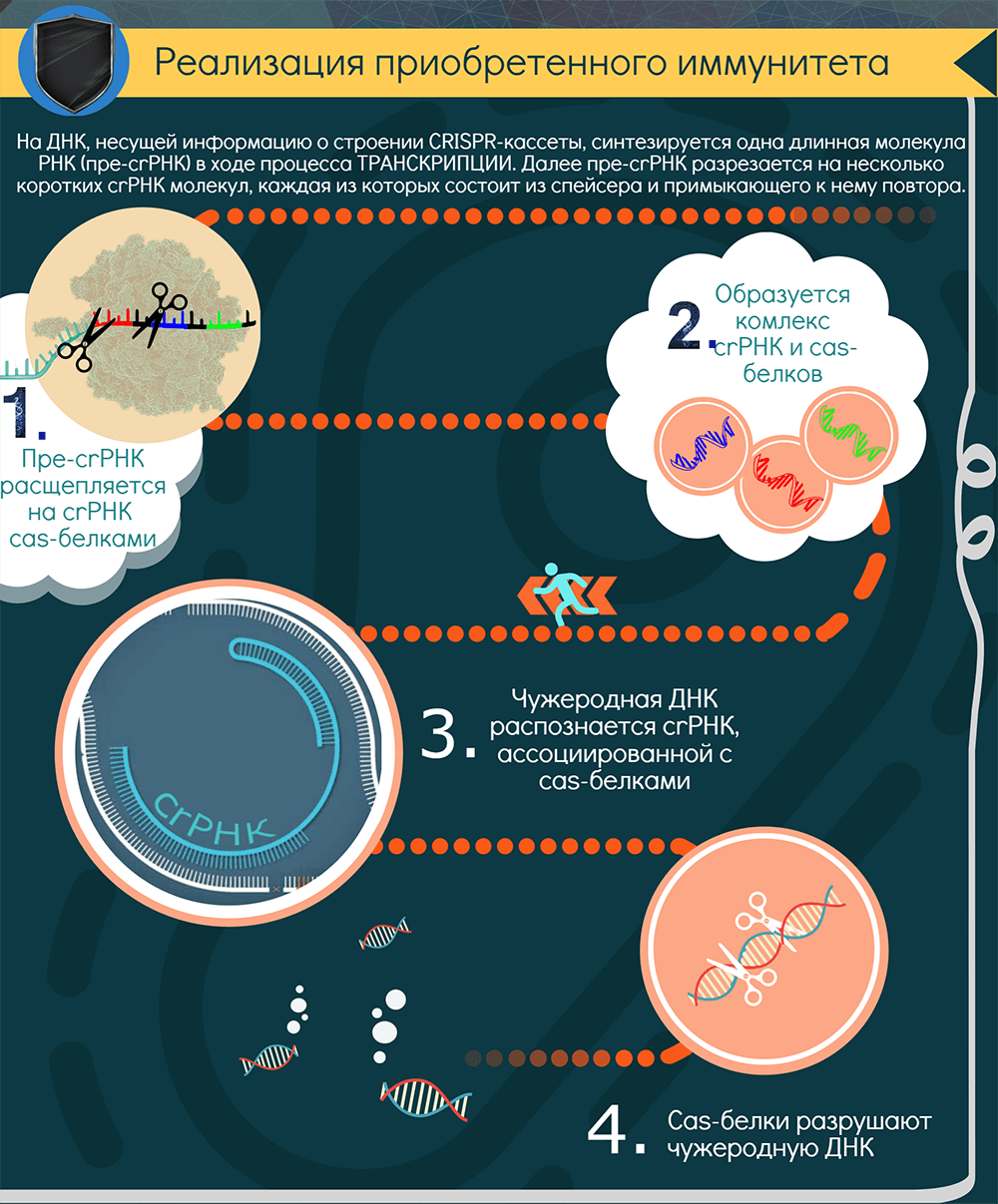
Как реализуется CRISPR-опосредованный иммунитет?
Для поиска повторно вторгающихся агентов CRISPR-кассета должна экспрессироваться. В результате ее транскрипции образуется длинная молекула РНК — pre-crРНК. С помощью РНКазы III и, как правило, Cas-белков транскрипт нарезается по повторам на отдельные crРНК — молекулы, содержащие один спейсер и кусочки окружающих его повторов (один из них длиннее). В системах II типа для этого процесса, называемого созреванием, необходим еще один участник — tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с cas-кластером [12].
Далее у систем I класса crРНК взаимодействует с комплексом Cas-белков, а у систем II класса crРНК либо дуплексы tracrРНК-crРНК связываются с одним белком-эффектором, например Cas9. Так образуется интерференционный функциональный модуль — рабочая иммунная единица, состоящая из направляющей РНК и эффекторного белка (или комплекса). Совокупность таких единиц «сканирует» клетку в поисках интервентов.
При обнаружении комплементарной crРНК последовательности, то есть протоспейсера, модуль «слипается» с ней и определяет, не помечена ли она как «своя», клеточная. Если нет, и если к ней прилегает тот самый PAM, то эффекторный белок, который представляет собой эндонуклеазу, разрезает обе цепи ДНК в строго определенных местах. Весь процесс называется интерференцией. В особом случае, у системы VI типа, происходит РНК-интерференция, потому что эффекторный белок является рибонуклеазой и разрушает РНК. Так или иначе, атакованные фаги или плазмиды выводятся из строя. Ну и появляется лишняя возможность «наворовать» новые спейсеры.
Какие проблемы могут возникнуть при реализации иммунного ответа? Не исключено, что по мере удаления от лидерной последовательности, то есть от CRISPR-промотора, шансы спейсера транскрибироваться и созреть уменьшаются. Кроме того, есть мнение, что удаленные спейсеры со временем могут накапливать мутации, препятствующие эффективной интерференции с мишенью, или вовсе удаляться. Но раз адаптация новых спейсеров происходит вблизи промотора, удаленные спейсеры представляют собой фото агентов, давно не нападавших на эту клеточную линию, и в постоянной боеготовности по отношению к ним клетка не нуждается. Настоящей же проблемой могут стать даже однонуклеотидные мутации мишени. В общем, комплементарность в этом деле превыше всего.
А не приручить ли нам чужой иммунитет?
Детально изучив принципы работы стрептококковой системы CRISPR-Cas9 (II тип), ученые подумали: а почему бы не попробовать с ее помощью корректировать геномы других организмов? Появились новые надежды относительно лечения генетических (и не только) заболеваний человека, ведь этот способ редактирования in vivo мог оказаться эффективнее уже вовсю тестируемых в то время нуклеаз ZFN и TALEN [13].
Получилась простая и, что немаловажно, дешевая двухкомпонентная система: ген cas9 и CRISPR-кассета транскрибируются в клеточном ядре выбранного организма, CRISPR-транскрипт нарезается на отдельные sgРНК, которые объединяются с белками Cas9 и ищут цель. Когда sgРНК находит комплементарный участок в геноме организма, Cas9 разрезает «натупо» обе цепи ДНК. Всё, работа CRISPR-системы на этом окончена. Теперь эстафета передается репарационным системам самогό организма. Они решают, как лучше залатать разрез: то ли просто сшить куски (это будет негомологичное соединение концов, NHEJ), то ли, если есть подходящая матрица с флангами, комплементарными участкам ДНК с двух сторон от разрыва, поставить «заплатку» (это будет гомологичная рекомбинация). Так вот, первый вариант выгоден, если нужно что-то вырезать, второй — если нужно что-то вставить или заменить дефектный участок ДНК на нормальный, который просто вводят на подходящем векторе. Иногда используют гомологию с парной хромосомой, если на ней нужный локус не дефектный.
Разумеется, технология пока не лишена недостатков. Cas9, например, может проявлять нецелевую активность, «закрывая глаза» на мелкие несоответствия между sgРНК и мишенью. По словам К. Северинова, основная проблема — это биоинформатическое предсказание мишеней, поскольку, помимо наличия участка PAM, необходимо учитывать массу факторов, включая состояние хроматина. Кроме того, сценарий, по которому пойдет репарация разреза, не всегда соответствует желаемому, поэтому сейчас активно ищут факторы, влияющие на выбор этого сценария клеткой. Помимо оптимизации CRISPR-Cas9 и механизмов ее доставки в нужные клетки, ведется апробирование других типов CRISPR-систем [14].
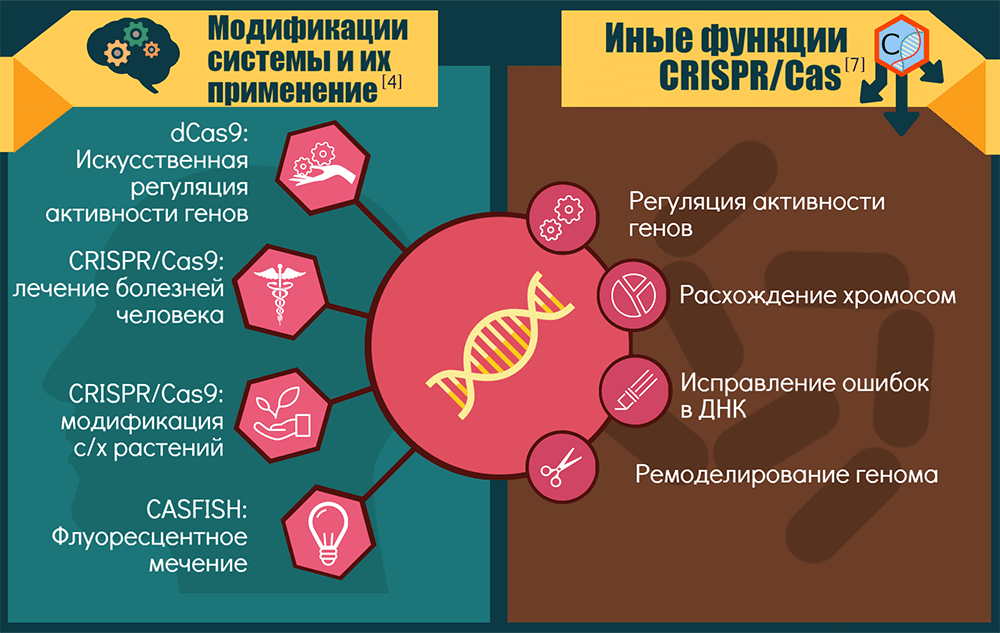
Спектр применений CRISPR-Cas9 и ее модификаций
Точки приложения CRISPR-технологии можно условно объединить в три крупные группы: «CRISPR — для исследований», «CRISPR — для биотехнологий» и «CRISPR — для терапии».
1. «CRISPR — для исследований». Технология позволяет изучать роль конкретных генов в процессах развития и жизнедеятельности организмов. Как вариант — устанавливать роль генов и их перестроек в возникновении и прогрессировании генетических болезней и рака: этот инструмент позволяет создавать прекрасные модельные системы [15].
Если Cas9 лишают одного нуклеазного домена, то белок становится никазой (nCas9) — режет только одну цепь ДНК, — а если лишают сразу двух, то белок становится инактивированным, или «мертвым» (dead, dCas9). Такой белок ничего не режет, зато систему CRISPR-dCas9 можно использовать для репрессии целых наборов генов или как платформу для конструирования более сложных регуляторных и модифицирующих комплексов. Например, если к ней привязать активирующий домен, то экспрессия целевых генов активируется. Для эпигенетической модификации нужных зон достаточно добавить модифицирующий домен. А пометив dCas9 флюоресцентными белками [16], можно визуализировать разные области хромосом. Ясно, что регуляторные возможности системы будут востребованы и в медицине. Кроме того, разные варианты CRISPR-Cas открывают новые возможности для скрининга мишеней лекарств [1].
2. «CRISPR — для биотехнологий». Здесь речь идет о применении CRISPR-Cas9 как минимум для трех целей:
3. «CRISPR — для терапии». Здесь пределов для фантазии, кажется, и вовсе нет. Если говорить о наследственных заболеваниях, то CRISPR-Cas9 в культурах клеток или животных моделях уже «примерили» для серповидноклеточной анемии и β-талассемии, M2DS-синдрома и миодистрофии Дюшенна, муковисцидоза (исправили мутантный CFTR-локус в кишечных стволовых клетках человека) и тирозинемии, катаракты (у мышей устранили доминантную мутацию в гене Crygc) и пигментного ретинита. Вообще, болезни глаз сейчас в центре внимания, потому что в глаза генетические конструкции легко доставлять [14].
Преимущества коррекции генома в зародышевой линии (как совокупности любых генеративных клеток, связывающих друг с другом поколения организмов) и стволовых клетках очевидны, но даже изменения, вносимые в соматические клетки уже развитых органов, дают эффект. Особенно если речь идет о борьбе с болезнями печени и мышц. О результатах терапевтического применения CRISPR-Cas9 в разных типах клеток рассказывает свежий обзор [21].
Отдельное перспективное направление — борьба с хроническими вирусными заболеваниями типа гепатитов и ВИЧ-инфекции. Если возбудитель сохраняется в организме в виде провируса (вирусной ДНК, встроенной в клеточный геном), то его можно просто вырезать. Именно так и поступил коллектив биологов из США, избавив лимфоциты человека от ВИЧ (об этом сообщили сразу две «биомолекулярные» статьи: «Битва века: CRISPR VS ВИЧ» [22] и «CRISPR/Cas9 как помощник в борьбе с ВИЧ» [23]). Правда, ВИЧ — объект крайне изменчивый, и с ним еще придется поломать копья.
Можно помечтать, что в терапии опухолей найдут применение варианты недавно описанной CRISPR-системы VI типа — той, что уничтожает только РНК, причем, как оказалось, любую клеточную РНК без разбора: запустить такую систему в раковую клетку — это как наслать на нее проклятье [14].
CRISPR-Cas — это не только иммунитет
Оказывается, для бактерий и их эволюции эта система значит намного больше.
Неканонические активности CRISPR-систем или их отдельных компонентов возникали как побочные продукты их иммунной функции либо как самостоятельно отбираемые признаки. Скорее всего, CRISPR-кассеты и Cas-белки когда-то работали порознь, причем исходная задача последних состояла в регуляции экспрессии генов и репарации ДНК [7]. Современные компоненты CRISPR-Cas замечены:
Инфографика выполнена совместно с Павлом Чирковым, магистром факультета политологии Санкт-Петербургского государственного университета. Одним файлом ее можно скачать здесь.