ксантома желудка что делать
Лечение рака желудка
О заболевании
Рак желудка – это новообразование в слизистой желудка. По мере разрастания опухоли она прорастает глубже в слои желудка, а также в ближайшие органы и лимфатические узлы.
Симптомы отличаются в зависимости от стадии онкологии. Чтобы подтвердить наличие опухоли, ее вид и ее стадию, пациент направляется на дополнительные исследования терапевтом или гастроэнтерологом.
При лечении проводится операция с последующей химиотерапией. Прогноз на выздоровление зависит от стадии рака, его вида и тактики проводимого лечения.
Виды рака желудка
В зависимости от гистологического строения, рак желудка делится на:
При раке желудка проводится иммуногистохимия для выявления HER/2 нео рецепторов. Эта опухоль отличается более агрессивным течением, но, вместе с тем, наличие данных рецепторов позволяет использовать в лечении высокоэффективный таргетный препарат (например, герцептин).
Симптомы рака желудка и первые признаки
Диагностика рака желудка на ранних стадиях происходит очень редко. Если вы следите за своим самочувствием и не пренебрегаете появившимися «малыми признаками», то лучше обратиться к врачу. В нашей клинике принимают онконастороженные терапевты и гастроэнтерологи, то есть они учитывают возможность наличия онкологии и, при малейшем подозрении, направляют таких пациентов на диагностику, которая позволяет исключить или выявить ранний рак.
Клиническое проявление онкологии напрямую зависит от стадии. Для начальных стадий характерно полное отсутствие симптомов или незначительное проявление:
К симптомам второй стадии относятся:
К симптомам третьей стадии относятся:
К симптомам четвертой стадии относятся:
Диагностика рака желудка
Установить верный диагноз можно только с помощью инструментальной диагностики. Но перед ее назначением предположительный диагноз должен подтвердиться другими диагностическими методами.
Для этого терапевтом или гастроэнтерологом проводится тщательный сбор и анализ жалоб пациента при подозрении на наличие онкологии. В зависимости от полученных данных назначается подходящая диагностика.
После всего этого проводятся лабораторные исследования:
Инструментальная диагностика рака предусматривает:
Стадии рака желудка и прогноз
1 стадия
Опухоль небольшого размера (до 2 см), занимает слизистый и подслизистый слой стенки желудка. Ближайшие лимфоузлы не поражены или поражены точечно, метастазов нет. Прогноз при данной стадии благоприятный и составляет 60-80% выживаемости.
2 стадия
Опухоль уже прорастает глубже в стенку желудка и поражает больше регионарных узлов (до 15), при этом метастазов нет. Прогноз при данной стадии составляет 50% выживаемости.
3 стадия
Происходит полное поражение всей стенки желудка и более отдаленных лимфоузлов, но нет метастазов в отдаленных органах. Возможно поражение опухолью соседних органов, но без поражения лимфоузлов. Прогноз при данной стадии составляет 20% выживаемости.
4 стадия
Характеризуется распространением рака на соседние органы или наличием хотя бы одного метастаза в отдаленные органы. Прогноз при данной стадии составляет 10% выживаемости.
Очень важно отметить, что при 4 стадии наша задача состоит в том, чтобы перевести заболевание в хроническую форму, что позволяет продлить жизнь пациента в 3 и более раз.
Не зависимо от стадии вы получите лечение европейского уровня, которое намного эффективнее, чем протоколы Минздрава, принятые в России и странах СНГ.
Метастазы при раке желудка
При раке желудка метастазы распространяются либо по лимфатическим путям, либо по системе кровоснабжения. Наиболее часто происходит метастазирование печени, поджелудочной, кишечника и брюшной стенки.
Лечение рака желудка
Рак желудка почти всегда лечится хирургически. Объем операции напрямую зависит от стадии заболевания. Если опухоль не успела прорасти вглубь стенки желудка, то проводят эндоскопическую резекцию при помощи гастроскопа.
При субтотальной гастрэктомии удаляется часть желудка, пораженную онкологией.
На более поздних стадиях желудок удаляется целиком с захватом окружающих тканей. Пищевод при этом сшивают с тонким кишечником. При наличии пораженных лимфоузлов, они также подлежат удалению.
В тяжелых случаях, когда полное излечение невозможно, проводится паллиативная операция. Хирург удаляет пораженную часть желудка, чтобы облегчить состояние пациента и перевести рак в хроническую форму.
Химиотерапия при раке желудка
Химиотерапия бывает адъювантной и неоадъювантной. То есть до операции и после нее. При некоторых видах онкологии ее совмещают с лучевой терапией. Сочетание химиотерапии и лучевой терапии может быть основной тактикой при метастазировании на поздних стадиях, когда полное излечение невозможно.
В отдельных случаях эффективны таргетные препараты: трастузумаб, рамуцирумаб, иматиниб, сунитиниб, регорафениб. Но их применение возможно только когда раковые клетки обладают нужными молекулярно-генетическими характеристиками.
Ксантоматоз
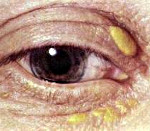
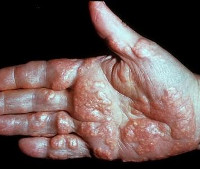
Ксантоматоз – обменное заболевание, при котором на поверхности кожных покровов и в некоторых других тканях формируются отложения липидов, главным образом холестерола и холестанола (ксантомы). Симптомами этого состояния являются желтоватые безболезненные бляшки и наросты на коже лица, нижних век (ксантелазма), конечностей и туловища без признаков воспаления. Диагностика ксантоматоза осуществляется по результатам осмотра кожных покровов, а также изучения основных показателей липидного обмена (уровня холестерина и липопротеидов в крови). Лечение разделяется на общее – коррекция липидного обмена – и местное, при котором производят удаление ксантом хирургическим путем или средствами медицинской косметологии.
Общие сведения
Ксантоматоз представляет собой множественные отложения липоидных веществ в коже (в некоторых случаях – в костях, твердой мозговой оболочке, сухожилиях), которые обусловлены гиперлипидемией. Одним из первых исследователей, который сумел верно описать и охарактеризовать это дерматологическое состояние еще в 1835 году, был французский врач П. Райе. Ксантоматоз кожи является лишь частью проявлений при нарушенном липидном обмене, помимо этого у больных могут наблюдаться также ксантелазмы, атеросклероз, липоидная дуга роговицы и даже пороки сердца, обусловленные отложением липидов на клапанах. Это состояние не является распространенным, может быть обусловлено, как первичными (генетическими) нарушениями, так приобретенными расстройствами метаболизма жиров. В некоторых случаях ксантоматоз обусловлен возрастными изменениями. В зависимости от типа и характера нарушений липидного обмена, это кожное заболевание может проявиться в разном возрасте – от детского и подросткового до преклонного и старческого.
Причины ксантоматоза
Главной причиной развития ксантоматоза является нарушение липидного обмена с развитием гиперлипидемии – состояния, при котором в крови резко увеличивается количество различных фракций липопротеидов. Такие изменения могут иметь различную природу – например, первичное расстройство метаболизма жиров имеет пять разновидностей. Каждая из них обусловлена нарушением работы определенного звена транспорта жиров и холестерина в организме, но все они имеют примерно одинаковый итог – триглицериды и холестерол в виде липопротеидов начинают накапливаться в крови, изменяя ее реологические свойства.
В результате сложных процессов липиды начинают проникать в клетки и межклеточное пространство тканей кожи и сухожилий, формируя там скопления, которые визуально определяются как ксантомы. Множественное образование таких скоплений на кожных покровах и носит название ксантоматоза.
Помимо первичных или наследственных нарушений липидного обмена, ведущих к гиперлипидемии и ксантоматозу, существуют и приобретенные факторы, способные увеличивать уровень триглицеридов и холестерина в крови. К ним относят сахарный диабет, высокое поступление жиров с пищей, гипотиреоз, воспаление поджелудочной железы (панкреатит), поражение печени (тяжелый гепатит, цирроз). В некоторых случаях гиперлипидемия с развитием ксантоматоза возникает в преклонном возрасте как часть комплекса старческих изменений в организме. Как правило, вторичные, или приобретенные, формы ксантоматоза чаще встречаются у лиц старшего или пожилого возраста, тогда как первичные могут развиваться как у детей, так и у взрослых. Патогенез отложения липидов в коже при вторичных гиперлипидемиях не имеет характерных отличий.
Симптомы ксантоматоза
Сами ксантомы при этом состоянии могут иметь различный внешний вид, который во многом зависит от причин, обусловивших развитие ксантоматоза. Так, выделяют эруптивные ксантомы, которые имеют сначала красный, затем желтоватый цвет, но багровый ободок сохраняется вокруг них еще долгое время. Они имеют четкие границы и полусферическую форму. Туберозные ксантомы характеризуются симметричным образованием, имеют желтый или коричневый цвет и могут достигать довольно крупных размеров – до 2-3 сантиметров. Плоские ксантомы, выявляемые при некоторых типах ксантоматоза, представляют собой пятна или бляшки желтого цвета, довольно часто возникают на ладонных поверхностях кисти. Также в отдельные типы иногда выделяют сухожильные ксантомы и ксантелазмы – жировые отложения на веках.
Классификация такого состояния, как ксантоматоз неотрывно связана с разновидностями нарушений липидного обмена. От типа подобных расстройств зависит характер липидных образований на коже и в других тканях, возраст их развития, клиническое течение и ряд других факторов. Все причины гиперлипидемии, ведущей к ксантоматозу, делят на две группы – первичные и вторичные. Первичные, в свою очередь, подразделяются на пять разновидностей, которые характеризуются патологиями разных звеньев липидного обмена:
Таким образом, если причиной ксантоматоза выступают первичные формы гиперлипидемии, то по характеру высыпаний, возрасту больного и другим симптомам можно примерно определить ее тип. В отношении вторичных типов нарушения липидного обмена такой четкой взаимосвязи не выявляется. Течение ксантоматоза при этом зависит от тяжести расстройства метаболизма липидов и реактивности организма – возможно появление как одиночных ксантом небольшого размера, так и множественных отложений жироподобных веществ по всему телу диаметром до 3-4 сантиметров. В случае вторичного ксантоматоза к клинической картине заболевания всегда добавляются симптомы основной патологии, которая стала причиной сбоя обмена жиров (сахарный диабет, цирроз печени и другие).
Диагностика ксантоматоза
Обычно в дерматологии диагностика такого состояния, как ксантоматоз, не представляет особых трудностей. Для этого используют метод осмотра кожных покровов пациента, биохимический анализ крови или исследование липидограммы, в спорных случаях могут производить биопсию ксантом для гистологического изучения. При осмотре дерматологом выявляются различные по форме, размерам и локализации образования от желтого до коричневого цвета, которые могут быть окружены багрово-красной каймой или неизмененной кожей. Они безболезненны и не вызывают у пациента никакого беспокойства, за исключением эстетического дефекта. Нередко обращает на себя внимание ожирение пациента или, наоборот, его чрезмерная худоба (при сахарном диабете первого типа).
Липидограмма указывает на высокий уровень различных фракций липидов крови – липопротеидов очень низкой плотности, хиломикронов, холестерина или триглицеридов. Увеличивается значение индекса атерогенности, что указывает на преобладание вредных фракций липопротеидов в крови больного. Сочетание гиперлипидемии и наличия ксантом на коже уже достаточно четко свидетельствует в пользу ксантоматоза у пациента. При гистологическом изучении тканей в очагах поражения определяется большое количество пенистых клеток с их преимущественной локализацией вокруг кровеносных сосудов. При окраске суданом-3 клеточные включения в них становятся оранжевого цвета, что говорит об их липидной природе. Эпидермис в области развития скоплений жироподобных веществ при ксантоматозе мало изменен, иногда отмечается незначительный гиперкератоз.
Лечение и прогноз ксантоматоза
Общее лечение ксантоматоза сводится к снижению уровня липоидных компонентов в крови и нормализации обмена жиров. Для этой цели используют как диету с низким содержанием липидов, так и специальные противоатеросклеротические препараты – например, аторвастатин. В тех случаях, когда гиперлипидемия обусловлена другим заболеванием, необходимо начинать его лечение – например, устранять гипотиреоз, гепатит, контролировать сахарный диабет. В некоторых случаях, особенно при молодом возрасте пациента, и если ксантоматоз проявлялся эруптивными ксантомами, после нормализации уровня липидов в крови кожные проявления заболевания способны самостоятельно исчезать. В других случаях ксантомы необходимо убирать хирургическими методиками, криодеструкцией, лазерным прижиганием или электрокоагуляцией.
Прогноз ксантоматоза напрямую зависит от причин гиперлипидемии, так как некоторые ее формы способны проявляться не только кожными симптомами, но и пороками сердца, атеросклерозом коронарных и мозговых сосудов, гепатомегалией. Ксантомы сами по себе не представляют угрозы жизни пациента и могут создавать только косметические неудобства. Прогноз относительно выздоровления и полного устранения ксантоматоза в ряде случаев благоприятный – при поддержании оптимального уровня липидов в крови новые образования не появляются, а уже сформировавшиеся можно убрать косметологическими методами. Однако если по различным причинам снова будет иметь место гиперлипидемия, то возможен рецидив заболевания.
Современная стратегия ведения пациента с предраковыми заболеваниями желудка

Представлен обзор, обобщающий существующие международные рекомендации по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка. Показано, что пациенты с хроническим атрофическим гастритом или кишечной метаплазией имеют повы
The review summarize existing international recommendations for managing patients with atrophic gastritis, intestinal metaplasia and gastric dysplasia. It is shown that patients with chronic anthropic gastritis or intestinal metaplasia have an increased risk of stomach adenocarcinoma development. Helicobacter pylori eradication tends to relieve indications of chronic nonatrophic gastritis and can lead to partial regression of atrophic gastritis, and reduces the risk of stomach cancer development.
Несмотря на успехи в области диагностики и лечения, рак желудка остается серьезной проблемой в мировом масштабе, занимая шестое место по уровню заболеваемости и второе — в структуре смертности от онкологических заболеваний [1–2]. Самые высокие показатели отмечаются в странах Восточной и Центральной Азии, Латинской Америке, самые низкие — в Северной Америке. В Восточной Азии заболеваемость раком желудка составляет 32,1 на 100 000 у мужчин, 13,2 — у женщин, в Южной Корее — 57,8 и 23,5 на 100 000, в Японии 40,7 и 16,0 на 100 000 для мужчин и женщин соответственно [1–2]. Наименьшая заболеваемость наблюдается в Северной Америке и большинстве районов Африки. Так, в Соединенных Штатах Америки (5,5 на 100 000 у мужчин; 2,8 — у женщин) [1]. Россия относится к странам с умеренным риском рака желудка, наряду с Португалией, Сингапуром, Эстонией. По итогам 2018 г., согласно российской статистике, в структуре общей заболеваемости удельный вес опухолей желудка достигал 20,4 на 100 000 населения у мужчин и 8,8 — у женщин [3]. Улучшение эпидемиологической ситуации по раку желудка наблюдается, как правило, в странах, где разработаны профилактические мероприятия, высокий уровень осведомленности населения и длительное время существуют национальные программы скрининга и ведения пациентов с предраковыми заболеваниями [4].
Цель представленного обзора — обобщение существующих международных рекомендаций по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка.
В 2012 г. Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter и микробиоты (EHMSG), Европейским обществом патологов (ESP) и Португальским обществом гастроинтестинальной эндоскопии (SPED) были разработаны первые международные рекомендации по лечению предраковых состояний и изменений желудка (MAPS I). В 2019 г. опубликована обновленная версия рекомендаций под названием MAPS II [4]. Данные рекомендации были представлены на рассмотрение в разных странах.
Различные формы рака имеют свои специфические характеристики, знание которых позволит оптимизировать диагностику рака желудка на ранних стадиях. Подавляющее большинство раков желудка — аденокарциномы (АК, около 90%), которые происходят из желез слизистой оболочки желудка. Аденокарциномы желудка (АКЖ) подразделяют на кардиальные и некардиальные. Выделяют два основных гистологических типа некардиальных АКЖ: диффузные и кишечные. Кардиальной формой рака желудка является некардиальная аденокарцинома кишечного типа (90% АКЖ). Последняя имеет строение опухоли, сходное с картиной рака кишки. Для них характерны отчетливые железистые структуры, состоящие из высокодифференцированного цилиндрического эпителия с развитой щеточной каемкой. Диффузный тип опухоли представлен слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки) и характеризуется диффузным инфильтративным ростом. Возможен смешанный тип — в опухоли присутствуют участки кишечного и диффузного типа [5]. Дифференцированный тип чаще встречается у пожилых мужчин и развивается медленно, тогда как диффузный тип чаще встречается у женщин более молодого возраста и имеет худший прогноз [5].
Обзор представленных рекомендаций не распространяется на наследственный/семейный диффузный рак желудка, для которого разработаны специальные рекомендации [6].
Аденокарцинома желудка кишечного типа представляет собой окончательный исход последовательности «воспаление — атрофия — метаплазия — дисплазия — карцинома», известной как каскад Корреа [7–11].
Рекомендация 1 (MAPS II). Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития аденокарциномы желудка (высокий уровень доказательности) [4].
Хронический атрофический гастрит и кишечную метаплазию (КМ) рассматривают как предраковые состояния, поскольку они сами по себе связаны с риском развития рака желудка и на их фоне возможно развитие дисплазии и аденокарциномы [7–11].
Рекомендация 2 (MAPS II). Гистологически подтвержденная кишечная метаплазия — наиболее надежный маркер атрофии слизистой оболочки желудка (высокий уровень доказательности) [4].
Рекомендация 3 (MAPS II). Необходимо выявлять пациентов с гастритом на поздних стадиях, т. е. с атрофией и (или) кишечной метаплазией, слизистой оболочки как антрального отдела желудка, так и тела желудка, поскольку считается, что они подвержены более высокому риску развития аденокарциномы желудка (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 4 (MAPS II). Дисплазию тяжелой степени и инвазивную карциному следует рассматривать как исходы, которые необходимо предотвратить при лечении пациентов с хроническим атрофическим гастритом или кишечной метаплазией (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 5 (MAPS II). У пациентов с эндоскопически определяемыми патологическими изменениями, указывающими на дисплазию легкой или тяжелой степени или карциному, следует определить стадию заболевания и начать лечение (высокий уровень доказательности, сильная рекомендация).
Рекомендация 6 (MAPS II). Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии (высокий уровень доказательности).
Рекомендация 7 (MAPS II). При наличии возможности и после надлежащего обучения для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 8 (MAPS II). Для надлежащего определения стадии предраковых состояний желудка первая диагностическая эндоскопия верхнего отдела желудочно-кишечного тракта должна включать взятие биопсийных образцов из желудка для определения наличия инфекции Helicobacter pylori и выявления атрофического гастрита на поздних стадиях (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 9 (MAPS II). Следует выполнить биопсию как минимум на двух топографических участках (по малой и большой кривизне, как в антральном отделе желудка, так и в теле желудка). Следует дополнительно выполнить биопсию видимых предполагаемых неопластических поражений (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 10 (MAPS II). Для выявления пациентов с гастритом на поздних стадиях можно использовать системы гистопатологического определения стадии заболевания (например, оперативную систему оценки гастрита (OLGA) и оперативную систему оценки гастрита, основанную на кишечной метаплазии (OLGIM)). Стадии III и IV могут указывать на пациентов, подверженных более высокому риску развития рака желудка [12].
Следует рассмотреть возможность выполнения дополнительной биопсии из угла желудка (умеренный уровень доказательности, слабая рекомендация). Данный подход позволяет обеспечить максимальную степень выявления пациентов с предраковыми состояниями, в особенности в случаях, когда применение хромоэндоскопии для прицельной биопсии невозможно [4].
В случае выявления патологического изменения и результатов эндоскопической оценки, указывающих на наличие дисплазии, рекомендуется проводить резекцию патологического участка без дополнительной биопсии [4].
При наличии возможности для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений. Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии. Если при такой эндоскопии высокого разрешения не выявлены патологические изменения, рекомендуется выполнить биопсию для определения стадии гастрита (если ее не выполняли ранее) и эндоскопическое наблюдение в течение от 6 месяцев (при дисплазии тяжелой степени) до 12 месяцев (при дисплазии легкой степени) [4].
Дисплазия желудка представляет собой предпоследнюю стадию последовательности желудочного канцерогенеза. Ее определяют как гистологически подтвержденные неопластические изменения эпителия без признаков тканевой инвазии, что указывает на непосредственное неопластическое предраковое изменение [13]. Всемирная организация здравоохранения подтвердила классификацию дисплазии/интраэпителиальной неоплазии [14]:
Диагноз «неопределенная дисплазия/неоплазия» не следует изначально рассматривать как безобидный, несмотря на то, что у большинства пациентов прогноз будет благоприятным. В действительности в одном из исследований было установлено, что 26,8% резецированных поражений, классифицированных как неопределенная дисплазия/неоплазия по результатам биопсии перед резекцией, фактически представляли собой неопластические поражения (5,0% — аденома и 21,8% — ранний рак желудка) [15].
Следует помнить, что даже дисплазия легкой степени может представлять собой злокачественное новообразование [16].
В случае видимых патологических изменений одной эндоскопической биопсии недостаточно для диагностики злокачественного новообразования, при наличии любого эндоскопически определяемого патологического изменения с любыми неопластическими изменениями необходимо производить его эндоскопическую резекцию[4].
Рекомендуется проверка гистологических препаратов и немедленная (в кратчайшие возможные сроки) повторная оценка с применением эндоскопии высокого разрешения и хромоэндоскопии [4].
При отсутствии эндоскопически определяемых патологических изменений у пациентов с дисплазией рекомендуется выполнять немедленную повторную оценку с применением эндоскопии высокого разрешения и хромоэндоскопии (виртуальной или с применением красителя) [4].
Пациентам с неопределенной дисплазией, дисплазией, как и с карциномой, диагностированными на основании результатов неприцельной биопсии, необходимо дообследование и лечение только в клиниках, специализирующихся на диагностике и эндоскопическом лечении рака желудка [4].
Неинвазивные методы диагностики предраковых изменений слизистой оболочки желудка
Низкий уровень пепсиногена I в сыворотке крови и (или) низкое соотношение пепсиногена I/II позволяет выявлять пациентов с атрофическим гастритом на поздних стадиях. У таких пациентов рекомендуется выполнять эндоскопию, в особенности при отрицательном результате серологического теста на H. pylori. В качестве предельных значений указывается уровень пепсиногена I
* ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва
** ФГБОУ ВО ОмГМУ МЗ РФ, Омск
*** МЦ ЦБ РФ, Москва
**** ФГБОУ ВО СибГМУ Минздрава России, Томск
# ФГБОУ ВО КубГМУ Минздрава России, Краснодар
## ГБУЗ ГБ № 3 г. Сочи Минздрава КК, Сочи
### ИГМАПО — филиал ФГОУ ДПО РМАНПО Минздрава России, Иркутск
#### ФГБОУ ВО КрасГМУ им. проф. В. Ф. Войно-Ясенецкого Минздрава России, Красноярск
@ ФГБОУ ВО УрГМУ Минздрава России, Екатеринбург
@@ ФГБОУ ВО Южно-Уральский ГМУ Минздрава России, Челябинск
Современная стратегия по ведению пациента с предраковыми заболеваниями желудка/ Л. Б. Лазебник, Е. А. Лялюкова, Г. В. Белова, И. В. Долгалёв, Н. В. Корочанская, В. К. Косёнок, А. С. Лялюкова, Е. В. Онучина, М. М. Петрова, Л. В. Прохорова, А. С. Сарсенбаева
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 60-64
Теги: хронический атрофический гастрит, кишечная метаплазия, аденокарцинома желудка