ксарелто или эликвис что лучше при тромбофлебите
Информация для пациентов с мерцательной аритмией по антитромботической терапии
(Американский Колледж врачей-пульмонологов и торакальных хирургов, 2012г.)
*С правками переводчика от 2017г. в связи с изменениями в методах лечения ФП*
Что такое мерцательная аритмия?
— Мерцательная аритмия представляет собой такое состояние, когда нормальная электрическая активность верхних камер сердца (предсердий) становится нерегулярной. Как следствие, сердце бьется неорганизованно, что проявляется нерегулярностью сердечных сокращений и снижением эффективности насосной функции сердца.
— Мерцательная аритмия является широко распространенным состоянием. У каждого четвертого человека старше 40 лет мерцательная аритмия развивается в течение их жизни.
Каковы симптомы мерцательной аритмии?
— У пациентов с мерцательной аритмией могут быть такие симптомы, как сердцебиение, одышка, дискомфорт или боль в грудной клетке, головокружение, утомляемость или потери сознания.
— Другие пациенты могут не иметь симптомов мерцательной аритмии вовсе, и это состояние выявляется в результате планового профилактического визита к врачу или обследования по поводу другого заболевания.
Почему пациенты с мерцательной аритмией нуждаются в разжижающей кровь терапии?
— Нерегулярность сердечных сокращений приводит к изменению тока крови. Это может привести к слипанию клеток крови и увеличению риска формирования тромба в верхней камере сердца (предсердии).
— Местом, куда чаще всего мигрирует тромб у пациентов с мерцательной аритмией, является головной мозг, что приводит к инсульту.
— Риск развития инсульта у пациентов с мерцательной аритмией в пять раз больше в сравнении с другими пациентами того же возраста без мерцательной аритмии.
— Прием препаратов, разжижающих кровь, снижает свертываемость крови и может уменьшать вероятность развития инсульта в будущем.
Что такое кровяной тромб?
Существуют ли разновидности инсультов?
— Существует 2 типа инсульта.
— Если кровяной тромб блокирует ток крови в мозговой артерии, речь идет об ишемическом инсульте.
— Если кровь проникает в вещество головного мозга, развивается геморрагический инсульт.
— Если у пациента с мерцательной аритмией происходит инсульт, он, как правило, более тяжелый, чаще приводит к смерти и инвалидизации в сравнении с инсультами у пациентов без мерцательной аритмии.
— Каждый четвертый ишемический (тромботический) и каждый второй геморрагический (связанный с кровоизлиянием) инсульты приводят к смерти.
— Если пациент выжил после перенесенного инсульта, в некоторых случаях какие-либо остаточные явления отсутствуют, тогда как у остальных пациентов сохраняются такие проявления инвалидизации, как слабость в одной половине тела, проблемы с ходьбой, а также проблемы с речью. Степень инвалидизации после перенесенного инсульта может варьировать в значительной степени.
Каковы факторы риска развития инсульта у пациентов с мерцательной аритмией?
— Предшествующий инсульт (включая «микроинсульты», как называют обычно транзиторные ишемические атаки).
— Сердечная недостаточность (в настоящее время или в прошлом).
— Высокое артериальное давление (в случае отсутствия адекватного контроля с помощью медикаментов).
— Возраст (риск растет по мере его увеличения).
— Сахарный диабет.
— Сосудистая патология (ишемическая болезнь сердца, препятствия кровотоку с артериях ног («атеросклероз периферических артерий»)).
— Женский пол.
Одинаков ли риск развития инсульта у пациентов с мерцательной аритмией?
— Нет. Риск развития инсульта зависит от того, есть ли у вас перечисленные факторы риска инсульта (предшествующий инсульт или транзиторная ишемическая атака, высокое артериальное давление, сердечная недостаточность, пожилой возраст (65 лет и старше), сахарный диабет, сосудистая патология, женский пол) и в каком количестве эти факторы риска присутствуют.
— Как правило, чем больше факторов риска имеет пациент, тем больше вероятность развития инсульта.
Какие меры могут быть предприняты для снижения риска инсульта?
— Для снижения тромбообразования и уменьшения риска возникновения инсульта пациенты могут принимать разжижающие кровь препараты, такие как антикоагулянты и антиагреганты.
Какие разжижающие кровь препараты применяются при мерцательной аритмии?
— Варфарин
— Дабигатран (Прадакса)
— Ривароксабан (Ксарелто)
— Апиксабан (Эликвис)
Каковы основные свойства данных препаратов, разжижающих кровь?
В каких случаях назначается лечение для профилактики инсульта у пациентов с мерцательной аритмией?
— Профилактическая терапия разжижающими кровь препаратами должна быть назначена большинству пациентов с мерцательной аритмией, имеющих один или несколько факторов риска инсульта (предшествующий инсульт или транзиторная ишемическая атака, высокое артериальное давление, сердечная недостаточность, возраст 65 лет и старше, сахарный диабет, сосудистая патология). Женщины имеют больший риск инсульта в сравнении с мужчинами, особенно в возрасте 65 лет и более.
— Пациенты, перенесшие в прошлом инсульт или транзиторную ишемическую атаку («микроинсульт»), должны получать разжижающую кровь терапию для профилактики повторного инсульта.
— Преимущества разжижающего кровь препарата (снижение риска инсульта) должны соотноситься с увеличением риска кровотечений на фоне приема этого лекарства.
Как я могу решить, какой из этих препаратов принимать в случае необходимости?
— Исследования показали, что прием всех перечисленных препаратов пациентами с мерцательной аритмией эффективен в сравнении с отсутствием такого лечения. Следует обсудить с вашим врачом, какой из этих препаратов выбрать.
— Решение о выборе наиболее подходящего вам конкретного препарата должно быть принято в рамках беседы с вашим врачом. Препарат должен быть выбран на основании вашего индивидуального риска инсульта и риска кровотечения на фоне приема данного препарата.
Каковы побочные эффекты приема препаратов, разжижающих кровь?
— Наиболее частым побочным эффектом разжижающих кровь препаратов является кровотечение. Чаще всего кровотечение небольшое, например, в виде синяка или носового кровотечения. У 1-2% пациентов, принимающих разжижающие кровь препараты, может развиться более тяжелое кровотечение, такое как желудочное кровотечение (рвота кровью) или кишечное кровотечение (кровь в стуле), которые могут требовать переливания крови и прерывания приема препаратов, разжижающих кровь.
— Наиболее серьезным побочным эффектом разжижающих кровь препаратов является кровотечением в мозг («геморрагический инсульт»).
— Другие проблемы, такие как головная боль, тошнота, желудочное расстройство, которые довольно часто возникают при приеме других препаратов, на фоне терапии разжижающими кровь препаратами возникают нечасто, поэтому в случае их появления в первую очередь стоит искать другие медицинские причины этих ощущений.
Буду ли я все время получать один и тот же препарат, разжижающий кровь. В одной и той же дозе?
— Ваша разжижающая кровь терапия может измениться со временем в случае изменения у вас риска развития инсульта. Например, это может произойти, когда вы станете старше или у вас появится риск развития большого кровотечения на фоне продолжающегося приема препарата, разжижающего кровь. Ваш доктор обсудит с вами и сделает необходимые изменения в вашей терапии в случае необходимости.
— Если вы с вашим врачом приняли решение о попытке восстановления нормального («синусового») ритма, ваш врач может выбрать применение контролируемого электрического разряда на область сердца («электрическая кардиоверсия») или специализированной процедуры, известной как катетерная аблация. Если вы предпочли кардиоверсию или аблацию, вы нуждаетесь в приеме антикоагулянтов как минимум в течение некоторого периода времени до и после процедуры с целью предотвращения формирования кровяного сгустка как следствия этой процедуры.
Как долго я должен принимать разжижающие кровь препараты?
— Как правило, пациенты с мерцательной аритмией принимают назначенные им разжижающие кровь препараты всю жизнь. В ряде случаев может быть необходимо прекратить прием разжижающих кровь препаратов. Если это произошло, ваш доктор пояснит для вас причины изменения терапии.
Следующие 2 секции предназначены для пациентов, принимающих варфарин.
Что такое МНО?
— МНО (международное нормализованное отношение) является мерой того, насколько быстро образуется тромб, и демонстрирует степень разжижения крови под действием варфарина.
— У пациентов, не принимающих антикоагулянты, уровень МНО составляет порядка 1,0. Для снижения риска инсульта при мерцательной аритмии, кровь должна быть более жидкой в 2-3 раза, чем в норме. Это означает, что кровь сворачивается с образованием тромба в 2-3 раза медленнее.
— Целевой уровень МНО у пациентов с мерцательной аритмией составляет от 2,0 до 3,0.
— Если кровь слишком густая (МНО менее 2,0), риск инсульта все еще высок.
— Если кровь слишком жидкая (МНО более 3,0), повышен риск кровотечения.
Что я могу делать, чтобы способствовать сохранению МНО в целевом диапазоне?
Напоминаем, что данные материалы носят исключительно обучающий характер и не могут заменить консультации врача. Пожалуйста, посетите вашего врача в случае необходимости обсуждения проблем, описанных в данном руководстве.
Материал подготовлен сотрудником отдела клинических проблем атеротромбоза Института Клинической Кардиологии им. А.Л.Мясникова к.м.н. Шахматовой О.О.
Дата публикации исправленной в соответствии с новыми данными версии – 21.11.2017
| НАЦИОНАЛЬНОЕ ОБЩЕСТВО ПО АТЕРОТРОМБОЗУ WWW.NOAT.RU | |||
| 105082, Москва, а/я 8 | email: info@noat.ru | ||
| © 1997—2017 «НОАТ». Все права защищены. Создание сайта: Ай Ти Легион | |||
Уважаемый посетитель NOAT.RU!
Настоящий раздел предназначен исключительно для лиц, имеющих среднее и высшее медицинское образование, а также студентов медицинских ВУЗов.
Никакие из опубликованных материалов не могут служить заменой медицинскому осмотру и не должны быть использованы как руководство к лечению. Только врач, который имеет личный контакт с пациентом, знаком с его историей болезни и наблюдает за состоянием его здоровья, может рекомендовать тот или иной метод лечения. Информация на данном сайте или другие предоставляемые им услуги не могут служить основанием для диагностики или лечения без соответствующего участия врача.
Ни при каких обстоятельствах администрация, составители, консультанты и правообладатели сайта не могут быть ответственны за любой непрямой, случайный или косвенный вред, причиненный здоровью и жизни, а также материальный ущерб или утерю прибыли, наступившую в результате любого использования или доступа или невозможности использования или получения доступа к ресурсу NOAT.RU или его содержимому.
Администрация NOAT.RU не несет ответственности за содержание баннеров и информационных материалов третьих лиц.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом, фельдшером или студентом медицинского ВУЗа.
Восстановление легких после коронавируса
Восстанавливаются ли легкие после COVID-19? Да. Но нужно не пропустить сроки реабилитации и серьёзно отнестись к рекомендациям врача.
Новая коронавирусная инфекция, вызванная SARS-CoV-2, недостаточно изучена, однако ясно, что она наносит вред всем органам и тканям человека. Вирус проникает в организм через слизистые оболочки носа, глаз, глотки. Первые симптомы появляются на 2-14 день. Обычно это повышение температуры выше 37.5 градусов Цельсия, насморк, потеря обоняния, сухой кашель, послабление стула, слабость и головная боль. На 6–10 сутки от момента появления первых симптомов могут начать беспокоить одышка, боль в груди, усиление кашля. Это тревожные симптомы, говорящие о поражении легких и требующие проведения дополнительного обследования: компьютерной томографии легких, измерения насыщения крови кислородом (сатурации).
Легкие после COVID-19
Попадая в организм человека через слизистые оболочки дыхательных путей SARS-CoV-2 вызывает мощнейшую воспалительную реакцию. Активируются иммунные клетки, вырабатывается колоссальное количество воспалительных веществ (воспалительных цитокинов). Интенсивность этой реакции скорее всего обусловлена генетически. Именно интенсивностью воспалительной реакции и определяется тяжесть поражения легочной ткани по данным исследований. В легочной ткани поражение при COVID-19 обусловлено как поражением самих альвеол (в которых происходит газообмен и кровь насыщается кислородом из воздуха) нашими собственными иммунными клетками так и поражением легочных сосудов, оплетающих альвеолы. Степень поражения легких можно определить при помощи КТ (компьютерной томографии).
Таблица 1. Поражение лёгких при COVID-19
Процент поражения легочной ткани
Поражена часть лёгкого. Небольшое затруднение дыхания.
Препараты для разжижения крови
Согласно результатам медицинских исследований, у сердечно-сосудистых заболеваний могут быть разные причины. И если одни (наследственность, возраст) остаются неизменными, то другие можно корректировать с помощью отказа от вредных привычек и изменения образа жизни.
Повышенная вязкость крови – медицинский термин, эквивалентный разговорному выражению «густая кровь». Традиционно считается, что сгущение крови связано с повышением уровня протромбина – компонента свертывающей системы крови. Такое мнение бытует из-за того, что такие серьезные осложнения сердечно-сосудистых заболеваний, как инфаркт и инсульт, чаще возникают при повышенном уровне протромбина. На самом деле вязкость определяется многими факторами.
Главная функция крови заключается в транспортировке дыхательных газов, гормонов, питательных и многих других веществ к органам и системам. От этого напрямую зависят практически все активные процессы, которые происходят в нашем организме. Отклонение от нормы провоцирует её сгущение и разжижение. И в первом, и во втором случаях это приводит к нежелательным результатам.
Как определить у себя сгущение крови?
Для хорошего движения по сосудам кровь должна быть достаточно текучей. Гемостаз — биологическая система, которая, с одной стороны, сохраняет жидкое и текучее состояние крови, а с другой стороны, останавливает кровотечения путем свертывания крови (коагуляции). Коагулограмма – лабораторный тест, который как раз и оценивает, насколько эффективно работает гемостаз.
Риск повышенного тромбообразования имеют люди с ожирением, сахарным диабетом, нарушениями ритма сердца (среди которых наиболее значимы фибрилляция и трепетание предсердий), низкой двигательной активностью, пациенты после крупных операций (например, протезирования суставов, клапанов сердца, экстренных операций и т. п.), с варикозной болезнью, перенесенными инфарктами миокарда, инсультами, с различными аутоиммунными заболеваниями.
Тромбообразование в определенном участке сосудистого русла сопровождается острым или постепенным нарушением кровоснабжения какого-либо органа с нарушением его функций и последующим некрозом тканей.
Помимо вышеперечисленных состояний, коагулограмму выполняют перед операциями для оценки риска кровотечений, при назначении некоторых лекарственных препаратов, а также обязательно при заболеваниях печени, поскольку большая часть белков системы свертывания крови синтезируется именно в этом органе.
Как действуют препараты для разжижения крови?
Так называемые разжижители помогают крови плавно течь по венам и артериям. Они используются для лечения сердечных заболеваний, препятствуют образованию опасных сгустков в сосудах.
При этом многие заблуждаются, думая, что препараты реально делают кровь более жидкой и каким-то чудом разбивают тромбы. Нет, это не так, но они не дают крови образовывать новые сгустки, а также замедляют рост уже существующих тромбов.
Классификация препаратов
В современной медицинской практике существует две группы противосвертывающих препаратов для разжижения крови на длительный прием, и для каждой есть свои конкретные показания.
1) Кардиологические аспирины (аспирин кардио, кардиомагнил, аспекард, полокард и т.д.). Показаны всем, у кого обнаружены или подозреваются атеросклеротические бляшки – ведь аспирин предотвращает “растрескивание” и тромбирование бляшек (процессы, которые приводят к инфаркту или инсульту).
2) Непрямые антикоагулянты – варфарин и его более дорогие сородичи (прадакса, ксарелто и др.). Предотвращают образование тромбов в местах, где ток крови по разным причинам замедляется и вследствие этого есть опасность образования тромбов.
Лекарства, разжижающие кровь, можно принимать:
Оральные антикоагулянты, вмешиваясь в этот процесс, существенно увеличивают время свертывания крови. Однако пероральные антикоагулянты не разжижают кровь и не растворяют уже образовавшиеся сгустки крови, хотя и позволяют прекратить рост имеющихся тромбов.
В норме естественные антикоагулянты крови способствуют тому, что ее свертывание происходит только при нарушении целостности кровеносных сосудов. Однако при определенных клинических состояниях, называемых тромбозными нарушениями, этот же механизм может приводить к нежелательному образованию опасных для жизни кровяных сгустков — тромбов. В таких ситуациях действие антикоагулянтов позволяет предотвратить избыточное тромбообразование.
Аспирин – пить или не пить, чтобы хорошо и долго жить?
Не один раз на приеме сталкивалась с ситуацией, когда пациент без явной патологии сам себе назначил кардиомагнил (или тромбоАСС, аспирин кардио и пр.), будучи уверенным, что абсолютно всем в его возрасте (то есть «после 45–50 лет») нужна именно такая профилактика заболеваний. Ведь сосед тоже пьет, по телевизору говорят, что нужно, и прочее…
Нужна ли на самом деле?
Дело в том, что современные рекомендации по лечению заболеваний(ССЗ) говорят о необходимости пожизненного приема аспирина теми людьми, которые уже перенесли события. К ним относятся инфаркт, инсульт, транзиторные ишемические атаки. Что же касается применения аспирина людьми, у которых в анамнезе вообще нет никаких заболеваний, в том числе и вышеперечисленных, то на сегодняшний день рутинное назначение аспирина (или других антитромботических препаратов) таким пациентам не рекомендовано отсутствия доказательной базы, подтверждающей прежде всего безопасность такой профилактики у данной категории пациентов.
Наиболее частым побочным эффектом при приеме аспирина является негативное влияние на слизистую оболочку желудка. Также при его длительном приеме увеличивается риск кровотечений различной локализации (, геморроидальных, носовых и пр.), и этим фактом никак нельзя пренебрегать, потому что в определенных ситуациях такие кровотечения могут стать жизнеугрожающими.
В связи с этим перед тем, как назначить пациенту аспирин, врач должен оценить пользу и риск от его приема. Доказано, что у пациентов, перенесших инфаркт или инсульт, польза профилактического приема аспирина перевешивает возможный риск кровотечений, следовательно, его прием рекомендован. И не до конца изучена роль аспиринау лиц, не имеющих в анамнезе ни того, ни другого. Те научные данные, которые мы имеем на сегодняшний день, говорят об отсутствии явной пользы от такой профилактики и при этом о повышении риска возникновения кровотечений различной локализации. Тем не менее, вопрос пока остается малоизученным, продолжаются крупные исследования, и мы ждем их результатов.
Что касается пациентов старших возрастных групп, имеющих факторы риска развития заболеваний (артериальная гипертензия, повышенный уровень холестерина крови и пр.), пациентов с сахарным диабетом, то ситуация примерно та же: до сих пор не было выявлено, что польза от приема аспирина превышает риск возникновения кровотечений у таких пациентов, в связи с чем его прием также не может быть рекомендован рутинно.
Когда еще не нужно принимать аспирин?
— При высоком артериальном давлении.
Потому что его прием может увеличить в данном случае риск возникновения геморрагического инсульта. При наличии гипертонии принимать аспирин нужно только тогда, когдадостигнут адекватный контроль артериального давления.
— При подозрении на инсульт.
Если мы имеем дело с подозрением на инсульт (у человека внезапно развились сильная слабость в руке или ноге, речевые, двигательные нарушения, опущен уголок рта, он не может улыбнуться и пр.), ни в коем случае в данной ситуации нельзя давать аспирин. Не существует объективных признаков, позволяющих однозначно отдифференцировать геморрагический (связанный с кровоизлиянием в мозг) и ишемический (связанный с закупоркой церебральной артерии атеросклеротической бляшкой) тип инсульта. А если инсульт геморрагический, и мы дадим такому человеку аспирин, то страшно представить, чем это может закончиться…
Все, что нужно сделать, если Вы подозреваете у человека инсульт — это уложить его в горизонтальное положение, постараться успокоить и как можно скорее вызвать скорую помощь.
Когда нужно принимать аспирин?
Только тогда, когда его назначил врач, оценивший пользу и риск от его приема и знающий показания к его назначению. Уровень тромбоцитов крови, прием других лекарств из группы нестероидных противовоспалительных препаратов, функция почек также всегда должны учитываться перед назначением данного препарата.
Как правило, всегда показан прием аспирина при ишемической болезни сердца, перенесенном инфаркте, некардиоэмболическом ишемическом инсульте или транзиторной ишемической атаке, при атеросклерозе артерий, стентировании артерий.
Если Вы решили всерьез заняться своим здоровьем, узнать, какие меры по профилактике заболеваний Вам необходимо предпринять, лучше обратиться к терапевту или кардиологу. Доктор назначит Вам необходимые анализы, электрокардиограмму и другие нужные обследования, измерит артериальное давление, выявит, есть ли у Вас факторы риска возникновения заболеваний, рассчитает Ваш риск и на основании этого даст необходимые рекомендации по профилактическим мероприятиям. И, поверьте, самое главное, о чем приходится говорить чаще всего — это об изменении образа жизни. Отказ от курения, нормализация массы тела, регулярные аэробные физические нагрузки (ходьба минимум 30 минут в день), диета с ограничением животных жиров — это основные мероприятия, без которых профилактика ССЗ будет считаться как минимум неполноценной, как максимум — неэффективной. А прием медикаментов может и вообще не понадобится, если все эти меры будут соблюдаться!
Антикоагулянты: взгляд анестезиолога-реаниматолога
Цель обзора: обсуждение возможностей проведения антикоагулянтной терапии с позиции анестезиолога-реаниматолога.
Основные положения. Анестезиологу-реаниматологу часто приходится сталкиваться с пациентами, получающими антикоагулянты по поводу сопутствующей патологии, и назначать антикоагулянты с профилактической и лечебными целями при жизнеугрожающих ситуациях. Появление на отечественном рынке новых оральных антикоагулянтов (НОАК) открывает широкие возможности для лечения тромботических осложнений. В обзоре подробно описываются показания к назначению НОАК, схемы перехода на препараты этой группы в качестве альтернативных антикоагулянтов, рассмотрены вопросы тактики при оперативных вмешательствах на фоне приема НОАК.
Заключение. НОАК являются надежной альтернативой парентеральным антикоагулянтам при терапии венозных тромбоэмболических осложнений у хирургических больных.
Врачи анестезиологи-реаниматологи чаще других специалистов сталкиваются с проблемами антикоагулянтной терапии. Прежде всего это обусловлено чрезвычайно широким спектром ситуаций, требующих применения антикоагулянтов (АК). В него входят профилактика венозных тромбоэмболических осложнений (ВТЭО) у хирургических больных после плановых и экстренных оперативных вмешательств; применение АК при ОКС, после операций на органах сердечно-сосудистой системы и для предотвращения тромбирования стентов различной локализации; поддержание достаточного уровня антикоагуляции при использовании экстракорпоральных методов детоксикации и заместительной почечной терапии; лечение синдрома диссеминированного внутрисосудистого свертывания крови и т. д. [3, 4].
В последнее время приобрела актуальность проблема приема пациентами АК по поводу сопутствующей патологии (например, фибрилляции предсердий (ФП) или имплантации искусственного клапана сердца) до поступления в стационар. Врачам приходится проводить лечение с учетом изменений в системе гемостаза, возникающих под влиянием антикоагулянтной терапии. Поэтому анестезиолог-реаниматолог должен хорошо разбираться в современных АК и знать особенности схем их назначения. Кроме того, постоянно возникает необходимость замены препаратов в протоколах антикоагулянтной терапии в связи с изменением клинической ситуации.
До недавнего времени анестезиологам-реаниматологам приходилось в основном назначать парентерально прямые АК — нефракционированный гепарин (НФГ), низкомолекулярные гепарины (НМГ) и фондапаринукс натрия. Небольшое число пациентов принимали непрямые АК — антагонисты витамина К (АВК), которые перед операцией заменяли на НФГ или НМГ. Однако сегодня арсенал клиницистов значительно расширился, так как появились АК для перорального приема: прямой ингибитор тромбина дабигатрана этексилат (Прадакса), а также прямые ингибиторы активированного фактора Х ривароксабан (Ксарелто) и апиксабан (Эликвис). Для обозначения этих препаратов в литературе используется устоявшийся термин «новые оральные антикоагулянты» (НОАК) [1, 4].
В Российской Федерации зарегистрированы следующие показания для назначения этих лекарственных средств: профилактика инсульта и системной тромбоэмболии у пациентов с неклапанной ФП; профилактика венозной тромбоэмболии (ВТЭ) после планового эндопротезирования тазобедренного или коленного сустава; лечение тромбоза глубоких вен (ТГВ), ТЭЛА и профилактика их рецидивов. Для ривароксабана дополнительно регламентировано использование в целях предупреждения смерти вследствие сердечно-сосудистых причин и инфаркта миокарда у пациентов после ОКС, протекавшего с повышением уровня кардиоспецифических ферментов.
Основные публикации посвящены сравнению эффективности и безопасности НОАК и варфарина — лекарственного средства из группы АВК [5, 6, 20, 24]. Чем же не устраивает клиницистов варфарин, почему ведутся поиски новых подходов к профилактике и лечению тромбоэмболических осложнений?
В литературе подробно изложены основные недостатки варфарина: медленное начало действия; узкое «терапевтическое окно»; индивидуальная вариабельность ответа на лечение; необходимость в регулярном мониторинге уровня антикоагуляции (контроле МНО) и в коррекции дозы. Значения МНО должны находиться в терапевтическом диапазоне не менее 60% времени, в противном случае возрастает риск тромбоэмболических осложнений и кровотечений [11]. Установлено, что при сочетанном приеме варфарина с рядом лекарственных средств (антибиотиками, статинами, антисекреторными препаратами и др.) его действие может снижаться или потенцироваться.
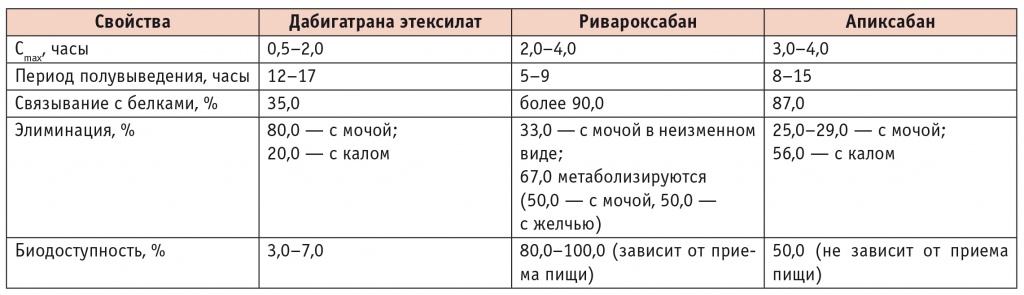
Фармакокинетические свойства новых оральных антикоагулянтов*
* Более подробную информацию см. в инструкциях по медицинскому применению лекарственных препаратов Ксарелто, Прадакса, Эликвис.
В общей популяции населения Российской Федерации количество пациентов, получающих НОАК с целью профилактики тромботических осложнений, постоянно увеличивается [2]. Соответственно в хирургические клиники все чаще госпитализируются пациенты, принимающие новые АК в связи с терапевтической патологией.
На сегодняшний день в хирургических стационарах чаще всего НОАК используют для профилактики ВТЭ после протезирования крупных суставов. Обычно АК назначают через 4-24 часа после операции, длительность курса зависит от наличия факторов риска и составляет от 10 до 14 дней у пациентов, перенесших эндопротезирование коленного сустава, от 32 до 38 дней — после операций на тазобедренном суставе.
Настоящей революцией стало использование НОАК для лечения ВТЭО, к которым относятся ТГВ, подкожный тромбофлебит и ТЭЛА. При применении дабигатрана этексилата требуется предшествующее парентеральное введение АК в течение 5 дней, что связано с особенностями его фармакокинетики. Терапия же ривароксабаном и апиксабаном начинается сразу после установления диагноза.
Вместе с тем появление рекомендаций по лечению ТГВ и ТЭЛА посредством НОАК было настороженно встречено анестезиологами-реаниматологами и хирургами. В первую очередь это обусловливалось формой выпуска НОАК: большинство специалистов были консервативно настроены в отношении возможности лечения острых состояний таблетированными лекарственными средствами; при этом аргументы о скорости всасывания в ЖКТ, биодоступности и эффективности не оказывали должного воздействия. Лечение ТГВ и ТЭЛА традиционно начинается с парентерального введения гепарина. Одной из причин этого является устоявшаяся практика снабжения отделений реанимации лекарственными средствами: во многих лечебных учреждениях считают, что таблетки в хирургической реанимации не нужны. Однако данные заблуждения преодолеваются.
Максимальный эффект НОАК отмечается примерно через 2 часа после приема внутрь первой дозы, поэтому стало возможно начинать лечение ТГВ и ТЭЛА с таблетированных лекарственных форм, отказавшись от первоначального парентерального введения АК.
Авторы исследования AMPLIFY дополнительно провели субанализ рисков рецидива ВТЭО и возникновения кровотечений в первые три месяца от начала терапии — на 7-й, 21-й и 90-й день лечения. Применение апиксабана не отличалось по эффективности от комбинированного использования эноксапарина и варфарина на всех этапах исследования, однако монотерапия апиксабаном имела явные преимущества в отношении риска возникновения кровотечений с самого начала лечения [27].
Было установлено также, что в группе апиксабана исследования AMPLIFY статистически значимо реже встречались случаи реадмиссии, а длительность госпитализации была меньше [24]. Обнадеживающие результаты были получены в подгруппе онкологических больных вышеприведенного исследования — как с диагностированными злокачественными заболеваниями в момент исследования (169 пациентов из 5395), так и с указаниями на онкологическую патологию в анамнезе (365 пациентов из 5395). В обоих случаях число повторных ВТЭО и кровотечений при использовании апиксабана было статистически значимо ниже [8].
В повседневной практике врачи сталкиваются с нерафинированными ситуациями, при которых у них возникает целый ряд вопросов по применению НОАК (например, связанных с лабораторным контролем, изменением схем антикоагулянтной терапии, передозировкой, периоперационным ведением больных). Попытаемся акцентировать внимание на проблемах повседневного использования НОАК.
Возможности лабораторной оценки новых оральных антикоагулянтов. У пациентов, принимающих НОАК согласно инструкции, не требуется проведения рутинного лабораторного контроля. При назначении дабигатрана этексилата установлена прямая корреляция между его концентрацией в плазме и выраженностью антикоагуляционного эффекта. Действие его основано на прямом ингибировании тромбина, поэтому возможен контроль по величине тромбинового времени [28]. При приеме ривароксабана и апиксабана отмечено индивидуальное увеличение хронометрических коагулологических тестов, таких как время свертывания, протромбиновое время и активированное частичное тромбопластиновое время. Однако из-за вариабельности реактивов воспроизводимость тестов в различных лабораториях низка, поэтому они не рекомендованы для оценки терапевтического эффекта препаратов [12]. Антикоагуляционное действие ривароксабана и апиксабана при необходимости можно оценить с помощью определения анти-Xa-активности, которая имеет прямую линейную зависимость от концентрации препарата в плазме [13, 16, 29]. Лабораторное определение анти-Xa-активности (методом хромогенного анализа ингибирования фактора Ха) может потребоваться у пациентов с предполагаемыми инвазивными процедурами, в том числе хирургическими операциями, и при подозрении на передозировку.
При переходе с варфарина на НОАК последние назначают при снижении МНО до 2,0, что обычно наблюдается через 72 часа после отмены АВК. Обратная замена НОАК на варфарин ассоциируется с увеличением риска тромботических осложнений, поэтому не менее 48 часов применяют оба препарата, ставя целью превышение МНО уровня 2,0. Осуществляя смену этих АК, необходимо помнить, что прием НОАК в ряде случаев приводит к увеличению МНО, поэтому перед очередным приемом АК анализы обычно повторяют.
Тактика ведения больных при возникновении кровотечений во время приема новых оральных антикоагулянтов. Назначение НОАК иногда осложняется возникновением кровотечений, не всегда связанных с их действием. Тактика ведения таких пациентов ориентирована на остановку кровотечения и выяснение причинно-следственной взаимосвязи с назначением препаратов. Учитывая сроки полувыведения НОАК, стоит ожидать восстановления свертывающей способности крови в течение суток. При возникновении кровотечения необходимо выяснить, сколько длится терапия НОАК, когда был прием последней дозы, назначались ли другие препараты, влияющие на гемостаз. Обязательно учитываются факторы, оказывающие влияние на концентрацию препарата в крови (прием лекарственных средств, служащих субстратом Р-гликопротеина, ингибиторов CYP3A4), наличие заболеваний почек и печени. Скорость элиминации дабигатрана этексилата зависит от функции почек, поэтому при возникновении кровотечения на фоне его приема целесообразно проводить стимуляцию диуреза. Добиться ускорения элиминации дабигатрана этексилата можно также с помощью гемодиализа, однако опыт его применения ограничен [30].
При незначительных кровотечениях достаточно использовать местный гемостаз (механическое прижатие) и перенести прием следующей дозы НОАК. В случаях возникновения массивного кровотечения проводят общепринятые в случае кровопотери мероприятия, и прием НОАК прекращается. Восполнение объема циркулирующей крови, а при необходимости и коррекция анемии проводятся по общим принципам лечения кровопотери. При кровотечениях из слизистых оболочек положительный эффект может быть достигнут назначением транексамовой кислоты — 15 мг/кг внутривенно болюсно, далее по 1 мг/кг/ч до купирования кровотечения. Введение препаратов протромбинового комплекса (в РФ имеется Протромплекс 600) изучалось на добровольцах [14]. Однако нет доказательств их влияния на исход кровотечения. Аналогичная ситуация наблюдается и при применении при жизнеугрожающих кровотечениях рекомбинантного фактора VIIa (НовоСэвен). Авторы подчеркивают, что при его использовании повышается риск развития тромбоза [21].
Периоперационное ведение больных, принимающих новые оральные антикоагулянты. При анализе популяции больных, принимающих НОАК, установлено, что у 25% пациентов в течение года возникает потребность в проведении инвазивных процедур или оперативных вмешательств [9]. Вместе с тем многие врачи не осведомлены в достаточной мере о риске возникновения кровотечений при приеме НОАК и тактике ведения больных при появлении осложнений [15].
У пациентов без выраженных нарушений метаболизма период полувыведения НОАК составляет 10-17 часов. При подготовке к плановым операциям или инвазивным процедурам необходимо взвешивать риск кровотечений, связанных с вмешательством, и риск тромбоза, связанный с прекращением антикоагулянтной терапии, индивидуально у каждого пациента.
Различные медицинские сообщества предлагают схожие рекомендации по ведению больных, получающих НОАК, в периоперационном периоде [10, 18, 19]. В случаях, когда хирургическая операция не сопровождается клинически значимым риском развития кровотечения и/или имеется возможность механической остановки кровотечения, например при выполнении большинства стоматологических вмешательств, отмена НОАК не требуется ( табл. 2 ). Целесообразно проводить операцию через 12-24 ч после приема препаратов, т. е. в момент минимальной концентрации НОАК в крови. Антикоагулянтная терапия возобновляется через 6 часов после окончания операции.
Классификация плановых хирургических вмешательств в зависимости от риска развития кровотечения [18]
* Вмешательство проводится в момент наименьшей концентрации новых оральных антикоагулянтов в крови, т. е. через 12 или 24 часа после последнего приема.
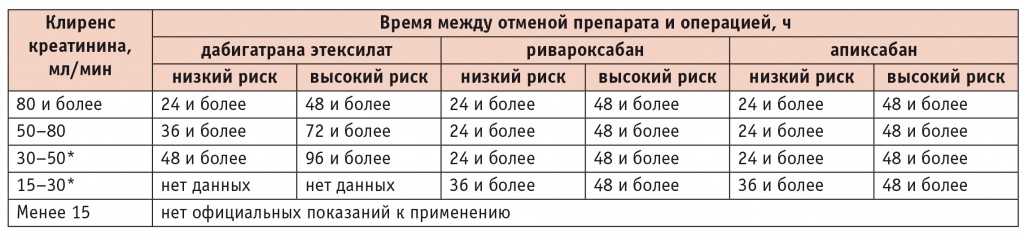
Перед выполнением операции с низким риском развития кровотечения рекомендуется прекратить прием НОАК за 24 часа до планового оперативного вмешательства ( табл. 2, 3 ). У больных с нарушением функции почек может потребоваться более ранняя отмена препаратов ( табл. 3 ). Если предстоит операция с высоким риском кровотечения, то время между отменой НОАК и операцией необходимо увеличивать ( табл. 2, 3 ). При сочетанном назначении НОАК с антиагрегантами время подготовки к хирургическому вмешательству увеличивается на 12 часов.
Возможные сроки отмены новых оральных антикоагулянтов до начала хирургического вмешательства у больных с низким и высоким риском кровотечений [18]
* Часть больных с таким клиренсом креатинина может получать антикоагулянты в более низких дозировках: дабигатрана этексилат ― 110 мг 2 раза в сутки; ривароксабан ― 15 мг 1 раз в сутки; апиксабан ― 2,5 мг 2 раза в сутки.
При полном гемостазе во время операции прием НОАК возобновляют в течение 6-8 часов. Однако если у хирургов нет уверенности в эффективном гемостазе, прием НОАК осуществляется через 24-48 часов. В целом при возобновлении антикоагулянтной терапии в течение первых 48 часов после операции необходимо соблюдать осторожность.
При высоком риске послеоперационных тромботических осложнений и риске кровотечения НОАК применяют в сниженной дозе. Если после операции пероральный прием препаратов невозможен, то на этот период назначают подкожное введение НМГ («мост-терапию»). Аналогичный подход оправдан у больных, получающих варфарин, когда прием антикоагулянта прекращают за 5 дней до операции. После возобновления лечения варфарином снова требуется около 5 дней для достижения целевых уровней МНО. Профилактика тромботических осложнений в этот период обычно достигается с помощью «мост-терапии» на основе НМГ.
При необходимости выполнения хирургических вмешательств по срочным и экстренным показаниям НОАК отменяют. Операцию по возможности откладывают на 12-24 часа. В работе G. Penod и соавт. предпринята попытка установить взаимосвязь между концентрацией НОАК в крови и риском кровотечения. Авторы считают, что при содержании НОАК в крови ниже 30 нг/мл риск кровотечения минимален и возможно проведение оперативного вмешательства. При уровне НОАК 30-200 мг/мл высока вероятность кровотечения и требуется отложить операцию на 12 часов с последующим повторным анализом содержания АК, а при концентрации 200-400 нг/мл — на 24 часа. Концентрация дабигатрана этексилата, превышающая 400 нг/мл, является показанием для проведения гемодиализа [26]. Несмотря на противоречивость данных, в случаях жизнеугрожающих кровотечений во время операции рекомендуют переливание препаратов протромбинового комплекса в дозе 25-50 Ед/кг [15].
Опыт использования НОАК при нейроаксиальной анестезии и люмбальной пункции ограничен, поэтому при выполнении этих вмешательств необходимо соблюдать особую осторожность. Из-за риска развития осложнений требуется полное восстановление свертывающей способности крови после прекращения действия АК. Мнения исследователей очень противоречивы. В рекомендациях Европейского общества аритмологов имеется положение о нежелательности проведения нейроаксиальных блокад на фоне приема НОАК [18]. В других работах допускается использование регионарных методов анестезии у пациентов, принимающих НОАК. Так, K. Waurick и соавт. рекомендуют отменять дабигатрана этексилат за 56-85 часов, ривароксабан — за 44-65 часов, а апиксабан — за 40-75 часов до выполнения эпидуральной анестезии. Эпидуральный катетер должен быть удален по меньшей мере за 5-7 часов до возобновления применения НОАК. При высоком риске развития тромботических осложнений возможно проведение «мост-терапии» НМГ [31]. После нетравматичной спинальной пункции назначение НОАК возможно через 4-8 часов после окончания операции. Если же выполнение спинномозговой анестезии сопровождалось техническими трудностями, то назначение НОАК нужно отложить на 24 часа [22].
Перед врачом и пациентом всегда стоит вопрос о наиболее эффективном и безопасном препарате. Прямых исследований по сравнению эффективности и безопасности в группе НОАК между препаратами не проводилось. Предпринимаются попытки сравнить эффективность различных НОАК и частоту побочных эффектов на основании разных источников. В связи с этим представляются интересными данные, полученные N. Kang и D. M. Sobieraj [20]. Был проведен литературный поиск рандомизированных исследований, в которых изучалась терапия ВТЭО препаратами из группы НОАК: дабигатрана этексилатом, ривароксабаном, апиксабаном. Изучение качества отобранных исследований проводилось на основании Кохрановского метода оценки риска ошибки. Авторы провели скорректированный непрямой сравнительный метаанализ оценки эффективности и безопасности применения НОАК. Вид НОАК значимо не влиял на риск смертельного исхода, частоту повторных ТГВ и ТЭЛА. Назначение дабигатрана этексилата сопровождалось увеличением риска возникновения большого кровотечения по сравнению с апиксабаном (ОР = 2,69, 95%-й ДИ: 1,19-6,07 и ОР = 2,74, 95%-й ДИ: 1,4-5,39 соответственно). В результате были сделаны выводы об одинаковой эффективности различных НОАК у больных с ВТЭО и большей безопасности апиксабана.
Главным недостатком НОАК при сопоставлении с варфарином является их высокая стоимость. На первый взгляд, действительно цена месячного курса терапии варфарином значительно ниже, чем НОАК. Однако при детальном рассмотрении установлена экономическая эффективность лечения НОАК пациентов с ФП за счет снижения числа госпитализаций, возникновения осложнений и затрат на лабораторный контроль МНО [17]. При этом высказывается точка зрения о преимуществах апиксабана по соотношению «эффективность/цена» [23].
Анестезиологам-реаниматологам все чаще приходится сталкиваться с лекарственными средства из группы НОАК. В стационары поступает все больше пациентов, принимающих НОАК в плановом порядке по поводу сопутствующей патологии. Профилактика ВТЭО у больных после операций на крупных суставах чаще всего осуществляется НОАК. Кроме того, установлена эффективность и безопасность НОАК для лечения и профилактики ТГВ и ТЭЛА. При этом доказанными являются возможность монотерапии и меньшее число геморрагических осложнений. Применение НОАК позволяет намного упростить лечение ТГВ и ТЭЛА за счет отказа от парентерального введения АК и использования фиксированной дозы препарата без рутинного лабораторного контроля. Меньшее число геморрагических осложнений при длительном приеме препаратов позволяет добиться экономического эффекта вследствие уменьшения частоты госпитализации. Публикации, посвященные НОАК, свидетельствуют о большей безопасности апиксабана в отношении риска кровотечений, также имеются данные о его преимуществах по соотношению «эффективность/цена». В рамках одной публикации невозможно дать рекомендации на все случаи жизни. Выбор конкретного препарата для профилактики и лечения ВТЭО у хирургических больных, безусловно, осуществляет клиницист, ориентируясь на индивидуальные особенности пациента, сопутствующую патологию, экстренность оперативного вмешательства, тяжесть течения послеоперационного периода, возможности медикаментозного обеспечения. Активное обсуждение оптимального использования АК на страницах журналов, конференциях, мастер-классах позволит донести до врачей всех специальностей основные достижения противотромботической терапии. Кроме того, важна выработка преемственности в назначении АК различными специалистами. Единые подходы терапевтов, кардиологов, хирургов, анестезиологов-реаниматологов к проведению антикоагулянтной терапии позволят безопасно «преодолеть» оперативные вмешательства и пребывание в отделениях реанимации при возникновении жизнеугрожающих хирургических заболеваний.