лечение абт что такое
Антибактериальная терапия инфекционных заболеваний в отделениях реанимации и интенсивной терапии
В.Б. Белобородов
Российская медицинская академия последипломного образования, Москва
Антибактериальная терапия (АБТ) является одним из важнейших компонентов лечения пациентов отделений интенсивной терапии и реанимации (ОИТР). Применение АБТ в условиях ОИТР преследует, как правило, две цели: лечение ведущего патологического процесса и/или нозокомиальной инфекции. В обоих случаях эффективность АБТ может существенно влиять на течение и исход заболевания.
Появление в 70-е годы специализированных ОИТР для больных инфекционными заболеваниями было объективной необходимостью, связанной с появлением новых возможностей лечения. Роль АБТ бактериальных инфекций существенно возрастала в связи с тем, что основной причиной развития жизнеугрожающих состояний был именно инфекционный процесс. Развитие жизнеугрожающего состояния было тесно связано с этиологией возбудителя, его вирулентностью и способностью макроорганизма адекватно реагировать на агрессию. Поэтому эффективное подавление патогенной бактериальной флоры являлось одним из важнейших условий лечения. Естественно, что определенные особенности физиологии ответа макроорганизма на инфекцию, например, закономерные иммунологические нарушения, связанные с возрастом (маленькие дети и пожилые пациенты), также играли важную роль и являлись независимым прогностическим фактором исхода заболевания.
Особенности применения АБТ в инфекционной патологии
Огромный опыт применения АБТ у инфекционных больных был накоплен в процессе развития инфекционной патологии как клинической дисциплины. Сопоставление клинических и бактериологических данных привело к формированию феномена этиологической диагностики. Она подразумевает систему клинико-этиологических сопоставлений и выявление клинических признаков, тесно связанных с этиологией возбудителя. Применение этого подхода в дальнейшем позволило на основании клинических признаков с высокой вероятностью предполагать этиологию возбудителя. Необходимо отметить, что внедрение современных технологий микробиологических исследований в неинфекционной клинике на современном этапе может способствовать развитию аналогичного подхода в общемедицинской практике.
С другой стороны, большой опыт проведения этиотропной терапии ряда инфекционных заболеваний указал на невысокую эффективность или опасность развития неблагоприятного течения заболевания. Это касается, в первую очередь, пациентов c острыми кишечными инфекциями. Были доказаны два основополагающих положения: тяжесть состояния пациентов напрямую связана со степенью выраженности водно-электролитных расстройств, и применение АБТ может приводить к хронизации процесса и формированию носительства патогенных бактерий. Проведение этих исследований совпало по времени с внедрением в клиническую практику антибактериальных препаратов нитрофуранового ряда и левомицетина.
Эффективность АБТ в лечении анаэробной клостридиальной инфекции оценивается противоречиво. Убедительно показана первостепенная важность проведения хирургической обработки и полноценного удаления пораженных тканей в плане прогноза исхода заболевания и купирования клинических признаков (например, столбняка и газовой гангрены). Несмотря на доказанную чувствительность возбудителей этих заболеваний in vitro к ряду антибактериальных препаратов и обязательность их применения, в большинстве случаев эта мера не позволяет контролировать распространение инфекции на окружающие ткани. Развитие инфекции преимущественно в нежизнеспособных тканях, которые не перфузируются кровью, а стало быть, лишены главного пути доставки антибактериальных препаратов, ставит под сомнение эффективность АБТ. Тем более, учитывая, что важнейшим патогенетическим звеном этих инфекций является действие экзотоксинов, а не самих бактерий.
В некоторых случаях локализация возбудителей также может оказывать влияние на эффективность АБТ. Так, известна высокая эффективность пенициллинов и макролидов в отношении Corinebacterium diphtheriae. Однако локализация микроорганизмов в толще многослойных фибриновых пленок на поверхности слизистой оболочки верхних дыхательных путей, в условиях гибели подлежащего эпителия, также является важным фактором ограничения доставки антибактериальных препаратов, вероятности создания ингибирующих рост микроорганизмов концентраций антибиотиков. Применение специфических антитоксической сыворотки или иммуноглобулина для связывания экзотоксина и профилактика цитотоксических эффектов, местное применение антисептиков оказываются намного более эффективными средствами лечения по сравнению с системным применением антибиотиков.
Таким образом, в ряде инфекционных заболеваний недостаточная эффективность АБТ связана с особенностями патогенеза, локализаций возбудителя или ограниченной возможностью создания бактерицидных концентраций в области персистенции патогена.
Особенности применения АБТ при генерализованных инфекциях
Некоторые инфекционные заболевания при определенных условиях могут протекать в виде генерализованных форм. К таким заболеваниям относятся сепсис, брюшной тиф, менингококковая инфекция, лептоспироз и др. Отличительной особенностью этих инфекций является наличие бактеремической фазы, когда возбудители способны размножаться в кровотоке, вызывать генерализованную воспалительную реакцию, поражение сосудистого эндотелия и органную патологию.
Еще одной особенностью является применение АБТ у пациентов с острой печеночно-почечной недостаточностью, например, при иктерогеморрагическом лептоспирозе. В этой ситуации АБТ проводится на фоне органозаместительной терапии (продленная ультрафильтрация, гемодиализ). Характерная клиническая картина и известная чувствительность лептоспир к антибиотикам позволяют проводить эффективную эмпирическую АБТ (пенициллин, ампициллин). При этом дозировка и кратность введения антибиотиков тесно связаны со степенью выраженности почечной недостаточности и характером проведения органозаместительной терапии. В ряде случаев (например, при проведении непрерывной гемофильтрации в течение нескольких суток) выбор дозировки препарата представляет определенную проблему из-за отсутствия информации о реальной концентрации препарата в крови из-за его выделения через мембрану гемофильтра в экстракорпоральный контур.
Отсутствие характерных клинических данных, указывающих на этиологию возбудителя, резко снижает эффективность эмпирической терапии и требует применения комбинации препаратов для максимального расширения спектра антимикробной активности.
В случае развития сепсиса выбор АБТ является достаточно сложным. Это связано с многообразием клинической картины сепсиса и крайней ограниченностью клинических симптомов, позволяющих с высокой степенью вероятности предположить этиологию заболевания. Тяжесть состояния пациентов, высокая вероятность развития органной недостаточности и септического шока диктуют необходимость применения АБТ. Важными факторами, облегчающими выбор антибиотиков, являются данные микробиологического мониторинга этиологии сепсиса в конкретном регионе или стационаре. Основной тенденцией эмпирического выбора препаратов является применение комбинированной терапии (цефалоспорины III-IV поколения + аминогликозиды) или монотерапии препаратом с ультрашироким антибактериальным спектром (карбапенемы). Важным фактором выбора именно этих препаратов является их спектр антибактериальной активности и наличие достоверных данных об их эффективности именно у пациентов ОИТР.
В отсутствие бактериологических данных о возбудителе сепсиса эффективность и длительность комбинированной терапии оцениваются по клиническим данным, важнейшими из которых являются снижение интенсивности генерализованной воспалительной реакции (температуры, лейкоцитоза, палочкоядерного сдвига, тахикардии, одышки, уровня белков острой фазы). В случае проведения комбинированной терапии развитие в процессе лечения резистентности возбудителя сепсиса маловероятно, поэтому при получении позитивного клинического эффекта переход к применению других антибактериальных препаратов нецелесообразен.
После выделения возбудителя сепсиса и определения его антибиотикорезистентности АБТ может претерпеть существенные изменения. Основными принципами выбора целенаправленной АБТ являются высокая эффективность, возможность монотерапии, применение препаратов с низкой токсичностью, применение менее дорогостоящих препаратов. При подтверждении высокой эффективности одного из препаратов, выбранных для проведения комбинированной эмпирической терапии, возможен также переход на монотерапию. Последующий переход на другой препарат в процессе АБТ нецелесообразен. Принципиальное изменение АБТ у больных сепсисом может потребоваться при развитии нозокомиальной инфекции.
Особенности применения АБТ у больных гнойными менингитами
Пациенты с гнойными менингитами являются одной из наиболее тяжелых категорий пациентов инфекционных ОИТР. Это связано с несколькими проблемами: быстрым развитием патологического процесса, значительной продолжительностью догоспитального периода, крайней тяжестью при поступлении, необходимостью поддержания ингибирующей концентрации препарата в субарахноидальном пространстве. Необходимо отметить, что все пациенты ОИТР с гнойными менингитами имеют различную степень нарушения сознания, высокую внутричерепную гипертензию, симптомы дислокации структур мозга. Высокая внутричерепная гипертензия связана с несколькими факторами: развитием местной воспалительной реакции, поражением капилляров с формированием интерстициального (вазогенного) отека головного мозга. В последующем это приводит к нарушению капиллярного кровотока с развитием метаболических (гипоксических) нарушений в клетках головного мозга, снижением доставки и пенетрации антибиотиков
В случае вторичных менингитов у нейрохирургических и ЛОР-пациентов эмпирическая антибактериальная терапия должна учитывать актуальность резистентных пневмококков, метициллинрезистентного S.aureus и коагулазонегативных стафилококков. Поэтому эмпирической терапией является комбинация ванкомицина и цефалоспорина III поколения. Применение ванкомицина для лечения менингита требует дополнительного обсуждения. Это связано с очень низкой проницаемостью препарата через гематоэнцефалический барьер. Идеальным является исследование концентрации ванкомицина в ликворе в процессе проведения терапии с возможной коррекцией уровня с помощью интратекального введения препарата. Доказанная эффективность применения кортикостероидов в комплексе лечения гнойных менингитов также способствует снижению пенетрации ванкомицина.
Особенности применения АБТ при нозокомиальных инфекциях
Нозокомиальные инфекции являются неизбежным злом длительного лечения пациентов в ОИТР. Первым этапом этого процесса является колонизация кожи и слизистой госпитальными штаммами микроорганизмов. Особенностью этих штаммов является приобретение непредсказуемой антибиотикорезистентности в соответствии с практикой применения антимикробных препаратов в данном отделении или учреждении.
Факторами, способствующими переходу колонизации в нозокомиальную инфекцию, являются повреждение слизистых оболочек и кожи, длительная катетеризация сосудов и мочевых путей, имплантация инородных тел и протезов, недостаточное кормление, снижение резистентности организма и др.
Многочисленными исследованиями, проведенными в различных стационарах, показана возможность снижения количества нозокомиальных инфекций только на одну треть даже при оптимальной организации лечебного процесса. Применение антибиотиков с целью профилактики нозокомиальных инфекций оказалось неэффективным.
Особенностью нозокомиальных инфекций в инфекционных ОИТР является то, что они развиваются у пациентов, уже страдающих тяжелым или осложненным инфекционным заболеванием. В этих случаях наличие клинических признаков тяжелой инфекции приводит к стиранию остроты появления клинических симптомов присоединения нозокомиальной инфекции. Поэтому диагностика нозокомиальной инфекции является ответственным и непростым делом. Наличие клинических данных позволяет диагностировать нозокомиальную инфекцию, однако данные микробиологического исследования и антибиотикограммы играют принципиальную роль для выбора АБТ. Необходимо помнить о высокой вероятности выделения штаммов микроорганизмов, не играющих этиологической роли в отношении данного вида нозокомиальной инфекции (контаминация). Даже в том случае, когда по результатам исследования антибиотикорезистентности они могут быть расценены как нозокомиальные. Поэтому от правильности проведения забора материала, проведения микробиологического исследования и адекватной клинической интерпретации полученных результатов зависит в целом эффективность лечения нозокомиальной инфекции. Необходимо напомнить, что только повторные высевы коагулазонегативных стафилококков во всех или подавляющем количестве образцов крови, взятых, по крайней мере, из двух периферических вен (не из катетеров), могут с высокой достоверностью указывать на этиологическую роль данного возбудителя. Применение бронхоальвеолярного лаважа или взятие образца для посева из трахеи под визуальным контролем с использованием специальных защищенных щеточек являются обязательным условием в определении этиологической значимости выделения возбудителя нозокомиальной пневмонии. Получение возбудителя из стерильного, только что введенного катетера из мочевых путей является подтверждением роли данного микроорганизма в этиологии инфекции. Эти методические приемы должны стать рутинными для проведения забора материала на микробиологическое исследование. Обсуждение роли отдельных микроорганизмов в этиологической структуре нозокомиальных инфекций, их антибиотикорезистентность и рекомендации по использованию антибактериальных препаратов могут проводиться только с использованием достоверных данных.
Таблица. Наиболее частые возбудители нозокомиальных инфекций в США
| Возбудитель | Количество случаев | % |
|---|---|---|
| Инфекции кровотока | ||
| Коагулазонегативные стафилококки | 8432 | 33,5 |
| S.aureus | 3381 | 13,4 |
| Энтерококки | 3161 | 12,8 |
| Пневмония | ||
| P.aeruginosa | 8307 | 17,4 |
| S.aureus | 8292 | 17,4 |
| Enterobacter | 5466 | 11,4 |
| Инфекции мочевых путей | ||
| E.coli | 8119 | 19,2 |
| Candida albicans | 6092 | 14,4 |
| Энтерококки | 5975 | 14,1 |
| P.aeruginosa | 4757 | 11,2 |
В заключение необходимо отметить, что электрофизиологический и лабораторный мониторинг пациентов ОИТР играет важную роль для контроля состояния пациентов, планирования объема необходимого лечения и прогноза заболевания. Важность микробиологического мониторинга пациентов ОИТР с применением современных методик неизмеримо возрастает при лечении инфекций, вызванных микроорганизмами с неизвестной антибиотикорезистентностью. Недостаточное внимание к этой серьезнейшей проблеме специалистов, проводящих комплексное лечение наиболее тяжелых пациентов, может сводить на нет огромные затраты, связанные с оказанием разнообразной специализированной помощи. С другой стороны, внедрение мер по профилактике и оптимизации этиотропной терапии инфекционных заболеваний и осложнений может существенно расширить возможности и повысить эффективность оказания помощи пациентам ОИТР. Нерациональная АБТ является экономически невыгодной и снижает эффективность как интенсивной терапии, так и всего комплекса лечения тяжелых больных.
Внебольничная пневмония у взрослых (рекомендации по лечению амбулаторных пациентов)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Диагностический минимум обследования
Помимо сбора анамнеза и физического обследования диагностический минимум должен включать исследования, позволяющие установить диагноз «внебольничная пневмония» (ВП) и решить вопрос о тяжести течения и необходимости госпитализации пациента. К ним относятся: рентгенография органов грудной клетки в 2-х проекциях, общий анализ крови.
Диагноз ВП может быть установлен только на основании клинической картины заболевания и данных физического обследования без проведения рентгенологического исследования. Однако рентгенография грудной клетки целесообразна в плане оценки тяжести заболевания и для решения вопроса о госпитализации.
Рутинная микробиологическая диагностика ВП в амбулаторной практике недостаточно информативна и не оказывает существенного влияния на выбор антибактериального препарата (категория доказательств В).
Выбор стартовой антибактериальной терапии
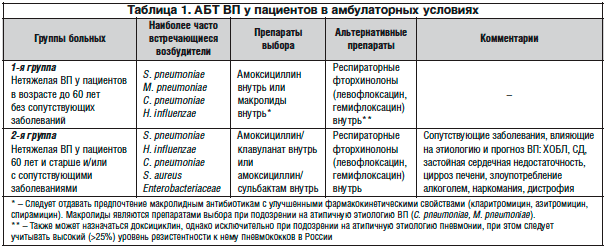
Рекомендации по эмпирической терапии ВП у амбулаторных больных представлены в таблице 1. Среди пациентов, которые могут получать лечение в амбулаторных условиях, выделяют 2 группы, различающиеся между собой по этиологической структуре и тактике антибактериальной терапии (АБТ).
В 1-ю группу включены пациенты в возрасте до 60 лет без сопутствующей патологии. У этих пациентов адекватный клинический эффект может быть получен при применении пероральных препаратов (категория доказательств С). В качестве препаратов выбора рекомендуются амоксициллин (категория доказательств D) или макролидные антибиотики. Несмотря на то, что in vitro аминопенициллины не перекрывают весь спектр потенциальных возбудителей, в ходе клинических исследований не выявлено различий в эффективности этих антибиотиков, а также отдельных представителей класса макролидов или респираторных фторхинолонов (категория доказательств А).
Макролидам следует отдавать предпочтение в первую очередь при непереносимости β-лактамов или при подозрении на атипичную этиологию заболевания (микоплазма, хламидии). В качестве альтернативных препаратов у этой группы пациентов рекомендуются респираторные фторхинолоны.
Во 2-ю группу включены лица пожилого возраста (60 лет и старше) и/или пациенты с сопутствующими заболеваниями, которые влияют на этиологию и являются факторами риска неблагоприятного прогноза при ВП:
У пациентов этой группы адекватный клинический эффект также может быть получен при назначении пероральных антибиотиков. Поскольку вероятность этиологической роли грамотрицательных микроорганизмов (в т. ч. обладающих некоторыми механизмами резистентности) у этих больных возрастает, в качестве препарата выбора рекомендуется амоксициллин/клавуланат. У пациентов данной категории возможно проведение комбинированной терапии β-лактамами и макролидами в связи с возможной хламидийной этиологией ВП. Альтернативой комбинированной терапии β–лактамами и макролидами может быть применение респираторных фторхинолонов (левофлоксацин, моксифлоксацин). Распространенную в некоторых регионах практику широкого использования аминогликозидов (гентамицин и др.) при лечении ВП следует признать ошибочной, т. к. они не активны в отношении пневмококка и атипичных возбудителей.
Парентеральное введение антибиотиков в амбулаторных условиях
Парентеральные антибиотики при лечении ВП в амбулаторных условиях не имеют доказанных преимуществ перед пероральными. Они могут применяться лишь в единичных случаях. У пациентов
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Только для зарегистрированных пользователей
Университет
БГСА вызывает различные варианты инфекции: поверхностные (фарингит, тонзиллофарингит, стрептодермия, рожа), инвазивные (некротизирующий фасциит или миозит, эндокардит, сепсис), токсин-опосредованные (скарлатина, синдром стрептококкового токсического шока); провоцирует развитие иммунно-опосредованных заболеваний у предрасположенных лиц (острый гломерулонефрит, острая ревматическая лихорадка (ОРЛ), постстрептококковый артрит, синдром PANDAS).
Наиболее частая клиническая форма БГСА-инфекции — ОТФ, т. е. острое воспаление лимфоидных образований глоточного кольца (чаще всего небных миндалин) и слизистой оболочки глотки, что имеет место примерно у 30 % всех детей с экссудативными тонзиллитами. Большинство случаев ОТФ у детей и взрослых вызваны вирусами (адено-, рино-, коронавирусы, вирусы гриппа, парагриппа, Эпштейна — Барр, Коксаки и т. д.). Это принципиально важно, т. к. вирусные ОТФ не требуют назначения антибактериальной терапии (АБТ).
В Международной классификации болезней Х пересмотра выделяют «Стрептококковый тонзиллит» (J03.0) и «Стрептококковый фарингит» (J02.0). В зарубежной литературе обычно используется термин «тонзиллофарингит» (считается, что изолированное воспаление этих структур ротоглотки как единого целого невозможно и говорит лишь о преимущественном поражении той или другой).
При диагностике и лечении стрептококковых ОТФ возникает ряд принципиальных вопросов. К сожалению, клинически и фарингоскопически отличить острый вирусный тонзиллит от БГСА непросто. Для стрептококкового ОТФ характерно отсутствие кашля, ринита, конъюнктивита, отмечаются выраженное увеличение и болезненность лимфоузлов в области угла нижней челюсти, насыщенная гиперемия мягкого неба и язычка, часто с петехиями, падение температуры через 12–24 часа после начала АБТ. Что касается налетов на миндалинах, то они с одинаковой частотой присутствуют и при вирусных тонзиллитах, особенно аденовирусной и ВЭБ-инфекции, и при стрептококковой инфекции. Однако при стрептококковых тонзиллитах налеты появляются в первые сутки болезни, а при вирусных обычно на 3–4-й день.
Для более эффективной клинической дифференциальной диагностики вирусного и стрептококкового тонзиллофарингита предложено использовать шкалы R. M. Centor и W. McIsaac (1998). Первая предназначена как для детей, так и для взрослых. По ней оценивают: температуру тела выше 38 °С, отсутствие кашля, увеличение и болезненность шейных лимфатических узлов, отечность миндалин, а также возраст больного (см. табл. 1). Чем выше сумма баллов, тем вероятнее риск БГСА-тонзиллита. Но даже при максимальной оценке по этой шкале вероятность выделения БГСА составляет всего 51–53 %. Несмотря на это детям с оценкой ≥ 3 баллов рекомендовано незамедлительно назначать АБТ из-за риска развития осложнений (см. табл. 2).
Бактериологическое исследование считается «золотым стандартом» диагностики, его чувствительность превышает 90 %, а специфичность 95–99 %. Основной недостаток — длительность (не менее 24–48 часов в случае выявления БГСА). Возможно получение ложноотрицательных результатов посевов по нескольким причинам. Во-первых, выделение стрептококков затруднено в тех случаях, когда наряду с ними в материале встречаются гемолитические стафилококки (Staphylococcus aureus), которые отличаются бурным ростом и «забивают» колонии стрептококков.
Во-вторых, культуральными методами не выделяются стрептококки, персистирующие внутриклеточно, что характерно для хронических тонзиллитов и после неадекватной АБТ. Для их выделения необходимы специальные микробиологические методы. В-третьих, во многих лабораториях для посева микроорганизмов используются питательные среды с добавлением донорской крови, а донорская кровь может содержать антитела к БГСА, которые препятствуют росту этих микроорганизмов. Важно помнить, что использование на амбулаторном этапе антибиотиков (даже их однократный прием) резко уменьшает вероятность выделения возбудителя бактериологическим методом.
В настоящее время широкое распространение получили методы экспресс-диагностики стрептококкового антигена в мазках с поверхности миндалин и/или задней стенки глотки (Streptatest, STREP-A-CHECK-1, Binax-Strep A), которые позволяют получать результат уже через 15–20 минут. Однако несмотря на высокую специфичность (95–100 %), они характеризуются более низкой чувствительностью (60–80 %), чем культуральное исследование.
Однако ни культуральное исследование, ни экспресс-тесты не позволяют дифференцировать больных с ОТФ стрептококковой этиологии от бессимптомных носителей БГСА с интеркуррентной вирусной инфекцией.
В соответствии с рекомендациями ESCMID (Европейского общества по клинической микробиологии и инфекционным заболеваниям) 2012 года культуральное исследование мазка на БГСА не рекомендуется как рутинное у всех пациентов с острой болью в горле. При высокой вероятности БГСА на основании оценки по клиническим шкалам следует по возможности провести экспресс-диагностику, в случае отрицательного результата экспресс-теста бактериологическое исследование не проводится.
IDSA (Американское общество специалистов по инфекционным болезням) рекомендует более широкое использование экспресс-теста и (или) культурального исследования мазка с задней стенки глотки, поскольку клинические симптомы не считаются надежными критериями при дифференциальной диагностике ОТФ, вызванного вирусами и БГСА, кроме случаев, когда выражены симптомы вирусной инфекции (насморк, кашель, осиплость голоса и/или язвенные поражения слизистой оболочки полости рта).
У детей и подростков отрицательные результаты экспресс-теста должны быть подтверждены культуральным исследованием (у взрослых необязательно в связи с низкой распространенностью БГСА-инфекции и крайне низким риском развития ревматической лихорадки в последующем). При положительном экспресс-тесте культуральное исследование нецелесообразно. У детей младше 3 лет классические стрептококковые ОТФ практически не встречаются, а обследование на БГСА в этой возрастной группе показано только, если она диагностирована у брата или сестры.
Лабораторные данные также не всегда позволяют отличить бактериальную инфекцию от вирусной. Маркерами бактериальной инфекции можно считать лейкоцитоз более 15 х 109/л, нейтрофилез более 10 х 109/л и/или палочкоядерных форм более 10 % или более 1,5 х 109/л, СРБ более 70 мг/л. Более низкие цифры или значительное повышение только одного из этих показателей нередко встречаются при вирусных инфекциях. Так у 1/3 детей с тонзиллитами, вызванными аденовирусами и вирусом Эпштейна — Барр, лейкоцитоз превышает 15 х 109/л, а СРБ 60 мг/л. С другой стороны, низкие цифры маркеров не обязательно позволяют исключить бактериальную инфекцию. Таким образом, лабораторные маркеры воспаления не всегда помогают в диагностике стрептококковой инфекции, их диагностическая ценность ниже, чем у катаральных симптомов, и рутинное исследование биохимического анализа крови при ОТФ не рекомендуется.
Серологическая диагностика БГСА-инфекции получила широкое распространение. Чаще всего в общеклинических лабораториях она ограничивается определением титра антител к стрептолизину О (АСЛ-О). Истинные БГСА-инфекции всегда вызывают специфический иммунный ответ — нарастание титра АСЛ-О. Определение АСЛ-О в венозной крови является высоко чувствительной и специфичной (около 80 %) реакцией, определение АСЛ-О в капиллярной крови значительно менее достоверно.
Синтез антител вообще и АСЛ-О в частности зависит от индивидуальных особенностей иммунного ответа: у одних он выраженный и длительный, у других замедленный. Синтез антител стартует через 1–2 недели от начала стрептококковой инфекции, но даже спустя 8 недель после перенесенного БГСА-тонзиллофарингита титр АСЛ-О может не достигать максимума. АСЛ-О способен сохраняться на очень высоком уровне до года.
Величина АСЛ-О в острый период не дает никакого представления о риске развития иммунных осложнений и не зависит от тяжести болезни. С другой стороны, если у больного уже в первые трое суток от начала тонзиллофарингита АСЛ-О повышен, это исключает острую стрептококковую инфекцию и говорит о том, что пациент перенес ее в сроки от 2 недель до 6–12 месяцев до обследования или страдает хроническим тонзиллитом. Иммунные осложнения (гломерулонефрит, ОРЛ) развиваются спустя 3–8 недель после БГСА-инфекции; если они не возникли в эти сроки, то вряд ли можно предполагать их развитие в дальнейшем (даже несмотря на повышенный уровень АСЛ-О).
Нужно четко понимать, что АСЛ-О представляют собой антитела распознавания антигена, а не его элиминации, и не лечить пациента антибиотиками, добиваясь нормализации этого показателя. Иммунный процесс имеет определенную стадийность, которая развивается, несмотря на гибель патогена. Лечить нужно инфекцию, а не повышенный уровень АСЛ-О! Определение титра АСЛ-О рекомендовано лишь в кардиоревматологии, нефрологии для доказательства стрептококковой этиологии поражения сердца и почек.
Для диагностики стрептококковой этиологии ОТФ определение уровня антител не используется, диагноз верифицируется культуральными методами. Этот тест может использоваться для дифференцировки активной инфекции от состояния носительства. (Достаточно подробно значение определения АСЛ-О описал Александр Лавринович в «МВ» от 5 января 2017 года).
Различают ранние и поздние (иммунные) осложнения БГСА-инфекции.
Ранние осложнения представлены шейным лимфаденитом, паратонзиллитом, парафарингитом, заглоточным и перитонзиллярным абсцессами. Этиология этих осложнений связана с сочетанной флорой (БГСА и анаэробы), проникающей в паратонзиллярную клетчатку и лимфоузлы из глубины лакун при тяжелом тонзиллите или вследствие травмы, например при обработке, тушировании миндалин. При этом у больного, несмотря на проводимое лечение, сохраняется лихорадка, боли при глотании, поворотах головы, открывании рта. При осмотре выявляются асимметрия зева, выбухание стенки глотки.
Иммунные осложнения БГСА-инфекции, к которым относятся постстрептококковый острый гломерулонефрит и острая ревматическая лихорадка, хорошо известны клиницистам. Последнее заболевание развивается у 0,3 % больных с нелеченным БГСА-тонзиллитом, из них у 40 % формируется хроническая ревматическая болезнь сердца. Адекватная АБТ на 80 % снижает риск развития острой ревматической лихорадки (ОРЛ), на 85 % — паратонзиллярного абсцесса.
Так называемые ревматогенные штаммы БГСА обладают рядом определенных свойств. Особое значение имеет М-протеин — типоспецифический антиген, располагающийся в наружном слое клеточной стенки. Антитела к М-протеину перекрестно реагируют с различными тканями организма-хозяина по принципу молекулярной мимикрии как основного патогенетического механизма развития иммунных осложнений БГСА-инфекции. Кроме того, белок М обладает свойствами суперантигена, вызывая поликлональную активацию лимфоцитов и образование низкоаффинных антител, что может привести к нарушению толерантности к собственным тканевым антигенам и развитию аутоагрессии, особенно у генетически предрасположенных больных. Эти свойства отмечены у серотипов М-3, М-5 и М-18.
Иммунопатологические осложнения БГСА-инфекции развиваются в стадии реконвалесценции. Острый гломерулонефрит манифестирует на 7–10-й день болезни, причем адекватная терапия ангины не снижает риска его развития. Клиника ОРЛ появляется через 2–3 недели после купирования симптомов ОТФ, причем лихорадка бывает не более чем у 30 % больных. Однако и в острый период ОТФ выявляются нарушения со стороны внутренних органов. Изменения со стороны сердечно-сосудистой системы характеризуются тахикардией, приглушенностью или ослаблением сердечных тонов.
При нормализации температуры тела тахикардия сменяется брадикардией, глухость сердечных тонов становится еще более выраженной. У 1/3 больных в острой стадии болезни выявляется микрогематурия, исчезающая при купировании синдрома интоксикации. Эти патологические изменения связаны с прямым действием токсинов стрептококка (экзотоксины, стрептокиназа, гиалуронидаза и др.) на органы, не имеют отношения к иммунопатологическим реакциям и не требуют проведения какой-либо противовоспалительной или иммуносупрессивной терапии.
Осложенные БГСА-инфекции
В последние годы появляется все больше сообщений о постстрептококковых аутоиммунных заболеваниях центральной нервной системы. Спектр их достаточно широк и включает в себя тики и обсессивно-компульсивные состояния. Малая хорея, которая развивается у 15 % детей после БГСА-инфекции, рассматривается как один из критериев острой респираторной лихорадки (ОРЛ), но может протекать и как изолированная патология. Характерны дистонии, паркинсонизм, а также психические нарушения и расстройства сна. Особенно часто эти осложнения БГСА-инфекции встречаются в детском возрасте, в связи с чем выделены в особую группу PANDAS (Pediatric autoimmune neuropsychiatric disorders associated with streptococcal infections — детские аутоиммунные нейропсихические расстройства, связанные со стрептококковой инфекцией). Патогенетический механизм нейродисфункции опосредован антителами к нейропротеинам по принципу антигенной мимикрии. Аутоиммунный характер этих заболеваний еще только изучается, тем не менее о нем говорит значительное улучшение психоневрологического состояния после тонзиллэктомии.
С 1990-х годов в США и Западной Европе регистрируются случаи чрезвычайно тяжелой инвазивной БГСА-инфекции, протекающей с гипотензией, коагулопатией и полиорганной недостаточностью (обозначается как синдром стрептококкового токсического шока — по аналогии со стафилококковым токсическим шоком, но со значительно более высоким уровнем летальности). Входными воротами для этой угрожающей жизни формы БГСА-инфекции служат кожа и мягкие ткани, однако в 10–15 % случаев заболевание ассоциируется с первичным очагом в лимфоидных структурах носоглотки.
Применение антибиотиков
Основной метод лечения БГСА-инфекции — системная антибиотикотерапия (АБТ), местная терапия носит вспомогательный характер. Цель — не только ликвидация клинических проявлений болезни, но и эрадикация БГСА из ротоглотки, что предотвращает распространение возбудителя и предупреждает развитие осложнений. Однако даже в случае отсутствия АБТ стрептококковый острый тонзиллофарингит (ОТФ) является саморазрешающимся в течение нескольких дней заболеванием. Сохранение симптомов более длительное время означает развитие гнойных осложнений или хронического носительства БГСА.
Стрептококки вообще и БГСА в частности являются исключением из всех клинически значимых микроорганизмов, поскольку не способны к выработке β-лактамаз. β-лактамные антибиотики остаются единственным классом препаратов, к которому у стрептококков не развилась устойчивость. В отличие от других стрептококков, БГСА не обладает способностью к модификации мишени действия для β-лактамов, поэтому повышение стандартных доз пенициллинов не требуется.
Частота клинической и микробиологической неэффективности пенициллинотерапии составляет 24–30 %. В качестве возможных причин могут выступать:
Низкая приверженность лечению. Поскольку на 3–4-е сутки АБТ симптомы болезни исчезают, большинство пациентов прекращают лечение. По некоторым данным, при назначении стандартной 10-дневной схемы пенициллинотерапии, на 9-е сутки продолжали прием препарата только 8 % больных. Несоблюдение сроков лечения пенициллином БГСА-инфекции может быть также одной из причин развития ОРЛ (в 10–15 % случаев).
Гидролиз пенициллина и амоксициллина β-лактамазами, которые продуцируются флорой, присутствующей в ротовой полости. У здоровых лиц миндалины в норме колонизированы ротоглоточной микрофлорой, представляющей приблизительно 200 видов микробов-комменсалов. Широкое применение АБТ (особенно при наличии хронического тонзиллита) приводит к тому, что состав флоры ротоглотки претерпевает изменения, при которых увеличивается количество штаммов бактерий, продуцирующих β-лактамазы.
Коагрегация, т. е. образование микробных сообществ (биопленок) благодаря адгезинам, синтезируемым ко-патогенами из предыдущего пункта. Уязвимость микроорганизмов в биопленке со стороны антибиотиков и иммунной системы резко снижается. Появление биопленок может рассматриваться как одно из показаний к тонзиллэктомии и ведущая причина хронического воспаления небных миндалин (хронического тонзиллита), особенно при наличии их гипертрофии.
Реинфицирование БГСА. Риск реинфекции особенно велик в закрытых и полузакрытых коллективах (детские сады, школы, детские дома и т. д.). Реинфекция может развиться при контакте с носителем БГСА (особенно если клинические симптомы у него отсутствуют), контаминированными предметами.
Недостаточное проникновение антибиотиков в ткань миндалин (может быть связано с конкретным препаратом либо cо склеротическими изменениями миндалин на фоне повторных ангин). В настоящее время показано, что макролиды и цефалоспорины создают сравнительно бóльшие тканевые концентрации, чем пенициллин.
In vitro обнаружена способность некоторых штаммов БГСА к внутриклеточному паразитированию в макрофагах и эпителиальных клетках дыхательных путей. Антибиотики, не обладающие способностью к внутриклеточному накоплению (все β-лактамы), не влияют на эти формы патогенов. Однако наличие таких штаммов in vivo не доказано.
Ложное рецидивирование: ОРВИ у носителей БГСА сопровождается положительными результатами бактериологического исследования, такие пациенты многократно проводят АБТ. Рекомендуется использовать клинические шкалы вероятности БГСА-инфекции перед назначением посевов, а также учитывать сроки наступления эффекта от АБТ: при БГСА-инфекции купирование лихорадки и болевого синдрома происходит через 12–48 часов, а то время как при ОРВИ средняя длительность лихорадки составляет 3–5 дней независимо от терапии. Однако при назначении АБТ на 2–3-й день ОРВИ возможна имитация положительного эффекта в связи с совпадением ожидаемого срока действия препарата с саморазрешением ОРВИ.
Все антибактериальные препараты, за исключением однократного назначения бензатина бензилпенициллина и 5-дневного курса азитромицина, должны применяться в течение 10 дней (см. табл. 1). Проведение бициллинопрофилактики у больных острым БГСА-тонзиллитом, получивших полный курс АБТ, считается необоснованным (вероятность сохранения носительства стрептококка крайне мала). Бициллин после адекватно пролеченной ангины назначают только детям с ревматической болезнью в рамках вторичной профилактики.
Лечение хронического рецидивирующего тонзиллита отличается от лечения острых форм из-за сопутствующей микрофлоры (см. табл. 2).
Носителям БГСА терапия антибиотиками не проводится, за исключением детей из закрытых коллективов: в этих случаях рекомендуется использовать клиндамицин или цефалоспорины (их способность к эрадикации данного возбудителя у носителей оказалась достоверно выше).
Рутинное культуральное исследование после окончания лечения не проводится, кроме особых обстоятельств: пациенты с высоким наследственным риском развития ОРЛ и пациенты с рецидивирующими эпизодами стрептококкового ОТФ. До 7–37 % больных, получавших адекватную АБТ, имеют положительный экспресс-тест или результат культурального исследования, что связано с носительством БГСА. Обследование и АБТ у бессимптомных контактных лиц и членов семьи пациента с БГСА-инфекцией не рекомендуется.
Таблица 1. Дозы и режим применения антибиотиков при остром БГСА-тонзиллите
Примечания:
1 — допускается применение амоксициллина в дозе 20 мг/кг 2 раза в день или 50 мг/кг 1 раз в день в течение 10 дней. Это увеличивает вероятность соблюдения пациентом врачебных назначений без ухудшения клинического и бактериологического результата терапии;
2 — с учетом узкого спектра действия феноксиметилпенициллин является оптимальным для лечения БГСА-тонзиллита, однако в настоящее время этот препарат в республике не зарегистрирован;
3 — пролонгированные пенициллины в качестве средства для лечения ангины показаны в случаях низкой комплаентности пациентов, при наличии ревматической лихорадки в анамнезе у больного или его ближайших родственников, неблагоприятных социально-бытовых условиях, вспышках БГСА-инфекции в детских дошкольных учреждениях, школах, интернатах, училищах;
4 — для эритромицина характерно наиболее частое, по сравнению в другими макролидами, развитие побочных реакций, особенно со стороны ЖКТ;
5 — схемы одобрены FDA;
6 — cогласно последним данным, ранее одобренная Фармкомитетом РФ схема (10 мг/кг/сут в 1 прием в течение 3 дней, курсовая доза 30 мг/кг) значительно уступает по бактериологической эффективности как 5-дневной схеме (12 мг/кг/сут в 1 прием в течение 5 дней, курсовая доза 60 мг/кг), так и препаратам сравнения.
Таблица 2. Дозы и режим применения антибиотиков при хроническом рецидивирующем БГСА-тонзиллите
Необходима ли сопроводительная терапия?
Другие назначения не являются обязательными. До сих пор больным рекомендуется сопроводительная терапия нестероидными противовоспалительными средствами (НПВС) и антигистаминными препаратами. Однако НПВС подавляют инфекционное воспаление, цель которого — ограничить и уничтожить инфекцию, а на развитие иммунопатологических реакций не влияют. НПВС при ангине следует назначать при сильной боли в горле (в течение первых 1–3 дней) и как жаропонижающее при высокой температуре (выше 39 °С).
Показания для назначения антигистаминных препаратов при БГСА-инфекции отсутствуют, поскольку гистамин при инфекционном процессе и иммунопатологических реакциях не играет существенной роли в развитии патологического процесса (просто является одним из многих медиаторов воспаления), а иммунные осложнения БГСА-инфекции не относятся к IgE-опосредованным. Назначение этих препаратов для профилактики медикаментозной аллергии также не показано, во-первых, потому, что препарат, вызывающий аллергию, должен быть всегда отменен, во-вторых, любые лекарственные комбинации повышают риск аллергических и токсических реакций.
Местная терапия ОТФ очень популярна в нашей стране, за рубежом не проводится, поскольку эффективность ее не доказана. Более того, обработка ватными тампонами воспаленных (с гнойным налетом) миндалин, особенно в домашних условиях, приводит к их травматизации, более глубокому проникновению инфекции, повышает риск осложнений и хронического течения. Целесообразность использования всевозможных спреев также вызывает сомнения, поскольку их экспозиция не превышает нескольких секунд: они смываются слюной и не обнаруживаются уже после первого глотка.
Популярны при ангине пастилки и таблетки для рассасывания. Они действительно облегчают боль в горле за счет анестезирующего компонента (чаще всего ментола), однако входящие в их состав антисептики, в отличие от антибиотиков, имеющих определенный спектр действия, уничтожают любую микрофлору ротоглотки и способствуют развитию дисбиоза. Аналогичным обезболивающим эффектом обладает теплое питье (чай или молоко с медом и малиной и др.).
Полоскания глотки также не рекомендуются в большинстве стран мира: при запрокидывании головы происходит раскрытие лакун, что облегчает проникновение инфекции в их глубину.
Медицинский вестник, 1,8 августа 2017