лечение гестагенами при гиперплазии эндометрия что это
Гиперплазия эндометрия – симптомы и лечение

Основная причина чрезмерного разрастания эндометрия – это повышенная выработка эстрогенов и недостаток прогестерона. Чаще всего, данная патология диагностируется у женщин в предменопаузе и у девочек- подростков. Оба состояния связаны с гормональной перестройкой организма. Для гиперплазии эндометрия характерен ановуляторный цикл – отсутствие овуляции.
Что может спровоцировать гиперплазию эндометрия?
Какие симптомы характерны для гиперплазии эндометрия?
Все эти симптомы могут сопровождать миому матки или даже выкидыш на раннем сроке, поэтому необходимо сделать УЗИ малого таза, чтобы определить причину нециклических выделений.
Способы диагностики гиперплазии эндометрия
Узи органов малого таза влагалищным датчиком определяет толщину эндометрия. Толщина эндометрия меняется на протяжении всего цикла, в период перед месячными фиксируется самое высокое значение. Для диагностики следует проводить УЗИ в первой половине цикла, обычно на 7-10 день. Толщина свыше 15 мм дает повод заподозрить патологию и направить пациентку на гистероскопию – внутреннее обследование матки гистероскопом (специальным оптическим прибором), сопровождающееся диагностическим выскабливанием эндометрия и исследование полученного материала для типирования гиперплазии. Так УЗИ дает лишь 68 процентов информативности при гиперплазии, а для гистероскопии это значение достигает 94 процентов.
Аспирационная биопсия – еще один метод диагностики, когда кусочек эндометрия, взятый из полости матки, направляется на гистологическое исследование.
В некоторых случаях гинеколог может направить пациентку на анализ крови на гормоны: эстроген и прогестерон, гормоны щитовидной железы и надпочечников.
Лечение гиперплазии.
Самым эффективным способом лечения гиперплазии эндометрия является раздельное диагностическое выскабливание. Проводится в условиях стационара, обычно под наркозом. Затем полученный эндометрий отправляется на гистологию, и в зависимости от полученного результата исследования назначается гормональное лечение.
Гормонотерапия нужна для подавления разрастания эндометрия и регулирования гормонального фона. Гормональное лечение зависит от возраста пациентки. Так женщинам до 35 лет назначают комбинированные оральные контрацептивы.
Лечение гестагенами – еще один способ гормонотерапии, подходит для лечения гиперплазии эндометрия любого типа. Спираль Мирена – это один из таких вариантов. Но существует и таблетированная форма – это назначение препаратов Утрожестан или Дюфастон.
Не следует пренебрегать гормональной терапией, так как процент рецидивов высок (полипы могут возникнуть вновь после их удаления и не один раз), а обильные кровотечения осложняются анемией.
Гиперплазия эндометрия матки
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
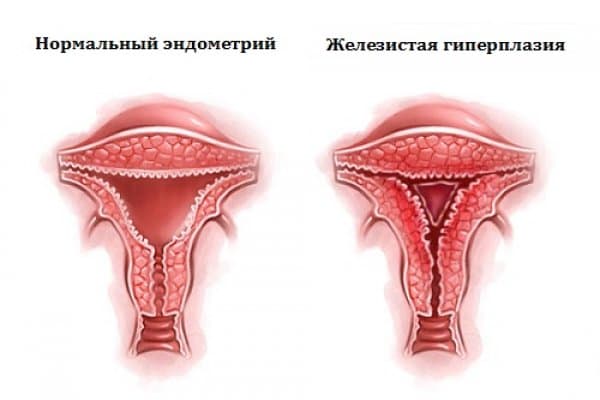
Эндометрий представляет собой нежную тонкую слизистую ткань, которая выстилает полость матки изнутри. Данная ткань каждый месяц быстро растет и утолщается под действием женских половых гормонов. В случае наступления беременности, эндометрий является «пуховой периной» на которую прикрепляется оплодотворенная яйцеклетка. При отсутствии беременности под действием гормонов эндометрий отторгается, выходит в виде менструальной крови.
Классификация гиперплазии эндометрия по локализации
Классификация гиперплазии эндометрия (по гистологической картине)
Причины гиперплазии эндометрия
В настоящее время основной причиной развития гиперплазии считается нарушение баланса женских половых гормонов, который чаще всего встречается в пубертатном периоде и перименопаузе.
Факторы риска развития гиперплазии эндометрия
Симптомы, которые встречаются при гиперплазии эндометрия
Основные из них при гиперплазии эндометрия могут быть:
Обследования, которые помогут выявить и поставить диагноз гиперплазии эндометрия
Лечение гиперплазии эндометрия
Практически в 100% случаев лечение гиперплазии эндометрия хирургическое.
Методами хирургического лечения гиперплазии эндометрия является гистероскопия и гистерорезектоскопия.
Данная операция проводится под общей анестезией. Продолжительность операции не превышает 30 минут, короткий период нахождения под общей анестезией позволяет врачам в тот же день отпустить пациентку домой.
Осложнения гиперплазии
При отсутствии должного и адекватного лечения гиперплазия эндометрия приводит к тяжелой анемии с значительным снижением уровня гемоглобина, появлению слабости, повышенной усталости, сонливости, что связано с большими потерями крови во время менструации. У молодых женщин гиперплазия эндометрия может быть причиной бесплодия и невынашивания беременности. Отдельные формы гиперплазии эндометрия (железистая и кистозная гиперплазии эндометрия) являются предраковым состоянием и в случае длительного наблюдения, при отсутствии лечения, могут переродиться в рак матки.
Профилактические мероприятия при данном заболевании необходимы для того, чтобы снизить риск развития рака эндометрия и предотвратить рецидив гиперплазии.
Гиперплазия эндометрия. Часто задаваемые вопросы
1. Что это такое? Доброкачественный процесс, который характеризуется чрезмерным разрастанием внутреннего слоя матки.
2. Из-за чего она возникает? Из-за постоянного воздействия полового гормона эстрогена на эндометрий, который вызывает его чрезмерное разрастание. Гиперэстрогения возникает из-за нарушения центральной регулиции менструального цикла, гормонопродуцирующих опухолей яичников, неправильного использования гормональных препаратов, дефицита прогестерона (гормон II фазы менструального цикла), обладающего антипролиферативным действием, так же в результате ановуляторных циклов.
3. Это распространенное заболевание? Частота встречаемости в структуре гинекологической заболеваемости 15-50%. По данным обращаемости пациенток частота встречаемости ГПЭ- 30%. В позднем репродуктивном возрасте и в перименопаузе встречается с частотой- 50%
4. Это заболевание очень опасно? Пристального внимания врачей заслуживают:
При отсутствии должного лечения гиперплазия эндометрия может приводить к серьезным маточным кровотечениям, со снижением гемоглобина крови и вытекающими отсюда последствиями.
5. Возможно ли забеременеть на фоне гиперплазии эндометрия? Ответ – нет. Гиперплазия эндометрия не возникает спонтанно, это следствие нарушений в репродуктивной системе женщины. Нарушение баланса между звеньями регуляции менструального цикла вызывает избыток эстрогенов в организме женщины, нехватку прогестерона, вследствие этого отсутствие овуляции (выхода яйцеклетки из фолликула для оплодотворения). Так же сам эндометрий структурно изменен, поэтому является неблагоприятным для имплантации (прикрепление плодного яйца к стенке матки).
7. Как диагностировать атипическую гиперплазию эндометрия? Большую информацию врач получает при опросе пациентки во время общения (возраст менархе или время наступления менопаузы, все особенности менструального цикла- его длительность, характер выделений и т.д.).
УЗ-исследование в зависимости от периода жизни женщины, а также фазы менструального цикла может дать информацию о состоянии эндометрия. По этим данным можно заподозрить проблему, однако подтвердить или опровергнуть атипию в клетках эндометрия нельзя. Только проведение гистероскопии с последующим гистологическим исследованием материала является золотым стандартом для диагностики этого состояния. Информативность метода более 90%.
8. Обязательно ли проводить выскабливание эндометрия при гиперплазии? Раздельное выскабливание цервикального канала и полости матки несет за собой лечебный и диагностический характер. Механическое удаление измененной патогенной ткани из полости матки предотвращает маточное кровотечение, что составляет лечебный эффект. Полученный соскоб отправляется на гистологическое исследование, после которого будет дано заключение о характере ткани, наличии или отсутствии признаков злокачественного поражения.
9. Возможен ли рецидив гиперплазии эндометрия? Да, возможен. Так как причиной гиперплазии эндометрия является нарушение гормонального баланса в организме женщины, то требуется обследование её гормонального фона. Для профилактики рецидива необходимо соответствующее лечение и исключение факторов риска.
Новая технология противорецидивной гормональной терапии гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста
Проведено исследование специфического связывания рецепторов прогестерона с синтетическими гестагенами у женщин позднего репродуктивного возраста. Разработана новая медицинская технология гесагенотерапии гиперпластических процессов эндометрия, позволяющая
The study on specific binding of progesterone receptors and synthetic gestogens in women of late childbearing age, was done. The new medical technology of gestogen therapy of hyperplastic processes of endometrium, which allows to reduce recurrence frequency, was developed.
.jpg)
Патогенез ГПЭ характеризуется сложным взаимодействием общих системных процессов и локальных изменений в эндометрии. В свете современных концепций в основе развития ГПЭ лежит гормональный дисбаланс, который выражается абсолютной или относительной гиперэстрогенемией [4–6]. Эндометрий является самой чувствительной тканью-мишенью половых гормонов. Исследования последних лет показали, что ведущую роль в развитии ГПЭ играет чувствительность слизистой оболочки матки к стероидным гормонам [2, 7–9]. Для противорецидивной терапии ГПЭ применяют гормональные препараты, состав и дозу которых выбирают в зависимости от результатов гистологического исследования соскоба эндометрия, сочетанных гинекологических и соматических заболеваний, возраста женщины и индивидуальной переносимости препарата. В практическом здравоохранении у пациенток позднего репродуктивного возраста наиболее часто используются синтетические гестагены. Однако, по литературным данным, отсутствие эффекта от гестагенотерапии при ГПЭ варьирует от 25,9% до 78,0% [6, 10].
Резервом повышения эффективности терапии ГПЭ является индивидуальный выбор препаратов. Для осуществления персонализованного подбора гормональной терапии мы предложили использовать силу связывания препарата с рецепторами прогестерона из ткани эндометрия конкретной пациентки. Данное предположение основано на тезисе, что сила связывания лиганда с рецептором определяет эффект от лечения, то есть чем выше связывание гестагенов с прогестерон-связывающими участками, тем лучший эффект ожидается от лечения.
С целью проверки данной гипотезы на кафедре молекулярной фармакологии и радиобиологии им. академика П. В. Сергеева ГБОУ ВПО РНИМУ им. Н. И. Пирогова совместно с МОНИИАГ было проведено исследование специфического связывания рецепторов прогестерона с синтетическими гестагенами у женщин позднего репродуктивного возраста с гиперпластическими процессами эндометрия. Проведенные в отделении гинекологической эндокринологии исследования показали, что выбор гестагена с учетом индивидуальной чувствительности эндометрия к препарату позволил значительно снизить частоту рецидивов железистой гиперплазии эндометрия [4, 5, 7]. По результатам исследования была разработана новая медицинская технология и получен патент на изобретение «Способ гестагенотерапии гиперпластических процессов эндометрия» [11].
Материал и методы исследования
В исследование вошли 164 женщины позднего репродуктивного возраста. Критериями включения в исследование явились: наличие ГПЭ (простой железистой гиперплазии и/или железистых полипов эндометрия), отсутствие тяжелой соматической патологии и выраженных метаболических нарушений, препятствующих проведению противорецидивной гормональной терапии.
Клинические методы исследования включали общее стандартное гинекологическое обследование женщин: осмотр шейки матки в зеркалах, влагалищное бимануальное исследование, трансвагинальное ультразвуковое сканирование органов малого таза (на 5–8 день менструального цикла), мазок на флору и ЗППП. Ультразвуковое сканирование органов малого таза у пациенток позднего репродуктивного возраста проводилось на базе НКО МОНИИАГ, аппаратом Siemens Sequoia 512 с использованием вагинального датчика от 6 до 8 мГц, в режиме двухмерной визуализации.
Ткань эндометрия для определения цитозольных рецепторов половых стероидов получали во время выскабливания стенок полости матки при использовании серийного аппарата Circon Acmi на базе эндоскопического отделения МОНИИАГ или путем эндорам-биопсии.
Уровень рецепторов прогестерона и специфическое связывание стандартных гестагенов с прогестерон-связывающими участками определяли в цитозоле биоптатов эндометрия по методу [12].
Цитозольную фракцию получали стандартным методом с помощью ультрацентрифугирования (105 000 g, ультрацентрифуга UP-65 M, 60’). Уровень рецепторов прогестерона (РП) и специфическое связывание гестагенов с прогестерон-связывающими участками определяли в цитозоле биоптатов эндометрия радиолигандным методом [13].
Белок определяли методом Лоури.
Статистическую обработку материала проводили на персональном компьютере, в работе использовалась программа GraphPad Prism 5.0 и стандартные методы статистического анализа.
Результаты и обсуждение
Из 136 обследованных пациенток с ГПЭ 73 (54%) были с рецидивирующим течением (в анамнезе от 1 до 6 раздельных диагностических выскабливаний (РДВ) слизистой стенок матки и цервикального канала), у остальных 63 женщин (46%) гиперплазия эндометрия была выявлена впервые.
В контрольную группу вошли 28 женщин (без измененного эндометрия), в группу с ГПЭ вошли 73 пациентки, при гистологическом исследовании у 51 (37,5%) пациентки были диагностированы железистые полипы эндометрия, а у 85 — простая железистая гиперплазия эндометрия.
У пациенток с ГПЭ в 112 случаях (82%) были гормонзависимые заболевания гениталий (миома матки и/или эндометриоз различной локализации), 58% обследуемых женщин имели избыточную массу тела (ИМТ ≥ 25).
37 (27,2%) пациенткам с ГЭ проводили гистероскопию с РДВ во II фазу менструального цикла в условиях МОНИИАГ. 99 (73%) женщинам РДВ с или без гистероскопии было проведено по месту жительства.
Уровень РП в эндометрии изменялся в зависимости от нозологической формы гиперплазии. Так, при полипах эндометрия средняя величина этого параметра снизилась в 1,4 раза по сравнению с нормой и составила в среднем 16,9 ± 3,7 фмоль/мг белка, а при железистой гиперплазии эндометрия — в 1,2 раза и равнялась 19,2 ± 5,6 фмоль/мг белка (р ≤ 0,05).
В качестве тестируемых гестагенов использовались: медроксипрогестерона ацетат, норэтистерон, дидрогестерон. Приведенные гестагены выбраны по принципу различий структуры и наличия доступных лекарственных форм. Уровень рецепторов прогестерона в цитозоле эндометрия, как и сила специфического связывания с гестагенами, варьировали в широких пределах. При этом усредненные данные показали, что наибольшую силу связывания продемонстрировал медроксипрогестерона ацетат (64,6 ± 7,2 при полипах эндометрия и 73,8 ± 5,2 при гиперплазии (р ≤ 0,001)), наименьшую — норэтистерон (52,7 ± 4,1 при полипах эндометрия и 60,3 ± 2,6 при гиперплазии (р ≤ 0,001)).
При исследовании были выделены следующие группы: контрольная группа (I группа) — 28 пациенток; женщины с рецидивирующим течением ГПЭ, которым была назначена гормональная противорецидивная терапия по методу слепой выборки (II группа) — 41 пациентка; женщины с рецидивирующим течением ГПЭ, которым назначалась гормональная противорецидивная терапия с учетом результатов связывающей активности гестагенов с прогестерон-связывающими участками (III группа) — 32 пациентки.
II группе была назначена гормональная противорецидивная терапия с использованием препаратов, в состав которых входят тестируемые гестагены. Эффективность терапии пациенток данной группы (отсутствие рецидивов в течение 6 месяцев по окончании лечения) сравнивали с результатами индивидуального тестирования аффинитета рецепторов прогестерона, полученных из эндометрия пациенток до начала лечения.
III группе была назначена гормональная терапия с учетом результатов связывающей активности гестагенов с прогестерон-связывающими участками цитозоля эндометрия конкретной пациентки.
Все пациентки, имеющие рецидивирующее течение заболевания, получали:
Оценка эффективности гормональной терапии проводилась по клиническим симптомам, а также по результатам трансвагинального ультразвукового сканирования органов малого таза на 3-м и 6-м месяцах гормональной терапии. Ультразвуковое исследование проводили на 4–8 день менструального цикла, толщина эндометрия считалась нормальной при значениях 0,3–0,6 см, если же она превышала данные значения, то проводилась гистероскопия для уточнения диагноза.
В результате клинико-лабораторного исследования показано, что во II группе частота рецидивов составила 17,1%, в то время как в III группе частота рецидивов составила 6,3%.
Сравнительный анализ противорецидивной эффективности синтетических гестагенов в проведенном исследовании показал, что количество рецидивов при использовании норэтистерона было максимально и составило 18 через 3 месяца во II группе, тогда как при терапии медроксипрогестерона ацетатом рецидивов обнаружено не было через 3 и 6 месяцев.
Выводы
Таким образом, нами рекомендуется алгоритм проведения персонализированной противорецидивной гормональной терапии по схеме, представленной на рис. 2.
Медико-социальная эффективность
Снижение частоты рецидивов гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста ведет к:
Таким образом, предложенная медицинская технология представляет собой подбор индивидуальной гормональной терапии гиперпластических процессов эндометрия на основании индивидуальной оценки связывающих свойств рецепторов прогестерона эндометрия.
Работа выполнена в рамках программы развития НИУ ГБОУ ВПО РНИМУ им Н. И. Пирогова, 2010–2019, приоритетное направление развития ПНР-2, персонализированная медицина.
Литература
В. И. Краснопольский*, доктор медицинских наук, профессор, член-корреспондент РАМН
Н. Д. Гаспарян*, доктор медицинских наук, профессор
Л. С. Логутова*, доктор медициинских наук, профессор
Е. Н. Карева**, доктор медицинских наук, профессор
О. С. Горенкова*, кандидат медицинских наук
Д. А. Тихонов**
*ГБУЗ Московской области МОНИИАГ,
**ГБОУ ВПО РНИМУ им. Н. И. Пирогова, Москва
Использование внутриматочной терапевтической системы в лечении рецидивирующих гиперпластических процессов эндометрия
Эндометрий — внутренняя функционально-активная оболочка матки, претерпевающая циклические изменения во время менструального цикла. Так в первой фазе естественного цикла (пролиферация, разрастание эндометрия в матке) активную роль в изменениях играют эстрогены, готовя эндометрий к приему яйцеклетки и возможной беременности. Затем, на этапе секреции (созревания), возрастает значение (и уровень) прогестерона, который стремительно снижается (если беременность не наступила) при десквамации (отторжении), когда наросший слой отторгается, и вместе с неоплодотворенной яйцеклеткой удаляется из организма.
Эндометрий чутко реагирует на изменения гормонального фона, на любые гормональные колебания, возникающие под воздействием как эндогенных, так и экзогенных ятрогенных факторов.
Гиперплазия эндометрия (ГЭ) — это одна из форм патологических пролиферативных изменений эндометрия. Она сопровождается структурной перестройкой железистого и в меньшей степени стромального компонентов эндометрия. 1 Состояние, при котором нарушено нормальное восстановление функционального слоя эндометрия.
Ведущий симптом этой патологии – аномальные маточные кровотечения, включая обильные маточные кровотечения, межменструальные кровотечения, нерегулярные кровотечения, ациклические кровотечения на фоне МГТ, постменопаузальные кровотечения. Однако в 10-30% течение ГЭ бессимптомное. 1
С позиции патогенеза, гиперплазия эндометрия – результат длительного воздействия избыточного уровня эстрогенов на эндометрий. На раннем этапе этот процесс обратим, гистология показывает нерезкое расширение желез на фоне нормального пролиферативного эндометрия («пролиферативный эндометрий с нарушениями»). Клинически это нарушение соответствует ановуляции. 5
На фоне длительного влияния высокого уровня эстрогенов (без воздействия прогестерона) развивается доброкачественная эндометриальная гиперплазия – непостоянная плотность расположения желез по всему объему; появление фокусов эндометрия (в них объем желез превышает объем стромы). Дальнейшее отсутствие компенсаторных эффектов прогестерона приводит к увеличению количества желез и объема стромы, появлению кистозных желез, развитию трубной метаплазии, образованию фибриновых тромбов в мелких сосудах и в конечном счете, – к реактивным изменениям. 5
В последние годы эксперты международных медицинских сообществ разработали рекомендации по ведению пациенток с гиперпластическими процессами эндометрия с учетом новой классификации ВОЗ (2014). Подходы к лечению таких пациенток у зарубежных и отечественных специалистов вполне сопоставими. 1, 6-8
Согласно рекомендациям, после подтверждения диагноза «доброкачественная гиперплазия эндометрия» и проведения оценки факторов риска врач назначает пероральные прогестины (ПП) в непрерывном режиме или содержащую левоноргестрел внутриматочную систему (ЛНГ-ВМС).
Многие врачи в качестве терапии первой линии считают более предпочтительной ЛНГ-ВМС –из-за более выраженного антипролиферативного эффекта, объясняемого тем, что при ее использовании локальное повышение концентрации левоноргестрела в эндометрии более значимо. 9 Это подтверждают и данные мета-анализа: ЛНГ-ВМС по сравнению с ПП более эффективно подавляет пролиферативную активность в эндометрии через 3, 6, 12 и 24 месяца лечения. Относительный риск (ОР) при 95%-ном доверительном интервале (ДИ) составляет 2,30 (1,39–3,82), 3,16 (1,84–5,45), 5,73 (2,67–12,33) и 7,46 (2,55–21,78) соответственно. Более того, у пациенток, применявших ЛНГ-ВМС, реже отмечаются нерегулярные кровяные выделения и побочные эффекты терапии. И им реже требовалось проведение гистерэктомии. 6
Авторов предлагаемого исследования заинтересовали возможности применения внутриматочной терапевтической системы, высвобождающей левоноргестрел – мирена, эффективность и безопасность ее применения при терапии пациенток с гиперпластическими процессами эндометрия.
Актуальность
В клинической практике врачи акушеры-гинекологи часто сталкиваются с ситуациями, когда имеются противопоказания к назначению гормональных препаратов прогестеронового ряда или продолжение гормонотерапии невозможно. Неоднократное рецидивирование гиперпластических процессов эндометрия в таких случаях приводит к необходимости повторных диагностических выскабливаний или переходу на более агрессивные хирургические вмешательства: аблацию эндометрия, термачойс, хирургическое удаление органа. Проблемы поиска эффективных органосохраняющих методов лечения ГЭ остаются актуальными, а решения – востребованными.
Цель исследования
Оценка эффективности использования внутриматочного контрацептивного гормонсодержащего средства мирена в ходе реабилитации женщин, страдающих доброкачественными формами рецивирующей гиперплазии эндометрия.
Материал и методы исследования
Нами было проведено клинико-инструментальное обследование и наблюдение 91 женщины (в возрасте от 35 до 48 лет). анамнезе этих пациенток не менее двух раз имела место железистая и железисто-кистозная гиперплазия эндометрия (простая гиперплазия без атипии) с повторным выскабливанием полости матки в течение последних двух лет. Из них 56 человек принимали гестагены (норколут, оргаметрил, дюфастон) в стандартных дозах на протяжении 2-7 месяцев.
При этом у 31 из них назначенная гормонотерапия была отменена через 2-3 месяца – в связи с развитием осложнений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы. У 4 пациенток на фоне приема гестагенов наступил рецидив ГЭ, а 21 женщина прекратила прием препаратов в течение 3 месяцев без объяснения причины. Часть женщин (35 человек) основной группы ранее получали только негормональное лечение и физиотерапию из-за наличия экстрагенитальной патологии.
Для оценки состояния эндометрия использовалось ультразвуковое исследование гениталий (М-эхо), гистероскопия с прицельной биопсией.
Результаты и их обсуждение
Из 91 женщины у 3-х произошла экспульсия спирали. У 2-х на УЗИ отмечалась неоднородность эндометрия с его толщиной 10-11 мм, в связи с чем была сделана гистероскопия с прицельной биопсией с сохранением ВМС в полости матки и поставлено гистологическое заключение «децидуальная трансформация ткани эндометрия». У 86 пациенток при УЗИ был диагностирован однородный эндометрий шириной 2-10 мм.
Из 12 женщин контрольной группы у 5 отмечался рецидив ГЭ, у 1 – атипическая ГЭ, 3 пациентки подверглись радикальному хирургическому вмешательству, у 3 остальных клинических данных за патологию эндометрия не выявлено.
Положительный результат использования препарата, на наш взгляд, объясняется высокой концентрацией левоноргестрела, который выделяется из депо и воздействует на рецепторный аппарат эндометрия при минимальном влиянии на другие органы и ткани, что приводит к положительным структурным изменениям, предотвращая рецидивирование и прогрессирование патологии.
Вывод
ЛНГ-ВМС главным образом оказывает местное гестагенное действие. Действующее вещество (левоноргестрел) высвобождается непосредственно в полость матки, это позволяет применять его в крайне низкой суточной дозе. Терапевтическая концентрация гестагена в эндометрии способствует снижению чувствительности его рецепторов (эстрогеновых и прогестероновых) и делает эндометрий невосприимчивым к эстрадиолу, оказывает сильное антипролиферативное действие. При применении ЛНГ-ВМС наблюдаются морфологические изменения эндометрия и слабая местная реакция на присутствие в матке инородного тела.
Рекомендуется использование ЛНГ-ВМС в лечении пациентов, страдающих доброкачественными формами гиперпластических процессов эндометрия.
_575.gif)
.gif)