левофлоксацин или ципрофлоксацин что эффективнее при мочеполовых инфекциях
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
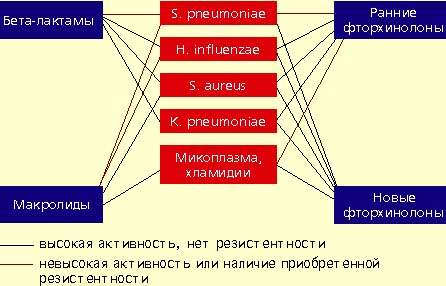 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Опыт применения нового фторхинолона моксифлоксацина (Авелокс) в урологической практике
Опубликовано в журнале:
Фарматека №1, 2003 И. И Деревянко
НИИ урологии МЗ РФ, Москва
Лечение инфекций мочевыводящих путей по-прежнему представляет собой значительные трудности. В первую очередь, это связано с различными осложняющими факторами, важнейшими из которых являются обструктивные уропатии, пожилой и старческий возраст большинства урологических больных, многочисленные сопутствующие заболевания.
Поиск более эффективных средств борьбы с возбудителями бактериальных инфекций осуществляется как с помощью совершенствования известных методов, так и путем создания новых антибактериальных препаратов.
В ряду современных антибактериальных средств фторхинолоны являются высокоэффективными антимикробными средствами, нашедшими широкое применение в терапии различных инфекций, в т.ч. и тяжелых форм инфекций моче выводящих путей, вызванных грамотрицательными аэробными бактериями. Накоплен значительный опыт лечения урологических инфекций ципрофлоксацином, офлоксацином, пефлоксацином и ломефлоксацином. В последние годы в арсенал врача вошли так называемые «новые» фторхинолоны, к числу которых относится моксифлоксацин.
Моксифлоксацин обладает широким спектром антимикробной активности, охватывающим практически все значимые уропатогены (табл. 1).
Таблица 1. Спектр антимикробной активности моксифлоксацина
in vitro
| Микроорганизмы | МПК90, мг/л |
| Escherichia coli | 0,016 |
| Klebsiella pneumoniae | 0,13 |
| Serratia marcescens | 0,25 |
| Enterobacter spp. | 0,06 |
| Citrobacter f reundii | 0,06 |
| Proteus mirabilis | 0,25 |
| Proteus vulgaris | 0,5 |
| Morganella morganii | 0,13 |
| Providentia rettgeri | 0,5 |
| Pseudomonas aeruginosa | 0,5-128 |
| Staphylococcus aureus | 0,06 |
| Staphylococcus saprophyticus | 0,125 |
| Staphylococcus epidermidis | 0,13 |
| Enterococcus faecalis | 1,0 |
| Neisseria gonorrhoeae | 0,03 |
| Mycoplasma hominis | 0,06 |
| Mycoplasma pneumoniae | 0,12 |
| Ureaplasma urealyticum | 0,25 |
| Chlamydia trachomatis | 0,12 |
| Chlamydia pneumoniae | 0,12 |
Моксифлоксацин, как и другие фторхинолоны, проявляет высокую активность в отношении грамотрицательных микробов семейства Enterobacteriacea, сопоставимую с таковой офлоксацина. Сравнение моксифлоксацина с ципрофлоксацином и новыми фторхинолонами (гатифлоксацин, грепафлоксацин, левофлоксацин и тровафлоксацин) показало, что ципрофлоксацин является наиболее активным препаратом в отношении Enterobacteriaceae с колебаниями МПК90 от моксифлоксацина для P. aeruginosa (0,5-128 мг/л) была сопоставима с таковой гатифлоксацина и грепафлоксацина, но ниже, чем у тровафлоксацина и клинафлоксацина.
По активности в отношении грамположительных микроорганизмов моксифлоксацин в 2-20 раз превосходит офлоксацин, один из наиболее активных фторхинолонов в отношении грамположительной микрофлоры in vitro. МПК90 моксифлоксацина для подавляющего большинства грамположительных микробов не превышает 0,25 мг/л. Препарат менее активен в отношении коагулазонегативных и золотистого стафилококков, резистентных к метициллину и оксациллину.
Моксифлоксацин высокоактивен в отношении чувствительных к метициллину клинических штаммов S. aureus и S. Epidermidis, превосходя по этому показателю многие «старые» фторхинолоны. Хотя активность моксифлоксацина в отношении метициллинрезистентных штаммов ниже, чем в отношении метициллинчувствительных, по воздействию на последние он превосходит другие фторхинолоны (офлоксацин, левофлоксацин, спарфлоксацин) и кларитромицин.
Менее активен моксифлоксацин в отношении энтерококков: МПКя> для Е. faecalis, по данным разных авторов, составляет от 0,25 до 16 мг/л.
Отмечается, что по антимикробному действию на атипичные микроорганизмы моксифлоксацин превосходит ко-амоксиклав, цефуроксим, офлоксацин, ципрофлоксацин, левофлоксацин, ломефлоксацин, миноциклин, эритромицин, азитромицин и доксициклин. В отношении хламидий моксифлоксацин по антимикробному действию сравним с гатифлоксацином, грепафлоксацином и тровафлоксацином.
В нашем исследовании моксифлоксацина принимали участие 46 пациентов с различными неосложненными (п = 22) и осложненными (п = 24) инфекциями мочевыводящих путей. Более подробно характеристика больных представлена в таблице 2.
Таблица 2. Распределение урологических больных, лечившихся моксифлоксацином (Авелокс, Bayer)
| Нозологические формы | Число больных | Осложняющие факторы | |||||||||||||||||||||
| Неосложненный пиелонефрит | 20 | ||||||||||||||||||||||
| Осложненный пиелонефрит | 15 | Мочекаменная болезнь, нефроптоз, нейрогенный мочевой пузырь, гидронефроз, ХПН*, сморщенная почка | |||||||||||||||||||||
| Неосложненный цистит | 2 | ||||||||||||||||||||||
| Осложненный цистит | 3 | Нейрогенный мочевой пузырь, стрессовое недержание мочи | |||||||||||||||||||||
| Простатит (острый и обострение хронического) | 6 | Доброкачественная гиперплазия простаты, цистостома | |||||||||||||||||||||
| Виды микроорганизмов | Количество культур |
| Escherichia coli | 9 |
| Serratia marcescens | 6 |
| Proteus mirabilis | 5 |
| Enterobacter agglomerans | 3 |
| Pseudomonas aeruginosa | 1 |
| Staphylococcus aureus | 3 |
| Staphylococcus epidermidis | 18 |
| Staphylococcus saprophyticus | 4 |
| Streptococcus spp. | 2 |
| Enterococcus faecalis | 5 |
| Итого | 56 |
С помощью проведенной терапии удалось элиминировать 48 культур из 56. Таким образом, бактериологическая эффективность лечения моксифлоксацином составила 85,7%.
Необходимо отметить, что в процессе лечения моксифлоксацином ни у одного из больных не было отмечено развития нежелательных побочных эффектов.
ЗАКЛЮЧЕНИЕ
Таким образом, результаты проведенного нами исследования свидетельствуют, что фторхинолон нового поколения моксифлоксацин является высокоэффективным средством лечения инфекций мочевыводящих путей.
Препарат обладает широким спектром антимикробной активности, охватывающим грамотрицательные и грам-положительные аэробные бактериии, атипичные микроорганизмы.
При лечении пиелонефрита, цистита и простатита клиническая эффективность моксифлоксацина составила 95,7%, бактериологическая эффективность-85,7%.
Превосходство моксифлоксацина над «старыми» фторхинолонами обеспечивается и выгодным сочетанием его фармакокинетических свойств:
Учитывая все вышеизложенное, моксифлоксацин может рекомендоваться для широкого применения в качестве высокоэффективного и безопасного средства терапии инфекций мочевыводящих путей.
РЕФЕРАТ
Опыт применения нового фторхинолона моксифлоксацина (Авелокс) в урологической практике
Левофлоксацин в лечении инфекции мочевыводящих путей
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
И нфекция мочевыводящих путей (ИМП) является одной из наиболее актуальных проблем современной урологии. Неадекватная терапия данного состояния часто приводит к возникновению бактериемии и сепсиса. В США ИМП является причиной обращения к врачу 7 млн пациентов в год, а у 1 млн – госпитализации [1].
Лечение инфекции мочевых путей подразумевает проведение эффективной и своевременной антибактериальной терапии при условии восстановления нормальной уродинамики, и преследует цель профилактики уросепсиса и возникновения рецидивов. Препаратами выбора для лечения ИМП во всем мире являются антибактериальные препараты группы фторхинолонов [1].
Дополнительной проблемой, значительно усложняющей лечение ИМП, является высокая устойчивость микроорганизмов к большинству антибактериальных препаратов, длительно применяющихся в урологической практике. Госпитализм, неадекватные по длительности курсы лечения и некорректное назначение лекарственных препаратов приводят зачастую к возникновению антибиотико–устойчивых штаммов. Появление нового эффективного препарата для лечения ИМП является значительным событием и привлекает пристальное внимание врачей.
Левофлоксацин (ЛФ) – новый антимикробный препарат группы хинолонов – представляет собой L–изомер офлоксацина. Поскольку на левофлоксацин приходится практически вся противомикробная активность в рацемической смеси изомеров, его активность in vitro в два раза превышает активность офлоксацина. Оба препарата проявляют сходный уровень токсичности в эксперименте на животных, что позволяет ожидать большей эффективности от применения левофлоксацина за счет более низкого уровня побочных эффектов. ЛФ предназначен для терапии инфекционно–воспалительных процессов, вызванных чувствительными к ЛФ микроорганизмами. Исследования последних лет продемонстрировали хорошую эффективность ЛФ при лечении осложненной и неосложненной урогенитальной инфекции. Фармакокинетика ЛФ сходна с таковой у офлоксацина: период полувыведения составляет приблизительно 6–7 ч, а максимальная концентрация в сыворотке крови достигается через 1,5 ч после приема внутрь. Механизм действия ЛФ сходен с таковым у всех фторхинолонов и заключается в ингибировании бактериальной топоизомеразы-4 и ДНК–гиразы – ферментов, отвечающих за репликацию, транскрипцию и рекомбинацию ДНК микробной клетки.
ЛФ обладает широким спектром антимикробной активности. ЛФ воздействует in vitro на следующие инфекционные агенты:
• аэробные грамположительные: Streptococcus agalactiae, Staphylococcus aureus and saprophyticus, Enterococcus faecalis, Streptococcus pneumoniae, Streptococcus pyogenes;
• аэробные грамотрицательные: Enterobacter cloacae, Escherichia coli, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae, Legionella pneumophila, Moraxella catarrhalis, Proteus mirabilis, Pseudomonas aeruginosa;
• другие микроорганизмы: Chlamydia pneumoniae, Mycoplasma pneumoniae.
Устойчивость к ЛФ, связанная со спонтанными мутациями, in vitro встречается сравнительно редко. Несмотря на наличие перекрестной устойчивости между ЛФ и другими фторхинолонами, некоторые микроорганизмы, устойчивые к хинолонам, могут быть чувствительными к ЛФ.
ЛФ противопоказан лицам с гиперчувствительностью к ЛФ или другим хинолоновым препаратам (их компонентам). В настоящее время воздействие ЛФ на детей, подростков, беременных и кормящих матерей не изучено.
Наиболее часто встречающимися побочными эффектами являются тошнота (1,3%), диарея (1,1%), головокружение (0,4%) и бессонница (0,3%). Все вышеуказанные эффекты дозозависимы и быстро исчезают после снижения дозы или отмены препарата.
Удобство применения ЛФ – один раз в день – является еще одним преимуществом этого препарата. Анализ научных публикаций, посвященных исследованиям эффективности и переносимости ЛФ, позволяет более четко представить его отличия от других хинолонов [2].
G. Richard et.al. изучали эффективность и безопасность применения ЛФ в дозе 250 мг 1 раз в день в сравнении с ципрофлоксацином в дозе 500 мг дважды в день в течение 10 дней в лечении 385 пациентов, страдающих от проявлений ИМП в рамках рандомизированного двойного слепого мультицентрового исследования. Всем больным перед началом лечения выполняли бактериологическое исследование мочи, по данным которого у всех пациентов выявлен рост патогенной микрофлоры и микробное число составило і105 микробных тел в 1 мл мочи. Клиническое выздоровление отмечено у 92% пациентов, получавших ЛФ, и 88% пациентов, получавших ципрофлоксацин. Побочные эффекты отмечены у 4 и 3% пациентов соответственно. Авторы делают вывод о том, что эффективность и безопасность терапии ЛФ сравнима с таковой при использовании ципрофлоксацина [3].
Y. Kawada et al. сравнивали эффективность ЛФ в дозе 100 мг дважды в день (135 пациентов) и офлоксацина в дозе 200 мг дважды в день (126 пациентов) в терапии пациентов с осложненной мочевой инфекцией. Положительный клинический результат получен у 83,7% пациентов в группе ЛФ и у 79,4% пациентов в группе офлоксацина. Указанные различия были статистически недостоверны. Побочные эффекты отмечены у 4,9% пациентов в группе офлоксацина. В группе ЛФ подобных эффектов отмечено не было, что, по мнению авторов, говорит о лучшей переносимости препарата [4].
Не выявили существенной разницы в эффективности и переносимости ЛФ и других хинолонов в рандомизированном двойном слепом исследовании G. Richard et al. Они использовали ЛФ в дозе 250 мг 1 раз в день и офлоксацин в дозе 200 мг дважды в день у 581 пациента с неосложненной ИМП. Клиническое улучшение или излечение отмечено у 98,1% пациентов в группе ЛФ и у 97% пациентов в группе офлоксацина [5].
В другом своем исследовании G. Richard, I. Klimberg et al. сравнивали эффективность и переносимость ЛФ, ципрофлоксацина и ломефлоксацина при лечении 259 пациентов с острым пиелонефритом в течение 10 дней. При одинаковой эффективности авторы отмечают значительно более низкий уровень побочных эффектов при лечении ЛФ по сравнению с другими препаратами (гастроинтестинальные расстройства у 2 больных и явления вагинита у 1) [6].
Интересное, на наш взгляд, исследование выполнили I. Klimberg et.al. Они изучали эффективность и переносимость ЛФ и ломефлоксацина в лечении осложненной мочевой инфекции. После рандомизации пациенты получали терапию указанными препаратами в стандартной дозировке в течение 7–10 дней. При этом у 461 пациента оценивалась безопасность и у 336 из них – микробиологическая эффективность. Средний уровень элиминации патогенов в группе ЛФ составил 95,5%, а в группе ломефлоксацина – 91,7%. Побочные эффекты отмечены, соответственно, у 2,6 и 5,2% пациентов. При этом в группе ломефлоксацина чаще встречались фотосенсибилизация и головокружение, а в группе ЛФ – тошнота. Шесть пациентов в каждой группе испытали различные гастроинтестинальные расстройства. Авторы утверждают, что эффективность ЛФ приблизительно одинакова с другими хинолонами, тогда как переносимость ЛФ несколько лучше [7].
Таким образом, левофлоксацин является новым антимикробным препаратом, применяемым для лечения инфекционно–воспалительных процессов в верхних и нижних мочевыделительных путях. Несмотря на то, что эффективность препарата близка к эффективности других хинолонов, очевидными приемуществами ЛФ являются низкий уровень побочных эффектов и возможность однократного приема в сутки. Существование внутривенной формы препарата позволяет более эффективно использовать его при лечении осложненной мочевой инфекции.
Материалы и методы
Нами было предпринято исследование эффективности ЛФ у пациентов с осложненной инфекцией мочевых путей. ЛФ был назначен 20 пациентам (19 женщин и 1 мужчина) в возрасте от 24 до 56 лет (средний возраст 41,3 лет) с осложненной ИМП, наблюдавшимся на кафедре урологии МГМСУ и в КДЦ ГКБ № 50. У 19 пациентов имело место обострение хронического пиелонефрита и хронического цистита. Одному пациенту препарат был назначен после контактной уретеролитотрипсии в связи с развитием инфекционно–воспалительных осложнений. ЛФ назначали в дозе 250 мг в сутки в течение 10 дней.
В исследование включали пациентов с ИМП на начальных стадиях развития воспаления, не принимавших до начала исследования антибактериальных препаратов.
Критерием включения было наличие хотя бы одного клинического симптома (озноб, боль в поясничной области, дизурия, боль в надлонной области, тошнота, рвота) в сочетании с микробиологическими критериями:
• число лейкоцитов в моче более 10 в поле зрения;
• число колониеобразующих единиц возбудителя >104;
• чувствительность к ЛФ по данным пробы с дисками.
До начала приема препарата все пациенты проходили обычное урологическое обследование, включающее посев мочи на флору с определением чувствительности к антибиотикам, общий анализ мочи, клинический и биохимический анализы крови, ультрасонографический мониторинг (УЗИ), рентгено-урологическое обследование. Ни у одного из обследованных не было признаков нарушения пассажа мочи по верхним мочевым путям.
Анализ результатов проводили на основании субъективной оценки эффективности лечения пациентами и врачом, а также динамики объективных исследований: анализов крови и мочи, картины УЗИ, посевов мочи, выполнявшихся до начала лечения, на 3, 10 и 17-е сутки лечения.
Отсутствие клинического эффекта от лечения определялось, как сохранение или усиление клинических проявлений в любое время после 3 дней лечения.
Группу сравнения составили 23 пациентки (средний возраст 38,7 лет) с острым пиелонефритом, которым проводилась терапия ципрофлоксацином по 1,0 г в сутки.
В группе ципрофлоксацина у 70% больных отмечена очень хорошая эффективность лечения, у 18% – хорошая. У 3 пациенток (12%) терапия ципрофлоксацином оказалась неэффективной, что выражалось в сохранении выраженной гипертермии и локальной болезненности в поясничной области. Двое из них были прооперированы в связи с развитием гнойного воспаления: им была выполнена ревизия почки, декапсуляция и нефростомия.
Основными жалобами пациентов были боли в поясничной области со стороны пораженного органа, озноб, учащенное болезненное мочеиспускание, слабость – все эти жалобы были связаны с активным воспалительным процессом в верхних и нижних мочевых путях. К окончанию лечения чувствовали себя удовлетворительно и не предъявляли жалоб все пациенты, получавшие левофлоксацин, и 88% пациентов, получавших ципрофлоксацин.
Ультразвуковой мониторинг размеров почек и толщины почечной паренхимы, проводившийся на протяжении исследования в основной группе, зафиксировал положительную динамику: увеличение размеров пораженной воспалительным процессом почки и локальное утолщение паренхимы регрессировали к 10–17 дню лечения у всех пациентов.
Имевшая место болезненность при пальпации поясничной области на стороне поражения также регрессировала у всех пациентов к концу исследования.
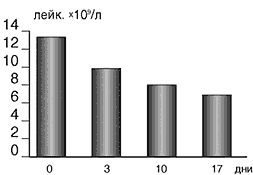
Мониторинг культурального исследования мочи на фоне терапии ЛФ выявил положительную динамику, выразившуюся в прогрессивном снижении степени бактериурии, а к 10–17 дню терапии посев мочи оказался стерильным. При лечении ЛФ регрессировали воспалительные изменения со стороны периферической крови. Это выразилось в нормализации количества лейкоцитов (рис. 1) и исчезновении палочкоядерного сдвига формулы крови.
Рис. 1. Динамика числа лейкоцитов крови при лечении ЛФ
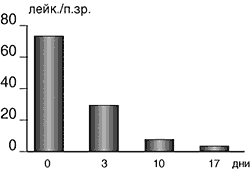
У всех больных основной группы с острым воспалительным процессом в верхних мочевых путях до лечения имелась выраженная лейкоцитурия, регрессировавшая к 10–17 дню, что подтверждено контрольными анализами мочи (рис. 2).
Рис. 2. Динамика числа лейкоцитов в анализе мочи при лечении ЛФ
У пациентов группы сравнения, закончивших исследование, также наблюдалась нормализация формулы крови, однако снижение лейкоцитоза крови было менее значительным (в среднем до 7,8х109), а лейкоцитурия оставалась на уровне 6–10 лейкоцитов в поле зрения.
На фоне лечения ЛФ на 3–10 день от начала лечения у 6 пациентов (30%) отмечены побочные реакции в виде тошноты, и у 3 из них (15%) – эпизоды диареи. Следует отметить, что эти явления были незначительными. К концу исследования жалобы на тошноту предъявляли 3 пациента, длительное время страдающие хроническим гастритом. Ни одному из пациентов не потребовалось проведение специального лечения в связи с вышеуказанными побочными реакциями, и ни один из них не отказался от проводимой терапии.
В группе ципрофлоксацина побочные реакции в виде тошноты и диареи, не потребовавшие отмены препарата, отмечены у 18% пациентов.
Согласно полученным нами данным, эффективность и безопасность лечения ЛФ были признаны хорошими и очень хорошими у 95% пациентов. Аналогичные результаты приводят в своих работах G. Richard, C. DeAbate et.al., применявшие препарат по аналогичной схеме и получившие клинический эффект у 98,1% пациентов [5]. Kondo K. et al. сообщают о 100% эффективности лечения левофлоксацином [8]. Столь высокие результаты объясняются непродолжительностью применения левофлоксацина в урологической практике, обусловливающей отсутствие устойчивых к его действию штаммов микроорганизмов. Надо отметить, что устойчивость к препаратам этой фармакологической группы, связанная со спонтанными мутациями in vitro, встречается крайне редко [1].
Эффективность терапии левофлоксацином у больных с острым пиелонефритом в исследовании G. Richard et al. составила 92%, в то время как в группе сравнения, где проводилось лечение ципрофлоксацином, она была несколько ниже и равнялась 88%. При этом количество побочных эффектов, зафиксированных на фоне лечения и выражавшихся в различной интенсивности диспепсических явлениях, составило в группе левофлоксацина 2%, а в группе ципрофлоксацина – 8% [3].
Согласно нашим данным, бактериологическое исследование мочи на 10-е сутки приема и через 7 дней после прекращения лечения показало отсутствие бактериурии у всех включенных в исследование пациентов. I. Klimberg et.al. исследовали микробиологическую эффективность левофлоксацина у 171 пациента. Курс лечения составил 10 суток. Препарат принимался в стандартной дозировке – 250 мг один раз в день. Средний уровень элиминации патогенных агентов в группе составил 95,5% [7].
Fu K.P. et.al., исследуя безопасность терапии левофлоксацином, пришли к выводу, что наиболее частыми побочными эффектами являются тошнота (1,3%) и диарея (1,1%). Несколько реже наблюдаются головокружение (0,4%) и бессонница (0,3%) [9]. У наших пациентов нарушения сна и головокружения отмечено не было, что, вероятно, объясняется небольшим количеством больных в группе по сравнению с Fu K.P., однако диарея и тошнота и у наших больных встречались достаточно часто.
На основании проведенного нами клинического исследования эффективности 10-дневной терапии ЛФ, можно заключить, что левофлоксацин является эффективным и безопасным средством для лечения больных с осложненной инфекцией мочевых путей.
1. Stratton C.W. A practical approach to diagnosing and treating urinary tract infections in adult // Antimicrob. Inf. Dis, 1996; 15: 37–40.
2. Davis R., Bryson H.M. Levofloxacin: a review of its antibacterial activity, pharmacokinetics and therapeutic efficasy // Drugs, 1994; 47: 677–700.
3. George A. Richard., Stacy Childs., Cynthia Fowler et. al. A comparison of Levofloxacin and Ciprofloxacin for the treatment of urinary tract infections // Clin. Infect. Dis, 1996; 23: 914, abs 293.
4. Y. Kawada., Y. Aso., S. Kamidono et.al. Comparative study of DR–3355 and Ofloxacin in complicated urinary tract infections. 31st Intersci Conf Antimicrob Agents Chemother. Chicago, Sept–Oct 1991 In: Programm and Abstracts, 1991: abs. 884.
5. Richard G., DeAbate C., Ruoff G. et.al. Short–course levofloxacin (250 mg qd) vs ofloxacin (200 mg bid) in uncomplicated UTI: a double–blind, randomized trial. 6th Int. Symp. on new Quinolones. Denver (Nov 1998) In: Abstracts, 1998: abs 126.
6. Richard G. A., Klimberg I. N., Fowler C. L., Callery–D’Amico S., Kim S.S. Levofloxacin versus ciprofloxacin versus lomefloxacin in acute pyelonephritis// Urology, 1998; 52: 51–5.
7. Ira W. Klimberg, Clair E. Cox, Cynthia L. Fowler et.al. A controlled trial of levofloxacin and lomefloxacin in the treatment of complicated UTI // Urology, 1998; 51: 610–5.
8. Kondo K., Akaeda T., Shidahara K., Nakayama Y. Usefullness of single–dose levofloxacin therapy for female acute uncomplicated cystitis // Jpn J Chemother, 1998; 46: 195–203.
- левофлоксацин или ципрофлоксацин что эффективнее при ковид
- левофлоксацин или ципрофлоксацин что эффективнее при пневмонии