лимфаденэктомия подмышечная что это
Лимфаденэктомия подмышечная что это
а) Показания для удаления подмышечных лимфоузлов:
— Плановые: опухоль неясного происхождения; подозрение на системное заболевание лимфатической системы; злокачественное заболевание молочной железы, грудной стенки или руки.
— Альтернативные операции: биопсия других лимфоузлов, чрескожный доступ под ультразвуковым или КТ наведением.
б) Предоперационная подготовка. Предоперационные исследования: ультразвуковое исследование в зависимости от основного заболевания.
в) Специфические риски, информированное согласие пациента:
— Лимфатический свищ
— Повреждение сосудов
— Повреждение нервов
г) Обезболивание. Местное обезболивание (для поверхностного доступа), общее обезболивание (маска или интубация).
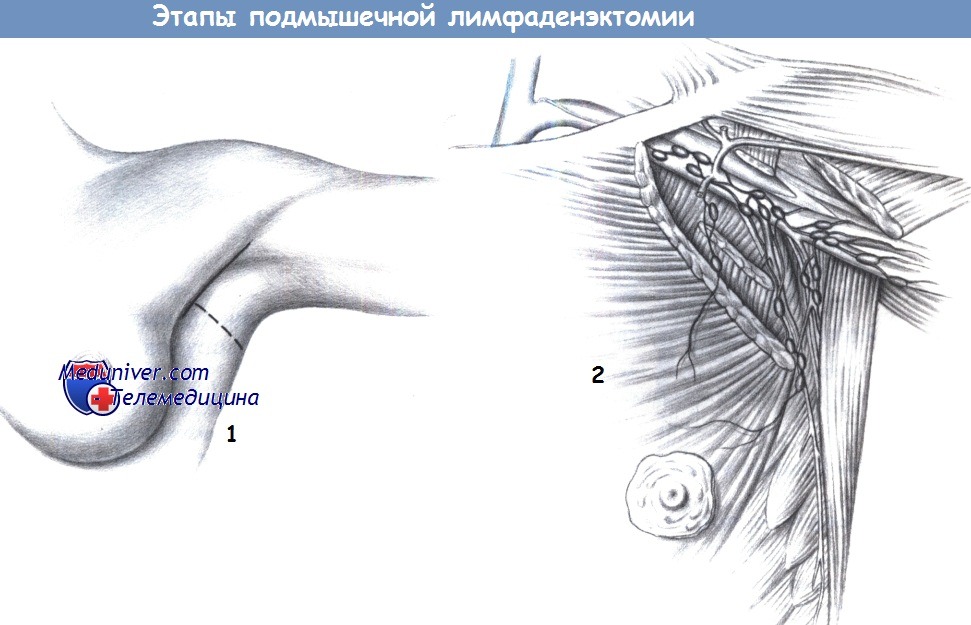
е) Доступ. По переднему краю подмышечной впадины или поперечный.
ж) Этапы подмышечной лимфаденэктомии:
— Доступ
— Границы диссекции
— Экспозиция нервов и сосудов
— Сохранение краниальных лимфатических сосудов
и) Меры при специфических осложнениях. Если развивается постоянный лимфатический свищ, требуется тщательная ревизия.
л) Оперативная техника удаления подмышечных лимфоузлов:
— Доступ
— Границы диссекции
— Экспозиция нервов и сосудов
— Сохранение краниальных лимфатических сосудов
1. Доступ. Подмышечная лимфаденэктомия может включать диссекцию подмышечной впадины или только биопсию. Полное очищение подмышечной впадины обязательно при операции по поводу рака молочной железы. Разрез проводится либо субпекторально в заднем грудном пространстве, либо поперечно, от большой грудной мышцы до края широчайшей мышцы спины.
2. Границы диссекции. Анатомическая диссекция должна принимать во внимание строение подмышечной впадины и ход лимфатических коллекторов. Легкодоступные лимфатические узлы расположены в дорзальной части подмышечной области, другие лимфатические коллекторы расположены вентрально под большой грудной мышцей и вдоль больших сосудов.
Тем не менее, для предотвращения лимфатического отека, лимфатические пути, идущие краниальнее магистральных сосудов, нужно сохранять. Поэтому диссекция должна быть направлена внутрь подмышечной впадины, и направляться вдоль грудоспинного сосудисто-нервного пучка и длинного грудного нерва под грудную мышцу.
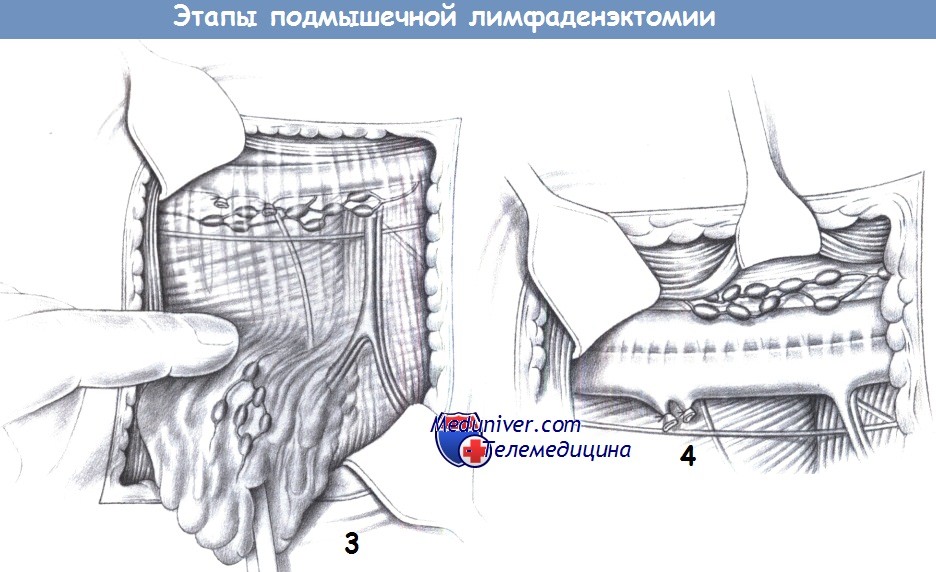
3. Экспозиция нервов и сосудов. Подмышечная лимфаденэктомия начинается с удаления жировой подушки подмышечной впадины и лимфатических элементов вдоль нижнего края сосудов. Мелкие сосуды пересекаются между лигатурами. Выделяется и предохраняется длинный грудной нерв. Грудоспинной сосудисто-нервный пучок нужно также обнаружить и изолировать. Сосудистые ветви, идущие к жировой подушке подмышечной впадины, пересекаются.
Лимфоузлы под грудной мышцей должны оставаться в макропрепарате. Это достигается поднятием грудной мышцы вентрально с открытием доступа к краниальным отделам подмышечной впадины. Подмышечная вена обнажается острым путем, рассечением сосудистого футляра. Мелкие сосуды перевязываются или коагулируются. Это позволяет достичь верхушки подмышечной впадины.
Диссекция проводится по передней поверхности передней зубчатой мышцы и дорзально ограничивается широчайшей мышцей спины, которая отводится в сторону крючком. Вся жировая ткань резецируется единым блоком. После удаления подмышечной жировой подушки анатомическая ситуация становиться очевидной. Сохраняются грудоспинные сосуды и нерв (дорзально), подмышечные сосуды (краниально) и длинный грудной нерв (медиально). В зависимости от распространения заболевания могут быть удалены латеральные лимфоузлы вдоль подмышечного сосудистого пучка.
4. Сохранение краниальных лимфатических сосудов. При выполнении подмышечной лимфаденэктомии необходимо оставлять интактными лимфатические пути краниальнее подмышечных сосудов. Иначе лимфатический отек верхней конечности будет постоянным. Операцию завершает активный дренаж, подкожные и кожные швы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лимфодиссекцией (или иначе лимфаденэктомией) называется хирургическое удаление лимфатических узлов при злокачественных опухолях. Лимфодиссекция не является самостоятельной операцией, а представляет собой часть хирургического противоопухолевого лечения.
Для чего проводится лимфодиссекция?
Злокачественные опухоли отличает способность образовывать метастазы, выходя за пределы первичного очага и начиная развиваться в других органах и тканях. Раковые клетки отделяются от первичной опухоли и распространяются по организму с током крови и лимфы, поражая в том числе и сами лимфатические узлы – сначала ближайшие.
Поэтому удаление вместе с первичной опухолью лимфатических узлов позволяет приостановить и даже предотвратить развитие метастазов. Результаты исследования удаленных при лимфодиссекции узлов помогают в составлении оптимальной программы дальнейшего лечения. Таким образом лимфодиссекция сочетает в себе непосредственно лечебную и диагностическую функции.
Показания к лимфодиссекции
Необходимость лимфодиссекции зависит от агрессивности конкретного заболевания и степени распространенности опухоли, то есть стадии рака.
Некоторые опухоли почти не метастазируют, поэтому при их лечении лимфодиссекция не применяется. Это, например, базальноклеточный рак. По той же причине в лимфодиссекции обычно нет необходимости на ранних стадиях рака.
Однако, для быстро метастазирующих видов рака лимфодиссекция является обязательной составляющей радикального лечения. При невозможности её проведения опухоль признается неоперабельной. Это касается, например, рака желудка, панкриатической карциномы, немелкоклеточной карциномы легкого.
В случае ряда заболеваний, — например, раке молочной железы, меланоме, плоскоклеточной карциноме кожи, — прежде чем проводить лимфодиссекцию, делают биопсию сторожевого лимфоузла, чтобы определить наличие в нем метастазов.
Сторожевым узлом называется ближайший на пути распространения опухоли лимфоузел. Чтобы обнаружить его, проводят картирование, выделяя пораженные ткани с помощью меченых изотопов или красящего вещества. После обнаружения сторожевой узел удаляется и передается на морфологическое исследование. Если в данном узле не выявлено следов поражения, то лимфодиссекцию не назначают, так как вероятность появления метастазов минимальна. Если же в сторожевом узле обнаружены опухолевые клетки, то без проведения лимфодиссекции прогноз ухудшается.
К вопросу о подмышечной лимфодиссекции у больных раком молочной железы
Авторами проведен анализ результатов лечения больных раком молочной железы, которым выполнялось оперативное вмешательство в объеме секторальной или радикальной резекции. Установлено, что секторальная резекция может успешно применяться в лечении больных раком молочной железы, не влияя на результаты трех- и пятилетней выживаемости, способствуя более рациональному использованию коечного фонда.
Последние десятилетия ознаменовались широким внедрением в повседневную онкологическую практику органосохранного лечения рака молочной железы. Это в первую очередь связано с уменьшением объема удаляемых тканей самой молочной железы — от квадрантэктомии к секторальной резекции и далее к туморэктомии. Многочисленные рандомизированные исследования свидетельствуют о высокой эффективности подобных операций [7, 10, 12]. Вместе с тем, органосохраняющие операции позволяют пациентке избежать хронической психотравмирующей ситуации, обусловленной утратой женственности.
Но не только оперативные вмешательства на молочной железе, но и на путях лимфоотока определяют прогноз и влияют на качество жизни пациенток раком молочной железы. В настоящее время большинство авторов склонны считать, что если показано выполнение подмышечной лимфодиссекции, то следует производить иссечение всех подмышечных лимфоузлов, включающих три уровня лимфооттока по Бергу [3], ибо отказ от удаления лимфоузлов на всех трех уровнях ведет к недооценке распространенности рака молочной железы. Некоторые авторы считают, что лимфостаз является серьезным осложнением полной подмышечной лимфодиссекции и предлагают удалять лимфоузлы первого уровня или проводить выборочное удаление отдельных подозрительных лимфоузлов. Наиболее перспективным в этом плане является изучение состояния «сторожевого узла» (наиболее близко расположенного к опухоли) для оценки распространения опухолевого процесса. Исследователи пытаются доказать, что отсутствие метастазов в «сторожевом узле» является доказательством отсутствия поражения всех лимфоузлов, а обнаружение метастазов может являться показанием к выполнению подмышечной лимфаденэктомии [1, 2, 3, 5, 11]. И только отдельные авторы высказываются за полный отказ от подмышечной лимфодиссекции. В 1971 г. H.S. Gallagеr предложил выделять так называемый «минимальный рак». Этим термином он и J. T. Martin обозначили дольковый рак in situ, внутрипротоковый рак в наибольшем размере не более 5 мм и минимальный инвазивный рак. В последнее время в эту группу включают самые разные по морфогенезу неинвазивные и инвазивные раки до 10 мм. У этих больных вероятность метастазирования в подмышечные лимфоузлы не превышает 6% [11]. Это означает, что у большого числа женщин выполнение подмышечной лимфодиссекции приводит к удалению нормальных лимфоузлов для получения прогностической информации, которая могла бы быть получена и при изучении различных характеристик первичной опухоли. В связи с этим ряд авторов считает обоснованным отказ от проведения подмышечной лимфодиссекции у больных ранним раком молочной железы.
В работе Haffty и соавт. (1993) представлены данные о 337 больных с I и II стадией рака, у которых было выполнено только удаление пораженного сегмента без подмышечных лимфоузлов с последующей лучевой терапией на молочную железу и подмышечную область [8]. При 10-летнем наблюдении у 8 больных был диагностирован рецидив в регионарных лимфатических узлах. Таким образом, показатель безрецидивного течения в данной зоне составил 97%, что позволило авторам считать такой объем оперативного вмешательства адекватным для больных с отсутствием данных за метастатическое поражение регионарных лимфатических узлов. Достаточно интересная информация содержится в работе Louis-Sylvestre и соавт. (2004) [9]. В исследование было включено 658 больных раком молочной железы с опухолью менее 3 см и отсутствием клинических данных за метастатическое поражение подмышечных лимфатических узлов. Все пациентки были рандомизированы в 2 группы: в первую вошли больные, которым была выполнена лимфодиссекция (n=326), во вторую — пациентки, которым провели только лучевую терапию на подмышечную область в дозе 50 Гр(n=332). Обе группы были сопоставимы по возрасту, распространенности опухолевого процесса, рецепторному статусу. Как показали результаты исследования, пятилетняя выживаемость была выше в группе пациенток, которым выполнялась лимфодиссекция (96,6% вместо 92,4%; р=0,009). Вместе с тем, десяти- и пятнадцатилетняя выживаемость в обеих группах была практически одинаковой (86,6% против 83,6% и 75,5% против 73,8% соответственно). Справедливости ради необходимо отметить, что рецидив в подмышечной области регистрировался чаще в группе пациенток, которым лимфодиссекция не выполнялась (3% против 1%, р=0,04%). Рецидивы в надключичной области, а также отдаленные метастазы в обеих группах регистрировались приблизительно с одинаковой частотой.
Однако имеются и другие данные. Bland и соавт. (1999) представили результаты лечения 547847 больных раком молочной железы I-II cстадии, которым были выполнены органосохранные операции в клиниках США с 1985 по 1995 гг. [11]. За этот период количество радикальных резекций увеличилось с 17,6% до 36,6%, а число секторальных резекция без подмышечной лимфодиссекции возросло с 6,4% до 10,6%. Последний вид оперативных вмешательств в 2 раза чаще проводился пациенткам старше 70 лет, почти в 3 раза чаще применялся у больных с I стадией заболевания, а также I и II стадией злокачественности. При сравнительном анализе показателей десятилетней выживаемости оказалось, что более выгодно выглядят радикальные резекции молочной железы, чем секторальные резекции: 86% и 58%.
В виду высокой частоты тяжелых сопутствующих заболеваний, снижения функциональных и адаптационно-компенсаторных возможностей организма у больных пожилого и старческого возраста очень часто проведение радикальных операций противопоказано из-за длительности наркоза и опасности серьезных осложнений, поэтому выбор оперативного вмешательства у этих больных является чрезвычайно важным [4].
Материал и методы
Нами проанализированы результаты лечения 101 больной раком молочной железы, которым выполнялось оперативное вмешательство в объеме секторальной резекции в Ульяновском областном клиническом онкологическом диспансере в период с января 1988 по декабрь 2008 г. В контрольную группу вошла 141 больная раком молочной железы, которым было применено оперативное вмешательство Показаниями для выполнения секторальной резекции у больных раком молочной железы служили: отказ больной от радикальной операции; наличие тяжелой сопутствующей патологии, не позволяющей выполнить радикальную операцию; отсутствие клинических данных за метастатическое поражение подмышечных лимфатических узлов. Состояние регионарных лимфатических узлов оценивалось на основании данных клинического и инструментального методов обследования (УЗИ, МРТ, маммография в косой проекции). В сомнительных случаях выполнялась пункционная биопсия подмышечных лимфатических узлов с цитологическим исследованием.
Распределение больных по возрасту показало, что более 2/3 пациенток было старше 60 лет (83,1%), при этом средний возраст пациенток составил 68,6 + 2,1 лет. Подавляющая часть больных (82,2%) находилась в постменопаузе.
В зависимости от распространенности первичного процесса больные распределились следующим образом: 0 стадию имели 8 пациенток (7,9%), I стадию — 45 (44,5%), II a стадию — 48 больных (47,5%). У большинства пациенток (67,4%) размеры первичного очага находились в пределах от 1 до 3 см, при этом средний размер опухоли составил 2,4 + 0,2 см. Из числа исследуемых больных подавляющему большинству (75 человек — 74,3%) проведена оценка степени злокачественности опухоли. Наиболее многочисленной оказалась группа пациенток со II степенью злокачественности — 51 больная (68%). Реже регистрировались I и III степени злокачественности — у 20 (26,6%) и 4 (5,3%) пациенток соответственно. Иммуногистохимическое исследование было проведено 13 больным (12,9%), причем у 12 пациенток был отмечен положительный рецепторный статус по эстрогеновым и прогестероновым рецепторам, в одном случае опухоль была положительна только по эстрогеновым рецепторам. Гиперэкспрессии HER-2/neu выявлено не было.
Учитывая средний возраст пациенток, немаловажным является факт наличия сопутствующей патологии. Соматические заболевания были зарегистрированы у 64 больных (63,4%). У большинства пациенток имелось несколько сопутствующих заболеваний. Наиболее часто встречалась патология сердечно-сосудистой системы: гипертоническая болезнь, стенокардия, постинфарктный кардиосклероз, нарушение ритма, порок сердца, недостаточность кровообращения. Вышеперечисленные заболевания были диагностированы у 48 пациенток (47,5%). Сахарный диабет различной степени тяжести зарегистрирован у 9 больных. Реже встречались последствия острого нарушения мозгового кровообращения (3 больных), хроническая почечная недостаточность (3 больных), бронхиальная астма (3 больных) и цирроз печения (1 больная). Рак другой локализации был выявлен у 4 больных.
От общего числа исследуемых больных чисто хирургическое лечение проведено 25 пациенткам (24,7%). Сочетание оперативного вмешательства с лучевой терапией получили 26 больных (25,7%), а сочетание оперативного лечения с лекарственной терапией — 23 пациентки (22,8%). Комплексное лечение, включающее хирургическое, лекарственное и лучевое, проведено 27 пациенткам (26,8%). Оперативное вмешательство осуществлялось в объеме секторальной резекции под местным обезболиванием. У 52 больных (51,5%) операция выполнялась в стационаре, в то время как у 49 (48,5%) — в амбулаторных условиях. Послеоперационная лучевая терапия проводилась в режиме дробно-протяженного фракционирования (РОД=2 Гр, СОД=44-50 Гр). Из системных методов лечения адьювантную полихимиотерапию получила одна больная, гормонотерапию антиэстрогенами — 49 пациенток.
На основании полученных данных, общая трехлетняя выживаемость составила 89,9%, а пятилетняя — 81,9%. Причем эти показатели оказались практически одинаковыми во всех исследуемых группах и, таким образом, не зависели от метода лечения. Мало чем они отличались и от результатов лечения больных раком молочной железы с использованием радикальной резекции (табл. 1). Показатели трехлетней и пятилетней выживаемости в данном случае достигали 93,2% и 85,2%, соответственно (р + 2,4 койко-дней, в то время как после секторальной резекции среднее пребывание на койке сокращается практически вдвое (12,8 + 1,1 койко-дней).
Резюме
При соблюдении критериев отбора, секторальная резекция может успешно применяться в лечении больных раком молочной железы, не влияя на результаты трех- и пятилетней выживаемости. Использование секторальной резекции у больных раком молочной железы способствует более рациональному использованию коечного фонда и экономии денежных средств лечебными учреждениями.
В.В. Родионов, А.А. Мидленко, А.В. Суетин, Э.Т. Рахматуллина, В.В. Музяков
Ульяновский областной клинический онкологический диспансер
1. Вельдшер Л.З., Габуния З.Р., Праздников Э.Н., Лучшев А.И., Чочуа Г.А., Гвахария Н.В., Прилепо Ю.В. Пути оптимизации объема лимфодиссекции при раке молочной железы. Вестник Московского Онкологического Общества 2001; 1: 2-3.
2. Вельдшер Л.З., Решетов Д.Н., Габуния З.Р., Прилепо В.Н., Прилепо Ю.В. Сторожевые лимфатические узлы при раке молочной железы. Маммология 2007; 1: 23-25.
3. Зуррида С. Локализованные формы рака молочной железы: комбинированная органосохраняющая терапия. Материалы IV ежегодной Российской онкологической конференции. Москва. 82-84 с.
4. Иванов В.М., Ротобельская Л.Е., Высоцкая И.В., Легков А.А. Современные возможности лечения рака молочной железы у больных пожилого и старческого возраста. Маммология 1996; 1: 45-48.
5. Поддубская Е.В., Ширяев С.В., Комов Д.В., Оджарова Г.А., Ожерельев А.С., Баранова М.П. «Сторожевой» лимфатический узел: оптимизация лечебно-диагностической тактики при раке молочной железы. Вестник Московского Онкологического Общества 2001; 1: 3-4.
7. Fisher B., Redmond C., Poisson R. et al. Eight-year results of randomized clinical trial comparing total mastectomy and lumpectomy with or without irradiation in treatment of breast cancer. N. Engl. J. Med 1989; 320: 822-828.
8. Haffy B.G., McKhann C., Beinfield M. et al. Breast conservation therapy with-out axillary dissection. A rational strategy in selected patients. Archives of Surgery.1993; 128(12): 1315-1319.
9. Louis-Sylvestre C., Clough K., Asselain B. et al. Axillary Treatment in Conservative Management of Operable Breast Cancer: Dissection of Radiotherapy? Results of a Randomized Study With15 Years of Follow-Up. J. Clin. Oncol. 2004; 1: 97-101.
10. van Dongen J., Voogd A., Fentiman I. et. al. Long-Term Results of a Randomized Trial Comparing Breast-Conserving Therapy With Mastectomy: European Organization for Research and Treatment of Cancer 10801 Trial. J. Nat. Cancer Inst. 2000; Vol. 92: 14.
11. Veronesi U., Paganelli G., Viale G. et al. Sentinel lymph node biopsy and axillary dissection in breast cancer: results in a large series. J. Natl. Cancer Inst.1999; 91(4): 368-373.
Лимфаденэктомия
Лимфаденэктомия (лимфодиссекция, удаление лимфатических узлов) означает оперативное удаление лимфатических узлов, которое производится, как правило, в рамках резекции злокачественной опухоли c диагностической и/или терапевтической целью.
Когда и как выполняется лимфаденэктомия при различных онкологических заболеваниях:
Во всех случаях лимфаденэктомия дает важную информацию относительно стадии опухоли и прогнозе лечения.
Терапевтический эффект лимфаденэктомии
Сегодня можно утверждать, что сопутствующая лимфаденэктомия улучшает прогноз лечения при таких видах рака как:
Биопсия сторожевых узлов
В настоящее время перед проведением радикальной диссекции лимфатических узлов проводится так называемая биопсия сторожевых узлов. Сторожевыми называют первые узлы на пути распространения опухоли по лимфатических протокам. Сторожевой узел служит своеобразным индикатором, если он не поражен опухолью, это означает что вероятность ее распространения в следующие лимфатические узлы ничтожно мала. Однако в случае поражения сторожевого узла, выполняется радикальное удаление лимфатических узлов.
Перед проведением биопсии сторожевых узлов, проводится их маркировка красящим или радиоактивным вещевом и помощью сцинтиграфии лимфатических узлов определяется их точное месторасположение.
Способы проведения лимфаденэктомии
Как правило, лимфаденэктомия проводится во время основной операции опухоли. Однако, в случае отдельного оперативного вмешательства процедура может быть проведена миниинвазивно, например, лапароскопически.
Возможные последствия лимфаденэктомии
Наиболее частым осложнением лимфаденэктомии является лимфостаз – застой жидкости в межклеточных пространствах, который вызывается плохим оттоком лимфы по лимфатическим сосудам. Чем больше лимфатических узлов удалено, тем выше риск возникновения лимфостаза.
Операции на подмышечных лимфатических узлах

Биопсия сигнального лимфатического узла
БСЛУ у больных с отсутствием метастатического поражения лимфатических узлов по данным предоперационного обследования – хорошая альтернатива для таких пациенток, позволяющая избежать ненужного удаления лимфатических узлов. Для визуализации лимфатического узла в подмышечной области, первым воспринимающим лимфу от молочной железы, используется индоцианин зелёный (indocianin green, ICG). Препарат вводится внутрикожно в область ареолы. Через 2-3 минуты на экране отображаются пути лимфооттока, по которым можно найти первый лимфатический узел, то есть сигнальный. Лимфатический узел удаляется и отправляется на гистологическое исследование. Подробнее о методе
Диагностику проводит известный онколог-маммолог России, доктор медицинских наук Сергей Михайлович Портной. БСЛУ (биопсия сигнального лимфатического узла), основанная на флуоресцентной лимфографии, на сегодняшний день является самым передовым методом. Фотодинамический глаз-камера выводит на экран изображение в инфракрасном диапазоне и позволяет произвести процедуру максимально точно и избежать применения радионуклидов. На территории Российской Федерации представлена только во Frau Klinik.