лимфоидная инфильтрация что это такое
Лимфоидная инфильтрация что это такое
Лимфатическую систему изучают по локализации или топографоана-томической принадлежности пораженных лимфатических узлов, их размерам, форме, структуре (однородная, неоднородная), расширению лимфатических стволов, сосудов.
Критерием поражения одного узла какой-либо одной группы считают увеличение его размеров до 15 мм и более. Визуализация одной группы узлов с размерами узлов 10-12 мм также расценивается как поражение. Пораженными считают также узлы диаметром 8-10 мм, выявленные в нескольких анатомических областях.
По форме поражения лимфатических узлов выделяют:
1) изолированную форму;
2) образование пакета узлов;
3) формирование конгломерата узлов;
4) лимфоидный инфильтрат.
Изолированной формой поражения являются одиночные увеличенные лимфатические узлы, не связанные между собой.
Группу изолированных лимфатических узлов, тесно соединяющихся между собой, расценивают как пакет. При этом между лимфатическими узлами всегда имеется ткань меньшей плотности.
Конгломератом лимфатических узлов считают объединенные в единое целое узлы с ровными или бугристыми контурами, имеющие, как правило, однородную плотность. Размеры конгломерата различны: от 50 мм до опухоли, охватывающей несколько анатомических групп.
При вовлечении в патологический процесс сальника, перикарда или плевры конгломерат может занимать большую часть брюшной или грудной полости. Главное отличие конгломерата — отсутствие границ между узлами.
Лимфоидный инфильтрат — патологическая ткань с нечеткими краями, расположенная по ходу лимфатических стволов и крупных лимфатических сосудов.
Выделение различных форм поражения лимфатических узлов имеет важное значение для оценки характера их изменений, контроля за динамикой патологического процесса в ходе лечения, поиска диагностических критериев изменения лимфатических узлов при некоторых заболеваниях. Структуру лимфатических узлов оценивают как однородную и неоднородную визуально и по их денситометрическим показателям.
Пакеты и конгломераты, как правило, имеют однородную плотность (35-48 HU). Неоднородная плотность констатируется при распаде узлов (конгломерата, инфильтрата) или при равномерном снижении плотности (24-32 HU). Экстранодальные поражения встречаются у 20% больных лимфомами. Наиболее часто вовлекаются легкие, кишечник, поджелудочная железа, мышцы, сальник, брюшина, надпочечники, перикард, головной и спинной мозг, орбиты.
Характерны нарушения анатомического состояния органов, их смещение лимфоидными образованиями, лимфоидная инфильтрация и увеличение лимфатических узлов окружающих тканей.
К КТ-признакам экстранодальных поражений при лимфомах относятся: очаговые образования, перибронхиальная инфильтрация, увеличение лимфатических узлов средостения, гидроторакс, поражение тканей грудной клетки.
Очаговые образования в легких выявляются в виде множественных субплевральных очагов лимфоидной ткани однородной плотности диаметром около 1 см. Очаги больших размеров неправильной формы встречаются редко.
Перибронхиальная и/или перивазальная инфильтрация наиболее выражена в периферических отделах легких и всегда имеет связь с плеврой. Она же обусловливает гиповентиляцию, иногда приводящую к ателектазам.
Поражения лимфатических узлов при лимфогранулематозе (ЛГМ) и неходжкинских лимфомах (НХЛ) различаются. При ЛГМ поражаются преимущественно ретростернальная, перикардиальная, трахеобронхиальная и бронхопульмональная группы; форма поражения — изолированная, пакет, реже инфильтрат. При НХЛ эти группы поражаются менее чем в 15% случаев; форма поражения изолированная, реже в виде пакета и конгломерата.
В плевральной полости на стороне поражения может определяться гидроторакс, обычно односторонний и незначительно выраженный.
Из субплевральных очагов и образований средостения лимфоидная ткань распространяется на ткани грудной стенки; иногда в процесс вовлекаются органы средостения, плевральная полость, легкие. Это более характерно для НХЛ.
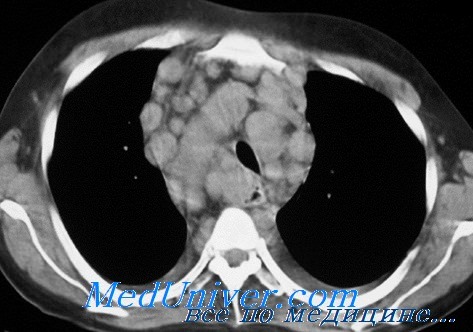
Поражение перикарда определяется в виде утолщения сердечной сумки до 5 мм и более, перикардиальный жир не прослеживается из-за перикардиальной лимфоидной инфильтрации, в полости перикарда имеется небольшое количество жидкости.
Поражение поджелудочной железы, надпочечников и почек может быть узловым и диффузным.
Узловая форма характеризуется увеличением органа, бугристыми краями за счет множественных узлов в ткани органа диаметром от 10 до 35 мм. Контуры при такой форме поражения четкие. Плотность узлов однородная (36-48 HU) и не всегда отличается от интактной ткани. В этом случае для лучшей визуализации применяется усиление. Очаги лимфоидного поражения имеют низкую плотность или незначительное повышение на фоне непораженной ткани.
Диффузное поражение проявляется увеличением органов в размере, нечеткостью контуров, снижением плотности, неоднородной структурой (29-45 HU). Окружающая клетчатка может уплотняться за счет лимфоидной инфильтрации.
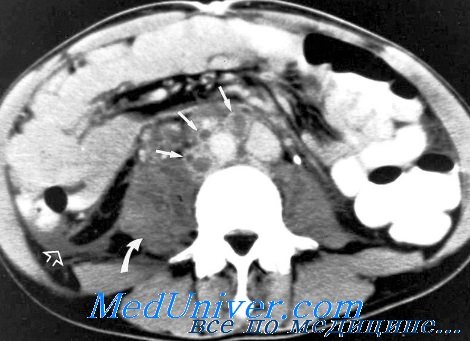
Поражение брюшины и сальника характеризуется утолщением брюшины за счет инфильтрации ее на значительном протяжении. При этом теряется четкость брюшины, не дифференцируются структуры стенки живота и жировой клетчатки.
Сальник имеет вид плотного (36-48 HU) ограниченного образования, прилежащего к брюшине. Границы его местами нечеткие. Лимфатические узлы брыжейки тонкой кишки, брюшной аорты увеличены, а форма их поражения представлена конгломератом, инфильтратом, реже пакетом.
Поражение кишечника чаще встречается в правой половине толстой кишки и характеризуется значительным утолщением стенок (до 5 мм и более) с концентрическим сужением просвета. Наружный контур кишки нечеток в связи с распространением опухолевой ткани за пределы органа, вовлечением окружающей клетчатки и брыжейки. Лимфатические узлы толстой кишки поражаются в форме одиночных узлов, реже в форме пакета.
Предварительная дифференциальная диагностика лимфогранулематоза (ЛГМ) и неходжкиновских лимфом (НХЛ)
| КТ-признаки | Лимфогранулематоз (ЛГМ) (Болезнь Ходжкина) | Неходжкинские лимфомы |
| Возраст | Чаще молодой | Чаще 40-70 лет |
| Стадия | Чаще локализованная | В 85% — генерализованная |
| Частота поражения лимфатических узлов средостения | Более 75% | Менее 25% |
| Частота поражения лимфатических узлов живота: — парааортальные: | Менее 40% | Более 75% |
| — брыжеечные: | Менее 3% | Около 70% |
| Количество групп пораженных лимфатических узлов | 1-2 группы | 3-4 и более |
| Форма поражения лимфатических узлов: — изолированная | Часто, от 6 мм и более | Часто, от 10 мм и более |
| — пакет узлов: | Часто | Часто |
| — конгломерат: | Редко, в средостении | Часто, у 1/3-1/2 |
| — лимфоидный инфильтрат: | Редко | Часто, у 1/3-1/2 |
| Структура лимфатических узлов | Часто однородная | У 1/2 неоднородная с распадом |
| Экстранодальные поражения: — ниже диафрагмы: | Редко | Часто |
| — множественность поражении: | Редко | Часто |
Лимфоидное поражение головного мозга и глазниц встречается крайне редко (1-2%), преимущественно у больных неходжкиновскими лимфомами (НХЛ). Лимфоидное образование головного мозга имеет характерные признаки: неправильную форму, расположение в передних отделах мозолистого тела или глубинных отделах височно-теменных областей. Вокруг опухоли наблюдается значительный отек вещества мозга, который вызывает сдавление рогов боковых желудочков, субарахноидального пространства и борозд.
После усиления лимфоидное образование приобретает более четкие очертания. В центре образования часто отмечается зона распада. В глазницах лимфоидная ткань расположена экстраорбитально, вовлекаются мышцы, слезная железа, иногда происходит разрушение прилежащих костных стенок.
Таким образом, КТ-признаки экстранодальных поражений при лимфогранулематозе (ЛГМ) и НХЛ весьма разнообразны и не имеют специфических черт. Вместе с тем, соблюдение оптимальной методики обследования, сочетание определенных КТ-признаков с учетом распространенности лимфаденопатии и гепатоспленомегалии позволяет проводить предварительную дифференциальную диагностику.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лимфоидная инфильтрация что это такое
Лимфоидная ткань, которой изобилует тонкая кишка, может стать очагом злокачественного перерождения. Желудочно-кишечная лимфома бывает локализованной (с вовлечением прилежащих лимфатических узлов или без него) или составляет часть системного процесса. Возможно поражение длинных участков тонкой кишки.
Симптомы неспецифические: боль, частичная непроходимость, иногда синдром мальабсорбции в сочетании с анорексией, потерей веса и другими соматическими проявлениями. Наиболее полную картину кишечной лимфомы устанавливают, сочетая компьютерную томографию с внутриполостными контрастными исследованиями.
Перечень характерных рентгенологических признаков включает кольцевой, полостной и аневризматический типы поражений, мишеневидные поражения при диссеминированной форме заболевания, узловую форму — лимфома при глютеновой энтеропатии (обычно Т-клеточные лимфомы). Ее всегда нужно подозревать у ранее компенсированных пациентов с ухудшением состояния, несмотря на соблюдение безглютеновой диеты.
Лимфома сама по себе может вызывать глютенчувствительную энтеропатию, которая отвечает на исключение глютена при отсутствии целиакии, причем риск особенно высок у пациентов пожилого возраста. Кишечная лимфома часто наблюдается на поздних стадиях СПИДа. Ее включают в дифференциальную диагностику у пациентов с генерализованной болью в животе, потерей веса и лихорадкой, особенно когда в ходе обследования точный диагноз установить не удалось.
Высокая настороженность, ранняя компьютерная томография и готовность к проведению лапароскопии или лапаротомии для получения гистологического материала имеют решающее значение при диагностике кишечных лимфом, однако при диффузном поражении проксимальной части тонкой кишки получить гистологическое подтверждение позволяет и дистальная дуоденальная биопсия.
Очаговые лимфомы, часто осложненные перфорацией и щелевидным изъязвлением, обычно встречаются в подвздошной кишке. Классификация кишечных лимфом основана на стандартных критериях для лимфом, расположенных по всему телу. Большинство из них В-клеточного происхождения, однако при целиакии они чаще имеют иную природу. Раньше такие лимфомы относили к гистиоцитарному типу, но это оказалось не совсем правильным, так как впоследствии было установлено, что они имеют Т-клеточное происхождение.
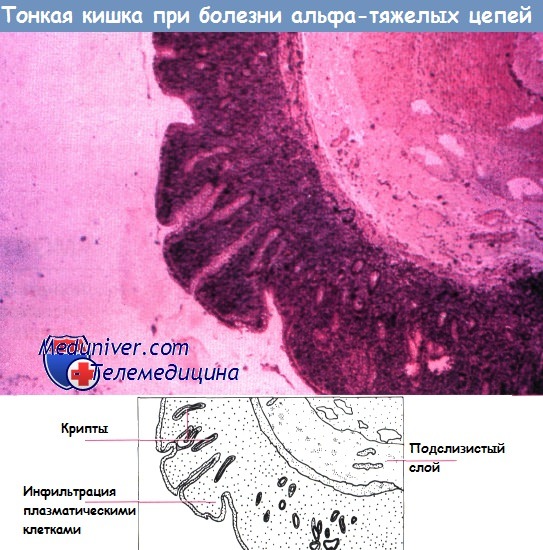
Этот тип лимфомы в основном поражает тощую кишку. Среди жителей восточной части Средиземноморья и Ближнего Востока распространена лимфома тонкой кишки без поражения лимфатических узлов. Термин не идеален, так как иммунопролиферация в кишечнике не всегда связана с образованием лимфомы, — у некоторых пациентов бывает болезнь тяжелых альфа-цепей. Предпочтительнее название «иммунопролиферативная болезнь тонкой кишки» (ИБТК). ИБТК включает две формы — лимфоматозную и нелимфоматозную.
Болезнь тяжелых а-цепей — скорее вариант иммунопролиферативной болезни тонкого кишечника, а не отдельное состояние. Пролиферация лимфоидной ткани системы синтеза IgA приводит к синтезу неполных молекул иммуноглобулина. Эта патология обнаруживается в основном среди бедных слоев населения Ближнего Востока, восточного Средиземноморья и Южной Африки.
Основные клинические проявления желудочно-кишечные, включая тяжелую мальабсорбцию; у некоторых пациентов отмечают утолщение концевых фаланг пальцев рук, легочные заболевания. В биоптатах тонкой кишки увеличено количество плазматических клеток и неполных молекул IgA, содержащих избыток тяжелых а-цепей. Эти молекулы легко обнаружить в крови, моче и секрете тощей кишки при помощи гель-электрофореза.
В большинстве случаев пролиферация кишечных плазматических клеток затрагивает брыжеечные лимфатические узлы, способствуя развитию лимфомы. На ранних стадиях эпителий интактен, крипты широко отделены друг от друга инфильтратами из плазматических клеток. В процессе пролиферации плазматических клеток в слизистой оболочке кишки они распространяются на лимфатические узлы, в большинстве случаев приводя к формированию классической лимфомы.
На ранних стадиях кишечный эпителий остается интактным, пространство между криптами увеличено за счет плазмаклеточного инфильтрата. Злокачественная инфильтрация бывает диффузно распространенной или с формированием лимфоидных фолликул, расположенных глубоко в собственной пластинке. На стадии инфильтрации мышц и разрушения крипт можно увидеть опухолевые образования. При иммуногистохимическом окрашивании выявляются а-цепи, исчезающие на поздних стадиях заболевания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лимфоцитарная инфильтрация Джесснера-Канофа
Лимфоцитарная инфильтрация Джесснера-Канофа – редкий хронический дерматоз, характеризующийся доброкачественной инфильтрацией кожи лимфоцитами. Заболевание имеет волнообразное течение, склонно к саморазрешению. Клинически проявляется высыпанием на неизменённой коже плоских гладких синюшно-розовых бляшек или папул, которые сливаются в очаги величиной с ладонь ребенка или взрослого. Первичные элементы имеют чёткие границы, шелушатся. Бляшки обычно единичные, располагаются на лице, шее, туловище, конечностях. Диагностируется клинически с гистологическим подтверждением, иногда проводят молекулярно-биологические исследования. Лечение – НПВС, гормональная терапия, препараты местного действия.
Общие сведения
Лимфоцитарная инфильтрация Джесснера-Канофа – доброкачественная псевдолимфома кожи с хроническим волнообразным рецидивирующим течением. Встречается редко. Чаще возникает у мужчин старше 20 лет. Сезонных, расовых различий не имеет, не эндемична. Иногда наблюдается улучшение в летний период. Впервые данная патология была описана в 1953 году, когда М. Джесснер и Н. Каноф рассмотрели ее как самостоятельное заболевание со сквозной инфильтрацией лимфоцитами всех слоёв дермы. Название «псевдолимфома» в 1965 году ввел К. Мач, объединивший инфильтрацию Джесснера-Канофа в одну группу с другими разновидностями лимфоцитарной инфильтрации.
В 1975 году О. Браун отдифференцировал тип заболевания, отнеся инфильтрацию лимфоцитами к В-клеточным псевдолимфомам, однако позже специалисты стали рассматривать патологию как Т-псевдолимфому. Именно Т-лимфоциты обеспечивают доброкачественное течение патологии и возможность спонтанной инволюции первичных элементов. Дальнейшие исследования показали, что в возникновении и течении лимфоцитарной инфильтрации Джесснера существенную роль играет иммунная система организма. Возможно, это связано с тем, что клетки иммунной системы располагаются в пищеварительном тракте, а он поражается в 70% случаев заболевания. Изучение лимфоцитарной инфильтрации Джесснера-Канофа продолжается и в настоящее время. Понимание причин возникновения и развития Т-лимфоидных процессов имеет большое значение в разработке патогенетического лечения псевдолимфом.
Причины лимфоцитарной инфильтрации
Наиболее вероятными причинами лимфоцитарной инфильтрации Джесснера-Канофа принято считать гиперинсоляцию, укусы клещей, инфекции, патологию желудочно-кишечного тракта, использование дерматогенной косметики и нерациональный приём лекарственных препаратов, провоцирующих системные иммунные нарушения, визуально представленные инфильтративными изменениями в коже. Механизм лимфоцитарной инфильтрации Джесснера-Канофа заключается в следующем: интактный эпидермис даёт Т-лимфоцитам возможность инфильтрировать глубокие слои дермы, располагаясь в сосочковых выростах и вокруг сосудистых сплетений по всей толще кожи. Триггеры заболевания запускают воспаление, на которое реагируют непосредственно клетки кожи и клетки иммунной системы. В процесс купирования воспаления включаются Т-лимфоциты, обеспечивающие доброкачественный ответ иммунной системы в виде пролиферации эпителиальных клеток дермы.
Одновременно в коже развивается банальное воспаление, проходящее три стадии: альтерации, экссудации и пролиферации с участием гистиоцитов – клеток ретикулярной ткани. Гистиоциты группируются и образуют островки, напоминающие лимфоидные фолликулы. На конечном этапе купирования воспаления два параллельных процесса пролиферации дополняют и усиливают друг друга. Так возникает очаг лимфоцитарной инфильтрации. Поскольку лимфоциты гетерогенны, оценка их гистохимических свойств с помощью иммунологических маркеров и моноклональных антител легла в основу иммунофенотипирования. Этот анализ имеет большое диагностическое значение в современной дерматологии.
Симптомы лимфоцитарной инфильтрации
Первичным элементом кожной сыпи при лимфоцитарной инфильтрации Джесснера-Канофа является крупная плоская розово-синюшная бляшка или папула с чёткими границами и гладкой поверхностью, имеющая тенденцию к периферическому росту. Сливаясь между собой, первичные элементы образуют кольцевидные или дугообразные «острова» с участками шелушения. Разрешение высыпавших элементов начинается с центра, поэтому сливные очаги могут иметь западание в центральной части. Типичной локализацией принято считать лицо, шею, околоушное пространство, затылок, лоб, щёки и скулы. Редко высыпания появляются на коже туловища и конечностях. Обычно первичный элемент одиночный, реже наблюдается тенденция к распространению процесса.
Лимфоцитарная инфильтрация Джесснера-Канофа характеризуется волнообразным рецидивирующим течением. Резистентна к проводимой терапии, способна спонтанно саморазрешаться. Рецидивы обычно возникают в местах прежней локализации, но могут захватывать и новые участки кожного покрова. Несмотря на длительное хроническое течение, внутренние органы в процесс не вовлекаются.
Диагностика лимфоцитарной инфильтрации
Заболевание диагностируется дерматологом на основании анамнеза, клиники, гистологии и люминесцентного микроскопирования (типичное свечение на границе дермоэпидермального соединения не определяется) с обязательной консультацией иммунолога и онколога. Гистологически при лимфоцитарной инфильтрации Джесснера-Канофа выявляется неизменённый поверхностный слой кожи. В толще дермальных слоёв обнаруживается группирование лимфоцитов и клеток соединительной ткани вокруг сосудов.
В сложных случаях проводят иммунотипирование опухоли, гистохимическое и молекулярное тестирование. К. Фан с соавторами рекомендуют основывать диагностику на результатах ДНК-цитофлюориметрии с анализом количества нормальных клеток (при лимфоцитарной инфильтрации Джесснера-Канофа более 97%). Дифференциальную диагностику проводят с саркоидозом, системной красной волчанкой, центробежной эритемой Биетта, кольцевидной гранулёмой, группой лимфоцитарных опухолей, токсикодермией и сифилисом.
Лечение лимфоцитарной инфильтрации
Лечение направлено на купирование острой фазы лимфоцитарной инфильтрации Джесснера-Канофа и увеличение продолжительности светлых промежутков. Терапия патологии неспецифическая. Отмечается хороший терапевтический эффект при назначении антималярийных препаратов (хлорохин, гидроксихлорохин) и нестероидных противовоспалительных средств (диклофенак, индометацин) после предварительного лечения сопутствующей патологии желудочно-кишечного тракта. Если состояние пищеварительной системы позволяет, применяют энтеросорбенты. Местно показаны гормональные кортикостероидные мази и кремы, а также инъекционные блокады очагов высыпаний триамцинолоном и бетаметазоном. При резистентности к проводимой терапии подключают плазмаферез (до 10 сеансов).
Особенности эндоскопической семиотики и антихеликобактерная терапия MALT-лимфом желудка
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%). Лимфомы толстой кишки наблюдаются в 5–10% случаев. Самыми редкими признаны первичные неходжкинские лимфомы пищевода [1].
В 1983 году Brooks и Enterline [2] провели клинико-морфологическое исследование, где показали, что нодальные и экстранодальные лимфомы отличаются по биологическим свойствам и что экстранодальные варианты лимфомы имеют более благоприятный прогноз.
Brooks и Enterline впервые отметили патогенетическую связь между хроническим воспалением слизистой оболочки желудка и развитием лимфомы. Было высказано предположение, что многие типы лимфом желудка представляют собой злокачественную трансформацию доброкачественных и длительно текущих лимфоцитарных поражений желудка. Авторы пришли к тому заключению, что длительная антигенная стимуляция вместе с аутоиммунным феноменом в клетках слизистой оболочки желудка в целом приводят к появлению злокачественного клона. Эта гипотеза была подтверждена результатами клинико-морфологических исследований, проведенных при лимфомах слюнной и щитовидной желез. Было показано, что лимфомы этих желез могут возникнуть на фоне хронического тиреоидита и сиалоаденита с синдромом Шегрена или без него.
P. Isaacson и D. H. Wright [3] обратили внимание на то, что большая часть первичных лимфом желудка развивается на фоне хронических гастритов. Более того, было показано, что другие варианты экстранодальных лимфом также связаны с хроническими воспалительными процессами. Доказано, что Нelicobacter pylori — грамотрицательная спиралевидная бактерия, впервые выделенная из гастробиоптата австралийскими исследователями Warren и Marschall в 1983 году, является причиной подавляющего большинства случаев хронических гастритов. Она приводит к возникновению язвенной болезни желудка, 12-перстной кишки, является одним из факторов риска аденокарциномы желудка.
Показано, что при эрадикации этого микроорганизма симптомы хронического воспаления становятся менее интенсивными и снижается степень лимфоцитарной инфильтрации. В 1993 году были представлены доказательства, что Н. pylori играет важную роль в возникновении подгруппы лимфом желудка MALT-типа [4]. Рядом авторов [5] было высказано мнение, что Н. pylori вызывает нарушение физиологических и иммунологических процессов, окислительное повреждение ДНК и пролиферацию как гемапоэтических, так и клеток слизистой оболочки желудка. В дальнейшем было установлено, что 90% больных MALT-лимфомой инфицированы Н. pylori [6, 7, 8]. Было показано также, что Н. pylori непосредственно и посредством цитотокина вызывает пролиферацию Т-клеток и макрофагов, что сопряжено с высвобождением цитокинов (интерлейкина-2 и интерлейкина-6). Последние, в свою очередь, вызывают пролиферацию В-клеток, способствуют развитию лимфоидных фолликулов и агрегатов лимфоцитов в толще слизистой оболочки желудка [9].
Материалы и методы исследования
Эндоскопическая картина лимфом желудка изучена нами у 250 пациентов, при этом поражение у 160 (64%) больных расценено как первичное, а у 90 (36%) — как вторичное, наблюдаемых в РОНЦ с 1995 года, из которых было 99 пациентов с MALT-лимфомой желудка. Разработаны эндоскопические и эндосонографические критерии диагноза MALT-лимфомы, ее дифференциально-диагностические признаки, проведена оценка лекарственной терапии.
Результаты и их обсуждение
При тщательном анализе развития болезни нами установлено, что в группе с первичными лимфомами желудка практически одна треть (32%) пациентов имели гастроэнтерологический анамнез: язвенную болезнь желудка, хронический атрофический, гипертрофический или смешанные гастриты, зачастую ассоциированные с инфекцией H. pylori.
Согласно нашим наблюдениям длительность существования гастроэнтерологической патологии до установления наличия опухоли в группе с первичной лимфомой желудка весьма вариабельна: в течение первых трех месяцев диагноз установлен у 30,6% (49 больных), в течение 6 месяцев у 18,1% (29 больных), в срок от 6 до 12 месяцев у 15,6% (25 больных). Отдельно следует отметить, что практически у трети пациентов (27,5% — 44 пациента) диагноз первичной лимфомы желудка был установлен спустя год (табл. 1).
Также отдельно необходимо отметить, что диагноз первичной лимфомы желудка у 8% пациентов выявлен при плановом обследовании по поводу сопутствующей патологии и оказался диагностической находкой, так как заболевание у части больных протекало бессимптомно.
В группе пациентов со вторичным поражением желудка от момента установления диагноза первичной локализации процесса до времени выявления поражения желудка сроки были различны и представлены в табл. 2.
Как видно из представленных в таблице данных, поражение желудка в большинстве случаев развилось в первые два года от начала заболевания, что диктует нам необходимость обязательных периодических эндоскопических исследований желудка с целью своевременного выявления метастатического поражения его при лимфомах.
В нашей работе чаще всего при лимфомах желудка имело место инфильтративно-язвенное и инфильтративное его поражение — 28,4% и 21,6% соответственно, затем в 14,8% встречается язвенная форма роста опухоли. Гастритоподобный вариант опухоли отмечен в 14,4%. Реже встречались смешанная и экзофитная формы роста опухоли — 12,0% и 8,8% соответственно.
Причем, как показывает анализ наших данных, при MALT-лимфоме преобладала гастритоподобная форма роста, которая составила 34,3%.
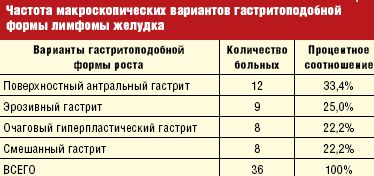
Эндоскопическая картина гастритоподобной формы лимфомы желудка является наиболее вариабельной и по преобладанию макроскопических признаков может проявляться в виде:
Естественно, такое деление является относительно условным, и эти формы выделяются нами по преобладанию наиболее выраженных указанных признаков, симулирующих ту или иную форму гастрита (табл. 3).
Анализируя полученные данные, чаще всего, в 33,4%, отмечался поверхностный антральный гастрит, вторым по частоте стал эрозивный гастрит — 25,0%, с одинаковой частотой в 22,2% встречается очаговый гиперпластический гастрит и смешанный гастрит.
При гастритоподобной форме лимфомы желудка в виде антрального гастрита, как следует из самого определения, визуальные проявления опухоли симулируют воспалительные изменения в антральном отделе желудка, которые отмечены нами в 33,4%. При сохраненной эластичности стенок желудка отмечается пастозность, разрыхленность и очаговая гиперемия слизистой антрального отдела желудка, чередующаяся с участками белесоватого цвета, ее повышенная контактная кровоточивость. Как и при других вариантах, характерным является появление стекловидного блеска. При проведении биопсии подвижность и эластичность слизистой оболочки снижена, отмечается ее фрагментация.
Изменения при лимфоме желудка в виде эрозивного гастрита отмечаются в 25,0% случаев и характеризуются наличием множественных поверхностный острых эрозий неправильной или щелевидной формы на фоне пастозной, неравномерно гиперемированной слизистой с усиленным сосудистым рисунком. Участки эрозий могут локализоваться в различных отделах желудка, чередуясь с неизмененной слизистой, либо занимать изолированную, ограниченную зону. Эластичность стенок остается, как правило, сохраненной или снижена незначительно.
Лимфома желудка в виде локального гиперпластического гастрита. Этот тип лимфомы отмечается в 22,2% случаев и характеризуется умеренным неравномерным утолщением складок на ограниченном участке чаще по большой кривизне и в проксимальном отделе желудка иногда с переходом на переднюю или заднюю стенки. Эластичность стенки сохранена, подвижность складок может быть сохраненной или сниженной. Поверхность складок покрыта вязкой стекловидной слизью, разрыхлена. При инсуффляции складки слизистой пораженного участка, как правило, не расправляются полностью.
В нашем исследовании инфицирование H. pylori было выявлено практически у всех больных при мелкоклеточном варианте и составило 96,7%, при промежуточном варианте MALT-лимфомы желудка — 90%, в отличие от смешанно-клеточных MALT-лимфом, при которых частота инфицирования составила только 53,8%.
При выявлении инфицирования H. pylori мы также определяли степень обсемененности. Оказалось, что при мелкоклеточных MALT-лимфомах высокая частота инфицирования сочетается с выраженной степенью обсемененности чаще (75,9%), чем при других подвариантах. Так, у больных с промежуточным вариантом наличие H. pylori-инфекции сопровождается выраженной степенью обсемененности достоверно реже и выявлено в 38,9%, при смешанных MALT-лифмомах выраженная степень обсемененности установлена у 57,1% пациентов.
Умеренная степень обсемененности при мелкоклеточных опухолях выявлена у 20,7%, при промежуточном варианте чаще — у 61,1%, а при смешанной MALT-лимфоме — у 14,3%.
Слабая степень обсемененности H. pylori встречается у больных MALT-лимфомой желудка крайне редко, она была определена лишь у трех пациентов.
Терапия больных первичной MALT-лимфомой представляет ряд особенностей. Это обусловлено тем, что в мировой практике накоплен относительно небольшой опыт использования всех видов лечебного воздействия — антихеликобактерной терапии, химиотерапии, лучевой терапии, хирургического лечения и их сочетаний.
Антихеликобактерная терапия использовалась нами только при I стадии (классификация Lugano, 1993) MALT-лимфомы желудка мелкоклеточного строения. Лечение проводилось в соответствии с рекомендациями Международного протокола LY03 по изучению MALT-лимфом желудка низкой степени злокачественности [10]. Нами применялась трехкомпонентная схема первой линии эрадикационной терапии, включающая одновременное применение в течение 10–14 дней следующих препаратов:
В результате проведенного лечения у 14 пациентов (87,5%) из 16 больных была достигнута полная ремиссия, у 2 больных (12,5%) констатирована стабилизация заболевания.
Терапевтический эффект антибиотикотерапии реализовался постепенно. Нами установлена последовательность исчезновения проявлений болезни. Первыми ликвидировались клинические симптомы: боль, изжога, тошнота, желудочный дискомфорт.
Вслед за эрадикацией H. pylori постепенно уменьшались визуальные эндоскопические проявления опухолевого поражения: сокращались размеры опухолевого поражения, подслизистой инфильтрации, уменьшался калибр складок слизистой, происходило рубцевание специфических язвенных дефектов, затем восстанавливалась нормальная архитектоника слизистой, исчезала деформация стенок желудка.
Необходимо акцентировать внимание на том, что сроки наступления полного терапевтического эффекта весьма вариабельны. Полная ремиссия, подтвержденная гистологическим и иммунологическим исследованием гастробиоптатов, была диагностирована у больных, получавших антихеликобактерное лечение, в сроки от 2 до 10 месяцев (медиана 5,5 месяцев).
Это означает, что лечение мелкоклеточных MALT-лимфом с применением антихеликобактерных препаратов — это терапия, осуществленная всего за 10–14 дней, но требующая в последующем взвешенного динамического наблюдения и корректной оценки происходящих изменений. Темп наступления полного клинического благополучия является косвенным признаком прогнозирования терапевтического эффекта.
Из 14 больных с подтвержденной полной ремиссией вследствие антихеликобактерной терапии только у одной больной в возрасте 51 год был констатирован рецидив заболевания при контрольном обследовании через 7 месяцев после окончания лечения без каких-либо клинических проявлений. Трактовка эндоскопической картины была сложной: осуществлялась дифференциальная диагностика между эрозивным гастритом и минимальными проявлениями лимфомы. Рецидив был подтвержден иммуноморфологическими исследованиями. В последующем больная получала последовательное лечение Лейкераном (хлорамбуцил), COP с эффектом, который расценен нами как стабилизация заболевания. Учитывая клиническое благополучие, а также наличие тяжелой сопутствующей патологии, было решено хирургическое лечение не применять, а больную оставить под динамическим наблюдением. В течение последующих 36 месяцев больной проводится регулярное обследование (каждые 4–5 месяцев). За этот период наблюдения прогрессирования заболевания не наступило по настоящее время.
Это наблюдение демонстрирует особое свойство мелкоклеточной MALT-лимфомы. Сочетание клинического благополучия с объективными данными стабилизации позволяет длительно наблюдать за больными на фоне проведения регулярного полноценного обследования.
Таким образом, антихеликобактерная терапия правомочна и эффективна при первичных MALT-лимфомах желудка, но при обязательном строгом соблюдении показаний к ее использованию — I стадия процесса с небольшим локализованным поражением слизистого и подслизистого слоев при H. pylori-позитивных опухолях. Обязательным является динамическое исследование опухолевого субстрата на наличие H. pylori, эрадикация которого необходима для реализации противоопухолевого эффекта. Отсутствие эрадикации H. pylori требует использования химиотерапии с повторными курсами антибиотикотерапии.