макрофаги что это такое в мазке у женщин
Роль макрофагов в маточно-плацентарных взаимодействиях при урогенитальном хламидиозе
Сибирский государственный медицинский университет, г. Томск
Введение. Макрофаги, наряду с NK-клетками (Natural killer, естественными киллерными клетками), являются наиболее многочисленной популяцией иммунокомпетентных клеток в маточно-плацентарной области [8]. Цитокины, вырабатываемые местными макрофагами, выступают посредниками в развитии воспалительных и иммунных реакций в системе мать-плацента-плод с нарушением морфологических и функциональных свойств клеточных мембран, энергетического обмена, истощением защитного резерва клеток [3].
Однако при наступлении беременности макрофаги, находящиеся в базальной децидуальной оболочке, приобретают специфический фенотип, который участвует в различных аспектах местного гомеостаза, развитии плаценты и в толерантности материнского организма к полуаллогенному трофобласту [12, 15]. Изменения количественного содержания или функционирования децидуальных макрофагов может нарушать функции инвазивного цитотрофобласта и плацентарное развитие, приводя к различным нарушениям беременности, вплоть до ее прерывания [13, 14]. Согласно данным разных исследователей, содержание макрофагов в базальной децидуальной оболочке достаточно велико (около 20 %) и остается таковым на протяжении всей беременности [13, 14]. При наличии инфекции, в условиях сниженной общей иммунореактивности беременной, децидуальные макрофаги участвуют в клеточном иммунном ответе, реализуют иммунные реакции, располагаясь в непосредственной близости к «объекту реакции» [2, 4, 7].
Второй популяцией макрофагов, локализующихся на границе мать-плод, являются макрофаги ворсин хориона или клетки Кащенко-Гофбауэра, имеющие плодное происхождение [8]. Их содержание в 4-20 недель гестации может составлять до 40 % всех нетрофобластных клеток [10]. В ранние сроки беременности клетки Кащенко-Гофбауэра являются единственной значимой популяцией иммунокомпетентных клеток в строме ворсин, способной стимулировать пролиферацию материнских лимфоцитов in vitro и, следовательно, участвовать в неспецифических защитных реакциях в плаценте при проникновении патогена [11].
В связи с этим целью настоящего исследования явилась оценка изменений численной плотности материнских и плодных макрофагов в ранние сроки беременности при инфицировании Chlamydia trachomatis.
Материал и методы. Методом сплошной выборки были обследованы 102 беременные женщины, направленные для искусственного прерывания беременности по немедицинским показаниям в гестационном сроке 6-8 недель. Средний возраст пациенток, включенных в исследование, статистически значимо не различался в исследованных группах и составил в среднем 28±5,3 лет.
До оперативного вмешательства все женщины были клинически обследованы. Оценку вагинально-цервикального биоценоза проводили на основании анализа уретральных, влагалищных и цервикальных мазков с окраской по Граму. Идентификацию урогенитальных хламидий осуществляли методом полимеразной цепной реакции. Критерием диагностики персистентной формы хламидийной инфекции являлось обнаружение антител класса G в сыворотке крови к рекомбинантному белку теплового шока hsp60 Chlamydia trachomatis; активной формы – совместное обнаружение антител класса G в сыворотке крови иммуноферментным методом к рекомбинантным белкам МОМР (главный белок наружной мембраны) и pgp3 (плазмидийный гликопротеин) Chlamydia trachomatis.
По результатам исследования были выделены следующие группы:
1-я – 24 пациентки с инфицированием Chlamydia trachomatis в активной форме;
2-я – 12 пациенток с инфицированием Chlamydia trachomatis в персистентной форме;
3-я (контрольная) – 66 пациенток без хламидийного инфицирования.
Критериями исключения из исследования являлись: наличие неразвивающейся беременности, анэмбриония, аутоиммунные заболевания, декомпенсированная экстрагенитальная патология и инфекции, передаваемые половым путем (гонорея, трихомониаз, уреа- и микоплазмоз). Женщины, лечившиеся по поводу хламидийной инфекции до наступления настоящей беременности, также исключались из исследования. Критериями включения в настоящее исследование были случаи нормально прогрессирующей беременности у женщин с хламидийной инфекцией.
Материал, полученный при выскабливании полости матки во время артифициального аборта, забирали для гистологического исследования. Объекты фиксировали в 10%-м растворе нейтрального формалина и по общепринятой методике заливали в парафин. После приготовления срезов толщиной 4-6 мкм, проводили иммуногистохимическое окрашивание при помощи моноклональных антител СD68 (Cluster of Differentiation 68) (DakoCytomation, Дания), визуализацию экспрессии осуществляли с использованием набора EnVision (DakoCytomation, Дания). Ядра докрашивали гематоксилином Майера.
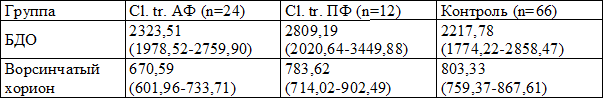
Для подсчета численной плотности клеток в 1 мм 2 среза базальной децидуальной оболочки и ворсинчатого хориона использовали окулярную вставку с известной площадью, при ок. 10 и об. 90. Просмотр и фотографирование микропрепаратов осуществляли на микроскопе «Axiostar plus» (Carl Zeiss, Германия). Cтатистическую обработку результатов проводили при помощи лицензионного пакета программ Statistica 6,0 for Windows. Анализ полученных данных осуществляли методами описательной статистики с вычислением медианы Ме и интерквартильного интервала Q1-Q3. Для оценки различий использовали непараметрический критерий Манна-Уитни. Значимость различий между показателями разных групп принимали при р 2
Примечание: статистически значимые отличия от соответствующей группы при р
Список использованных источников:
1. Айламазян Э.К., Полякова В.О., Линькова Н.С. и др. Роль резидентных иммунных клеток в развитии плаценты в норме и при патологии// Журнал акушерства и женских болезней. 2010. № 6. С. 8-14.
3. Канн Н.Е., Орджоникидзе Н.В. Современные представления о внутриутробной инфекции// Акушерство и гинекология. 2004. № 6. С. 3-5.
5. Мустафина Л.Р., Хон Е.В., Логвинов С.В., Юрьев С.Ю. Морфофункциональная характеристика ворсинчатого хориона в ранние сроки беременности при наличии урогенитальной инфекции// Бюллетень сибирской медицины. 2011. № 6. С. 19-23.
6. Мустафина Л.Р., Логвинов С.В., Юрьев С.Ю. Влияние хламидийного инфицирования цервикального канала на показатели локального иммунитета базальной децидуальной оболочки в ранние сроки беременности// Врач-аспирант. 2012. № 5 (54). С. 176-181.
7. Романовская В.В. Прогностическое значение компонентов врожденного иммунитета (TLR2, TLR4 и HBD1) у беременных с высоким риском реализации внутриутробной инфекции: Автореф. дис. … канд. мед. наук. – М., 2008. 17 с.
9. Сельков С.А., Соколов Д.И. Иммунологические механизмы контроля развития плаценты// Журнал акушерства и женских болезней. 2010. № 1. С. 6-10.
10. Goldstein J., Braverman M., Salafia C. et al. The phenotype of human placental macrophages and its variation with gestational age// Am. J. Pathol. 1988 N 3. Р. 648-659.
11. Hunt J.S., King C.R. Jr., Wood G.W. Evaluation of human chorionic trophoblast cells and placental macrophages as stimulators of maternal lymphocyte proliferation in vitro// J. Reprod. Immunol. 1984 N 6. Р. 377-391.
13. Lash G.E., Otun H.A., Innes B.A. et al. Regulation of extravillous trophoblast invasion by uterine natural killer cells is dependent on gestational age// Hum. Reprod. 2010. N5. P. 1137-1145.
14. Nagamatsu T., Schust D.J. The immunomodulatory roles of macrophages at the maternal-fetal interface// Reprod. Sci. 2010. N3. Р. 209-218.
15. Renaud S.J., Graham C.H. The role of macrophages in utero-placental interactions during normal and pathological pregnancy// Immunol. Invest. 2008. N 5. Р. 535-564.
16. Takeda K., Akira S. Toll-like receptors in innate immunity// Int. Immunol. 2005. N 1. P. 1-14.
Гинекологический мазок «на флору»: на что смотреть, и как понять
Большинству женщин мазок «на флору» знаком, как самый «простой» гинекологический анализ. Однако исследование куда «полезнее», чем может казаться. И всего несколько (а то и одно) отклонений способны подсветить значимые проблемы, еще до появления каких-либо симптомов. Так как же понять полученные результаты? Рассказываем по пунктам.
1. Эпителий
Как известно, любой живой объект в природе имеет ограниченный срок жизни, по истечении которого он погибает «от старости».
Эпителий в гинекологическом мазке – это и есть слущенные «старые» клетки слизистой оболочки влагалища, цервикального или уретры (в зависимости от оцениваемого локуса). Которые могут присутствовать в материале в умеренных количествах.
Превышение нормативных пределов («много» или «обильно») может указывать на:
Уменьшение или отсутствие эпителия в мазке – на атрофические изменения, недостаток эстрадиола или избыток андрогенов.
Кроме того, ввиду зависимости эпителия от уровня половых гормонов, его количество в материале может сильно меняться в зависимости от дня цикла, начиная с единичного «в поле зрения» в самом начале – до умеренного и даже большого количества ближе к овуляции и во время нее.
А появление в мазке так называемых «ключевых клеток» (эпителий, «облепленный» мелкими кокковыми бактериями) – является маркером бактериального вагиноза.
2. Лейкоциты
«Норма» лейкоцитов в мазке также сильно зависит от стадии цикла и уровня половых гормонов, а также исследуемого локуса.
Так, за «максимум» для:
Повышение показателя – очевидно, свидетельствует о воспалении, а полное отсутствие может иметь место в норме в самом начале цикла.
Слизь
Результат «отсутствует», «мало» или «умеренно» для этого показателя является нормой, что тоже связано с индивидуальными особенностями гормонального фона и циклом.
А вот «много» слизи в мазке – может свидетельствовать о том, что мазок взят в середине цикла, дисбиотических изменениях или избытке эстрогенов. Поэтому требует внимания специалиста или, как минимум, контроля в динамике.
Флора
Преобладающей флорой женских половых путей в норме у женщин репродуктивного возраста, как известно, являются лактобактерии (или палочки Дедерлейна). Количество которых может быть от умеренного до обильного, в том зависимости, в том числе, от фазы менструального цикла.
Патологические элементы
Присутствия мицелия грибов, трихомонад, диплококков (в том числе и возбудитель гонореи), лептотрикса, мобилункуса и прочих патогенных микроорганизмов в нормальном мазке не допускается, даже в минимальном количестве. А их выявление – серьезный повод незамедлительно обратиться за лечением.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
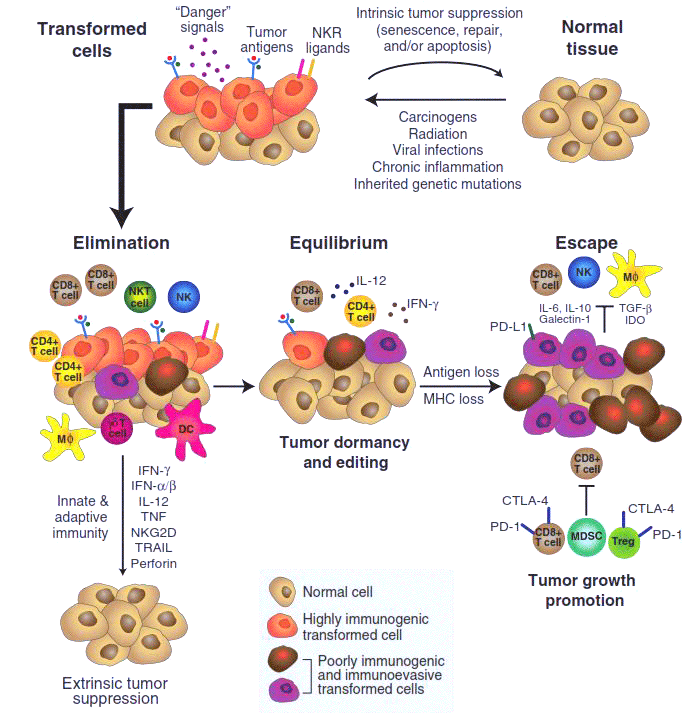
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
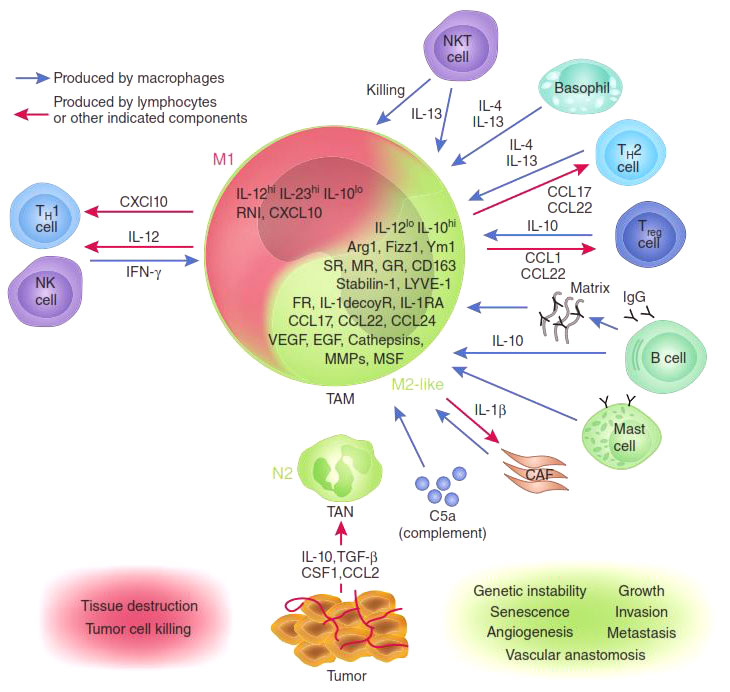
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Гинекологический мазок «на флору»: на что смотреть, и как понять
Большинству женщин мазок «на флору» знаком, как самый «простой» гинекологический анализ. Однако исследование куда «полезнее», чем может казаться. И всего несколько (а то и одно) отклонений способны подсветить значимые проблемы, еще до появления каких-либо симптомов. Так как же понять полученные результаты? Рассказываем по пунктам.
1. Эпителий
Как известно, любой живой объект в природе имеет ограниченный срок жизни, по истечении которого он погибает «от старости».
Эпителий в гинекологическом мазке – это и есть слущенные «старые» клетки слизистой оболочки влагалища, цервикального или уретры (в зависимости от оцениваемого локуса). Которые могут присутствовать в материале в умеренных количествах.
Превышение нормативных пределов («много» или «обильно») может указывать на:
Уменьшение или отсутствие эпителия в мазке – на атрофические изменения, недостаток эстрадиола или избыток андрогенов.
Кроме того, ввиду зависимости эпителия от уровня половых гормонов, его количество в материале может сильно меняться в зависимости от дня цикла, начиная с единичного «в поле зрения» в самом начале – до умеренного и даже большого количества ближе к овуляции и во время нее.
А появление в мазке так называемых «ключевых клеток» (эпителий, «облепленный» мелкими кокковыми бактериями) – является маркером бактериального вагиноза.
2. Лейкоциты
«Норма» лейкоцитов в мазке также сильно зависит от стадии цикла и уровня половых гормонов, а также исследуемого локуса.
Так, за «максимум» для:
Повышение показателя – очевидно, свидетельствует о воспалении, а полное отсутствие может иметь место в норме в самом начале цикла.
Слизь
Результат «отсутствует», «мало» или «умеренно» для этого показателя является нормой, что тоже связано с индивидуальными особенностями гормонального фона и циклом.
А вот «много» слизи в мазке – может свидетельствовать о том, что мазок взят в середине цикла, дисбиотических изменениях или избытке эстрогенов. Поэтому требует внимания специалиста или, как минимум, контроля в динамике.
Флора
Преобладающей флорой женских половых путей в норме у женщин репродуктивного возраста, как известно, являются лактобактерии (или палочки Дедерлейна). Количество которых может быть от умеренного до обильного, в том зависимости, в том числе, от фазы менструального цикла.
Выявление в мазке «смешанной, преимущественно палочковой» флоры – также является вариантом нормой. Правда, если эти самые палочки – «мелкие, полиморфные», то есть морфологически соответствуют лактобактериям.
Преобладание в мазке кокковой флоры, и, особенно, если ее количество «обильно» – признак выраженных дисбиотических нарушений. Что требует более детальной оценки качества микрофлоры и, что важно, соотношения ее представителей между собой (к примеру, анализ «Фемофлор-16». Поскольку ассоциировано со множеством репродуктивных патологий (в том числе и скрытого характера).
Патологические элементы
Присутствия мицелия грибов, трихомонад, диплококков (в том числе и возбудитель гонореи), лептотрикса, мобилункуса и прочих патогенных микроорганизмов в нормальном мазке не допускается, даже в минимальном количестве. А их выявление – серьезный повод незамедлительно обратиться за лечением.