макрофаги что это в пункции молочной железы
Иммунные клетки помогают перестраиваться молочной железе
Когда молочной железе становятся ненужными некоторые протоки, образовавшиеся в период вскармливания, их съедают местные иммунные клетки.
Когда приходит время кормить молоком детёныша, молочные железы меняются – в них разрастаются молочные протоки, собирающие молоко от скоплений железистых клеток. Когда период вскармливания заканчивается, молочная железа снова меняется: разветвлённые многочисленные протоки исчезают, их клетки отмирают. Естественно, всё это подчиняется гормональным сигналам, однако в самой железе должны быть механизмы, обеспечивающие такие перестройки в структуре.
Исследователи из Медицинского института Уолтера и Элизы Холл вместе с коллегами из Мельбурнского университета сообщают в Nature Cell Biology, что им удалось обнаружить клетки, которые помогают избавиться молочной железе от лишних протоков. Это макрофаги – иммунные клетки, которые есть во многих органах и тканях; они активно ползают между другими клетками, образующими орган, и в буквальном смысле поедают всё подозрительное и ненужное: бактерий, вирусы, молекулярные обломки, оставшиеся от погибших клеток, и т. д. Макрофаги, обслуживающие конкретный орган, называют резидентными макрофагами – если не случается ничего чрезвычайного, они свой орган не покидают.
Авторы работы утверждают, что те макрофаги, которые обнаружились в молочной железе – это новая их разновидность, до сих пор никому не известная. Звездообразные макрофаги сидят в молочных протоках, они малоподвижны, стиснуты между двумя слоями клеток, и образуют что-то вроде сети. Когда клетки протоков начинают отмирать за ненадобностью, макрофаги протягивают к ним свои «руки»-отростки и поедают их. То есть новые макрофаги помогают молочной железе вернуться в некормящее состояние. Никакие другие иммунные клетки эту работу делать не могут: когда местные макрофаги удаляли из протоков молочной железы, ненужные клетки оставались несъеденными.
Притом макрофаги должны понимать, когда молочные протоки нужно уничтожать и когда не нужно. Рак молочной железы, одна из самых распространённых злокачественных опухолей, начинается с клеток протоков молочной железы, и, по словам исследователей, число макрофагов увеличивается по мере роста опухоли. Иммунитет должен уничтожать раковые клетки, но, возможно, макрофаги мешают другим иммунным клеткам делать своё дело, потому что полагают, что сейчас просто настало время молочной железе разрастаться.
Возможно, опухоли груди будет легче лечить, если найти способ если как-то подействовать на эти грудные макрофаги, сделать так, чтобы они мешали другим иммунным клеткам атаковать раковые клетки, а ещё лучше – чтобы они сами начали их уничтожать.
Функции макрофагов в различных условиях микроокружения опухоли
Связанные с опухолью макрофаги, как известно, стимулируют ключевые этапы прогрессирования опухоли. В этом обзоре рассказывается о многочисленных экспериментальных и клинических исследованиях, проведенных с целью изучения функций, регуляции и клинической значимости опухолевых макрофагов. В отношении клинической значимости наиболее интересны три участка инвазии раковых клеток: опухолевые гнезда, пограничная зона между стромой и опухолевыми клетками, а также области, близкие к сосудистой сети опухоли или удаленные от нее. Более полное понимание разнообразия опухолевых макрофагов может привести к разработке избирательных методов лечения, основанных на восстановлении противораковых функций этих клеток.
Вступление
Опухолевые макрофаги (ОМ) изобилуют в большинстве типов злокачественных новообразований, способствуют опухолевому ангиогенезу, выходу раковых клеток из опухоли в кровоток, способствуют их выживанию и постоянному росту в метастатических колониях, подавлению противоопухолевых иммунных механизмов. В то же время ОМ могут подавлять, дополнять или опосредовать противоопухолевые эффекты цитотоксических агентов, лучевой терапии, антиангиогенных препаратов и ингибиторов контрольных точек.
Происхождение этих клеток в настоящее время является предметом обсуждения. Недавние исследования показали, что макрофаги во многих тканях происходят не из циркулирующих моноцитов, как первоначально предполагалось, а из эмбриональных макрофагов (особенно из макрофагов желточного мешка), которые закладываются в тканях во время развития. Эти предшественники остаются в тканях взрослого организма и размножаются, таким образом, сохраняясь независимо от гемопоэтической системы взрослого человека. В некоторых органах, например, в кишечнике, основные популяции макрофагов развиваются путем рекрутирования моноцитов. Выборочное истощение каждого из этих двух подтипов ОМ показало, что только эмбриональные макрофаги поддерживают опухолевый рост.
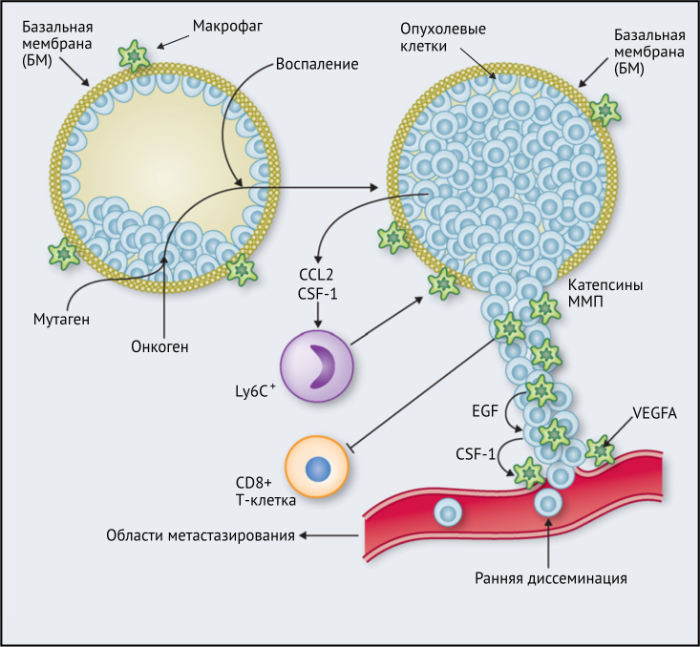
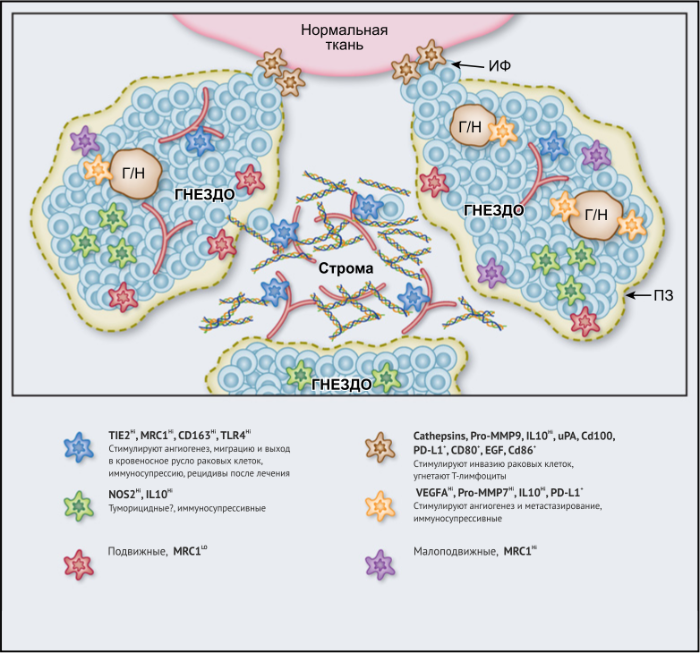
ОМ могут находиться в различных состояниях активации. Обычно они отклоняются от «классически» активированного, агрессивного по отношению к опухоли фенотипа (иногда называемого M1) в сторону «альтернативно» активированного опухолевого промотора (M2). Однако как и макрофаги во многих других тканях, ОM обладают замечательной функциональной пластичностью и часто экспрессируют маркеры, характерные для обоих состояний активации, что делает такой полярный подход к их классификации неточным. Предполагается, что функции ОМ могут, по крайней мере частично, регулироваться их расположением в опухоли; что они проявляют разные функции по меньшей мере в трех областях инвазии раковых клеток: области высокой плотности раковых клеток (так называемом «опухолевом гнезде»); периваскулярной (ПВ) нише; и плохо васкуляризованных гипоксических/некротических областях опухоли (Рис.1 и 2).
Области инвазии
Существует по крайней мере три основных локализации, в которых прогрессия опухоли была ассоциирована с повышенной инвазией клеток.
Результаты исследований, проведенных на мышах, показывают, что макрофаги способствуют развитию злокачественных опухолей различными способами: реконструируют внеклеточный матрикс, опосредуют разрушение базальной мембраны, увеличивают подвижность раковых клеток, и их способность к миграции, способствуют прогрессированию преинвазивных поражений, выделяют фактор роста эндотелия сосудов A (VEGF-A). Макрофаги вокруг преинвазивных поражений молочных желез у мышей высвобождают CXCR2-связывающие хемокины CXCL1 и CXCL5, которые способствуют миграции и инвазии соседних предростопластических (предраковых) эпителиальных клеток. В то же время подавление активности макрофагов вызывало замедление развития инвазии опухолевых клеток и развития опухоли в целом.
Недавнее исследование на модели рака легких Kras G12D показало, что нарушение регуляции онкогенов, таких как Myc, в раковых клетках вызывает трансформацию медленно прогрессирующей аденомы легкого в агрессивную аденокарциному. Это связано с тем, что изменения в Myc стимулировали увеличение экспрессии CCL9 и IL-23 эпителиальными клетками легких. CCL9 затем стимулировал накопление VEGFA + макрофагов и, следовательно, ангиогенез опухоли, а также PD-L1-зависимое вытеснение T- и B-клеток. Кроме того, IL-23 стимулировал гибель Т- и В-клеток и цитотоксических NK-клеток (Рис.1).
Следует отметить, что антитела против CD68 продолжают широко использоваться в качестве иммунных меток ОМ в опухолях (Таблица 1). Однако как и многие другие антитела, маркирующие отдельные типы клеток, человеческие анти-CD68 иногда маркируют клетки, отличные от ОM. Например, методом качественного анализа с помощью иммуноокрашивания удалось установить, что некоторые клетки CD68 + в опухолях молочной железы человека не экспрессируют рецептор к КСФ-1 (КСФ-1Р), CD45 или другие маркеры эпителиальных клеток, эндотелиальных клеток или клеток стенок сосудов (то есть гладкомышечных клеток, перицитов или фибробластов). Остается неизвестной как принадлежность этих клеток, так и то, маркируются ли они антителами к CD68 иного происхождения.
ОМ в ИФ опухоли поджелудочной железы RIP1-Tag2 мыши усиливают инвазивный потенциал раковых клеток посредством экспрессии катепсинов B и S, двух ферментов, регулируемых IL-4, высвобождаемым раковыми клетками и инфильтрирующими опухоль Т-клетками. Кроме того, было показано, что CD4 + Т-клетки в опухолях MMTV-PyMT увеличивают инвазивность раковых клеток благодаря IL-4, что затем стимулирует ОM экспрессировать эпидермальный фактора роста (EGF).
Эти экспериментальные данные хорошо согласуются с данными исследований, согласно которым ОM в ИФ опухолей желудка человека выделяют MMP9 — фермент, разрушающий матрикс, — и рецептор сериновых протеаз, урокиназный активатор плазминогена (УАП, урокиназа). Интересно, что ОМ вдоль ИФ первичной карциномы толстой кишки экспрессируют CD80 и CD86 (костимуляторные сигналы, необходимые для активации Т-клеток), что указывает на то, что они могут иметь потенциал для стимулирования противоопухолевого иммунитета при этом типе рака. Это может объяснить наблюдение, что повышенное количество CD68 + ОM в ИФ колоректальных опухолей человека коррелируют с более высокой выживаемостью без рецидива (RFS) (Таблица 1). Тем не менее, в ИФ опухолей могут присутствовать различные ОM-подмножества, причем некоторые из них являются иммуносупрессивными. Например, ОM в ИФ гепатоцеллюлярных карцином (ГЦК) экспрессируют более высокое количество лиганда иммуносупрессивной контрольной точки PD-L1, чем ОМ в других опухолевых гнездах, и связаны с плохой выживаемостью. Кроме того, было показано, что семафорин 4D (SEMA4D, CD100) — цитокин, экспрессия которого особенно выражена в ИФ опухоли толстой кишки Colon26, стимулирует ОM, которые экспрессируют иммуносупрессивный цитокин IL-10 в ИФ, и таким образом подавляют активированные CD8 + Т-клетки. Блокада антител SEMA4D подавляла ОМ в ИФ и повышала эффективность лечения ингибиторами контрольных анти-PD-1 и анти-CTLA4 (Рис.2).
Опухолевые гнезда
Возможные функции ОМ в непосредственной близости от раковых клеток в опухолевых «гнездах», по-видимому, варьируются в зависимости от типа опухоли. Например, ОM, экспрессирующие NOS2 — фермент, связанный с их цитотоксическим потенциалом, — обнаруживаются в тесном контакте с раковыми клетками в некоторых опухолях предстательной железы, а большое количество ОM в опухолевых гнездах коррелирует с улучшенным прогнозом при раке эндометрия, а также снижением количества рецидивов рака желудка (Таблица 1). Повышенное количество ОM коррелирует с уменьшенной общей выживаемостью и RFS при злокачественных меланомах, а также опухолях молочной железы и пищевода (Таблица 1). ОМ в гнездах ГЦК человека экспрессируют IL-10 и рекрутируют иммуносупрессивные клетки FoxP3 + Treg, хотя нет данных, что эти Treg влияют на исход заболевания (Рис. 2).
Интересно, что ОМ экспрессируют сигнальный регуляторный белок альфа (SIRP-α) на своей поверхности, который связывается с трансмембранным белком CD47 на злокачественных клетках. Когда это происходит, подавляется способность ОM обнаруживать и фагоцитировать опухолевые клетки. Различные исследования показали, что блокирование CD47 прерывает этот сигнал «не ешь меня» и вызывает разрушение опухолей при посредстве ОM у мышей, а высокая экспрессия CD47 обуславливает плохой прогноз рака мочевого пузыря, острого миелоидного лейкоза, неходжкинских лимфом и рака молочной железы. Так опухолевые клетки уклоняются от наблюдения ОМ.
Строма
В области стромы большинства солидных опухолей опухолевых клеток обычно мало либо нет вовсе. Она состоит из сложной сети макромолекул, формирующих внеклеточный матрикс(ВКМ), к которым относятся коллагеновые фибриллы, ламинин, фибронектин, тенасцин C и гиалуроновая кислоту (ГК). В нем часто находятся популяции различных клеток, включая фибробласты, эндотелиальные клетки, перициты, лимфоциты и миелоидные клетки. Ряд исследований показал, что компоненты ВКМ (и/или продукты его протеолиза), такие как фибронектин, ламинин-10, версикан (хондроитинсульфатсодержащий протеогликан) и фрагменты ГК, регулируют фенотип макрофагов. Пинто и его коллеги в исследованиях in vitro показали, что бесклеточный ВКМ, выделенный из колоректальных опухолей, стимулирует макрофаги экспрессировать IL-10, TGF-β и снижает экспрессию рецепторов хемокинов C-C 7 (CCR7), TNF-α и IL-6. Кроме того, повышенная экспрессия стромальными ОМ лигандов хемокинов C-C 18 (CCL18) связана с повышенным метастазированием и снижением выживаемости у пациентов при раке молочной железы. Это согласуется с рядом исследований, свидетельствующих о корреляции между большим количеством стромальных ОМ и низкой общей выживаемостью и RFS при опухолях молочной железы, пищевода, желудка, поджелудочной железы, орофациальных, кожных (Таблица 1). Существует зависимость от типа опухоли, поскольку такой корреляции при раке эндометрия, шейки матки и легких не выявлено, а при раке мочевого пузыря прослеживается уменьшение метастазирования в лимфатических узлах и улучшение выживаемости (Таблица 1).
Помимо описанных выше химических компонентов стромы опухоли, функции ОМ также регулируют ее биофизические свойства. Архитектоника и плотность ВКМ регулирует экспрессию различных провоспалительных генов макрофагами in vitro путем активации сигнальных путей TLR4 в этих клетках. Высокие уровни 22 общих составляющих матрикса («меток матрикса») положительно коррелируют как с плотностью опухоли, так и с инфильтрацией ОМ при метастазах рака яичников, хотя еще предстоит выяснить, есть ли причинно-следственная связь между инфильтрацией и структурой опухоли. Также следует отметить, что разные области стромы при данной опухоли могут различаться по своим химическим и биофизическим свойствам и влиять на ОМ по-разному (Рис. 2).
Периваскулярная ниша
Подмножество ОМ лежит близко или на поверхности кровеносных сосудов в опухолях мышей и человека. Эти клетки часто экспрессируют большое количество маркеров, связанных с M2: TIE2 (основной рецептор ангиопоэтина), MRC1 и CD163, — и играют ключевую роль в стимулировании ангиогенеза опухоли, метастазирования и рецидива после терапии первой линии. Из-за их относительно высокой экспрессии TIE2 эти клетки первоначально назывались «TIE2-экспрессирующие моноциты/макрофаги (TEM)». Частота TEM также положительно коррелирует с плотностью микрососудов (MVD) у некоторых типов опухолей человека (Табл. 1).
Генетическая делеция периваскулярных (ПВ) TIE2 + ОМ или фармакологическая блокада основного лиганда TIE2 — ангиопоэтина 2 (AGPT2), — продемонстрировали важную роль этого подмножества ОM в ангиогенезе опухоли и ее росте у различных мышиных моделей рака. Стимуляция экспрессии генов TEM, выделенных из опухолей мыши, привела к более высокой экспрессии ряда генов, способствующих развитию опухолей, включая Mmp9, Vegfa, Cxcl12, Tlr4 и Nrp1, чем TIE2- ОM из тех же опухолей.
ПВ TIE2 + ОM также участвовали в рецидиве первичных опухолей мыши после различных форм лечения. Они учащают рецидивы глиомы после местного облучения, а также при опухолях легких и молочной железы после химиотерапии. В такие моменты они экспрессируют большое количество CXCR4 и рекрутируются с помощью активированного CXCL12 в ПВ нише. Это подмножество ОМ затем стимулирует реваскуляризацию и рост опухоли посредством высвобождения VEGF-A. Позднее исследование подтвердило, что экспрессия TIE2 в ОМ необходима для стимуляции васкуляризации после химиотерапии у мышей. Кроме того, недавно рекрутированные моноциты также мигрируют вокруг опухолей, не подвергавшихся терапии, зависимым от CXCR4 образом. Меченые моноциты проникали в ПВ зону опухоли PyMT, где они затем подвергались воздействию TGFβ, выделяемого раковыми клетками, что стимулировало эти моноциты повышать свою экспрессию CXCR4 и мигрировать к CXCL12-экспрессирующим фибробластам вокруг опухолевых кровеносных сосудов в богатых коллагеном стромальных областях. Как только они примыкают к сосудам, моноциты дифференцируются в «метастаз-ассистирующие» ПВ ОM, участвующие в TMEM.
Наконец, в метастатических областях, таких, как легкие, подмножество макрофагов CCR2 + Ly6C + способствует выходу раковых клеток в кровеносное русло и образованию из них метастазов. Эти «метастаз-ассоциированные макрофаги» (MAM) были использованы в мышиных моделях опухолей, чтобы напрямую связать молекулу адгезии сосудистых клеток-1 (VCAM-1) с раковыми клетками через их α4-интегрины. Этот процесс впоследствии увеличивает выживаемость раковых клеток в таких метастатических областях. Кроме того, связывание CCL2 с CCR2 на MAM стимулирует высвобождение ими CCL3, который связывается с CCR1 на раковых клетках и облегчает их удержание в легких. Эти MAM также способствуют постоянному росту метастатических повреждений с помощью сигналов VEGFR1 и CSF-1R.
Гипоксические/некротические области
Гипоксия является отличительной чертой солидных опухолей и связана с увеличением инвазии и метастазов, сопротивлением терапии и плохим клиническим исходом. Гипоксические области обычно имеют парциальное давление кислорода (рО2) ниже 10 мм рт. ст. Они расположены более чем в 150 мкм от опухолевых кровеносных сосудов. Они образуются в опухолях, когда потребность клеток в кислороде опережает их снабжение плохо организованными опухолевыми сосудами. Эти области были идентифицированы в опухолевых срезах с использованием маркеров гипоксических клеток, например, пимонидазола, или иммуноблока для индуцируемой гипоксией альфа-субъединицы транскрипционных факторов HIF 1 и 2. Большое количество гипоксических ОМ ассоциируется с повышенным уровнем ангиогенеза опухолей, метастазами, сниженной RFS и/или снижением общей выживаемости при раке молочной железы, эндометрия и шейки матки (Таблица 1).
ОM в таких областях регулируют HIF 1 и 2 и различные гены-мишени HIF, такие как VEGF-A, GLUT1 и MMP7. Хемокины, усиливающие гипоксию, рекрутируют в гипоксические области ОМ, в том числе хемокин C-X-C 12 (CXCL12), полипептид-активирующий эндотелий-клеточный моноцит II (EMAP-II), эндотелин 2, VEGF-A и SEMA3A. Гипоксические ОМ иммобилизируются в этих областях прямым ингибирующим действием гипоксии на их подвижность и снижением экспрессии их рецепторов опухолевых хемокинов CCR2, CCR5 и NRP1.
Гипоксические ОМ способствуют ангиогенезу опухоли, уклонению от иммунитета и метастазированию в различных экспериментальных моделях. Например, они регулируют экспрессию большого количества проангиогенных и иммуносупрессивных цитокинов в гипоксических зонах опухоли, а когда их проникновение в гипоксические области опухолей затруднено сигнальной блокадой SEMA3A/NRP1, опухолевый ангиогенез заметно снижается и противоопухолевый иммунитет восстанавливается. Гипоксические ОМ также способны подавлять активацию Т-клеток различными способами, влияя на IL-10 и на контрольные точки, например, через лиганд PD-L1. Макрофаги, кокультивированные с клетками ГЦК в гипоксических условиях, увеличивают экспрессию индоламин 2,3-диоксигеназы (IDO), которая подавляет пролиферацию местных цитотоксических Т-клеток и увеличивает популяцию клеток Treg.
Хотя воздействие гипоксии само по себе не может изменить фенотип ОМ в отношении стимуляции роста опухоли, некоторые исследования показали, что низкий уровень рН и лактат (которые накапливаются в слабо васкуляризированных, гипоксических областях из-за плохого сосудистого питания) совместно индуцируют проангиогенный фенотип ОМ, который, в свою очередь, восстанавливает перфузию крови. Действительно, молочная кислота может стимулировать экспрессию VEGF-A макрофагами. Как упоминалось ранее, этот цитокин является не только проангиогенным в опухолях, но также способен стимулировать выход в сосуды раковых клеток.
Опухолевая гипоксия также может модулировать функции ОМ опосредованно, стимулируя раковые клетки выделить белок группы 1 с высокой подвижностью (HMGB1), который, в свою очередь, стимулирует продукцию IL-10 ОM. Гипоксия также индуцирует метаболические изменения в ОМ, которые затем непосредственно влияют на функции соседних клеток. Например, гипоксия стимулирует экспрессию REDD1, ингибитора mTOR и ключевого модулятора метаболизма в ответ на доступность питательных веществ и потребность в энергии. Ингибирование mTOR в ОM сильно снижает их поглощение глюкозы и активность гликолиза, оставляя больше глюкозы для соседних эндотелиальных клеток. Это повышает способность раковых клеток проникать в сосудистое русло, соответственно, приводит к формированию отдаленных метастазов.
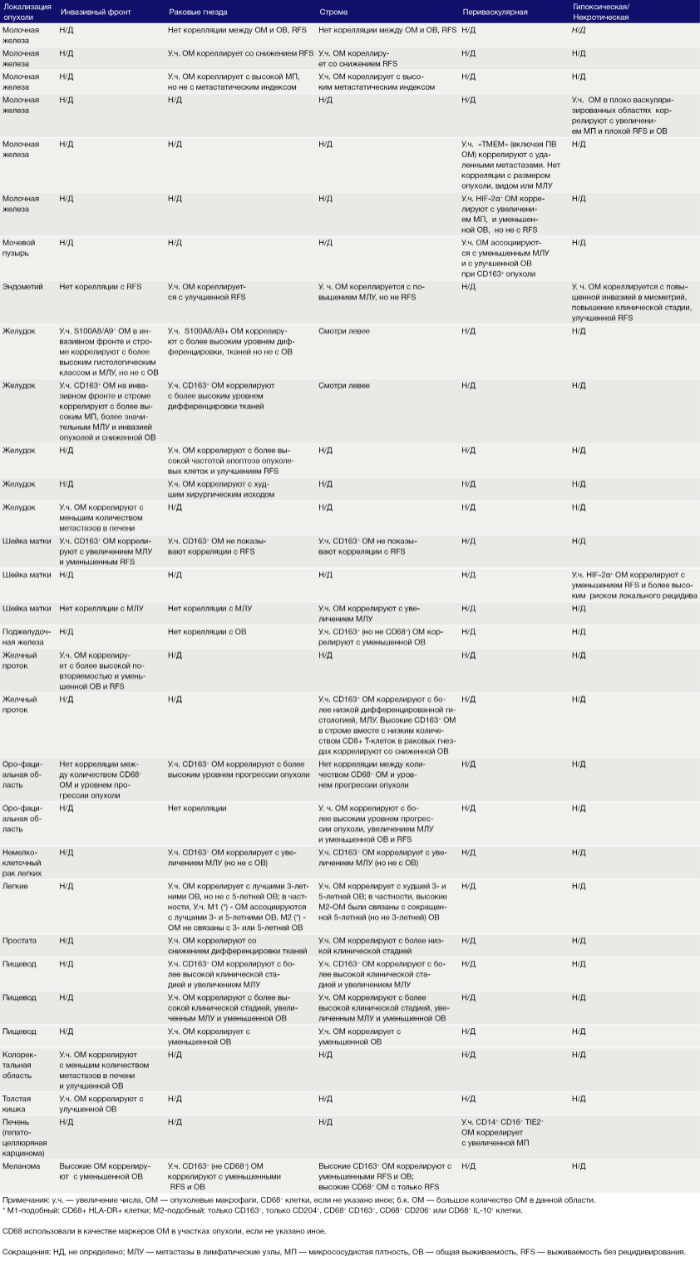
Таблица 1. Опухолевые макрофаги в различных злокачественных новообразованиях человека: корреляция с клинико-патологическими проявлениями
Заключение
Ряд экспериментальных исследований на мышах подтвердил способность различных опухолевых популяций дифференцированно регулировать фенотип ОМ. Важность этого подчеркивается клиническими отчетами, показывающими, что число или фенотип ОМ в определенных областях опухоли коррелируют с RFS и выживаемостью (Таблица 1).
Имеются данные о роли подмножеств ОM в определенных областях опухолей, ограничивающих ответ опухолей на лечение. Например, облучение, сосудистые разрушающие агенты и цитотоксические препараты индуцируют пролиферацию ПВ ОM, что способствует ангиогенезу опухоли и рецидиву после терапии. Гипоксические ОМ также были вовлечены в устойчивость опухолей к противоопухолевой терапии и способствуют рецидиву.
Демонстрация того, что ОМ стимулируют ряд механизмов опухолеобразования на мышиных моделях опухолей, побудила к развитию терапевтических подходов к истощению или перепрограммированию ОМ. На сегодняшний день общие ингибиторы ОМ, включая те, которые нацелены на CSF-1-CSF-1R и CCL-CCR2, в значительной степени не показали эффективности в клинических испытаниях в качестве монотерапии рака, хотя они могут оказаться эффективными в сочетании с другими терапевтическими агентами. Ингибитор CSF-1-R PLX3397 показал значительную эффективность при лечении теносиновиальной гигантоклеточной опухоли, лечение также выявило побочное действие, вызванное долгосрочным истощением всех макрофагов.
Таргетная терапия в отношении определенных ОM-подмножеств в опухолях может стать отличным методом в качестве противоопухолевой терапии посредством истощения или перепрограммирования тех ОМ, которые способствуют с помощью различных механизмов опухолевой прогрессии, при этом она должна оставлять или усиливать те подмножества ОМ, которые способствуют противоопухолевому иммунитету. Прогресс в нашем понимании того, как фенотип подмножеств ОМ в различных областях опухоли зависит от их онтогенеза, статуса активации и сложного комплекса местных взаимодействий поможет разработать такой терапевтический подход. Раскрытие сложного массива влияний на поведение ОM потребует многогранного подхода к исследованиям, однако это может привести к появлению новых возможностей в лечении опухолевых заболеваний, появлению новых таргетных противоопухолевых препаратов.
Источник: Yang M. et al. Diverse Functions of Macrophages in Different Tumor Microenvironments //Cancer research. – 2018. – Т. 78. – №. 19. – С. 5492-5503.
Макрофаги в молочной и щитовидной железе
Осмотр и пальпация (ощупывание) щитовидной железы 
В молочной и щитовидной железе при этом можно определить уплотнения и другие изменения, которые могут быть признаком растущей опухоли. Однако не всегда узел в тканях говорит о раке. Также это может быть киста, доброкачественное новообразование и т.д. Чтобы сделать предположение о диагнозе и запланировать лечение, делают биопсию желез – добывают кусочек ткани и под микроскопом изучают его клеточный состав. Если речь идет о молочной железе, то женщинам также могут провести исследование выделений из соска. В зависимости от результатов микроскопии устанавливают, что у человека за болезнь и как ее лечить. Наличие определенных клеток во взятой пробе указывает на наличие конкретного заболевания.
В этом посте мы не будем детально описывать разные картины биоптата щитовидной и молочных желез, разберем лишь частный вопрос: присутствие в этих органах клеток-макрофагов.
Макрофаги в молочной железе:

Совершенно правильная логическая цепочка. Если в ткани молочной железы и выделениях из соска много фагоцитов, это говорит о патологии. Так, когда в препарате присутствуют нейтрофилы, макрофаги и гистиоциты (это разновидность макрофагов, находящаяся в норме в соединительной ткани), то это прямо указывает на наличие воспалительного процесса.
Перед лаборантом, изучающим добытый от пациента образец, стоит задача не только обнаружить, но и изучить строение найденных макрофагов. В них всегда немало всякого «мусора», который представляет собой остатки и фрагменты перевариваемых или уже переваренных ими агрессоров. Если удается распознать, что именно находится внутри макрофагов, это помогает понять, против чего боролись эти фагоциты, а значит, сделать вывод, что за болезнь у пациента.
Так, иногда встречаются макрофаги в молочной железе с включениями «обломков» эритроцитов и гемосидерина (гемосидерин – один из конечных продуктов разрушения гемоглобина). Если макрофаги с гемосидерином находят в препарате, это говорит о присутствии в железе полости, внутри которой находится кровь. Последнее встречается при посттравматических изменениях, при некоторых формах мастопатии.
Макрофаги в щитовидной железе:
Макрофаги и нейтрофилы в щитовидной железе также в большом количестве обнаруживаются при заболеваниях. Довольно распространена такая патология этого органа как киста. Сделав пункцию (прокол) кисты, специалисты получают жидкость. В ней мало клеток, среди них преобладают макрофаги с гемосидерином – их еще называют сидерофагами.
Также макрофаги в щитовидной железе могут встречаться при других заболеваниях, например, при воспалительном процессе. Однако при аутоиммунном тиреоидите, который является основным воспалительным заболеванием этого органа, таких фагоцитов в биоптате немного – в железе преобладают лимфоциты, а другие иммунные клетки встречаются реже.
Итак, присутствие большого количества макрофагов в описанных 
Кстати, когда речь идет о выздоровлении, важно не только непосредственно воздействовать на причину болезни (онкологический, воспалительный, дисгормональный процесс), но и уделять внимание поддержке иммунной системы, частью которой являются пресловутые макрофаги. Прием препарата Трансфер Фактор позволяет нормализовать деятельность иммунитета и помочь макрофагам в осуществлении их благого дела – борьбы с возбудителями заболеваний и другими вредоносными факторами.
Регулярная терапия этим средством может помочь выздороветь от большинства заболеваний молочной и щитовидной желез, а при профилактическом приеме предупредить их появление. При устойчивой и слаженной работе всех звеньев иммунитета, что достигается благодаря Трансфер Фактору, риск заболеть аутоиммунными, воспалительными и даже онкологическими процессами этих органов многократно уменьшается.