макрофаги единичные в моче что это значит
Общий анализ мочи. Нормы общего анализа мочи. Общий анализ мочи, расшифровка. Нормы мочи у взрослых, женщин и мужчин. Норма мочи у детей.
Информация подготовлена врачами лабораторий и клиник ЦИР.
Общеклиническое исследование мочи (общий анализ мочи, ОАМ) включает определение физических свойств, химического состава и микроскопического изучения осадка.
Физические свойства мочи
Основные физические свойства мочи, определяемые при ОАМ:
Цвет мочи
Цвет мочи в норме колеблется от светло-желтого до насыщенного желтого и обусловлен содержащимися в ней пигментами (урохром А, урохром Б, уроэтрин, урорезин и др.).
| Дети | Различные оттенки желтого цвета |
| Мужчины | Различные оттенки желтого цвета |
| Женщины | Различные оттенки желтого цвета |
Интенсивность цвета мочи зависит от количества выделенной мочи и ее удельного веса. Моча насыщенного желтого цвета обычно концентрированная, выделяется в небольшом количестве и имеет высокий удельный вес. Очень светлая моча мало концентрированная, имеет низкий удельный вес и выделяется в большом количестве.
Изменение цвета может быть результатом патологического процесса в мочевой системе, воздействием компонентов рациона питания, принимавшихся лекарств.
Прозрачность (мутность)
Нормальная моча прозрачна. Помутнение мочи может быть результатом наличия эритроцитов, лейкоцитов, эпителия, бактерий, жировых капель, выпадения в осадок солей, рН, слизи, температуры хранения мочи (низкая температура способствует выпадению солей).
В случаях, когда моча бывает мутной, следует выяснить, выделяется ли она сразу же мутной, или же это помутнение наступает через некоторое время после стояния.
| Дети | Полная прозрачность |
| Мужчины | Полная прозрачность |
| Женщины | Полная прозрачность |
Удельный вес мочи (г/л)
У здорового человека на протяжении суток может колебаться в довольно широком диапазоне, что связано с периодическим приемом пищи и потерей жидкости с потом и выдыхаемым воздухом.
Удельный вес мочи зависит от количества растворенных в ней веществ: мочевины, мочевой кислоты, креатинина, солей.
Реакция мочи (pH)
pH мочи у здорового человека, находящегося на смешанном пищевом режиме, кислая или слабокислая.
Реакция мочи может меняться в зависимости от характера пищи. Преобладание в пищевом рационе белков животного происхождения приводит к резко кислой реакции, при овощной диете реакция мочи щелочная.
Химическое исследование мочи
В настоящее время химическое исследование мочи проводят на автоматических анализаторах с использованием метода сухой химии.
Химическое исследование включает в себя определение в моче:
Белок в моче, норма белка в моче
В нормальной моче содержится очень незначительное количество белка (менее 0,002 г/л), которое не обнаруживается качественными пробами, поэтому считается, что белка в моче нет. Появление белка в моче называется протеинурией.
Материалы по теме
Лицензия № ЛО-77-01-013791 от 24.01.2017
Лаборатории ЦИР — независимые медицинские лаборатории © «Лаборатории ЦИР» 2006–2021
© ООО «КИиР»; © ООО «КИР»; © ООО «ЦИР-П» Карта сайта
Для врачей
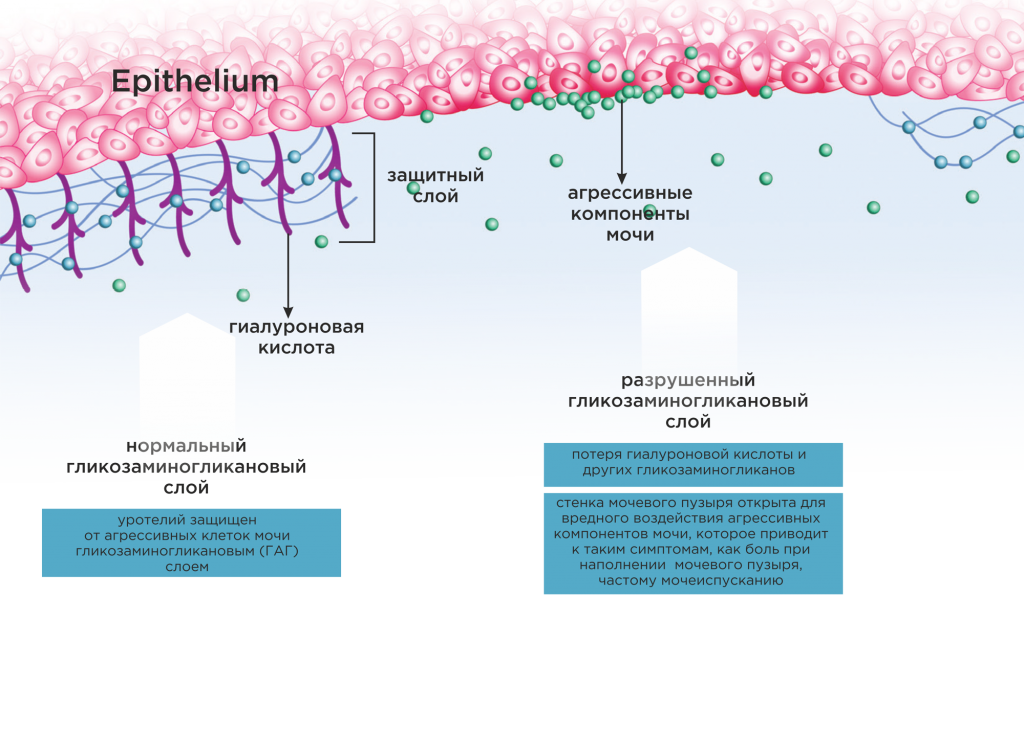
Современные представления о патогенезе интерстициального цистита (другое название – синдром болезненного мочевого пузыря) основаны на теории разрушения защитного слоя уротелия. Защитный слой мочевого пузыря состоит из так называемых гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфата) и поэтому называется гликозаминогликановым.
Считается, что при разрушении гликозаминогликанового слоя мочевого пузыря, агрессивные компоненты проникают в подслизистый слой уротелия, воздействуют на нервные окончания вызывая симптомы, характерные для интерстициального цистита – боль при наполнении мочевого пузыря, частое мочеиспускание.
Однако, мы до сих пор не знаем – почему разрушается защитный слой эпителия мочевого пузыря.
На этот счет есть много разных теорий, но ни одна из них не подкреплена серьезными доказательствами.
Однако, мы точно знаем, что в эпителии мочевого пузыря при интерстициальном цистите обнаруживается много макрофагов (тучных клеток, mast cells), а в моче – вещества, которые тучные клетки выделяют и которые вызывают воспаление и боль (интерлейкин-6, Фактор Роста Нервов, гистамин). А еще нам известно, что макрофаги могут выделять гиалуронидазу и глюкуронидазу – ферменты, которые разрушают гиалуроновую кислоту. Но ведь гиалуроновая кислота является основным компонентом гликозаминогликанового слоя!
Этот процесс называется дегрануляцией тучных клеток.
Интересно то, что такой же процесс (мастоцитоз) происходит и при других заболеваниях:
— Синдроме Раздраженного Кишечника
Очень часто эти заболевания сочетаются с интерстициальным циститом у одного и того же человека.
Так может быть, это не разные заболевания, а проявления одной и той же болезни, но в разных органах?
Скорее всего, так и есть и эта болезнь называется: синдром активации макрофагов (mast cells activation syndrome).
Макрофаги (тучные клетки) – это настоящие нанороботы нашего организма. В них хранится несколько десятков биологически активных веществ для регуляции функций, ремонта нашего организма. Еще несколько десятков веществ они могут синтезировать за несколько минут или часов – в зависимости от задач, которые перед ними стоят.
Мы пока не знаем точно, что именно заставляет макрофаги так себя вести – почему ремонтные нанороботы начинают разрушать организм, вместо восстановления?
Известно несколько факторов, которые их активируют:
Женские гормоны (эстрогены) активируют макрофаги. У меня есть несколько пациенток, у которых симптомы интерстициального цистита усиливаются в первую фазу цикла. А вот при беременности уровень эстрогенов снижается и поэтому, во время беременности симптомы интерстициального цистита часто менее выражены.
Стресс, особенно хронический, также активирует макрофаги. Пациенты с интерстициальным циститом часто отмечают усиление боли при стрессе, нервных переживаниях.
Вирусы и патогенные бактерии, которые образуют колонии внутри уротелия, тоже могут выступать активаторами макрофагов.
Диагностика интерстициального цистита
Диагностика интерстициального цистита, как проявления синдрома активации тучных клеток основана на:
— Биопсии мочевого пузыря (повышенное число тучных клеток).
— Определении гистамина или Н-метилгистамина в моче.
— Определении Интерлейкина-6 в моче.
— Определении Фактора Роста Нервов в моче.
— Определении триптазы в моче.
Что касается терапии интерстициального цистита при синдроме активизации тучных клеток, необходимо:
1. Защитить уротелий от воздействия агрессивных компонентов мочи, поскольку они провоцируют дегрануляцию тучных клеток (инстилляции гиалуроновой кислоты, хондроитинсульфата, прием хондроитинсульфата внутрь).
2. Десенсибилизировать («успокоить») тучные клетки (инстилляции лидокаина, дексаметазона, гиалуроновой кислоты, димексида).
3. Снизить уровень стресса (легкие антидепрессанты, большие дозы магния, транскраниальная электростимуляция, йога, плавание, ходьба не менее 10 000 шагов в день).
4. Антигистаминные препараты 2-го или 3-го поколения.
Мы используем файлы cookie: это помогает сайту работать лучше. Если Вы продолжаете использовать сайт, то этим выражаете свое согласие с Пользовательским соглашением.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
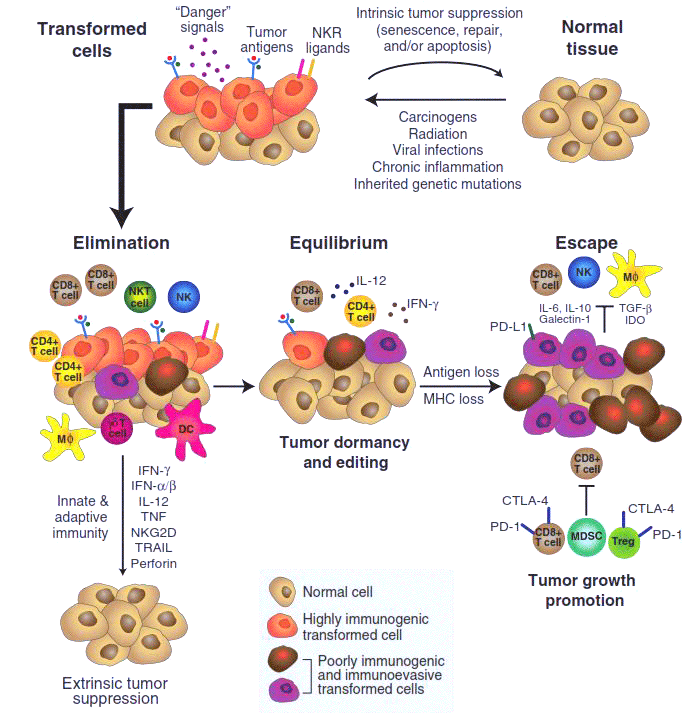
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
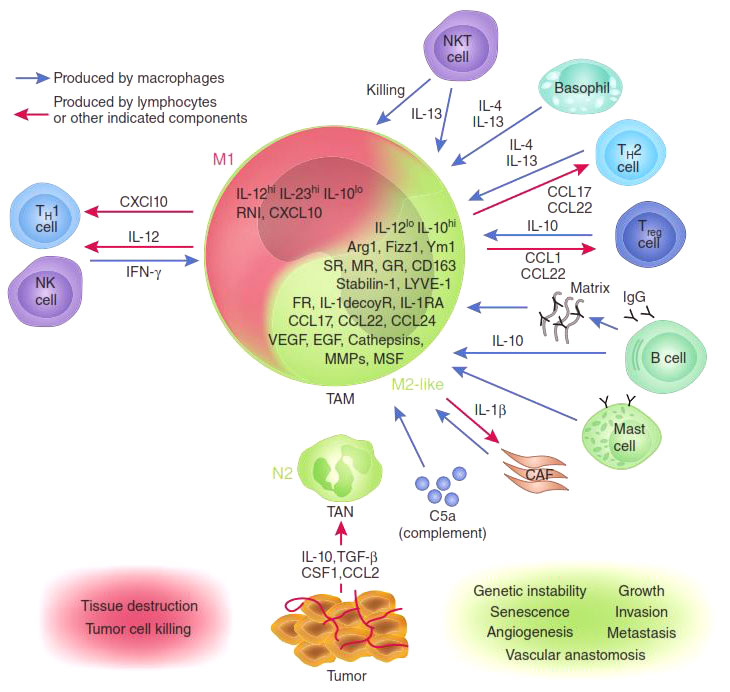
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Макрофаги в моче: что это значит, чем это опасно и что делать
Иммунная система человека — это дар природы, который трудно переоценить. Благодаря защитной функции организма ежедневное столкновение с различными болезнетворными микроорганизмами – бактериями и вирусами, не приносит значительного урона деятельности органов и систем.
Определить количество клеток, ответственных за иммунитет позволяют клинические лабораторные анализы крови и мочи. На основании данных лабораторных анализов в комплексе с жалобами, клиническими симптомами, признаками, результатами прочих исследований, в том числе инструментальных.
Макрофаги в моче
Одними из наиболее активных защитников от инфекции являются специфические клетки – макрофаги, лейкоциты и лимфоциты.
Специалист на основании полученных анализов делает выводы о том, соответствует ли определенное количество тех или иных клеток норме здорового человека или отклонения являются подтверждением присутствия воспалительного процесса или других патологических состояний.
Итак, насколько опасно появление в моче макрофагов и чем это может быть чревато для исследуемого человека в ближайшем будущем и на перспективу?
Макрофаг – клетка человеческого организма, значительно превышающая по размерам другие элементы. Название состоит из двух частей, где «макрос» на греческом языке обозначает большой, гигантский, а «фагос» – истребитель, пожиратель.
Действительно, его основные задачи состоят в следующем:
Важная особенность деятельности макрофагов. Они не просто призваны уничтожить клетки, которые приносят вред и представляют собой значительную опасность. Благодаря макрофагам распознаются и презентуются антигены чужеродных объектов, несущих вред и разрушение иммунитета.
В нормальном состоянии макрофаги в моче не выявляются или могут встречаться в количестве 1 – 2 в поле зрения, что соответствует нормальному состоянию здоровья или индивидуальным особенностям организма. Другие клетки – защитники лейкоциты могут находиться в моче здорового человека не более чем 10 в поле зрения.
Что это значит
Появление макрофагов и увеличение лейкоцитов в моче называется лейкоцитурией. Основными анализами, которые позволяют определить отклонения, является общий анализ мочи и анализ по методике Нечипоренко.
Исследование с применением современного метода тестов недостаточно точное, под влиянием внешних факторов отклонения могут колебаться в пределах от 17 до 90%.
Изменения лейкоцитарной формулы, в том числе и появление макрофагов в моче может быть следствием различных причин:
Важно рассматривать появление макрофагов в анализах мочи как результат наследственных изменений органов, врожденные нарушения строения мочевыделительной системы и гинекологической сферы у женщин.
Чем это опасно
Определение той или иной причины массового появления макрофагов в моче в значительной мере определяет дальнейшую стратегию лечения. Насколько эффективно можно избавиться от причин, вылечить основное заболевание, настолько же быстро и качественно удастся восстановить здоровье.
Появление иммунных клеток в анализах мочи представляет значительную опасность для организма. Это может сигнализировать о следующих опасных для жизни состояниях, которые до определенного времени не показывают четкой клинической картины.
Наличие макрофагов в моче клиницисты считают одним из самых достоверных сигналов организма о серьезных патологических изменениях.
Что делать
Чтобы исключить вероятность ошибки в полученных анализах, специалист назначает повторное прохождение диагностических процедур. После получения результатов, доктор назначает прохождение консилиума различных специалистов – нефролога, гинеколога, аллерголога.
В конечном итоге пациенту назначается комплексное лечение, противогистаминные, иммуностимулирующие и общеукрепляющие препараты. Нужно как можно скорее попасть на прием к доктору.