макрофаги в моче у ребенка что это значит
Для врачей
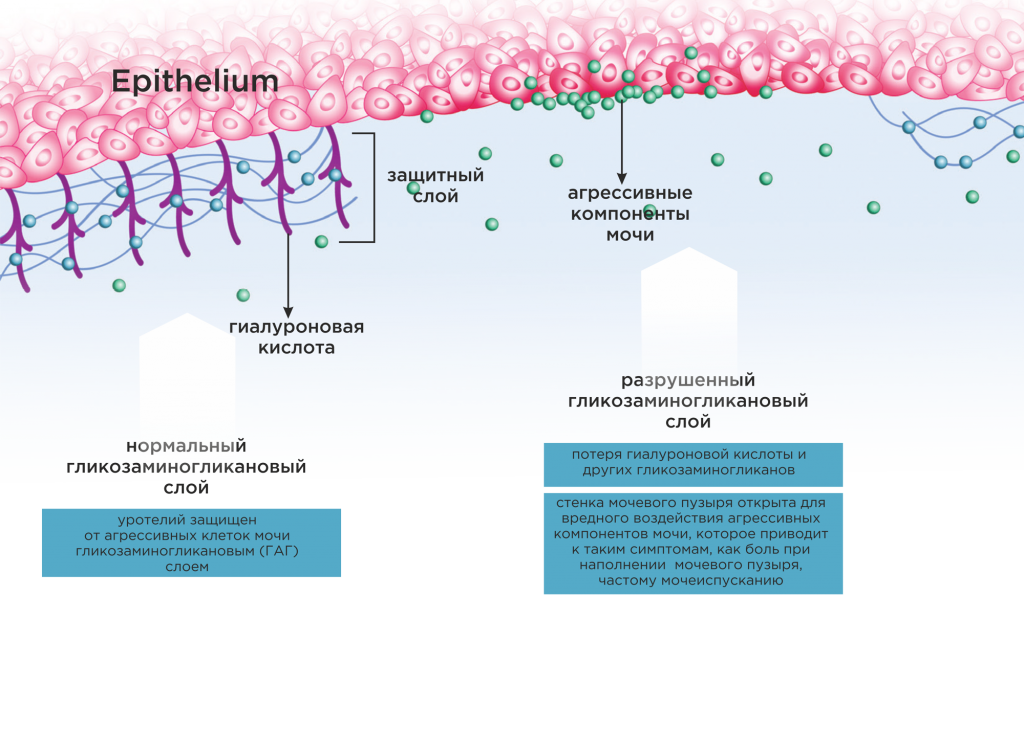
Современные представления о патогенезе интерстициального цистита (другое название – синдром болезненного мочевого пузыря) основаны на теории разрушения защитного слоя уротелия. Защитный слой мочевого пузыря состоит из так называемых гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфата) и поэтому называется гликозаминогликановым.
Считается, что при разрушении гликозаминогликанового слоя мочевого пузыря, агрессивные компоненты проникают в подслизистый слой уротелия, воздействуют на нервные окончания вызывая симптомы, характерные для интерстициального цистита – боль при наполнении мочевого пузыря, частое мочеиспускание.
Однако, мы до сих пор не знаем – почему разрушается защитный слой эпителия мочевого пузыря.
На этот счет есть много разных теорий, но ни одна из них не подкреплена серьезными доказательствами.
Однако, мы точно знаем, что в эпителии мочевого пузыря при интерстициальном цистите обнаруживается много макрофагов (тучных клеток, mast cells), а в моче – вещества, которые тучные клетки выделяют и которые вызывают воспаление и боль (интерлейкин-6, Фактор Роста Нервов, гистамин). А еще нам известно, что макрофаги могут выделять гиалуронидазу и глюкуронидазу – ферменты, которые разрушают гиалуроновую кислоту. Но ведь гиалуроновая кислота является основным компонентом гликозаминогликанового слоя!
Этот процесс называется дегрануляцией тучных клеток.
Интересно то, что такой же процесс (мастоцитоз) происходит и при других заболеваниях:
— Синдроме Раздраженного Кишечника
Очень часто эти заболевания сочетаются с интерстициальным циститом у одного и того же человека.
Так может быть, это не разные заболевания, а проявления одной и той же болезни, но в разных органах?
Скорее всего, так и есть и эта болезнь называется: синдром активации макрофагов (mast cells activation syndrome).
Макрофаги (тучные клетки) – это настоящие нанороботы нашего организма. В них хранится несколько десятков биологически активных веществ для регуляции функций, ремонта нашего организма. Еще несколько десятков веществ они могут синтезировать за несколько минут или часов – в зависимости от задач, которые перед ними стоят.
Мы пока не знаем точно, что именно заставляет макрофаги так себя вести – почему ремонтные нанороботы начинают разрушать организм, вместо восстановления?
Известно несколько факторов, которые их активируют:
Женские гормоны (эстрогены) активируют макрофаги. У меня есть несколько пациенток, у которых симптомы интерстициального цистита усиливаются в первую фазу цикла. А вот при беременности уровень эстрогенов снижается и поэтому, во время беременности симптомы интерстициального цистита часто менее выражены.
Стресс, особенно хронический, также активирует макрофаги. Пациенты с интерстициальным циститом часто отмечают усиление боли при стрессе, нервных переживаниях.
Вирусы и патогенные бактерии, которые образуют колонии внутри уротелия, тоже могут выступать активаторами макрофагов.
Диагностика интерстициального цистита
Диагностика интерстициального цистита, как проявления синдрома активации тучных клеток основана на:
— Биопсии мочевого пузыря (повышенное число тучных клеток).
— Определении гистамина или Н-метилгистамина в моче.
— Определении Интерлейкина-6 в моче.
— Определении Фактора Роста Нервов в моче.
— Определении триптазы в моче.
Что касается терапии интерстициального цистита при синдроме активизации тучных клеток, необходимо:
1. Защитить уротелий от воздействия агрессивных компонентов мочи, поскольку они провоцируют дегрануляцию тучных клеток (инстилляции гиалуроновой кислоты, хондроитинсульфата, прием хондроитинсульфата внутрь).
2. Десенсибилизировать («успокоить») тучные клетки (инстилляции лидокаина, дексаметазона, гиалуроновой кислоты, димексида).
3. Снизить уровень стресса (легкие антидепрессанты, большие дозы магния, транскраниальная электростимуляция, йога, плавание, ходьба не менее 10 000 шагов в день).
4. Антигистаминные препараты 2-го или 3-го поколения.
Мы используем файлы cookie: это помогает сайту работать лучше. Если Вы продолжаете использовать сайт, то этим выражаете свое согласие с Пользовательским соглашением.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
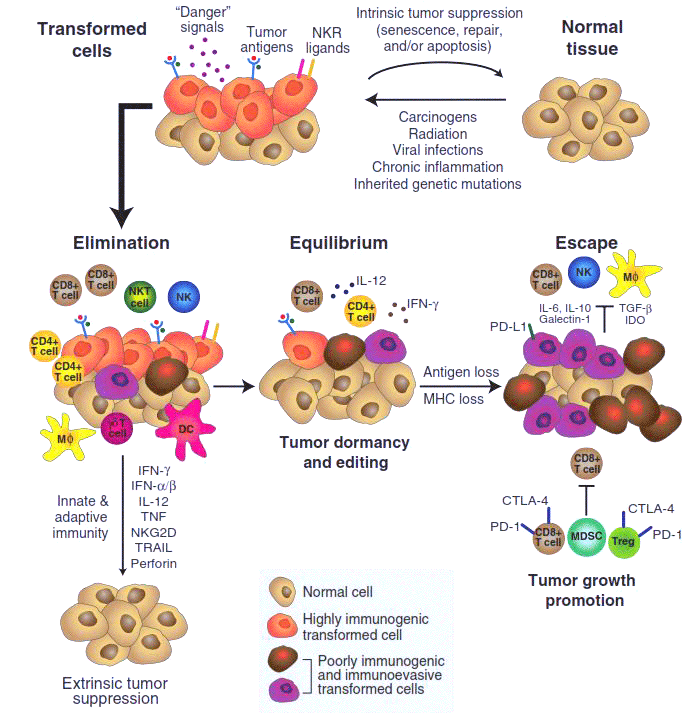
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
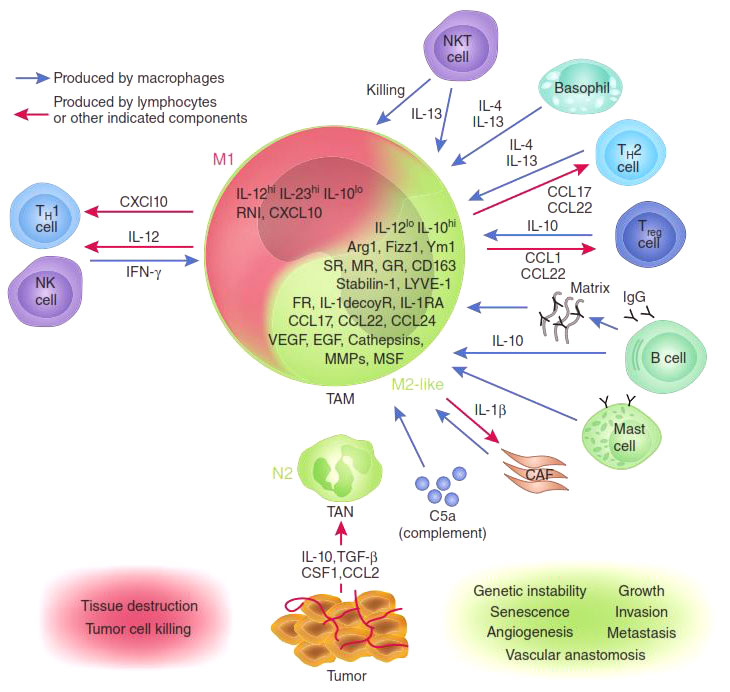
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Инфекция мочевой системы у детей
Термином «инфекция мочевой системы» (ИМС) обозначается воспалительный процесс в мочевой системе без специального указания на этиологию и локализацию (мочевые пути или почечная паренхима) и определения его характер
Термином «инфекция мочевой системы» (ИМС) обозначается воспалительный процесс в мочевой системе без специального указания на этиологию и локализацию (мочевые пути или почечная паренхима) и определения его характера.
Термин «инфекция мочевой системы» объединяет все инфекционно-воспалительные заболевания органов мочевой системы (ОМС) и включает в себя пиелонефрит (ПН), цистит, уретрит и асимптоматическую бактериурию. Таким образом, это групповое понятие, но не нозологическая форма. Соответственно, постановка диагноза «инфекция мочевой системы» возможна только на начальных этапах обследования, когда выявляются изменения в моче (лейкоцитурия и бактериурия), но нет указаний на локализацию воспалительного процесса. В дальнейшем такие дети требуют полноценного нефроурологического обследования и определения уровня поражения ОМС, после чего устанавливается более точный диагноз (цистит, ПН и т. д.). Такой подход оправдан еще и потому, что соответствует этапности выявления патологии, принятой в педиатрической службе нашей страны. Первые признаки инфекционно-воспалительных заболеваний ОМС, как правило, выявляются на доклиническом этапе (амбулаторно-поликлиническая служба, скоропомощная служба), когда, в большинстве случаев, нет возможности установить точную локализацию процесса. Поэтому правомочна постановка диагноза «инфекция мочевых путей или мочевой системы». В дальнейшем, в специализированном стационаре, диагноз уточняется.
В отечественной литературе встречаются различные термины для обозначения инфекционного процесса в ОМС: «инфекция ОМС», «мочевая инфекция», «инфекция мочевыводящих путей» и т. п. При этом в каждое название вкладывается определенный смысл. Например, «инфекция ОМС» и «мочевая инфекция» подразумевает возможность локализации инфекции в любом отделе ОМС или тотальное поражение почек и мочевыводящих путей; «инфекция мочевыводящих путей» подразумевает инфицирование только мочевыводящих путей, но не почек и т. д. Такое разнообразие терминов вносит определенную путаницу, тем более что любой из подобных диагнозов все равно требует обследования и уточнения локализации. На наш взгляд, для удобства целесообразно считать термины «инфекция мочевых путей», «инфекция ОМС» и т. д. синонимами, подразумевая при этом, что любой из них не может являться окончательным и требует уточнения.
Однако подобный подход не совсем соответствует МКБ-10 (1995 г.). По рекомендации экспертов ВОЗ, заложенной в основу МКБ-10, инфекция мочевых путей является самостоятельной нозологической единицей и подразумевает заболевание, при котором нет данных о поражении паренхимы почек, но есть признаки транзиторного воспаления нижних мочевых путей, определить локализацию которого в момент обследования невозможно. Таким образом, понятие «инфекции мочевых путей» сужается до поражений мочевого пузыря и уретры и исключает ПН, который по МКБ-10 относится к группе тубуло-интерстициальных нефритов.
Такое узкое толкование термина имеет свои следствия. Во-первых, это подразумевает, что диагноз «инфекции мочевых путей» может быть установлен только в стационаре после комплексного нефроурологического обследования. Во-вторых, лечение может и должно быть назначено и без установленной локализации инфекционно-воспалительного процесса. В-третьих, фактически «инфекция мочевых путей» сводится к транзиторной лейкоцитурии и бактериурии на фоне основного интеркуррентного заболевания (бронхит, пневмония, ОРВИ, ангина и др.) и быстро исчезает на фоне лечения основного заболевания и антибактериальной терапии. Поэтому и курсы антибактериальных препаратов должны быть короткими (5–7 дней).
Не претендуя на объективность, мы считаем более удобным использование термина «инфекция мочевых путей» в соответствии с отечественной традицией, т. к. подобное понимание является повсеместно распространенным среди педиатров нашей страны и больше соответствует структуре педиатрической и детской нефрологической службы. Кроме того, инфекционные поражения органов мочевой системы связаны общностью этиопатогенеза и терапевтической тактики.
Эпидемиология
Распространенность ИМС в популяции достаточно велика и составляет до 80% всех заболеваний ОМС. Среди всех заболеваний инфекционной этиологии ИМС занимает второе место после ОРВИ.
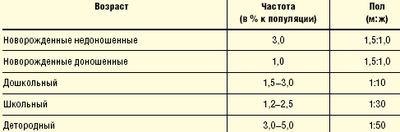
Распространенность ИМС зависит от возраста и пола (табл. 1). Если в периоде новорожденности мальчики болеют в полтора раза чаще девочек, то в последующие месяцы эти показатели уравниваются, к 1 году частота ИМС среди девочек уже в 4 раза больше, а после года жизни частота встречаемости ИМС у девочек в десятки раз превышает таковую у мальчиков. Среди пациентов детородного возраста у женщин ИМС встречается в 50 раз чаще, чем у мужчин (исключая уретриты и простатиты). Это приводит нас к выводу, что фактически ПН и циститы — это «женские» заболевания. В детском возрасте распространенность ПН достигает 20–22 случаев на 1000 детей (М. В. Эрман, 1997).
Терминология
ПН — неспецифическое, острое или хроническое микробное воспаление в чашечно-лоханочной системе и интерстициальной ткани почек с вовлечением в патологический процесс канальцев, кровеносных и лимфатических сосудов.
Цистит — микробно-воспалительный процесс в стенке мочевого пузыря (как правило, в слизистом и подслизистом слое).
Асимптоматическая бактериурия — состояние, когда при полном отсутствии клинических проявлений заболевания бактериурия выявляется одним из нижеперечисленных способов: 10 и более микробных тел в 1 мл мочи; или более 105 колоний микроорганизмов одного вида, выросших при посеве 1 мл мочи, взятой из средней струи; или 103 и более колоний микроорганизмов одного вида при посеве 1 мл мочи, взятой катетером; или любое количество колоний микроорганизмов при посеве 1 мл мочи, полученной путем надлобковой пункции мочевого пузыря.
Наличие бактерий в общем анализе мочи не является достоверным критерием бактериурии.
Пути проникновения инфекции в мочевую систему
Возбудитель может попасть в ОМС тремя путями: гематогенным, лимфогенным и восходящим.
Лимфогенный путь попадания возбудителей связан с общей системой лимфообращения между ОМС и кишечником. В норме лимфа оттекает от почек и мочевыводящих путей к кишечнику, поэтому распространение бактерий из полости кишечника к ОМС по лимфатическим сосудам исключается; более того, сама слизистая кишечника является барьером для проникновения микроорганизмов в кровь и лимфу. Однако в условиях нарушения барьерных свойств слизистой оболочки кишки и лимфостаза вероятность инфицирования ОМС флорой кишечника многократно возрастает. Такая ситуация возникает при длительно существующей диспепсии (диареях и, особенно, хронических запорах), колитах, инфекционных заболеваниях кишечника, нарушениях его моторики и дисбактериозах. При лимфогенном пути проникновения инфекции из мочи будут высеваться представители кишечной микрофлоры.
Восходящий путь распространения инфекции является доминирующим. Анатомическая близость уретры и ануса приводит к тому, что в периуретральной зоне всегда имеется большое количество бактерий, попадающих из области ануса. Особенности строения наружных половых органов у девочек и более короткая уретра создают наиболее благоприятные условия для проникновения бактерий в ОМС восходящим путем, что обуславливает более высокую частоту ИМС. Поэтому очень важным является правильный и регулярный туалет промежности (подмывание от вульвы к анусу), привитие девочке с раннего детства навыков личной гигиены. Основными возбудителями при восходящем пути являются представители микрофлоры кишечника.
Этиологическая структура ИМС
Наиболее часто при ИМС высеваются представители семейства Enterobacteriacae, а среди них — кишечная палочка (E. coli), доля которой по данным разных авторов колеблется от 40 до 90%.
Многоцентровое исследование АРМИД, проводимое в различных центрах нашей страны в 2000–2001 гг., выявило, что в 57% случаев возбудителем внебольничной ИМС у детей является кишечная палочка, в 9% — протей, в 9% — энтерококки, в 9% — клебсиеллы, в 6% — энтеробактеры, в 6% — синегнойная палочка и в 4% — стафилококки (Страчунский Л. С., Коровина Н. А., Папаян А. В. с соавт., 2001).
Следует также учитывать изменение состава возбудителей с возрастом пациента. Так, если у новорожденных и детей первого года жизни в 75–85% возбудителем при ПН являяется кишечная палочка, то у мальчиков доля ее в дальнейшем снижается до 33% и возрастает роль Proteus (до 33%) и St. aureus (до 12%); тогда как у девочек до 10 лет также часто высевается кишечная палочка (до 85%), а после 10 лет — кишечная палочка (до 60%) и St. aureus (до 30%). Сводные данные по этиологической структуре ПН у детей приведены в табл. 2.
Состав высеваемой микрофлоры при хроническом течении ПН имеет некоторые особенности. При этом повышается роль микробных ассоциаций, наличие которых может рассматриваться как один из факторов хронизации (табл. 3). Помимо этого особенностью результатов посевов при хроническом ПН является более низкое, чем при остром, количество высеваемых микроорганизмов. По данным некоторых авторов диагностически значимая бактериурия выявляется при остром ПН в два раза чаще, чем при хроническом. Однако при этом доля грамположительной флоры у детей с хроническим ПН выше. Помимо этого, при хроническом ПН намного чаще обнаруживаются L-формы бактерий.
Определенную роль в генезе ИМС играют вирусы (аденовирус, грипп, Коксаки А и др.). Острая вирусная инфекция или персистенция вирусов в почечной ткани вызывает повреждение уроэпителия, снижение местной резистентности, нарушение микроциркуляции и пр., способствуя таким образом проникновению бактерий в ОМС.
Предрасполагающие факторы и группы риска
Развитие инфекционно-воспалительного процесса в мочевой системе, как правило, происходит при наличии предрасполагающих факторов со стороны макроорганизма, основным из которых является обструкция току мочи на любом уровне.
Нормальная уродинамика является одним из факторов, препятствующих восходящему распространению микроорганизмов и их адгезии на поверхности эпителия. Поэтому любое анатомическое или функциональное нарушение тока мочи можно рассматривать как благоприятный фактор для развития инфекции.
Мочевая обструкция имеет место при всех вариантах аномалий развития и структуры органов мочевой системы, при кристалурии и мочекаменной болезни и др.
Функциональные нарушения моторики мочевых путей (гипо-, гиперкинезия), даже кратковременные, способствует застою мочи, создавая условия для адгезии микроорганизмов и колонизации эпителия. Функциональная обструкция может возникать при абсолютно нормальном строении органов мочевой системы, ее провоцируют переохлаждения, заболевания кишечника, интоксикации, стрессы и т. п.
Помимо обструкции тока мочи развитию ИМС будут способствовать генетические факторы, обменные нарушения, хронические заболевания кишечника, снижение общего и местного иммунитета и пр.
Большей склонностью к развитию ИМС обладают представители III (В0) и IV (АВ) групп крови, т. к. у них на поверхности уроэпителия обнаруживаются рецепторы для фиксации бактерий.
Все это позволяет выделить условные группы риска по развитию инфекции органов мочевой системы:
Варианты течения ИМС
При всем многообразии клинико-лабораторных проявлений инфекции органов мочевой системы можно условно выделить три варианта ее течения.
Клинические проявления заболевания отсутствуют. При исследовании мочи выявляются: бактериальная лейкоцитурия, абактериальная лейкоцитурия, изолированная бактериурия. Возможные причины: инфекционное поражение на любом уровне мочеполовой системы — асимптоматическая бактериурия, латентная инфекция нижних мочевых путей, латентное течение ПН, вульвит, баланит, фимоз и др.
Клинические проявления в виде дизурии (боль при мочеиспускании, поллакиурия, недержание или неудержание мочи и др.); боль или дискомфорт в надлобковой области. Мочевой синдром в виде бактериальной лейкоцитурии (возможно в сочетании с гематурией различной степени выраженности) или абактериальной лейкоцитурии. Возможные причины: цистит, уретрит, простатит.
Клинические проявления в виде лихорадки, симптомов интоксикации; боль в пояснице, боку, животе, с иррадиацией в пах, внутреннюю поверхность бедра. Мочевой синдром в виде бактериальной лейкоцитурии или абактериальной лейкоцитурии, иногда умеренная гематурия. Изменения в крови: лейкоцитоз, нейтрофилез со сдвигом влево, ускорение СОЭ. Возможные причины: ПН, ПН с циститом (при дизурии).
Особенности течения ПН
В клинике ПН у детей раннего возраста преобладают симптомы интоксикации. Возможно развитие нейротоксикоза, появление менингеальной симптоматики, частых срыгиваний и рвоты на высоте интоксикации. Нередко у детей первого года жизни возможен полный отказ от еды с развитием гипотрофии. При осмотре обращает на себя внимание бледность кожных покровов, периорбитальный цианоз, возможна пастозность век.
Часто ПН в раннем возрасте протекает под разнообразными «масками»: диспептические расстройства, острый живот, пилороспазм, кишечный синдром, септический процесс и др. При появлении подобной симптоматики необходимо исключить наличие инфекции мочевой системы.
У детей старшего возраста «общеинфекционные» симптомы проявляются менее резко, нередко возможны «беспричинные» подъемы температуры на фоне обычного самочувствия. Для них характерна лихорадка с ознобом, симптомы интоксикации, постоянные или периодические боли в животе и поясничной области, положительный симптом поколачивания. Возможно течение ПН под «маской» гриппа или острого аппендицита.
Особенности течения цистита
У детей старшего возраста и взрослых цистит чаще всего протекает как «местное страдание», без лихорадки и симптомов интоксикации. При геморрагическом цистите ведущим в мочевом синдроме будет гематурия, иногда макрогематурия.
У детей грудного и раннего возраста цистит часто протекает с симптомами общей интоксикации и лихорадкой. Для них характерно частое развитие странгурии (задержки мочи).
Для диагностики инфекции органов мочевой системы используются лабораторные инструментальные методы исследования.
Обязательные лабораторные исследования:
Дополнительные лабораторные исследования:
Обязательные лабораторные исследования:
Дополнительные лабораторные исследования:
Принципы терапии инфекционных заболеваний органов мочевой системы
Лечение микробно-воспалительных заболеваний органов мочевой системы предусматривает не только проведение антибактериальной, патогенетической и симптоматической терапии, но и организацию правильного режима и питания больного ребенка. Тактика лечения будет рассмотрена на примере ПН как наиболее тяжелого инфекционного заболевания ОМС.
Вопрос о госпитализации при ПН решается в зависимости от тяжести состояния ребенка, риска развития осложнений и социальных условий семьи. Во время активной стадии заболевания при наличии лихорадки и болевого синдрома назначается постельный режим на 5–7 суток. При цистите и асимптоматической бактериурии госпитализации как правило не требуется. В этот период ПН используется стол № 5 по Певзнеру: без ограничения соли, но с повышенным питьевым режимом, на 50% больше возрастной нормы. Количество соли и жидкости ограничивается только при нарушении функции почек. Рекомендуется чередовать белковую и растительную пищу. Исключаются продукты, содержащие экстрактивные вещества и эфирные масла, жареные, острые, жирные блюда. Выявляемые обменные нарушения требуют специальных корригирующих диет.
Медикаментозная терапия ИМС включает антибактериальные препараты, противовоспалительную десенсибилизирующую и антиоксидантную терапию.
Проведение антибактериальной терапии основывается на следующих принципах:
Терапия ПН включает несколько этапов: этап подавления активного микробно-воспалительного процесса с использованием этиологического подхода, этап патогенетического лечения на фоне стихания процесса с использованием антиоксидантной защиты и иммунокоррекции, этап противорецидивного лечения. Терапия острого ПН, как правило, ограничивается первыми двумя этапами, при хроническом включаются все три этапа лечения.
При выборе антибактериальных препаратов необходимо учитывать следующие требования: препарат должен быть активен в отношении наиболее часто встречающихся возбудителей инфекции мочевой системы, не быть нефротоксичным, создавать высокие концентрации в очаге воспаления (в моче, интерстиции), оказывать преимущественно бактерицидное действие, обладать активностью при значениях рН мочи больного (табл. 4); при сочетании нескольких препаратов должен наблюдаться синергизм.
Длительность антибактериальной терапии должна быть оптимальной, обеспечивающей полное подавление активности возбудителя; обычно составляет в стационаре около 3–4 недель со сменой антибиотика каждые 7–10 дней (или заменой на уросептик).
Стартовая антибактериальная терапия назначается эмпирически, исходя из наиболее вероятных возбудителей инфекции. При отсутствии клинического и лабораторного эффекта через 2–3 дня необходимо сменить антибиотик. При манифестном тяжелом и среднетяжелом течении ПН препараты вводят преимущественно парентерально (внутривенно или внутримышечно) в условиях стационара. При легком и в ряде случаев среднетяжелом течении ПН стационарное лечение не требуется, антибиотики вводятся перорально, курс лечения составляет от 14 до 20 дней.
Некоторые антибиотики, применяемые при стартовой терапии ПН:
– Амоксициллин и клавулановая кислота:
– Аугментин — 25–50 мг/кг/сут, внутрь — 10–14 дней;
– Амоксиклав — 20–40 мк/кг/сут, внутрь — 10–14 дней.
– Цефуроксим (Зинацеф, Кетоцеф, Цефурабол), цефамандол (Мандол, Цефамабол) — 80–160 мг/кг/сут, в/в, в/м — 4 раза в сутки — 7–10 дней.
– Цефотоксим (Клафоран, Клафобрин), цефтазидим (Фортум, Вицеф), цефтизоксим (Эпоцелин) — 75–200 мг/кг/сут, в/в, в/м — 3–4 раза в сутки — 7–10 дней;
– Цефоперазон (Цефобид, Цефоперабол), цефтриаксон (Роцефин, Цефтриабол) — 50–100 мг/кг/сут, в/в, в/м — 2 раза в сутки — 7–10 дней.
– Гентамицин (Гарамицин, Гентами-цина сульфат) — 3,0–7,5 мг/кг/сут,в/м, в/в — 3 раза в сутки — 5–7 дней;
– Амикацин (Амицин, Ликацин) — 15–30 мг/кг/сут, в/м, в/в — 2 раза в сутки — 5–7 дней.
В период стихания активности ПН антибактериальные препараты вводят преимущественно перорально, при этом возможна «ступенчатая терапия», когда перорально дается тот же препарат, что и вводился парентерально, или препарат той же группы.
Наиболее часто в этот период используются:
– Амоксициллин и клавулановая кислота (Аугментин, Амоксиклав).
– Цефаклор (Цеклор, Верцеф) — 20–40 мг/кг/сут.
– Цефтибутен (Цедекс) — 9 мг/кг/сут, однократно.
– Нитрофурантоин (Фурадонин) — 5–7 мг/кг/сут.
– Налидиксовая кислота (Неграм,Невиграмон) — 60 мг/кг/сут;
– Пипемидовая кислота (Палин, Пимедель) — 0,4–0,8 г/сут;
– Нитроксолин (5-НОК, 5-Нитрокс) — 10 мг/кг/сут.
При тяжелом септическом течении, микробных ассоциациях, полирезистентности микрофлоры к антибиотикам, при воздействии на внутриклеточные микроорганизмы, а также для расширения спектра антимикробного действия при отсутствии результатов посевов используется комбинированная антибактериальная терапия. При этом комбинируются бактерицидные антибиотики с бактерицидными, бактериостатические с бактериостатическими антибиотиками. Некоторые антибиотики в отношении одних микроорганизмов действуют бактерицидно, в отношении других — бактериостатически.
К бактерицидным относятся: пенициллины, цефалоспорины, аминогликозиды, полимиксины и др. К бактериостатическим — макролиды, тетрациклины, хлорамфеникол, линкомицин и др. Потенциируют действие друг друга (синергисты): пенициллины и аминогликозиды; цефалоспорины и пенициллины; цефалоспорины и аминогликозиды. Являются антагонистами: пенициллины и хлорамфеникол; пенициллины и тетрациклины; макролиды.
С точки зрения нефротоксичности, нетоксичными или малотоксичными являются эритромицин, препараты группы пенициллина и цефалоспорины; умеренно токсичными являются гентамицин, тетрациклин и др.; выраженной нефротоксичностью обладают канамицин, мономицин, полимиксин и др.
Факторами риска нефротоксичности аминогликозидов являются: продолжительность применения более 11 суток, максимальная концентрация выше 10 мкг/мл, сочетание с цефалоспоринами, заболевания печени, высокие уровни креатинина. После курса антибиотикотерапии лечение следует продолжить уроантисептиками.
Препараты наликсидиновой кислоты (Невиграмон, Неграм) назначают детям старше 2 лет. Эти средства являются бактериостатиками или бактерицидами в зависимости от дозы по отношению к грамотрицательной флоре. Их нельзя назначать одновременно с нитрофуранами, которые оказывают антагонистический эффект. Курс лечения составляет 7–10 дней.
Грамурин, производное оксолиновой кислоты, обладает широким спектром действия на грамотрицательные и грамположительные микроорганизмы. Применяется у детей в возрасте от 2 лет курсом 7–10 дней. Пипемидовая кислота (Палин, Пимидель) оказывает влияние на большинство грамотрицательных бактерий и на стафилококки. Назначается коротким курсом (3–7 дней). Нитроксолин (5-НОК) и нитрофураны — препараты широкого бактерицидного действия. Препаратом резерва является офлоксацин (Таривид, Заноцин). Он обладает широким спектром действия, в т. ч. и на внутриклеточную флору. Детям назначается только в случае неэффективности других уросептиков. Применение Бисептола возможно только в качестве противорецидивного средства при латентном течении ПН и при отсутствии обструкции в мочевых органах.
В первые дни заболевания на фоне повышенной водной нагрузки применяют быстродействующие диуретики (Фуросемид, Верошпирон), которые способствуют усилению почечного кровотока, обеспечивают элиминацию микроорганизмов и продуктов воспаления и уменьшают отечность интерстициальной ткани почек. Состав и объем инфузионной терапии зависят от выраженности синдрома интоксикации, состояния больного, показателей гемостаза, диуреза и других функций почек.
Этап патогенетической терапии начинается при стихании микробно-воспалительного процесса на фоне антибактериальных препаратов. В среднем это происходит на 5–7 день от начала заболевания. Патогенетическая терапия включает противовоспалительную, антиоксидантную, иммунокоррегирующую и антисклеротическую терапию.
Комбинация с противовоспалительными препаратами используется для подавления активности воспаления и усиления эффекта антибактериальной терапии. Рекомендуется прием нестероидных противовоспалительных препаратов — Ортофена, Вольтарена, Сургама. Курс лечения составляет 10–14 дней. Применение индометацина в детской практике не рекомендуется вследствие возможного ухудшения кровоснабжения почек, снижения клубочковой фильтрации, задержки воды и электролитов, некроза почечных сосочков.
Десенсибилизирующие средства (Тавегил, Супрастин, Кларитин и др.) назначаются при остром или хроническом ПН с целью купирования аллергического компонента инфекционного процесса, а также при развитии сенсибилизации больного к бактериальным антигенам.
В комплекс терапии ПН включают препараты с антиоксидантной и антирадикальной активностью: Токоферола ацетат (1–2 мг/кг/сут в течение 4 недель), Унитиол (0,1 мг/кг/сут в/м разово, в течение 7–10 дней), Бета-каротин (по 1 капле на год жизни 1 раз в день в течение 4 недель)и др. Из препаратов, улучшающих микроциркуляцию почек, назначаются Трентал, Циннаризин, Эуфиллин.
Противорецидивная терапия ПН предполагает длительное лечение антибактериальными препаратами в малых дозах и проводится, как правило, в амбулаторно-поликлинических условиях. С этой целью используют: Фурагин из расчета 6–8 мг/кг в течение 2 недель, далее при нормальных анализах мочи переход на 1/2–1/3 дозы в течение 4–8 недель; назначение одного из препаратов пипемидовой кислоты, налидиксовой кислоты или 8-оксихинолина по 10 дней каждого месяца в обычных дозировках в течение 3–4 месяцев.
Лечение цистита
Лечение цистита предусматривает общее и местное воздействие. Терапия должна быть направлена на нормализацию расстройств мочеиспускания, ликвидацию возбудителя и воспаления, устранение болевого синдрома. В острую стадию заболевания рекомендуется постельный режим до стихания дизурических явлений. Показано общее согревание больного. На область мочевого пузыря применяется сухое тепло.
Диетотерапия предусматривает щадящий режим с исключением острых, пряных блюд, специй и экстрактивных веществ. Показаны молочно-растительные продукты, фрукты, способствующие ощелачиванию мочи. Рекомендуется обильное питье (слабощелочные минеральные воды, морсы, слабоконцентрированные компоты) после снятия болевого синдрома. Увеличение диуреза уменьшает раздражающее действие мочи на воспаленную слизистую оболочку, способствует вымыванию продуктов воспаления из мочевого пузыря. Прием минеральной воды (Славяновская, Смирновская, Ессентуки) из расчета 2–3 мл/кг за 1 час до еды оказывает слабое противовоспалительное и спазмолитическое действие, изменяет рН мочи. Медикаментозная терапия цистита включает применение спазмолитических, уросептических и антибактериальных средств. При болевом синдроме показано применение возрастных доз Но-шпы, Папаверина, Белладоны, Баралгина.
При остром неосложненном цистите целесообразно использование пероральных антимикробных препаратов, выводящихся преимущественно почками и создающих максимальную концентрацию в мочевом пузыре. Стартовыми препаратами терапии острого неосложненного цистита могут быть «защищенные» пенициллины на основе амоксициллина с клавулановой кислотой. В качестве альтернативы могут использоваться пероральные цефалоспорины 2–3 поколения. При выявлении атипичной флоры используются макролиды, грибов — антимикотические препараты.
Минимальный курс лечения составляет 7 дней. При отсутствии санации мочи на фоне антибактериальной терапии требуется дообследование ребенка. Уросептическая терапия включает применение препаратов нитрофуранового ряда (Фурагин), нефторированных хинолонов (препараты налидиксовой и пипемидовой кислот, производные 8-оксихинолина).
В последние годы для лечения циститов широко применяется фосфомицин (Монурал), принимаемый однократно и обладающий широким антимикробным спектром действия. В острый период заболевания проводят фитотерапию с антимикробным, дубящим, регенерирующим и противовоспалительным эффектом. В качестве противовоспалительного средства используются брусничный лист и плоды, кора дуба, зверобой, календула, крапива, мать-и-мачеха, подорожник, ромашка, черника и др. Регенерирующим эффектом обладают ячмень, крапива, брусничный лист.
Антибактериальная терапия хронического цистита проводится длительно и часто сочетается с местным лечением в виде инстилляций мочевого пузыря. При катаральном цистите используются водный раствор Фурацилина, масло облепихи и шиповника, синтомициновая эмульсия. Инстилляции антибиотиков и уросептиков применяются при геморрагическом цистите. При лечении буллезной и гранулярной формы используется р-р Колларгола и нитрата серебра. Длительность курса составляет 8–10 процедур объемом 15–20 мл, при катаральном цистите требуется 1–2 курса инстилляций, при гранулярном и буллезном — 2–3 курса, интервал между курсами 3 месяца.
При частых рецидивах возможно применение иммуномодулирующих препаратов. Могут быть использованы инстилляции Томицидом (продукт жизнедеятельности непатогенного стрептококка), оказывающего также и бактерицидное действие. Томицид повышает содержание sIgA в слизистой оболочке мочевого пузыря.
В качестве физиотерапии используется электрофорез, токи надтональной частоты, электрическое поле сверхвысокой частоты, аппликации Озокерита или парафина. Физиотерапевтическое лечение рекомендуется повторять каждые 3–4 месяца.
Тактика ведения детей с асимптоматической бактериурией
Решение о применении антибактериальной терапии при асимптоматической бактериурии всегда является сложным для врача. С одной стороны, отсутствие клиники и выраженного мочевого синдрома не оправдывает применения 7-дневного курса антибиотиков и уросептиков из-за возможных побочных эффектов. К тому же врачу часто приходится преодолевать предубежденность родителей против использования антибактериальных препаратов.
С другой стороны, более короткие курсы неэффективны, т. к. лишь сокращают период бактериурии, создавая «мнимое благополучие», и не предотвращают последующего развития клинических симптомов заболевания. Также короткие курсы антибиотиков способствуют возникновению устойчивых штаммов бактерий. В большинстве случаев асимптоматическая бактериурия не требует лечения. Такой больной нуждается в дообследовании и уточнении диагноза.
Антибактериальная терапия необходима в следующих ситуациях: