маммарокоронарное шунтирование что это
Операция маммарно-коронарного шунтирования (МКШ): история разработки и внедрения в клинику
Дата доклада: 19.05.2015
Секция: Симпозиум «Операции в кардиохирургии: уроки истории» Заседание 2.
Синельников М.Е., Чумаков А.В.
ГБОУ ВПО Первый МГМУ им. И.М.Сеченова;
Коронарное шунтирование – один из основных методов лечения ишемической болезни сердца (ИБС). В настоящее время «золотым стандартом» этого метода является маммарокоронарное шунтирование (МКШ). Целью нашей работы стала систематизация знаний об истории разработки и внедрения в клинику данной операции. В середине XX столетия хирурги многих клиник мира выполняли больным, страдавшим ИБС, известные с начала века операции непрямой реваскуляризации миокарда (НРМ): операции перикардокардиопексии по К. Беку (1935) и её варианты, операцию перевязки внутренней грудной артерии (ВГА) по Фиески (1939). «Мостом» от операций НРМ к прямым вмешательствам на коронарных артериях явилась операция имплантации ВГА в миокард желудочков по А. Вайнбергу (1946). В апреле 1952 г. В.П. Демихов впервые в мире наложил в эксперименте анастомоз конец-в-бок между ВГА и передней нисходящей ветвью (ПМЖВ) левой коронарной артерии (КА) при помощи канюли Пайра. Он предложил отказаться от имплантации ВГА в миокард по Вайнбергу, а вместо этого анастомозировать ее свободный конец с КА ниже места её окклюзии (принцип ПРМ). 2 мая 1960 г. Р. Гётц впервые в мире сформировал анастомоз между правой ВГА и правой КА у больного при помощи танталовой канюли Пайра, но о выполненной им операции не сообщил. 25 февраля 1964 г. В.И. Колесов впервые в мире выполнил ПРМ путём наложения шовного анастомоза «конец-в-бок» между левой ВГА и одной из ветвей левой КА у 44-летнего больного. По мнению Л.А. Бокерия и С.П. Глянцева (2014), идею анастомоза В.И. Колесов мог взять у В.П. Демихова. К 1977 г. В. И. Колесов разработал несколько модификаций своей операции: МКШ «конец-в-бок» и «конец-в конец», МКШ с предварительным проведением ВГА в туннеле под эпикардом, ретроградное МКШ, МКШ с одновременной эндартерэктомией, МКШ с имплантацией другой ВГА в миокард по Вайнбергу, МКШ в сочетании с АКШ, МКШ при помощи сосудосшивающего аппарата и др. Первым в мире В.И. Колесов провел ПРМ при остром инфаркте миокарда и нестабильной стенокардии, выполнил МКШ на работающем сердце и через миниторакотомию. Современные тенденции развития коронарной хирургии направлены на усовершенствование техники минимально инвазивной ПРМ, основным требованием которой является отказ от ИК и выполнение операции на работающем сердце, а также применение артерий для шунтирования КА. Это стало возможно с внедрением в практику прецизионной и роботизированной техники, проведение вмешательств на КА с эндоскопической поддержкой.
Маммарокоронарное шунтирование что это
Аортокоронарное шунтирование (АКШ)
АКШ относится к Хирургическим методам лечения ишемической болезни сердца (ИБС), которые имеют цель прямое увеличение коронарного кровотока, т.е. реваскуляризацию миокарда.
Показания к реваскуляризации миокарда (операции коронарного шунтирования)
Основными показаниями к реваскуляризации миокарда являются:
2) прогностически неблагоприятное поражение коронарного русла – проксимальные гемодинамически значимые поражения ствола ЛКА и основных коронарных артерий с сужениями на 75% и более и проходимым дистальным руслом,
3) сохранная сократительная функция миокарда с ФВ левого желудочка 40% и выше.
Накопленный огромный опыт коронарографических исследований подтвердил известный еще по патологоанатомическим данным факт преимущественно сегментарного характера поражения коронарных артерий при атеросклерозе, хотя нередко встречаются и диффузные формы поражения. Ангиографические показания к реваскуляризации миокарда можно сформулировать следующим образом: проксимально расположенные, гемодинамически значимые обструкции основных коронарных артерий с проходимым дистальным руслом. Гемодинамически значимыми считаются поражения, приводящие к сужению просвета коронарного сосуда на 75% и более, а для поражений ствола ЛКА – 50% и более. Чем проксимальнее расположен стеноз, и чем выше степень стеноза, тем более выражен дефицит коронарного кровообращения, и тем в большей степени показано вмешательство. Наиболее прогностически неблагоприятно поражение ствола ЛКА, особенно при левом типе коронарного кровообращения. Крайне опасно проксимальное сужение (выше 1 септальной ветви) передней межжелудочковой артерии, которое может привести к развитию обширного инфаркта миокарда передней стенки левого желудочка. Показанием к хирургическому лечению является также проксимальное гемодинамически значимое поражение всех трех основных коронарных артерий.
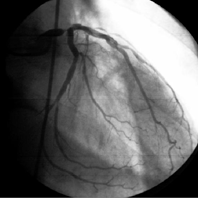
Коронарограмма левой коронарной артерии: критический стеноз ствола ЛКА с хорошим дистальным руслом
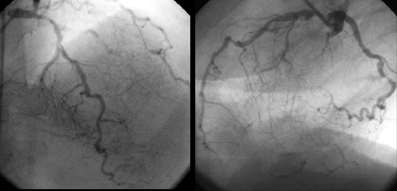
Одним из важнейших условий выполнения прямой реваскуляризации миокарда является наличие проходимого русла дистальнее гемодинамически значимого стеноза. Принято различать хорошее, удовлетворительное и плохое дистальное русло. Под хорошим дистальным руслом подразумевают проходимый до концевых отделов, без неровности контуров, удовлетворительного диаметра участок сосуда ниже последнего гемодинамически значимого стеноза. Об удовлетворительном дистальном русле говорят при наличии неровности контуров или гемодинамически незначимых стенозов в дистальных отделах коронарной артерии. Под плохим дистальным руслом понимают резкие диффузные изменения сосуда на всем протяжении или отсутствие контрастирования его дистальных отделов.
Коронарограмма: диффузное поражение коронарных артерий с вовлечением дистального русла
Противопоказаниями к аортокоронарному шунтированию традиционно считаются: диффузное поражение всех коронарных артерий, резкое снижение ФВ левого желудочка до 30% и менее в результате рубцового поражения, клинические признаки застойной сердечной недостаточности. Существуют и общие противопоказания в виде тяжелых сопутствующих заболеваний, в частности, хронических неспецифических заболеваний легких (ХНЗЛ), почечной недостаточности, онкологических заболеваний. Все эти противопоказания носят относительный характер. Преклонный возраст также не является абсолютным противопоказанием к выполнению реваскуляризации миокарда, то есть более правильно говорить не о противопоказаниях к АКШ, а о факторах операционного риска.
Техника операции реваскуляризации миокарда
Операция АКШ заключается в создании обходного пути для крови минуя пораженный (стенозированный или окклюзированный) проксимальный сегмент коронарной артерии.
Существует два основных метода создания обходного пути: маммарокоронарный анастомоз и обходное аортокоронарное шунтирование аутовенозным (собственной веной) или аутоартериальным (собственной артерией) трансплантатом (кондуитом).
При маммарокоронарном шунтировании используют внутреннюю грудную артерию (ВГА), ее обычно «переключают» на коронарное русло путем анастомозирования с коронарной артерией ниже стеноза последней. ВГА заполняется естественным путем из левой подключичной артерии, от которой она отходит.
При аортокоронарном шунтировании используют так называемые «свободные» кондуиты (из большой подкожной вены, лучевой артерии или ВГА) дистальный конец анастомозируют с коронарной артерией ниже стеноза, а проксимальный – с восходящей аортой.
Прежде всего, важно подчеркнуть, что АКШ – это микрохирургическая операция, поскольку хирург работает на артериях диаметром 1,5-2,5 мм. Именно осознание данного факта и внедрение прецизионной микрохирургической техники обеспечило тот успех, который был достигнут в конце 70-х – начале 80-х гг. прошлого века. Операцию проводят с использованием хирургических бинокулярных луп (увеличение х3-х6), а некоторые хирурги оперируют с применением операционного микроскопа, позволяющего достичь увеличения х10 – х25. Специальный микрохирургический инструментарий и тончайшие атравматические нити (6/0 – 8/0) дают возможность максимально прецизионно сформировать дистальные и проксимальные анастомозы.
Операцию проводят под общим многокомпонентным обезболиванием, а в ряде случаев, особенно при выполнении операций на бьющемся сердце дополнительно используют высокую эпидуральную анестезию.
Техника аортокоронарного шунтирования.
Операцию осуществляют в несколько этапов:
1) доступ к сердцу, осуществляемый обычно путем срединной стернотомии;
2) выделение ВГА; забор аутовенозных трансплантатов, выполняемый другой бригадой хирургов одновременно с производством стернотомии;
3) канюляция восходящей части аорты и полых вен и подключение ИК;
4) пережатие восходящей части аорты с кардиоплегической остановкой сердца;
5) наложение дистальных анастомозов с коронарными артериями;
6) снятие зажима с восходящей части аорты;
7) профилактика воздушной эмболии;
8) восстановление сердечной деятельности;
9) наложение проксимальных анастомозов;
10) отключение ИК;
11) деканюляция;
12) ушивание стернотомического разреза с дренированием полости перикарда.
Большинство хирургов вначале накладывают дистальные анастомозы аортокоронарных шунтов. Сердце ротируют для доступа к соответствующей ветви. Коронарную артерию вскрывают продольно на относительно мягком участке ниже атеросклеротической бляшки. Накладывают анастомоз конец в бок между трансплантатом и коронарной артерией. Сначала формируют дистальные анастомозы свободных кондуитов, а в последнюю очередь – маммарокоронарный анастомоз. Внутренний диаметр коронарных артерий составляет обычно 1,5-2,5 мм. Чаще всего шунтируют три коронарные артерии: переднюю межжелудочковую, ветвь тупого края огибающей артерии и правую коронарную артерию. Примерно у 20% больных требуется выполнение четырех и более дистальных анастомозов (до 8-ми). По окончании наложения дистальных анастомозов после профилактики воздушной эмболии зажим с восходящей аорты снимают. После снятия зажима сердечную деятельность восстанавливается самостоятельно или путем электрической дефибрилляции. Затем на пристеночно отжатой восходящей аорте формируют проксимальные анастомозы свободных кондуитов. Больного согревают. После включения кровотока по всем шунтам постепенно заканчивают ИК. Затем следуют деканюляция, реверсия гепарина, гемостаз, дренирование и ушивание ран.
Многочисленные исследования убедительно доказали, что операции прямой реваскуляризации миокарда увеличивают продолжительность жизни, снижают риск развития инфаркта миокарда и улучшают качество жизни по сравнению с медикаментозной терапией, особенно в группах больных с прогностически неблагоприятным поражением коронарного русла.
Бимаммарное шунтирование
Это операция на открытом сердце, которая проводится с целью восстановления коронарного кровотока. В качестве шунтов используют правую и левую внутренние грудные артерии.
Об операции
Использование артерий, близких по анатомическому строению к коронарным сосудам, демонстрирует гораздо лучший отдаленный результат. В настоящее время во всем мире все чаще используют внутренние грудные (маммарные) артерии, как наиболее жизнеспособные и имеющие ряд преимуществ. Маммарные артерии более долговечны и спустя несколько лет сохраняют свою проходимость и обеспечивая тем самым полноценное поступление крови. В то время как венозный трансплантат подвержен атеросклерозу, развитию патологических изменений, что может привести к его тромбозу.
В кардиохирургическом отделении ФНКЦ ФМБА проводится несколько вариантов бимаммарного шунтирования:
Преимущества методики
Показания к бимаммарному шунтированию
В зависимости от степени повреждения сосудов и нарушения кровообращения кардиохирург может рекомендовать бимаммарное шунтирование.
Показания к операции:
Необходимость хирургического вмешательства определятся врачом индивидуально в каждом конкретном случае.
Как и любой другой метод хирургического лечения, бимаммарное шунтирование имеет противопоказания:
Подготовка к операции
Подготовка к бимаммарному шунтированию требует тщательного предоперационного обследования. В него входят:
В зависимости от наличия сопутствующих заболеваний может быть назначена консультация у других специалистов и проведены дополнительные исследования:
Вы можете в плановом порядке быть госпитализированы в наше кардиологическое отделение, где перед операцией вам проведут все необходимые исследования. В структуру ФНКЦ ФМБА входит собственный клинико-диагностический центр, поэтому мы гарантируем качественную и точную диагностику, достоверные результаты анализов.
За 7-10 дней до операции пациенту дают рекомендации по отмене препаратов, влияющих на свертываемость крови. Также в это время нельзя употреблять алкоголь и необходимо отказаться от курения.
За сутки до бимаммарного шунтирования пациенту разрешается завтрак и обед, легкий ужин. На ночь ставится очистительная клизма и исключается прием любой пищи и жидкости.
Утром пациент принимает душ. Перед операцией его осматривает хирург и анестезиолог. Врачи подробно рассказывают о ходе операции, ее объеме и особенностях, возможных осложнениях во время хирургического вмешательства и как бригада врачей будет с ними справляться. Пациент подписывает информационное согласие на оперативное вмешательство. Больному вводят седативные препараты для снятия эмоционального напряжения и волнения, после чего доставляют в операционный блок.
Проведение бимаммарного шунтирования
Бимамммарное шунтирование проводится под общим наркозом как на работающем сердце, так и на остановленном в условиях искусственного кровообращения. Операция длится около 4 часов.
Кардиохирурги нашей клиники придерживаются следующего алгоритма при выполнении операции:
Во время проведения бимаммарного шунтирования кардиохирург может параллельно провести РЧА легочных вен, если у пациента наблюдается аритмия. В клинике ФНКЦ ФМБА проводят разные операции, когда параллельно с шунтированием сердца удаляют опухоль в любом органе. Или бимаммарное шунтирование выполняется в комплексе с операцией на клапанах сердца или сонной артерии.
После операции
Первые сутки после операции пациент находится в отделении реанимации под постоянным присмотром наших врачей и медицинского персонала. Если осложнений нет, через сутки снимают дренажную систему и переводят в отделение кардиологии. Больному объясняют, как правильно нужно себя вести, чтобы не было возможных осложнений. В стационаре пациент находиться от 7 до 10 дней, в течение этого времени его наблюдают специалисты (работа сердца, заживление швов, общее состояние).
Перед выпиской больного осматривает кардиолог, делает контрольное обследование, дает рекомендации и памятку по восстановлению.
Во время реабилитации необходимо:
Важно, чтобы пациент отнесся ко всем рекомендациям серьезно. Период реабилитации имеет важную роль в восстановлении организма после проведенной операции. Принимайте все лекарства в соответствии с назначениями врача, дополнительные препараты должны быть согласованы. Повторный осмотр у кардиолога необходимо пройти через 1 месяц, затем через 3, 6, 12.
Нашим пациентам мы предлагаем программу реабилитации в нашей клинике ФНКЦ ФМБА.
Стоимость проведения операции бимаммарного шунтирования
Кардиохирургия является одним из основных направлений деятельности ФНКЦ ФМБА. Каждый из врачей, ведущих прием, имеет опыт проведения кардиохирургических операций более 15 лет. Для каждого пациента разрабатывается индивидуальный план лечения.
В нашей клинике операция может проводиться бесплатно в рамках высокотехнологичной медицинской помощи ВМП, по страховым полюсам ДМС или платно.
Стоимость платной операции определяется объемом хирургического вмешательства, состоянием пациента при поступлении, сопутствующими заболеваниями и может варьироваться от 420 000 – 450 000 рублей. В эту сумму входит:
Записаться на прием к кардиохирургам ФНКЦ ФМБА России Вы можете в любое удобное для вас время, предварительно позвонив по телефону… или заполнив специальную форму записи на сайте.
Многолетний опыт наших кардиохирургов подтвержден большим количеством успешных операций. Кардиологическое отделение проводит уникальные операции различной сложности. Многопрофильность центра, выдающиеся хирурги и современное оснащение операционных позволяют проводить комплексное лечение пациента и одномоментные операции по разным направлениям.
Маммарокоронарное шунтирование что это
РНЦХ им. акад. Б.В. Петровского РАМН
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
Маммарокоронарное и аутовенозное подключично-коронарное шунтирование из левосторонней торакотомии
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(4): 4-10
Белов Ю. В., Лысенко А. В., Комаров Р. Н., Стоногин А. В. Маммарокоронарное и аутовенозное подключично-коронарное шунтирование из левосторонней торакотомии. Хирургия. Журнал им. Н.И. Пирогова. 2016;(4):4-10.
Belov Iu V, Lysenko A V, Komarov R N, Stonogin A V. Coronary artery bypass grafting using internal thoracic artery and saphenous vein via left thoracotomy. Khirurgiya. 2016;(4):4-10.
https://doi.org/10.17116/hirurgia201644-7
РНЦХ им. акад. Б.В. Петровского РАМН
РНЦХ им. акад. Б.В. Петровского РАМН
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
История хирургической реваскуляризации миокарда началась с маммарокоронарного шунтирования из левосторонней торакотомии, т. е. с методики, известной в наши дни как MIDCABG (Minimally Invasive Direct Coronary Artery Bypass Grafting) [3, 4].
В настоящее время именно маммарокоронарный анастомоз с передней межжелудочковой ветви (ПМЖВ) считается «золотым стандартом» и показателем высочайшего качества проведения операции прямой реваскуляризации миокарда.
Маммарокоронарное шунтирование при изолированном поражении ПМЖВ является операцией выбора ввиду того, что стентирование ее проксимального отдела при однососудистом поражении не всегда технически возможно и имеет несколько худшие отдаленные результаты [2].
Немаловажным фактором, способным уменьшить количество послеоперационных осложнений после маммарокоронарного шунтирования, является возможность выполнения этой операции из левосторонней торакотомии, без распиливания грудины, без нарушения каркасной функции грудной клетки и риска несостоятельности шва грудины, а самое главное, без искусственного кровообращения [1].
Таким образом, из минимального разреза и без искусственного кровообращения возможно выполнить реваскуляризацию миокарда с хорошим непосредственным и отдаленным результатом как первично, так и у пациентов с дисфункцией наложенного ранее шунта к ПМЖВ [5, 7, 8].
С учетом возрастающего интереса к гибридным вмешательствам маммарокоронарное шунтирование из левосторонней торакотомии может быть одним из этапов такого лечения. Например, первым этапом пациенту выполняем маммарокоронарный анастомоз из левосторонней торакотомии с последующим стентированием коронарной артерии другого бассейна, стентированием аорты или проведением имплантации транскатетерного аортального клапана [6].
В нашем сообщении мы попытаемся кратко представить показания к маммарокоронарному шунтированию из левосторонней торакотомии, особенности хирургической техники выполнения операции и ведения пациентов.
Показания к маммарокоронарному шунтированию из левосторонней торакотомии:
1. Хроническая окклюзия ПМЖВ.
2. Стеноз проксимального отдела ПМЖВ более 75%, не пригодный для ангиопластики со стентированием.
3. Двухсосудистое поражение: стеноз ПМЖВ более 75% с непротяженным локальным сужением (более 65%) огибающей или правой коронарной артерии.
4. Многососудистое поражение со стенозом проксимального отдела ПМЖВ более 75% и диффузным дистальным поражением других коронарных бассейнов.
Оптимальным для выполнения маммарокоронарного шунтирования из левосторонней торакотомии, по нашему мнению, является следующее:
1. Проксимальная окклюзия или критический стеноз ПМЖВ и/или диагональной ветви (ДВ).
2. Диаметр ПМЖВ не менее 1,75-2,00 мм, без кальциноза и дистального поражения.
3. Сохранная насосная функция сердца без больших рубцовых поражений передней стенки, верхушки и межжелудочковой перегородки.
1. Воспалительные заболевания левого легкого и плевры.
3. Атеросклероз подключичных артерий со стенозированием в первом сегменте 50% и более.
4. Окклюзия подвздошных артерий с крупными коллатералями из системы внутренней грудной артерии (ВГА).
Количество дистальных анастомозов при операции из левосторонней торакотомии обычно не превышает 1-2, хотя некоторые авторы сообщали о секвенциальном шунтировании 3 коронарных артерий.
Техника операции. Пациента укладываем на правый бок с валиком под левой половиной грудной клетки под углом около 45°, левую руку, согнутую в локтевом суставе, фиксируем над головой пациента.
Мы рекомендуем оставить обработанным левый треугольник Скарпы для подключения периферического искусственного кровообращения и/или проведения внутрибаллонной аортальной контрпульсации в случае необходимости. У пациентов крайне высокого риска допустима превентивная постановка интродьюсеров в бедренные сосуды или выполнение операции в условиях параллельного периферического искусственного кровообращения.
Учитывая ограниченный размер хирургического доступа, следует предусмотреть возможность использования наружного дефибриллятора или дефибриллятора с одним наружным электродом.
После обработки грудной клетки пациента операционное поле заклеиваем хирургической пленкой с обязательной визуализацией ключицы, грудины, яремной вырезки, эпигастральной области и передней подмышечной линии.
В зависимости от конституциональных особенностей пациента и предполагаемого места наложения дистального анастомоза выполняем переднюю торакотомию в четвертом или пятом межреберье длиной от 7 до 10 см, медиальный край разреза начинаем по парастернальной линии.
При выполнении торакотомии следует избегать излишней травматизации тканей. Для дополнительного расширения доступа в случае необходимости можно аккуратно отсечь хрящевую часть V и/или VI ребра от грудины. Существует несколько модификаций специальных ретракторов для мобилизации внутренней грудной артерии (ВГА) из торакотомного доступа, но можно с успехом использовать обычный малый торакальный расширитель.
Однолегочная интубация может оказаться необходимой при выраженной эмфиземе, но обычно этого не требуется.
Применение налобного света с мощной лампой крайне желательно при мобилизации левой ВГА из левосторонней торакотомии. Для манипуляций при ее мобилизации могут потребоваться инструменты длиной 25-30 см.
Легкое отводим тупфером латерально и вниз, после чего визуализируем левую ВГА. Ее мобилизацию удобнее сначала провести в каудальном, а затем в краниальном направлении на протяжении от шестого-седьмого межреберья до подключичной артерии по методике полной скелетизации.
После введения полной дозы гепарина (300 ЕД/кг) производим клипирование и отсечение ВГА в дистальном направлении и ее дилатацию 2% раствором папаверина (1 мл в 30 мл 0,9% раствора натрия хлорида) c помощью шприца с ограничением давления до 100 мм рт.ст.
Следующим этапом оцениваем гемостаз и проводим визуальный контроль для выявления возможных дефектов ВГА (травма, отслоение интимы, гематомы). На короткое время снимаем зажим с проксимального конца ВГА и вводим 3-5 мл 2% раствора папаверина в подключичную артерию. Убедившись в хорошей пульсации, наличии удовлетворительного свободного кровотока и качественного гемостаза, клипируем дистальный конец ВГА. Эту артерию с целью профилактики ее спазма накрываем салфеткой, пропитанной 2% раствором папаверина, которую сохраняем до микрохирургического этапа операции.
Перикард вскрываем в продольном направлении медиальнее прохождения левого диафрагмального нерва, предварительно удалив жировые подвески. Края перикарда прошиваем швами-держалками, обычно по 3 на каждую сторону. Проводим ревизию сердца и выбираем оптимальное место для наложения дистального анастомоза ВГА с ПМЖВ.
В случае необходимости есть возможность немного улучшить экспозицию ПМЖВ, для этого следует произвести тракцию в дистальном и проксимальном направлении за швы-держалки, проведенные под ПМЖВ.
Место наложения дистального анастомоза с ПМЖВ фиксируем вакуумным или компрессионным стабилизатором миокарда. Артериотомию выполняем скальпелем с лезвием № 11, далее расширяем разрез до необходимого размера микрохирургическими ножницами.
Обязательно проверяем проходимость артерии бужом в дистальном направлении. В случае появления признаков ишемии миокарда или нарушения ритма сердца немедленно осуществляем установку временного внутрипросветного шунта максимально возможного диаметра. По стандартной методике накладываем маммарокоронарный анастомоз нитью пролен 8/0 (рис. 1).

При планировании маммарокоронарного шунтирования ДВ и ПМЖВ следует сначала наложить анастомоз бок в бок с ДВ, а затем анастомоз конец в бок с ПМЖВ.
После пуска кровотока проводим контроль гемостаза и инородных тел, в обязательном порядке подшиваем 2 электрода к левому желудочку.
Для дренирования полости перикарда мы не используем отдельный дренаж, а делаем коагулятором отверстие диаметром около 2 см в проекции верхушки сердца, тем самым обеспечивая беспрепятственное сообщение перикарда и левой плевральной полости. Перикард обычно сводим 2-3 наводящими швами.
После перевода пациента в отделение реанимации дренажи подключаем на аспирацию, выполняем рентгенографию органов грудной клетки.
В случае, если позволяет гемодинамика, для профилактики спазма ВГА мы применяем интраоперационное внутривенное медленное введение блокаторов медленных кальциевых каналов.
В послеоперационном периоде в обязательном порядке определяем время свертывания крови; если оно меньше 8 мин, назначаем введение гепарина по 2500 ЕД каждые 4 ч.
Сразу после перевода пациента на самостоятельное дыхание и экстубации даем ему 150 мг клопидогреля, 100 мг ацетилсалициловой кислоты и блокатор медленных кальциевых каналов.
При подключично-коронарном шунтировании аутовену необходимой длины сначала анастомозируем с подключичной артерией, доступ к которой выполняем на 1 см ниже ключицы по среднеключичной линии.
Подключичная артерия лежит в рыхлом клетчаточном пространстве сразу под ключичной порцией большой грудной мышцы. Артерию берем на две держалки и аккуратно подтягиваем вверх; книзу и кзади от подключичной артерии пальпируем межреберье и делаем коагулятором канал шириной около 1 см для последующего проведения шунта в плевральную полость.
После введения полной дозы гепарина (300 ЕД/кг) подключичную артерию пережимаем атравматическими зажимами в дистальном и проксимальном направлении, выполняем артериотомию по нижней стенке скальпелем с лезвием № 11, далее заводим в просвет стандартный перфоратор аорты диаметром 4-5 мм.
По стандартной методике формируем анастомоз конец в бок с аутовеной под углом около 90°. Проводим шунт в плевральную полость под контролем зрения и по возможности предупреждаем перегиб и перекрут последнего. Дальнейший ход операции не отличается от стандартного (рис. 2).

Обсуждение
Выполнение операции из левосторонней торакотомии требует от хирурга аккуратности и прецизионности. Выполнять такие операции следует хирургу, имеющему достаточный опыт проведения прямой реваскуляризации миокарда без искусственного кровообращения.
Исключение искусственного кровообращения, потенциальной возможности нестабильности грудины и небольшой разрез делают MIDCABG и LAST крайне привлекательными методиками для пациента и врача.
Использование временного интракоронарного шунтирования при наложении дистального анастомоза с ПМЖВ не обязательно, но желательно ввиду особенностей манипуляций в ограниченном пространстве хирургического доступа.
При возникновении любого состояния, угрожающего жизни пациента (нарушение ритма, неконтролируемое кровотечение, интрамиокардиальный ход проксимальной и средней трети ПМЖВ и/или невозможность закончить операцию из торакотомии) хирург должен иметь четкий алгоритм действий. При планировании операций из левосторонней торакотомии всегда надо учитывать ограничения этой методики и быть готовым к конверсии доступа (к срединной стернотомии) и/или переходу на искусственное кровообращение.
Соблюдая показания и выполняя операцию по представленной методике, можно добиться хороших результатов даже у очень тяжелой категории пациентов с хронической обструктивной болезнью легких, эмфиземой, бронхиальной астмой, тяжелым течением сахарного диабета и диффузным поражением коронарных артерий бассейна огибающей и правой коронарной артерий.