мамоклам и кламин чем отличаются
Основные результаты научно-исследовательской работы и перспективы химиопрофилактики рака
Достижения и перспективы химиопрофилактики рака
С середины 80-х годов 20 века в лаборатории предклинических испытаний, наряду с работами прикладного характера, определилось самостоятельное научное направление по разработке проблемы химиопрофилактики опухолей (В.Г. Беспалов, В.А. Александров), основываясь на современных принципах, которые практически не изменились до сих пор. Разработка средств для химиопрофилактики рака является сложным и длительным процессом, который должен проходить следующие этапы: доклиническое изучение антиканцерогенной активности на моделях опухолей различных органов и оценка возможных токсических свойств, предварительное клиническое изучение эффективности и безопасности у относительно небольшого числа пациентов из групп повышенного риска злокачественных опухолей, итоговое клиническое изучение на больших контингентах пациентов с оценкой онкологической заболеваемости и смертности. Перспективными для химиопрофилактики рака являются вещества, обладающие выраженным антиканцерогенным действием на широком спектре экспериментальных моделей опухолей, не имеющие токсических свойств, показавшие эффективность и безопасность в клинических исследованиях.
Цель химиопрофилактики – поиск эффективных средств (природных и синтетических), способных тормозить или препятствовать возникновению и развитию опухолей и внедрение наиболее активных препаратов в клиническую практику.
Средства для профилактики рака должны отвечать следующим основным требованиям:
Усилия в разработке этой проблемы были сосредоточены на поиске препаратов, способных ингибировать канцерогенез при их использовании, в основном, в период постинициации, т.е. в фазу промоции и прогрессии опухолей. Именно такой подход является наиболее перспективным для химиопрофилактики рака, поскольку показания к применению антипромоторных препаратов необычайно широки: среди популяции практически здоровых лиц, живущих в экологически неблагоприятных условиях; в группах с высоким риском развития рака; среди больных с преопухолевыми заболеваниями; у онкологических больных в период ремиссии после проведенного радикального лечения.
С первых шагов разработки проблемы химиопрофилактики рака решалась важная и трудоемкая задача по отработке моделей опухолей (как злокачественных, так и доброкачественных), вызываемых с достаточно высокой частотой в течение относительно непродолжительного времени (не более 1–1,5 лет), особенно тех локализаций, которые относятся к наиболее распространенным. В итоге в лаборатории были освоены, а также разработаны новые оригинальные экспериментальные модели всех основных опухолей, встречающихся у человека (табл. 1). Кроме того, в лаборатории была разработана модель опухолей молочной железы, эндокринной и репродуктивной систем и других органов, индуцированных гамма-облучением, у крыс; многоорганные модели канцерогенеза, вызываемого химическими канцерогенами.
Таблица 1. Экспериментальные модели предрака и рака, применяемые в лаборатории, для изучения антиканцерогенных средств
Локализация
Метод индукции
Гистологический тип
МНМ интраммамарно, МНМ или ДМБА в/в у крыс
Инициация МНМ в/в + промоция тестостероном в/б у крыс
Простатическая интраэпителиальная неоплазия, аденокарциномы
МХ интратрахеально у крыс, уретан в/б у мышей
АОМ п/к у крыс и мышей, МНМ интраректально у крыс
Очаги аберрантных крипт, аденокарциномы
Плоскоклеточные карциномы, папилломы
ДЭНА в/б у крыс и мышей
Пренеопластические очаги, гепатоцеллюлярные карциномы
ДМБА + ТПА или БП накожно
Плоскоклеточные карциномы, папилломы
Глиомы головного и спинного мозга, невриномы периферических нервов
Основные результаты научно-исследовательской работы
Доклиническое и клиническое изучение антиканцерогенной активности синтетических и природных веществ
К настоящему времени на различных моделях опухолей изучено более 80 веществ, и из них более 50 проявило антиканцерогенную активность, основные из которых представлены в табл. 2. В результате проведенной работы впервые выявлен ряд новых антиканцерогенных веществ, у известных ингибиторов установлена способность тормозить развитие опухолей ранее неизвестных локализаций.
Таблица 2. Ингибиторы канцерогенеза, изученные в лаборатории
Класс соединений
Препараты и вещества
Ретинол, альфа-токоферол, аскорбиновая кислота, тиамин, рибофлавин, витаминно-минеральные комплексы
Бета-каротин обычный и липосомальный
Селенит натрия, молибдат натрия, цинка сульфат
Нестероидные противовоспалительные средства
Диазепам, дифенин, карбонат лития
Тималин, тимоген, эпиталамин, кортексин
Органические кислоты и их соли
Фумаровая кислота, глюкарат кальция, глюкуронат калия
Биотехнологические растительные препараты
Экстракты лекарственных растений
Betula pendula, Eleutherococcus senticosus, Filipendula ulmaria, Glycyrrhiza glabra, Plantago major, Rhaponticum cartamoides, Urtica dioica
Пищевые вещества и природные комплексы
Концентрат ламинарии, масло зародышей пшеницы, пренолы из хвои, провитаминный концентрат из хвои, оксигумат торфяной, отруби пшеницы, рыбий жир, хвойный комплекс, экстракт фукусный
На основании полученных результатов по всем испытанным веществам на разных моделях были сделаны важные общие выводы:
В результате экспериментов были отобраны и предложены для дальнейшего клинического изучения наиболее эффективные и безопасные антиканцерогенные вещества. Разработан алгоритм клинических исследований химиопрофилактических препаратов у пациентов из групп повышенного риска рака молочной железы, желудка, легких, толстой кишки с использованием клинических, эндоскопических, гормональных, биохимических, иммунологических, эхографических, рентгенологических, гистологических, цитологических, цитоморфометрических исследований и оценкой влияния на промежуточные биомаркеры повышенного онкологического риска. В проведенных клинических испытаниях выявлены химиопрофилактические средства, оказывающие выраженное лечебное действие на патологические сдвиги у пациентов из групп повышенного онкологического риска. Кламин (БАД на основе концентрата ламинарии) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию кишечной метаплазии и дисплазии у больных атрофическим гастритом; улучшал клинико-рентгенологическую картину, вызывал регрессию дисплазии и метаплазии эпителия бронхов у больных хроническим бронхитом курильщика; вызывал регрессию предраковых очагов у больных красным плоским лишаем ротовой полости; нормализовал стул, подавлял повышенную пролиферацию эпителия слизистой оболочки и вызывал частичную регрессия полипов у пациентов с аденоматозными полипами толстой кишки. Лесмин (БАД на основе хвойного комплекса) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, подавлял инфекцию Helicobacter pylori, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию лимфоплазмоцитарной инфильтрации и кишечной метаплазии слизистой оболочки желудка у больных атрофическим гастритом. Результаты доклинического и клинического изучения пищевых веществ и разработанных в лаборатории на их основе БАД опубликованы в нескольких монографиях (в частности: Беспалов В.Г. Питание и профилактика онкологических заболеваний. – Великий Новгород, Полиграфическая компания «Позитив», 2015. – 242 с.).
На основе концентрата ламинарии в качестве фармацевтической субстанции был создан и внедрен в клиническую практику лекарственный препарат мамоклам, который применяется для лечения фиброзно-кистозной болезни молочных желез. В проведенных клинических испытаниях установлено, что мамоклам значительно уменьшает проявления масталгии, предменструального напряжения молочных желез и альгоменореи, ослабляет пальпаторные признаки фиброзно-кистозной болезни, нормализует менструальный цикл, баланс тиреоидных и половых гормонов; по данным маммографии и эхографии вызывает регрессию фиброаденоматозных уплотнений и кист в ткани молочных желез, приводит к уменьшению диаметра расширенных млечных протоков, снижает маммографическую плотность. Результаты клинического изучения мамоклама обобщены в монографии: Беспалов В.Г. Мастопатия и лекарственный препарат мамоклам. Методическое пособие для врачей. – СПб.: Издательство «Игра света», 2008. – 68 с.
Доклиническое и клиническое изучение противоопухолевой активности фармакологических веществ и препаратов
В последние годы нами были пересмотрены результаты изучения ранее синтезированных противоопухолевых препаратов, чтобы выявить наиболее перспективные для внедрения в клиническую практику после более углубленного и широкого экспериментального исследования. Наибольший интерес привлекли два препарата: диоксадэт и хлонизол.
Диоксадэт относится к группе алкилирующих соединений – этилениминов. В лаборатории были разработаны новая схема синтеза фармацевтической субстанции и новая лекарственная лиофилизированная форма препарата, которые обеспечивают большую безопасность в производстве; разработан новый проект ФСП на лекарственную форму; проведены доклинические исследования по оценке противоопухолевой активности диоксадэта на стандартных моделях трансплантированных опухолей в сравнении с цитостатиками, применяемыми в клинической практике.
В доклинических исследованиях была установлена выраженная противоопухолевая активность диоксадэта на широком спектре перевиваемых опухолей у лабораторных животных. Данные сравнительного изучения диоксадэта свидетельствуют о его более высокой противоопухолевой активности, чем у наиболее близкого к нему по структуре тиофосфамида. В эксперименте на крысах с перевиваемой асцитной опухолью яичника противоопухолевое действие диоксадэта при внутрибрюшинном введении сравнимо с действием цисплатина, являющегося стандартом в клинической интраперитонеальной химиотерапии рака яичника. С учетом того, что диоксадэт, в отличие от препаратов платины, обладает значительно более низкой токсичностью, не вызывает осложнений в виде спаечного процесса, перспективным является применение диоксадэта для интраперитонеальной химиотерапии рака яичника. В экспериментах с асцитной опухолью Эрлиха у мышей выявлен выраженный синергизм противоопухолевого действия диоксадэта в комбинации с гемцитабином при отсутствии повышения токсичности.
Клинические испытания диоксадэта по II фазе были проведены в 15 онкологических учреждениях у 229 больных распространенными формами злокачественных новообразований различных локализаций. Несмотря на то, что все больные были с далеко зашедшими формами злокачественных новообразований, практически при всех локализациях был доказан объективный противоопухолевый эффект диоксадэта. Особенно сильным противоопухолевый эффект диоксадэта оказался в лечении распространенных форм рака яичников и молочной железы, в том числе у больных с асцитом и ранее леченных другими алкилирующими агентами. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации при операбельных и распространенных формах рака почки. Химиоэмболизация с диоксадэтом повышала 2- и 3-летнюю выживаемость больных неоперабельным раком почки. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации печеночной артерии у больных с первичным раком печени и метастазами в печень колоректального рака. Была доказана эффективность химиоэмболизации с диоксадэтом в виде получения объективного противоопухолевого ответа и увеличения выживаемости больных.
Диосадэт обладает выраженным так называемым контактным противопухолевым действием. В настоящее время в лаборатории развивается направление использования диоксадэта в различных режимах интраперитонеальной химиотерапии канцероматоза брюшной полости. Доклинические исследования показали, что диоксадэт при интраперитонеальной химиотерапии превосходит по эффективности и безопасности другие применяемые с этой целью цитостатики: циспалатин, паклитаксел, митомицин С, мелфалан.
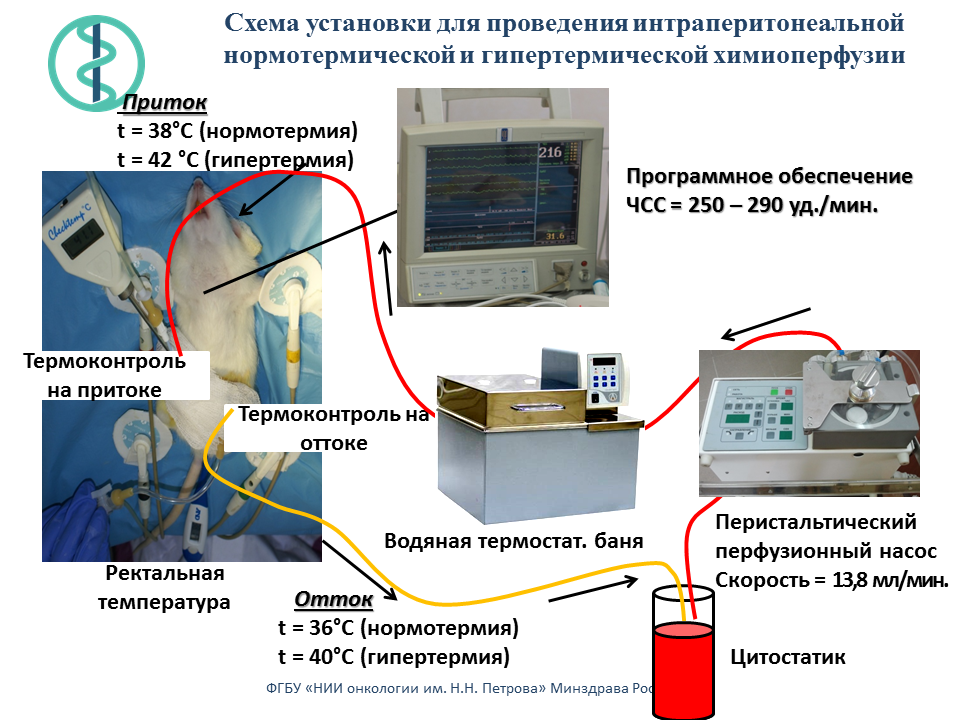
Создана экспериментальная установка для химиоперфузионного лечения канцероматоза брюшной полости на моделях у крупных и мелких лабораторных животных.
Результаты доклинического и клинического изучения химиоперфузионного лечения злокачественных опухолей обобщены в монографии: Беляева О. А., Беспалов В. Г., Сенчик К. Ю., Киреева Г. С., СтуковА. Н., Гафтон Г. И., Карачун А. М., Гусейнов К. Д. Беляев А. М. Химиоперфузионное лечение канцероматоза брюшной полости. – СПб., 2016. – 146 с.
Проведено сравнительное статистическое исследование результатов восьми независимых экспериментов по изучению эффективности интраперитонеальной химиотерапии. Изучены режимы инъекционной внутрибрюшинной (в/б) химиотерапии (ИВХ), нормо– и гипертермической химиоперфузии (НИПХ и ГИПХ) препаратом диоксадэт на модели перевиваемого асцитного рака яичника (РЯ) у 288 крыс самок Вистар. Перевивка РЯ осуществляли в/б в количестве 1?107 опухолевых клеток, интраперитонеальную химиотерапию проводили однократно через 48 часов после трансплантации опухоли. Диоксадэт вводили в максимально переносимых дозах в/б: при ИВХ с помощью шприца в дозе 1,5 мг/кг массы тела; при НИПХ и ГИПХ раствор с цитостатиком прокачивали через брюшную полость специальным насосом соответственно в дозе 30 мг/кг при температуре 36,5–37,5°С и 15 мг/кг при температуре 40,5–41,5°С. В контрольных группах крысам в/б аналогичными путями вводили физиологический раствор. Противоопухолевые эффекты лечения оценивали по увеличению средней продолжительности жизни крыс. Для статистического анализа использован принцип гармонизации статистических доказательств и предсказаний. В контрольной группе с инъекционным в/б введением физиологического раствора средняя продолжительность жизни составила 15 дней, 95% доверительный интервал (ДИ) от 12 до 19. По сравнению с данным контролем воздействие ИВХ, НИПХ и ГИПХ увеличивало среднюю продолжительность жизни соответственно на 85, 97 и 202% (p
Актуальные аспекты лечения мастопатии
Одним из наиболее распространенных проявлений дисгормональных расстройств у женщин является фиброзно-кистозная мастопатия (ФКМ).
Одним из наиболее распространенных проявлений дисгормональных расстройств у женщин является фиброзно-кистозная мастопатия (ФКМ).
Впервые кистозную болезнь молочной железы (МЖ) описал Cooper в 1829 г. В 1838 г. J. Velpean в описании мастопатии применил термин «хроническая индурация». В 1840 г. R. Brodi предложил называть это заболевание «серозно-кистозная опухоль МЖ», а Schimmelbusch (1892) «кистозная аденома». Единая общепринятая терминология гиперпластических процессов до сих пор отсутствует. В скандинавской и английской литературе большинство форм мастопатии обозначают как фиброаденоматоз или фиброаденоматоз с наличием кист или без них. В отечественной литературе наиболее часто используются термины «мастопатия», «фиброзно-кистозная мастопатия», «фиброаденоматоз», «дисгормональная гиперплазия МЖ» и «дисгормональные заболевания МЖ (ДЗМЖ)».
Несмотря на множество предложенных классификаций мастопатии ни одна из них до конца не отражает всего многообразия происходящих при этом клинико-морфологических изменений.
В возникновении и развитии ДЗМЖ ведущая роль отводится состоянию гипоталамо-гипофизарной системы. Нарушение нейрогуморальной регуляции репродуктивного цикла ведет к активации пролиферативных процессов в МЖ. Многочисленными клиническими исследованиями установлено, что доброкачественные заболевания МЖ в 70% случаев сочетаются с нарушениями в нейроэндокринной и репродуктивной системах.
Мастопатии — сборная группа заболеваний МЖ, при которых меняется количественное взаимоотношение железистой, жировой и соединительной тканей. Наблюдается гиперплазия эпителия, усиленная продукция секрета, расширение протоков вплоть до образования микрокист, гиперплазия и фиброз соединительной ткани, формирование больших кист и узловых пролифератов [1, 3, 5].
По определению ВОЗ (Женева, 1984) мастопатия (дисплазия МЖ) определяется как фиброзно-кистозная болезнь, характеризующаяся широким спектром пролиферативных и регрессивных изменений ткани МЖ с ненормальным соотношением эпителиального и соединительнотканного компонентов [6].
Являясь частью репродуктивной системы женщины, циклические изменения в репродуктивной системе непосредственным образом отражаются на состоянии МЖ. Ткань МЖ является мишенью для половых гормонов, а также гормонов других эндокринных желез, которые принимают активное участие в функционировании ткани в репродуктивном возрасте, во время беременности и лактации. Актуальность исследования данной темы не вызывает сомнений.
Предоставленный материал основан на многолетнем опыте, накопленном на кафедре радиологии РМАПО, по лечению пациентов с ДЗМЖ, в рамках научной программы «Современные подходы к диагностике и лечению различных заболеваний МЖ».
Классификация мастопатии, предложенная Н. И. Рожковой (1993):
Фиброзно-кистозная болезнь принадлежит к весьма неоднородным (по клинике и диагностике) заболеваниям. Такая мозаичность обусловлена многофакторной природой заболевания, в ее формировании повинны разнообразные гормональные расстройства, стрессы, нарушения репродуктивной функции (отсутствие или поздние первые роды, нарушение ритма менструации), заболевания щитовидной железы и других желез внутренней секреции, неустойчивая нервная система, остеохондроз, гинекологическая патология и др. [1, 2].
Несмотря на множество предложенных классификаций мастопатии ни одна из них до конца не отражает всего многообразия происходящих при этом морфологических изменений. Основным проявлением мастопатии в данной возрастной группе является синдром предменструального напряжения, возникающий, как правило, во вторую фазу менструального цикла, включающий целый комплекс изменений в МЖ. Степень и характер данных изменений способны варьировать от незначительного дискомфорта до выраженной болезненности, проявляющейся как в покое, так и при движении, сопровождающейся увеличением объема груди, чувством распирания, иногда выделениями из сосков серозно-молозивного характера. Данное состояние часто сопровождается головными болями, отеками, повышенной нервной возбудимостью, беспокойством, чувством страха. Варианты могут быть разными. Развитие мастопатии часто сопряжено с нарушениями менструального ритма. Характерно, что все эти состояния проходят после начала менструации, возобновляясь вновь ко второй половине цикла.
Клинический осмотр и пальпация дополняются комплексным рентгеномаммографическим (РМ), ультразвуковым (УЗИ), радиотермометрическими (РТМ-диагностикой) и другими видами инструментальных исследований, с преобладанием возможностей каждого из них в зависимости от индивидуальных особенностей пациентки и конкретной клинической ситуации (рис.).
Вышеперечисленные диагностические методы в раздельном применении имеют свой порог эффективности.
Инструментальные методы позволяют распознать структурные особенности МЖ, однако в большинстве своем они не пригодны для оценки дисгормональных проблем. Основными гормонами, регулирующими менструальный цикл, являются гормоны гипофиза, стероидные гормоны яичников.
Несмотря на то, что практика в лечении диффузных мастопатий насчитывает более 100 лет, до сегодняшнего дня еще не создана единая модель патогенетической терапии, позволяющая практическому врачу дать рекомендации по выбору рациональных медикаментозных комплексов. Остаются совершенно не ясными вопросы, касающиеся продолжительности терапии, обеспечивающей нормализацию гормон-метаболических показателей и клинической картины. Вопрос о применении гормональных препаратов также остается спорным. В то же время лечение должно быть комплексным, длительным, с учетом гормональных, метаболических особенностей больной, сопутствующих заболеваний и выраженности самой мастопатии.
Стратегической ошибкой является изолированное лечение МЖ, не предусматривающее коррекцию гормонального статуса. В таком случае терапия будет носить симптоматический характер и не устранит основную причину заболевания. Однако лечение мастопатии гормональными средствами в настоящее время не может быть рекомендовано из-за побочных эффектов применения синтетических гормонов. Их, как правило, назначает гинеколог-эндокринолог после детального изучения гормонального статуса пациентки (динамический контроль за гормональным статусом, что не всегда экономически доступно пациентам).
В связи с этим ученые всего мира уже многие годы пытаются найти средство, нормализующее дисбаланс гормонального фона и в то же время не нарушающее многосложную и хрупкую эндокринную систему, функционирующую в организме женщины по законам, не до конца изученным к настоящему моменту.
В прошлом столетии прогресс в области фармакохимии привел к увеличению количества химических лекарственных средств, однако в последнее десятилетие интерес исследователей и врачей вновь обращен к препаратам растительного происхождения, отличительная особенность которых — полифункциональность, мягкость действия, минимум побочных эффектов, наличие эффекта последействия, отсутствие развития лекарственной болезни и эффекта отмены препарата.
Современное лечение мастопатий предусматривает определенную этапность. На первом этапе предусматривалась нормализация нарушенной нейрогуморальной регуляции. На втором — поддержание регуляции в организме на физиологическом уровне. Частота выявления того или иного вида патологии МЖ у пациентов с гиперпластическими процессами зависит от менструальной функции в той же мере, в которой сама менструальная функция связана с уровнем синтеза эстрадиола и прогестерона в яичниках, пролактина гипофиза, с нормальным функционированием прямых и обратных связей в системе гипоталамус–гипофиз–яичники.
Важно соблюдать принципы длительности и непрерывности лечения больных мастопатией. Ввиду этого подбор используемых препаратов должен быть тщательно взвешен. Длительная интенсивная терапия в начале и поддерживающие курсы на протяжении нескольких месяцев являются основным условием надежного излечения. Лекарственным средствам должны предъявляться жесткие требования.
Одним из наиболее эффективных препаратов является растительный фитогомеопатический препарат Мастодинон.
Согласно многократно обоснованным фармакологическим и клиническим исследованиям, содержащийся в Мастодиноне экстракт Agnus castus (витекс священный, или авраамово дерево) и еще пять растительных компонентов обладают уникальной природной способностью связывать допаминовые рецепторы и тем самым ингибировать синтез пролактина. Патофизиологически это блокирует латентную гиперпролактинемию, что способствует сужению протоков; снижению активности пролиферативных процессов и образованию соединительнотканного компонента, уменьшает кровенаполнение, приводит к обратному развитию дегенеративных процессов тканей молочных желез, восстановлению функции яичников. Многие синтетические препараты, обладающие теми же свойствами, не нашли широкого применения из-за побочных эффектов (оценка результатов лечения основывалась в первую очередь на субъективных ощущениях женщин и данных клинического, ультразвукового, радиотермографического исследований).
Клинически (после месячного приема Мастодинона) это проявляется снижением отека МЖ, ослаблением болевого синдрома, уменьшением нагрубания в предменструальный период. Назначение препарата «Мастодинон» у большой группы больных с ФКМ, проявляющейся масталгией, выявило, что препарат также нейтрализует нарушения менструального цикла, снижает последствия хронического стресса, уменьшает количество приступов мигрени, снижает проявления психического напряжения. Однако отмечено, что во многих случаях период улучшения после длительного приема препарата сменялся возобновлением жалоб. Препарат хорошо переносится, побочные эффекты редки и малочисленны. Крайне редко бывает индивидуальная непереносимость, в таких случаях назначение лучше отменить. Случаи передозировки препарата не зарегистрированы.
Мастодинон назначается по 30 капель с небольшим количеством жидкости утром и вечером; курс лечения — не менее 3 месяцев. В последние годы появилась таблетированная форма Мастодинона, упрощающая процесс приема препарата.
По данным наблюдений в нашей клинике при ультразвуковых исследованиях отмечено относительное уменьшение мелких кист и кистозного компонента, в некоторых случаях уменьшение или полное прекращение молозивных выделений из сосков (12%). Значительное облегчение почувствовали 70% пациенток, принимавших препарат. Значительного влияния Мастодинона на динамику кистозных образований при выраженном поликистозе МЖ не отмечено.
Учитывая комплексный подход к лечению мастопатии, Мастодинон хорошо сочетается с применяемыми средствами лечения, не дублируя механизм их действия. Немаловажное значение имеет соотношение экономической доступности с качеством препаратов [6, 7, 8].
Важным аспектом при назначении терапии имеют вопросы о причинах болевого синдрома, которые могут быть связаны с гиперпластическими процессами в самой железе и иметь внесистемное происхождение; а также длительный психический стресс, который, как известно, приводит к изменению секреторной функции эндокринных желез и сам по себе является причиной возникновения большинства заболеваний. Не учитывать данный факт при назначении лечения мастопатии невозможно.
Врач-маммолог, проводя прием и назначая лечение, должен владеть навыками психотерапевтических бесед. Однако этого, как правило, недостаточно. При выраженной нервно-психической симптоматике необходима консультация специалиста. Самостоятельное назначение психотропных средств (нейролептики, транквилизаторы) даже при выраженных формах ФКМ ввиду многих побочных эффектов при длительной терапии нецелесообразно.
При выборе оптимального способа лечения необходимо учитывать и диетические факторы (известно отрицательное воздействие на МЖ как переедания, так и недоедания).
С целью улучшения функции печени назначают витамины, принимающие участие в инактивации избытка эстрогенов, которые могут провоцировать мастопатию:
Вполне оправдано также использование целебных свойств растений, что обусловлено наличием в них алкалоидов, витаминов, антибиотических веществ, минеральных солей, растительных гормонов и многих других важных для организма веществ. Известно, что лекарственные травы способны многосторонне воздействовать на организм, одновременно оказывая лечебный эффект при нескольких заболеваниях. Поэтому, имея в арсенале 10–15 трав и применяя их в различных комбинациях, можно успешно лечить ряд заболеваний молочных желез и сопутствующие заболевания органов и систем.
Для лечения мастопатии применялись различные сборы. В зависимости от характера патологии МЖ в них входили: тысячелистник, кукурузные рыльца, можжевеловые ягоды, листья крапивы, череды, корень валерианы и многие другие травы. Помимо непосредственного эффекта, отмечалось положительное влияние на психоэмоциональное состояние женщин: нормализовался сон, стабилизировалось кровяное давление, уменьшалось или пропадало чувство тревоги, канцерофобии.
Современные эпидемиологические, экспериментальные и клинические исследования позволили прийти к заключению, что чрезмерное применение животных жиров вызывает увеличение содержания желчных кислот и их дериватов, которые аккумулируются как преканцерогены и канцерогены. Однако невозможно рекомендовать какую-либо диету, которая могла бы предупредить возникновение опухолей и дисфункциональных состояний. Но рекомендации по исключению вредных привычек, достаточное потребление воды, умеренное недоедание, пища с достаточным количеством клетчатки способствовали профилактике предопухолевых и опухолевых заболеваний.
Широкое распространение в лечении мастопатии получил препарат «Кламин», который содержит концентрат ламинарии, β-каротин, альгинат натрия, маннит, стеарит кальция. В состав концентрата входит комплекс микро- и макроэлементов (калий, кальций, магний, фосфор, сера, йод, селен, цинк, бром, железо и др.), полиненасыщенные жирные кислоты, ди- и триглицериды, фосфаты, пигменты. Кламин нормализует липидный обмен, снижает повышенный уровень холестерина в крови, обладает иммуностимулирующим и гепатопротекторным свойствами.
В настоящее время весьма актуальна концепция о необходимости патогенетической терапии мастопатии с целью профилактики рака. Учитывая роль мастопатии в развитии рака, представляется перспективным использование в лечении больных с мастопатией препаратов, содержащих антиканцерогенные вещества, которые способны тормозить возникновение и развитие злокачественных опухолей МЖ. Такой подход направлен как на патогенетическое лечение мастопатии, так и на профилактику рака МЖ.
Очень важно, что имеется ряд доказательств о способности компонентов лекарственного средства «Мамоклам» снижать риск рака МЖ. При высоком потреблении морских водорослей в пищу отмечается низкая заболеваемость раком МЖ. Пищевой дефицит йода, дисфункция и заболевания щитовидной железы ассоциируются с увеличением риска рака МЖ. Йод в щитовидной железе связывается с липидами, данные йодированные липиды обладают антипролиферативным действием как на нормальные, так и на опухолевые клетки МЖ. Увеличение потребления полиненасыщенных жирных кислот (ПНЖК) Омега-3 в сочетании с включением в рацион значительного количества рыбы и различных морепродуктов снижает риск рака МЖ. Порошок из водоросли ламинарии, рыбий жир, ПНЖК Омега-3 и хлорофилл тормозят канцерогенез МЖ у животных. Как сам препарат «Мамоклам», так и его активная субстанция «Клам» в экспериментах на лабораторных животных эффективно тормозили развитие индуцированных канцерогенами и спонтанных опухолей МЖ.
Эффективность лекарственного препарата «Мамоклам» высока; он может использоваться как в комплексном лечении больных с мастопатией, так и самостоятельно в виде монотерапии. В связи с тем, что Мамоклам содержит антиканцерогенные вещества и предупреждает канцерогенез МЖ в эксперименте, перспективным является его назначение в качестве средства для снижения риска рака МЖ.
Механизмы лечебного действия Мамоклама у больных с мастопатией связаны с содержащимися в этом средстве йоде, ПНЖК Омега-3 и хлорофилле. У пациенток, страдающих мастопатией, часто отмечаются скрытые нарушения тиреоидного гомеостаза по типу гипотиреоза. Чаще всего гипофункция щитовидной железы развивается при хроническом недостатке йода в рационе. В Японии у женщин по сравнению с США и Европой значительно реже встречаются мастопатия и рак МЖ; одним из объяснений такого положения является высокое потребление японскими женщинами йода в составе морских водорослей. При дисфункции щитовидной железы нарушается работа яичников, усиливается выработка гипофизом пролактина, что имеет большое значение в патогенезе мастопатии. Йод стимулирует выделение гипофизом лютеинизирующего гормона, способствуя овуляции при ановуляторных циклах или более активной функции желтого тела в случае его недостаточности. Йод также угнетает эстрогенобразовательную функцию яичников. Поступающий с пищей йод накапливается не только щитовидной железой, но и МЖ. В тканях МЖ обнаружены также рецепторы к гормону щитовидной железы трийодтиронину. Йод в тканях МЖ связывается с липидами, которые регулируют процессы пролиферации клеток МЖ и оказывают антиоксидантное действие. Уменьшение концентрации йода в тканях МЖ имеет большое значение в механизмах развития мастопатии. В клинических исследованиях установлено положительное действие йода в лечении мастопатии. Широко применявшийся ранее йодид калия имеет существенные недостатки: возникновение при длительном приеме явлений йодизма и возможность возникновения индуцированной патологии щитовидной железы, диспептические побочные эффекты. Органически связанный йод в составе Мамоклама не имеет этих недостатков. ПНЖК Омега-3 через вмешательство в синтез простагландинов нормализуют баланс половых гормонов, что может объяснять их лечебное действие при мастопатии. Хлорофилл обладает антиоксидантным, противовоспалительным, антимутагенным и антиканцерогенным действием, что также имеет отношение к патогенезу мастопатии. Таким образом, Мамоклам в результате действия йода, ПНЖК Омега-3 и хлорофилла нормализует баланс тиреоидных и половых гормонов, а также процессы пролиферации в ткани МЖ, что оказывает лечебное действие у больных с мастопатией [3, 4].
Препарат «Мамоклам» применяют внутрь до еды, по 1–2 таблетки, 2–3 раза в день с равными промежутками в течение дня (суточная доза 3–6 таблеток); продолжительность курса лечения — от 1 до 3 месяцев. При необходимости рекомендуется повторять курсы лечения после перерыва от 2 недель до 3 месяцев. Противопоказания: повышенная чувствительность к компонентам препарата, заболевания почек, гиперфункция щитовидной железы, многоузловой зоб, тиреотоксикоз различного генеза, беременность, период кормления грудью.
При применении препарата «Мамоклам» в терапевтических дозах организм получает йод в количестве, несколько превышающем рекомендуемую физиологическую дозу данного микроэлемента, в связи с чем Мамоклам не следует применять с препаратами, содержащими йод.
Набор средств для лечения дисгормональных заболеваний МЖ достаточно велик. Диффузный вариант мастопатии вовсе не опасен для жизни. Тем не менее, оставленное без внимания и адекватного лечения, что случается весьма часто, это заболевание причиняет существенные неудобства и неприятности как страдающим этой болезнью женщинам, так и их близким. Длительно существующая мастопатия является ведущим фактором риска развития рака МЖ. Учитывая широкое распространение мастопатии среди женского населения и относительно невысокую эффективность лечения, необходимо также упомянуть о существовании проблемы экономических затрат и потерь, связанных с этим заболеванием, поэтому очевидна актуальность дальнейших исследований.