мамоклам или кламин что лучше
Основные результаты научно-исследовательской работы и перспективы химиопрофилактики рака
Достижения и перспективы химиопрофилактики рака
С середины 80-х годов 20 века в лаборатории предклинических испытаний, наряду с работами прикладного характера, определилось самостоятельное научное направление по разработке проблемы химиопрофилактики опухолей (В.Г. Беспалов, В.А. Александров), основываясь на современных принципах, которые практически не изменились до сих пор. Разработка средств для химиопрофилактики рака является сложным и длительным процессом, который должен проходить следующие этапы: доклиническое изучение антиканцерогенной активности на моделях опухолей различных органов и оценка возможных токсических свойств, предварительное клиническое изучение эффективности и безопасности у относительно небольшого числа пациентов из групп повышенного риска злокачественных опухолей, итоговое клиническое изучение на больших контингентах пациентов с оценкой онкологической заболеваемости и смертности. Перспективными для химиопрофилактики рака являются вещества, обладающие выраженным антиканцерогенным действием на широком спектре экспериментальных моделей опухолей, не имеющие токсических свойств, показавшие эффективность и безопасность в клинических исследованиях.
Цель химиопрофилактики – поиск эффективных средств (природных и синтетических), способных тормозить или препятствовать возникновению и развитию опухолей и внедрение наиболее активных препаратов в клиническую практику.
Средства для профилактики рака должны отвечать следующим основным требованиям:
Усилия в разработке этой проблемы были сосредоточены на поиске препаратов, способных ингибировать канцерогенез при их использовании, в основном, в период постинициации, т.е. в фазу промоции и прогрессии опухолей. Именно такой подход является наиболее перспективным для химиопрофилактики рака, поскольку показания к применению антипромоторных препаратов необычайно широки: среди популяции практически здоровых лиц, живущих в экологически неблагоприятных условиях; в группах с высоким риском развития рака; среди больных с преопухолевыми заболеваниями; у онкологических больных в период ремиссии после проведенного радикального лечения.
С первых шагов разработки проблемы химиопрофилактики рака решалась важная и трудоемкая задача по отработке моделей опухолей (как злокачественных, так и доброкачественных), вызываемых с достаточно высокой частотой в течение относительно непродолжительного времени (не более 1–1,5 лет), особенно тех локализаций, которые относятся к наиболее распространенным. В итоге в лаборатории были освоены, а также разработаны новые оригинальные экспериментальные модели всех основных опухолей, встречающихся у человека (табл. 1). Кроме того, в лаборатории была разработана модель опухолей молочной железы, эндокринной и репродуктивной систем и других органов, индуцированных гамма-облучением, у крыс; многоорганные модели канцерогенеза, вызываемого химическими канцерогенами.
Таблица 1. Экспериментальные модели предрака и рака, применяемые в лаборатории, для изучения антиканцерогенных средств
Локализация
Метод индукции
Гистологический тип
МНМ интраммамарно, МНМ или ДМБА в/в у крыс
Инициация МНМ в/в + промоция тестостероном в/б у крыс
Простатическая интраэпителиальная неоплазия, аденокарциномы
МХ интратрахеально у крыс, уретан в/б у мышей
АОМ п/к у крыс и мышей, МНМ интраректально у крыс
Очаги аберрантных крипт, аденокарциномы
Плоскоклеточные карциномы, папилломы
ДЭНА в/б у крыс и мышей
Пренеопластические очаги, гепатоцеллюлярные карциномы
ДМБА + ТПА или БП накожно
Плоскоклеточные карциномы, папилломы
Глиомы головного и спинного мозга, невриномы периферических нервов
Основные результаты научно-исследовательской работы
Доклиническое и клиническое изучение антиканцерогенной активности синтетических и природных веществ
К настоящему времени на различных моделях опухолей изучено более 80 веществ, и из них более 50 проявило антиканцерогенную активность, основные из которых представлены в табл. 2. В результате проведенной работы впервые выявлен ряд новых антиканцерогенных веществ, у известных ингибиторов установлена способность тормозить развитие опухолей ранее неизвестных локализаций.
Таблица 2. Ингибиторы канцерогенеза, изученные в лаборатории
Класс соединений
Препараты и вещества
Ретинол, альфа-токоферол, аскорбиновая кислота, тиамин, рибофлавин, витаминно-минеральные комплексы
Бета-каротин обычный и липосомальный
Селенит натрия, молибдат натрия, цинка сульфат
Нестероидные противовоспалительные средства
Диазепам, дифенин, карбонат лития
Тималин, тимоген, эпиталамин, кортексин
Органические кислоты и их соли
Фумаровая кислота, глюкарат кальция, глюкуронат калия
Биотехнологические растительные препараты
Экстракты лекарственных растений
Betula pendula, Eleutherococcus senticosus, Filipendula ulmaria, Glycyrrhiza glabra, Plantago major, Rhaponticum cartamoides, Urtica dioica
Пищевые вещества и природные комплексы
Концентрат ламинарии, масло зародышей пшеницы, пренолы из хвои, провитаминный концентрат из хвои, оксигумат торфяной, отруби пшеницы, рыбий жир, хвойный комплекс, экстракт фукусный
На основании полученных результатов по всем испытанным веществам на разных моделях были сделаны важные общие выводы:
В результате экспериментов были отобраны и предложены для дальнейшего клинического изучения наиболее эффективные и безопасные антиканцерогенные вещества. Разработан алгоритм клинических исследований химиопрофилактических препаратов у пациентов из групп повышенного риска рака молочной железы, желудка, легких, толстой кишки с использованием клинических, эндоскопических, гормональных, биохимических, иммунологических, эхографических, рентгенологических, гистологических, цитологических, цитоморфометрических исследований и оценкой влияния на промежуточные биомаркеры повышенного онкологического риска. В проведенных клинических испытаниях выявлены химиопрофилактические средства, оказывающие выраженное лечебное действие на патологические сдвиги у пациентов из групп повышенного онкологического риска. Кламин (БАД на основе концентрата ламинарии) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию кишечной метаплазии и дисплазии у больных атрофическим гастритом; улучшал клинико-рентгенологическую картину, вызывал регрессию дисплазии и метаплазии эпителия бронхов у больных хроническим бронхитом курильщика; вызывал регрессию предраковых очагов у больных красным плоским лишаем ротовой полости; нормализовал стул, подавлял повышенную пролиферацию эпителия слизистой оболочки и вызывал частичную регрессия полипов у пациентов с аденоматозными полипами толстой кишки. Лесмин (БАД на основе хвойного комплекса) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, подавлял инфекцию Helicobacter pylori, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию лимфоплазмоцитарной инфильтрации и кишечной метаплазии слизистой оболочки желудка у больных атрофическим гастритом. Результаты доклинического и клинического изучения пищевых веществ и разработанных в лаборатории на их основе БАД опубликованы в нескольких монографиях (в частности: Беспалов В.Г. Питание и профилактика онкологических заболеваний. – Великий Новгород, Полиграфическая компания «Позитив», 2015. – 242 с.).
На основе концентрата ламинарии в качестве фармацевтической субстанции был создан и внедрен в клиническую практику лекарственный препарат мамоклам, который применяется для лечения фиброзно-кистозной болезни молочных желез. В проведенных клинических испытаниях установлено, что мамоклам значительно уменьшает проявления масталгии, предменструального напряжения молочных желез и альгоменореи, ослабляет пальпаторные признаки фиброзно-кистозной болезни, нормализует менструальный цикл, баланс тиреоидных и половых гормонов; по данным маммографии и эхографии вызывает регрессию фиброаденоматозных уплотнений и кист в ткани молочных желез, приводит к уменьшению диаметра расширенных млечных протоков, снижает маммографическую плотность. Результаты клинического изучения мамоклама обобщены в монографии: Беспалов В.Г. Мастопатия и лекарственный препарат мамоклам. Методическое пособие для врачей. – СПб.: Издательство «Игра света», 2008. – 68 с.
Доклиническое и клиническое изучение противоопухолевой активности фармакологических веществ и препаратов
В последние годы нами были пересмотрены результаты изучения ранее синтезированных противоопухолевых препаратов, чтобы выявить наиболее перспективные для внедрения в клиническую практику после более углубленного и широкого экспериментального исследования. Наибольший интерес привлекли два препарата: диоксадэт и хлонизол.
Диоксадэт относится к группе алкилирующих соединений – этилениминов. В лаборатории были разработаны новая схема синтеза фармацевтической субстанции и новая лекарственная лиофилизированная форма препарата, которые обеспечивают большую безопасность в производстве; разработан новый проект ФСП на лекарственную форму; проведены доклинические исследования по оценке противоопухолевой активности диоксадэта на стандартных моделях трансплантированных опухолей в сравнении с цитостатиками, применяемыми в клинической практике.
В доклинических исследованиях была установлена выраженная противоопухолевая активность диоксадэта на широком спектре перевиваемых опухолей у лабораторных животных. Данные сравнительного изучения диоксадэта свидетельствуют о его более высокой противоопухолевой активности, чем у наиболее близкого к нему по структуре тиофосфамида. В эксперименте на крысах с перевиваемой асцитной опухолью яичника противоопухолевое действие диоксадэта при внутрибрюшинном введении сравнимо с действием цисплатина, являющегося стандартом в клинической интраперитонеальной химиотерапии рака яичника. С учетом того, что диоксадэт, в отличие от препаратов платины, обладает значительно более низкой токсичностью, не вызывает осложнений в виде спаечного процесса, перспективным является применение диоксадэта для интраперитонеальной химиотерапии рака яичника. В экспериментах с асцитной опухолью Эрлиха у мышей выявлен выраженный синергизм противоопухолевого действия диоксадэта в комбинации с гемцитабином при отсутствии повышения токсичности.
Клинические испытания диоксадэта по II фазе были проведены в 15 онкологических учреждениях у 229 больных распространенными формами злокачественных новообразований различных локализаций. Несмотря на то, что все больные были с далеко зашедшими формами злокачественных новообразований, практически при всех локализациях был доказан объективный противоопухолевый эффект диоксадэта. Особенно сильным противоопухолевый эффект диоксадэта оказался в лечении распространенных форм рака яичников и молочной железы, в том числе у больных с асцитом и ранее леченных другими алкилирующими агентами. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации при операбельных и распространенных формах рака почки. Химиоэмболизация с диоксадэтом повышала 2- и 3-летнюю выживаемость больных неоперабельным раком почки. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации печеночной артерии у больных с первичным раком печени и метастазами в печень колоректального рака. Была доказана эффективность химиоэмболизации с диоксадэтом в виде получения объективного противоопухолевого ответа и увеличения выживаемости больных.
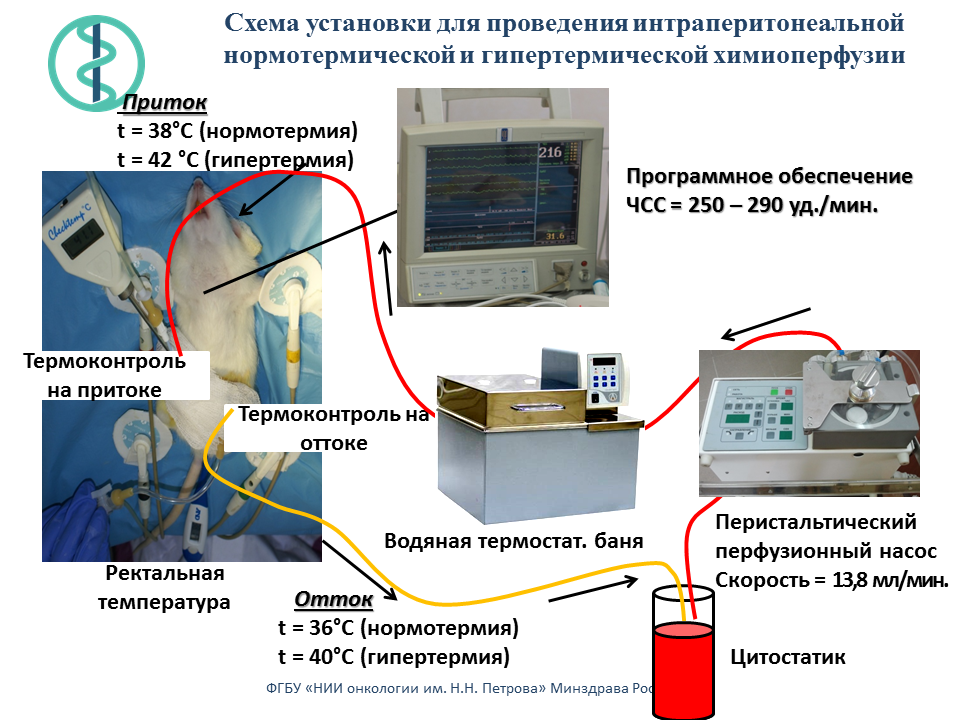
Диосадэт обладает выраженным так называемым контактным противопухолевым действием. В настоящее время в лаборатории развивается направление использования диоксадэта в различных режимах интраперитонеальной химиотерапии канцероматоза брюшной полости. Доклинические исследования показали, что диоксадэт при интраперитонеальной химиотерапии превосходит по эффективности и безопасности другие применяемые с этой целью цитостатики: циспалатин, паклитаксел, митомицин С, мелфалан.
Создана экспериментальная установка для химиоперфузионного лечения канцероматоза брюшной полости на моделях у крупных и мелких лабораторных животных.
Результаты доклинического и клинического изучения химиоперфузионного лечения злокачественных опухолей обобщены в монографии: Беляева О. А., Беспалов В. Г., Сенчик К. Ю., Киреева Г. С., СтуковА. Н., Гафтон Г. И., Карачун А. М., Гусейнов К. Д. Беляев А. М. Химиоперфузионное лечение канцероматоза брюшной полости. – СПб., 2016. – 146 с.
Проведено сравнительное статистическое исследование результатов восьми независимых экспериментов по изучению эффективности интраперитонеальной химиотерапии. Изучены режимы инъекционной внутрибрюшинной (в/б) химиотерапии (ИВХ), нормо– и гипертермической химиоперфузии (НИПХ и ГИПХ) препаратом диоксадэт на модели перевиваемого асцитного рака яичника (РЯ) у 288 крыс самок Вистар. Перевивка РЯ осуществляли в/б в количестве 1?107 опухолевых клеток, интраперитонеальную химиотерапию проводили однократно через 48 часов после трансплантации опухоли. Диоксадэт вводили в максимально переносимых дозах в/б: при ИВХ с помощью шприца в дозе 1,5 мг/кг массы тела; при НИПХ и ГИПХ раствор с цитостатиком прокачивали через брюшную полость специальным насосом соответственно в дозе 30 мг/кг при температуре 36,5–37,5°С и 15 мг/кг при температуре 40,5–41,5°С. В контрольных группах крысам в/б аналогичными путями вводили физиологический раствор. Противоопухолевые эффекты лечения оценивали по увеличению средней продолжительности жизни крыс. Для статистического анализа использован принцип гармонизации статистических доказательств и предсказаний. В контрольной группе с инъекционным в/б введением физиологического раствора средняя продолжительность жизни составила 15 дней, 95% доверительный интервал (ДИ) от 12 до 19. По сравнению с данным контролем воздействие ИВХ, НИПХ и ГИПХ увеличивало среднюю продолжительность жизни соответственно на 85, 97 и 202% (p
Продукция компании
Лекарственный препарат «Мамоклам»
Мамоклам производят по уникальной технологии из морской водоросли ламинарии. Действующие вещества: йод в органической форме, полиненасыщенные жирные кислоты омега-3 типа, хлорофилл. Препарат рекомендуется для патогенетического лечения мастопатии. Высокая эффективность мамоклама (до 90%) и его безопасность доказана в клинических испытаниях, проведенных в ведущих российских маммологических и онкологических клиниках.
Мамоклам:
БАД «Кламин»
Кламин — одна из первых биологически активных добавок к пище (БАД), созданная в 1992 г. петербургскими учеными компании «Фитолон-Наука» и НИИ онкологии им. проф. Петрова. Все эти годы Кламин пользуется неизменным спросом и авторитетом, а его репутация — эффективного и безопасного, проверенного на практике средства — неизменно растет в среде медиков и у широкого круга потребителей. Кламин — уникальная БАД, которая одинаково уместна в домашней аптечке, на атомной субмарине и в фитнес-клубе. За 15 лет, служа людям верой и правдой, Кламин стал настоящей легендой.
Кламин относится к наиболее важным для российского населения оздоровительным продуктам: вещества, содержащиеся в данном препарате, очень нужны людям, проживающим в нашей стране. Кламин — концентрат полезнейших природных веществ, выделенных по уникальной и запатентованной технологии из морской водоросли ламинарии. Кламин содержит в естественном состоянии все ценные компоненты ламинарии: йод, калий, кальций, железо, селен и другие макро- и микроэлементы, полиненасыщенные жирные кислоты омега-3 типа, хлорофилл, фитостерины, полисахариды.
Лечение диффузной фиброзно-кистозной мастопатии
Фиброзно-кистозная мастопатия (ФКМ) — доброкачественное поражение молочной железы — характеризуется спектром пролиферативных и регрессивных изменений ткани с нарушением соотношения эпителиального и соединительно-тканного компонентов. В последние годы отме
Фиброзно-кистозная мастопатия (ФКМ) — доброкачественное поражение молочной железы — характеризуется спектром пролиферативных и регрессивных изменений ткани с нарушением соотношения эпителиального и соединительно-тканного компонентов. В последние годы отмечается неуклонный рост этой патологии во всем мире (А. Г. Егорова, 1998; В. И. Кулаков и соавт., 2003). Мастопатия возникает у 30–70 % женщин репродуктивного возраста, при гинекологических заболеваниях частота ее возрастает до 70 — 98 % (А. В. Антонова и соавт., 1996).
В пременопаузе встречается у 20 % женщин. После наступления менопаузы новые кисты и узлы, как правило, не появляются, что доказывает участие гормонов яичников в возникновении болезни.
В настоящее время известно, что злокачественные заболевания молочных желез встречаются в 3–5 раз чаще на фоне доброкачественных новообразований молочных желез и в 30 % случаев при узловых формах мастопатии с явлениями пролиферации. Поэтому в противораковой борьбе наряду с ранней диагностикой злокачественных опухолей не меньшее значение имеет своевременное выявление и лечение предопухолевых заболеваний.
Различают непролиферативную и пролиферативную формы ФКМ. При этом риск малигнизации при непролиферативной форме составляет 0,86 %, при умеренной пролиферации — 2,34 %, при резко выраженной пролиферации — 31,4 % (С. С. Чистяков и соавт., 2003).
Основную роль в возникновении ФКМ отводят дисгормональным расстройствам в организме женщины. Известно, что развитие молочных желез, регулярные циклические изменения в них в половозрелом возрасте, а также изменения их функции в период беременности и лактации происходит под влиянием целого комплекса гормонов: гонадотропинрилизинг гормона (ГнРГ) гипоталамуса, гонадотропинов (лютеинизирующий и фолликулостимулирующий гормоны), пролактина, хорионического гонадотропина, тиреотропного гормона, андрогенов, кортикостероидов, инсулина, эстрогенов и прогестерона. Любые нарушения баланса гормонов сопровождаются диспластическими изменениями ткани молочных желез. Этиология и патогенез ФКМ до настоящего времени окончательно не установлены, хотя со времени описания данного симптомокомплекса прошло более ста лет. Важная роль в патогенезе ФКМ отведена относительной или абсолютной гиперэстрогении и прогестерондефицитному состоянию. Эстрогены вызывают пролиферацию протокового альвеолярного эпителия и стромы, а прогестерон противодействует этим процессам, обеспечивает дифференцировку эпителия и прекращение митотической активности. Прогестерон обладает способностью снижения экспрессии рецепторов эстрогенов и уменьшения локального уровня активных эстрогенов, ограничивая тем самым стимуляцию пролиферации тканей молочной железы.
Гормональный дисбаланс в тканях молочной железы в сторону дефицита прогестерона сопровождается отеком и гипертрофией внутридольковой соединительной ткани, а пролиферация протокового эпителия приводит к образованию кист.
В развитии ФКМ немаловажную роль играет уровень пролактина крови, который оказывает многообразное действие на ткань молочных желез, стимулируя обменные процессы в эпителии молочных желез в течение всей жизни женщины. Гиперпролактинемия вне беременности сопровождается набуханием, нагрубанием, болезненностью и отеком в молочных железах, больше выраженными во второй фазе менструального цикла.
Наиболее частой причиной развития мастопатии являются гипоталамо-гипофизарные заболевания, нарушения функции щитовидной железы, ожирение, гиперпролактинемия, сахарный диабет, нарушение липидного обмена и т. д.
Причиной возникновения дисгормональных расстройств молочных желез могут быть гинекологические заболевания; сексуальные расстройства, наследственная предрасположенность, патологические процессы в печени и желчных путях, беременность и роды, стрессовые ситуации. Часто ФКМ развивается в период менархе или менопаузы. В подростковом периоде и у молодых женщин наиболее часто выявляется диффузный тип мастопатии с незначительными клиническими проявлениями, характеризующимися умеренной болезненностью в верхненаружном квадранте молочной железы.
В 30–40-летнем возрасте чаще всего выявляются множественные мелкие кисты с преобладанием железистого компонента; болевой синдром обычно выражен значительно. Единичные большие кисты наиболее характерны для больных в возрасте 35 лет и старше (А. Л. Тихомиров, Д. М. Лубнин, 2003).
ФКМ встречаются и у женщин с регулярным двухфазным менструальным циклом (Л. М. Бурдина, Н. Т. Наумкина, 2000).
Диффузная ФКМ может быть:
Диагностика заболеваний молочной железы основывается на осмотре молочных желез, их пальпации, маммографии, УЗИ, пункции узловых образований, подозрительных участков и цитологическом исследовании пунктата.
Исследование молочных желез репродуктивного возраста необходимо проводить в первой фазе менструального цикла (2–3-й день после окончания менструации), так как во второй фазе из-за нагрубания желез велика вероятность диагностических ошибок (С. С. Чистяков и соавт., 2003).
При осмотре молочных желез оценивают внешний вид желез, обращая внимание на все проявления асимметричности (контуров, окраски кожи, положения сосков). Затем осмотр повторяется при поднятых руках пациентки. После осмотра производится пальпация молочных желез сначала в положении пациентки стоя, а затем лежа на спине. Одновременно пальпируются подмышечные, подключичные и надключичные лимфатические узлы. При обнаружении каких-либо изменений в молочных железах проводятся маммография и УЗИ.
УЗИ молочных желез приобретает все большую популярность. Этот метод безвреден, что позволяет при необходимости многократно повторять исследования. По информативности он превосходит маммографию при исследовании плотных молочных желез у молодых женщин, а также в выявлении кист, в том числе и мелких (до 2–3 мм в диаметре), при этом без дополнительных вмешательств дает возможность судить о состоянии эпителия выстилки кисты и проводить дифференциальную диагностику между кистами и фиброаденомами. Кроме того, при исследовании лимфатических узлов и молочных желез с диффузными изменениями УЗИ является ведущим. В то же время при жировой инволюции тканей молочных желез УЗИ по информативности значительно уступает маммографии.
Маммография — рентгенография молочных желез без применения контрастных веществ, выполняемая в двух проекциях, — в настоящее время является наиболее распространенным методом инструментального исследования молочных желез. Достоверность ее весьма велика. Так, при раке молочной железы она достигает 95 %, причем этот метод позволяет диагностировать непальпируемые (менее 1 см в диаметре) опухоли. Однако этот метод ограничен в применении. Так, маммография противопоказана женщинам до 35 лет, при беременности и лактации. Кроме того, информативность данного метода недостаточна при исследовании плотных молочных желез у молодых женщин.
Несмотря на всеми признанную связь заболеваний молочных желез и гениталий в России не разработана концепция комплексного подхода к диагностике и лечению заболеваний молочных желез и органов репродуктивной системы. Сравнение изменений молочных желез при миоме матки и воспалительных заболеваниях гениталий показало, что частота патологических изменений в молочных железах при миоме матки достигает 90 %, узловые формы мастопатии чаще имеют место при сочетании миомы матки с аденомиозом (В. Е. Радзинский, И. М. Ордиянц, 2003). На основании указанных данных и того факта, что у женщин с доброкачественными заболеваниями молочных желез более половины страдают миомой матки, аденомиозом и гиперплазией эндометрия, авторы относят женщин с этими заболеваниями к группе высокого риска возникновения болезней молочной железы.
При воспалительных заболеваниях женских половых органов частота доброкачественных заболеваний молочных желез оказалась существенно ниже — только у каждой четвертой, узловые формы у них не были выявлены.
Следовательно, воспалительные заболевания гениталий не являются причиной развития ФКМ, но могут сопутствовать гормональным нарушениям.
Маммологическое исследование женщин репродуктивного возраста с различными гинекологическими заболеваниями выявил у каждой третьей больной диффузную форму мастопатии, треть женщин имела смешанную форму ФКМ. Узловая форма мастопатии определялась у пациенток с сочетанием миомы матки, генитального эндометриоза и гиперплазии эндометрия.
Лечение больных с узловыми формами доброкачественных заболеваний молочных желез начинают с проведения пункции с тонкоигольной аспирацией. При обнаружении клеток с дисплазией в узловом образовании или клеток рака во время цитологического исследования, производится оперативное лечение (секторальная резекция, мастэктомия) со срочным гистологическим исследованием удаленной ткани.
В зависимости от результатов обследования проводятся лечение гинекологической патологии, мастопатии, коррекция сопутствующих заболеваний.
Важное значение в лечении и профилактике заболеваний молочных желез придается диете: характер питания может оказать влияние на метаболизм стероидов. Повышенное количество жиров и мясных продуктов сопровождается снижением уровня андрогенов и повышением содержания эстрогенов в плазме крови. Кроме того, придается особое значение достаточному содержанию витаминов в пищевом рационе, а также грубоволокнистой клетчатке, поскольку доказаны ее антиканцерогенные свойства.
За последние годы увеличилась частота использования лекарственных препаратов растительного происхождения в лечении доброкачественных заболеваний молочных желез.
В. И. Кулаков и соавторы (2003) при лечении больных с различными формами мастопатии, сопровождающимися мастальгией, применяли вобэнзим и фитотерапию. Эффективность лечения мастальгии через 3 мес составила 65 %.
Много исследований посвящены вопросам лечения этой патологии, но проблема остается актуальной и в настоящее время (Л. Н. Сидоренко, 1991; Т. Т. Тагиева, 2000).
Для лечения мастопатии, ассоциированной с мастальгией применяются различные группы препаратов: анальгетики, бромкриптин, масло ночной примулы, гомеопатические препараты (мастодинон), витамины, йодид калия, оральные контрацептивы, фитопрепараты, даназол, тамоксифен, а также натуральный прогестерон для трансдермального применения. Эффективность этих средств различается. Патогенетически наиболее обоснованным методом лечения является применение препаратов прогестерона.
С конца 80-х гг. прошлого века с лечебной и контрацептивной целью широко применяются инъецируемые (депо-провера) и имплантируемые (норплант) прогестагены (А. Г. Хомасуридзе, Р. А. Манушарова, 1998; Р. А. Манушарова и соавт., 1994). К инъекционным препаратам пролонгированного действия относятся медроксипрогестерона — ацетат в виде депо-провера и норэтиндрон — энантат. Механизм действия указанных препаратов сходен с таковым у прогестиновых компонентов комбинированных оральных противозачаточных средств. Депо-провера вводится внутримышечно с 3-месячным интервалом. Наиболее частыми осложнениями, возникающими в результате применения препарата депо-провера, являются продолжительная аменорея и межменструальные кровянистые выделения. Данные наших исследований показали, что препарат не оказывает отрицательного влияния на нормальную ткань молочных желез и матки, в то же время обладает лечебным эффектом при гиперпластических процессах в них (Р. А. Манушарова и соавт.,1993). К препаратам пролонгированного действия относится и имплантируемый препарат норплант, который обеспечивает контрацептивное и лечебное действие в течение 5 лет. На протяжении многих лет считалось, что нельзя назначать гормональные препараты пациенткам с ФКМ с момента выявления заболевания и до показаний к хирургическому лечению. В лучшем случае осуществляли симптоматическую терапию, состоящую в назначении сбора трав, препаратов йода, витаминов.
В последние годы в результате проведенных исследований стала очевидной необходимость активной терапии, в которой ведущее место принадлежит гормонам. По мере накопления клинического опыта использования норпланта появились сообщения о его положительном действии на диффузные гиперпластичесие процессы в молочных железах, поскольку под влиянием гестагенного компонента в гиперплазированном эпителии последовательно происходит не только торможение пролиферативной активности, но и развитие децидуалоподобной трансформации эпителия, а также атрофические изменения эпителия желез и стромы. В связи с этим применение гестагенов оказывается эффективным у 70 % женщин с гиперпластическими процессами в молочных железах. Изучение влияния норпланта (Р. А. Манушарова и соавт., 2001) на состояние молочных желез у 37 женщин с диффузной формой ФКМ показало уменьшение или прекращение болевых ощущений и чувства напряжения в молочных железах. При контрольном исследовании через 1 год на УЗИ или маммографии отмечалось снижение плотности железистого и фиброзного компонентов за счет уменьшения участков гиперплазированной ткани, что трактовали как регресс гиперпластических процессов в молочных железах. У 12 женщин состояние молочных желез оставалось прежним. Несмотря на исчезновение у них мастодинии, структурная ткань молочных желез не претерпевала каких-либо изменений. Наиболее частым побочным действием норпланта, как и депо-провера, является нарушение менструального цикла в виде аменореи и межменструальных кровянистых выделений. Применение пероральных гестагенов при межменструальных кровянистых выделениях и комбинированных контрацептивов при аменорее (в течение 1 — 2 циклов) приводит к восстановлению менструального цикла у подавляющего большинства пациентов.
В настоящее время для лечения ФКМ применяются и пероральные (таблетированные) гестагены. Среди этих препаратов наиболее широкое распространение получили дюфастон и утрожестан. Дюфастон является аналогом природного прогестерона, полностью лишен андрогенных и анаболических эффектов, безопасен при длительном применении и обладает прогестагенным действием.
Утрожестан — натуральный микронизированный прогестерон для перорального и вагинального применения. В отличие от синтетических аналогов имеет выгодные преимущества, заключающиеся в первую очередь в том, что входящий в его состав микронизированный прогестерон полностью идентичен натуральному, что обусловливает практически полное отсутствие побочных эффектов.
Микронизированный утрожестан назначается по 100 мг 2 раза в сутки, дюфастон по 10 мг 2 раза в сутки. Лечение проводится с 14-го дня менструального цикла в течение 14 дней, 3–6 циклов.
Комбинированные оральные контрацептивы назначаются с целью блокады овуляции и исключения циклических колебаний уровней половых гормонов.
Даназол назначается по 200 мг в течение 3 мес.
Агонисты ГнРГ (диферелин, золадекс, бусерелин) вызывают временную обратимую менопаузу. Лечение мастопатии агонистами ГнРГ проводится с 1990 г.
Первый курс лечения обычно назначается в течение 3 мес. Лечение агонистами ГнРГ способствуют торможению овуляции и функции яичников, способствует развитию гипогонадотропной аменореи и обратному развитию симптомов мастопатии.
При циклической гиперпролактинемии назначаются агонисты дофамина (парлодел, достинекс). Эти препараты назначаются во вторую фазу цикла (с 14– 16-го дня цикла) до начала менструации.
Широкое распространение в последние годы получили различные фитотерапевтические сборы, которые обладают противовоспалительным болеутоляющим, иммуномодулирующим эффектом. Сборы назначаются во вторую фазу менструального цикла и применяются длительно.
Одним из наиболее эффективных средств лечения мастопатии является комбинированный гомеопатический препарат — мастодинон, представляющий собой 15 % спиртовый раствор с вытяжками из лекарственных трав цикламена, чилибухи ириса, тигровой лилии. Препарат выпускается во флаконах по 50 и 100 мл. Назначается мастодинон по 30 капель 2 раза в день (утром и вечером) или по 1 таблетке 2 раза в день в течение 3 мес. Продолжительность лечения не ограничена
Мастодинон за счет дофаминергического эффекта приводит к снижению повышенного уровня пролактина, что способствует сужению протоков,снижению активности пролиферативных процессов, уменьшению образования соединительно-тканного компонента. Препарат в значительной степени уменьшает кровенаполнение и отек молочных желез, способствует снижению болевого синдрома, обратному развитию изменений тканей молочных желез.
При лечении диффузных форм мастопатии широкое распространение получил препарат кламин, который является растительным адаптогеном, обладающим антиоксидантной, иммунокорригирующей, гепатопротективной активностью, оказывает энтеросорбирующий и легкий слабительный эффект. Одной из важнейших характеристик кламина является наличие в его составе йода (1 таблетка содержит 50 мкг йода), который в районах с йодным дефицитом полностью покрывает его недостаток.
Высоким антиоксидантным, иммуностимулирующим эффектом обладает препарат фитолон, представляющий собой спиртовый раствор липидной фракции бурых водорослей. Действующим началом являются медные производные хлорофилла, микроэлементы. Препарат назначается внутрь в виде капель или наружно. Совместно с комплексом трав оказывает хорошее рассасывающее действие.
При наличии сопутствующих заболеваний необходимо проводить их лечение. При сочетании диффузной ФКМ с миомой матки, гиперплазией эндометрия, аденомиозом к проводимой терапии необходимо дополнительно подключить чистые гестагены (утрожестан, дюфастон).
Под нашим наблюдением находились 139 женщин, которые жаловались на ноющие боли, ощущение распирания и тяжести в молочных железах, усиливающиеся в предменструальные дни, иногда начиная со второй половины менструального цикла. Возраст пациенток колебался от 18 до 44 лет. Всем пациенткам проводили осмотр, пальпацию молочных желез, при этом обращали внимание на состояние кожи, соска, форму и размер молочных желез, наличие или отсутствие выделений из сосков. При наличии выделений из сосков проводилось цитологическое исследование отделяемого.
Всем женщинам проводили УЗИ молочных желез, а при наличии узлов — УЗИ и бесконтрастную маммографию, по показаниям проводилась пункция образования с последующим цитологическим исследованием полученного материала. Путем УЗИ молочных желез диагноз диффузной формы ФКМ был подтвержден в 136 наблюдениях.
Менструальный цикл был нарушен по типу олигоменореи у 84 женщин, у 7 из наблюдавшихся пациенток отмечалась полименорея, а у 37 больных цикл внешне был сохранен, но по тестам функциональной диагностики была выявлена ановуляция. У 11 женщин менструальный цикл не был нарушен, но у них были ярко выражены симптомы предменструального синдрома, которые наблюдались в каждом менструальном цикле и сказывались на качестве жизни пациентки.
У 29 больных мастопатия сочеталась с гиперпластическими процессами в матке (миома матки, гиперплазия эндометрия), у 17 — с аденомиозом, у 27 больных наряду с мастопатией имелись воспалительные заболевания гениталий, у 9 женщин выявлена патология щитовидной железы. У обследованных часто наблюдалась экстрагенитальная патология, а 11 ближайших родственников имели доброкачественные и злокачественные заболевания гениталий и молочных желез.
По результатам обследования проводили лечение гинекологической патологии, мастопатии и других сопутствующих заболеваний. Для лечения мастопатии у 89 больных применяли прожестожель, гель, 1 % — натуральный микронизированный растительного происхождения прогестерон местного действия. Назначался препарат в дозе 2,5 г геля на поверхность каждой молочной железы 1 — 2 раза в день, в том числе во время менструации. Препарат не влияет на уровень прогестерона в плазме крови и оказывает только местное действие. Применение прожестожеля продолжали от 3 до 4 мес. При необходимости больным назначали курс поддерживающей терапии: витаминами Е, В, С, А, РР. Кроме того, назначали седативные средства (настойка валерианы, мелиссану, пустырник) и адаптогены (элеутерококк, женьшень).
У 50 женщин лечение мастопатии проводили мастодиноном, который назначали по 1 таблетке 2 раза в день двумя курсами, по 3 мес каждый, с интервалом между курсами в 1 мес. Основным активным компонентом препарата мастодинон является экстракт Agnus castus (прутняк), который действует на допаминовые Д2-рецепторы гипоталамуса и снижает секрецию пролактина. Снижение секреции пролактина приводит к регрессу патологических процессов в молочных железах и купирует болевой синдром. Циклическая секреция гонадотропных гормонов при нормальных уровнях пролактина восстанавливает вторую фазу менструального цикла. Одновременно ликвидируется дисбаланс между уровнем эстрадиола и прогестерона, что положительно сказывается на состоянии молочных желез.
УЗИ проводили через 6–12 мес после начала лечения. Положительной динамикой считали уменьшение диаметра протоков, количества и диаметра кист, а также их исчезновение.
После проведенного лечения (в течение 4–6 мес) у всех 139 женщин уже через 1 мес отмечалась положительная динамика, что выражалось в уменьшении и/или прекращении болевых ощущений, чувства напряжения в молочных железах.
При контрольном УЗИ через 6–12 мес после окончания лечения отмечалось снижение плотности железистого и фиброзного компонентов за счет уменьшения участков гиперплазированной ткани, что трактовалось как регресс гиперплазированного процесса в молочных железах. У 19 женщин с диффузной формой ФКМ и у 3 с фиброаденомой при обьективном осмотре и УЗИ изменений в состоянии молочных желез не выявлено, однако все пациентки отмечали улучшение состояния (исчезли болезненность, чувство напряжения и распирания в молочных железах).
Побочные эффекты при применении препаратов мастодинона и прожестожеля не отмечены ни в одном наблюдении.
Применение указанных препаратов патогенетически обосновано.
Для лечения мастопатии не существует алгоритма лечения. Консервативное лечение показано всем пациенткам с диффузной формой мастопатии.
Р. А. Манушарова, доктор медицинских наук, профессор
Э. И. Черкезова, кандидат медицинских наук