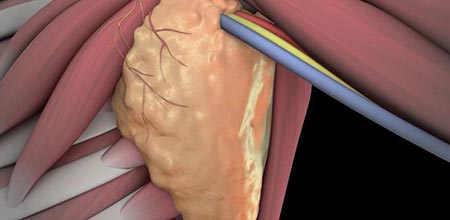
медиастинальная лимфодиссекция что это
Лимфодиссекция
Лимфодиссекция — операция по удалению лимфоузлов при злокачественных опухолях. Особенность операции заключается в удалении группы лимфоузлов вместе с окружающей их клетчаткой.
Показания к проведению лимфодиссекции
При лечении злокачественных опухолей выполнение лимфодиссекции является стандартной манипуляцией, которая может быть этапом первичной операции по удалению опухоли. В ходе хирургического вмешательства проводится удаление пораженных метастазами лимфоузлов. По завершению операции проводится гистологическое исследование лимфоузлов с целью оценки распространенности заболевания.
Лимфодиссекция выполняется при:
Лимфодиссекция выполняется с целью максимального удаления опухолевых клеток. В иных случаях операция, сопровождаемая дальнейшими осложнениями из-за нарушения лимфооттока, не оправдана. При развитии панкреатической и кожной немелкоклеточной карциноме, рака желудка и мочеполовой системе лимфодиссекция является стандартным этапом лечения.
Виды лимфодиссекции
Особенности проведения хирургического вмешательства по удалению лимфоузлов зависят от вида лимфодиссекции. Классифицируют процедуру по анатомическому принципу, характеру операции и другим критериям.
по месту расположения лимфоузлов
медиастинальная центральная, подколенная, подмышечная, шейная лимфодиссекция т. д.
по объему хирургического вмешательства
региональная (близко расположенные узлы), селективная (выборочная) и расширенная (разноуровневые группы узлов)
по уровню удаляемой группы лимфоузлов
все виды лимфодиссекции имеют группу «D», в зависимости от удаленности их нумеруют от 1 до 4
На выбор тактики проведения лимфодиссекции влияют разные факторы и в каждом случае врач индивидуально подбирает схему операции. Так при раке молочной железы может быть проведена подмышечная лимфодиссекция регионального типа D1.
Как проходит операция
В Юсуповской больнице лимфодиссекция выполняется в отделении хирургии высококвалифицированными хирургами-онкологами. Метод операции всегда определяется с целью достижения максимального результата по уничтожению раковых клеток на оперируемом участке.
Особенности проведения лимфодиссекции:
Процесс операции предполагает рассечение кожного покрова и мышечной ткани для удаления скальпелем лимфоузлов вместе с жировой клетчаткой, а также перевязки и иссечения сосудов. Первичное хирургическое вмешательство предполагает локальное удаление лимфатических узлов. При рецидивирующем раке (например, опухоль щитовидной и молочной железы) проводится центральная лимфодиссекция.
По завершению хирургических манипуляций накладываются швы. Такая техника подходит для лимфодиссекции поверхностных лимфатических узлов. Внутренние лимфоузлы удаляют лапароскопическим методом вместе с опухолью и окружающей клетчаткой.
После операции
Реабилитация после лимфодиссекции может проходить по-разному. Главной целью специалистов является предупреждение развития лимфореи, состояние характеризующееся выделением лимфатической жидкости наружу и создания благоприятной среды для возникновения инфекционного процесса, а также затруднения приживления кожи.
Если был удален внутренний лимфоузел, то истечение лимфы происходит быстро, что способствует ускоренному восстановлению. При иссечении внешних лимфатических узлов послеоперационный период более сложный, поскольку истечение лимфы протекает медленно. Риск лимфореи в таких случаях значительно выше.
В целях предупреждения осложнений пациенту назначается антибиотикотерапия, а швы снимают только после подтвержденного заживления места хирургического вмешательства. Общее восстановление зависит от диагноза.
Записаться на прием к врачу в Юсуповской больнице
Раковые заболевания в 90% случаях требуют хирургического лечения. Результат операции зависит от многих факторов, среди которых квалификация и опыт хирурга. В Юсуповской больнице хирурги-онкологи проводят широкий спектр хирургических операций абдоминального и классического типа. Специалисты клиники оказывают всю необходимую поддержку онкобольным на всех этапах лечения.
Медиастинальная лимфодиссекция что это
Липецкая областная клиническая больница, Липецк
Реферат. Систематическая лимфодиссекция как радикальная лечебная процедура при хирургическом лечении рака легкого признана как оперативная процедура, позволяющая оценить истинную распространенность опухолевого процесса. Из 300 оперативных вмешательств 150 (50,0%) составили «расширенные» операции, которые сопровождались систематической медиастинальной лимфодиссекцией по принципиальным соображениям. Другим 150 (50,0%) больным выполнены «типичные» операции без систематической медиастинальной лимфодиссекции. Общая 5-летняя выживаемость, равная 30% при послеоперационной летальности 6,7%, свидетельствует о высоком качестве хирургической помощи в клинике. До настоящего времени прослежены 254 (85,0%) пациента из 300.
Ключевые слова: рак легкого, комбинированное лечение, лимфодиссекция.
В лечении рака легкого в настоящее время прослеживаются две основные тенденции, зачастую взаимоисключающие друг друга. Сторонники комбинированного лечения видят возможность повышения эффективности лечения рака легкого, прежде всего, в применении различных вариантов лучевой и химиотерапии, хирургический же этап при этом считается совершенно стандартным [1, 5, 6, 7, 11, 12, 14]. Приверженцы же агрессивной хирургической тактики, наоборот, занижают роль химиолучевого компонента в лечении рака легкого, считая основным способом улучшения результатов лечения рака легкого выполнение операции с расширенной лимфодиссекцией [2, 3, 10, 13]. Исследованиями ряда авторов [1, 2] было показано, что комбинированное лечение с использованием предоперационной химиолучевой терапии позволило увеличить 5-летнюю выживаемость больных раком легкого по сравнении с чисто хирургическим лечением на 10—20%, не оказывая при этом существенного влияния на частоту послеоперационных осложнений и летальность. Вместе с тем существуют исследования [5, 6, 8], в которых было показано, что выполнение расширенных операций с медиасти-нальной лимфодиссекций позволяет снизить частоту местных рецидивов с 30 до 15%. Как японские, так и европейские авторы [10] сообщают о повышении 5-летней выживаемости после расширенных операций в среднем на 10—20%. Медиастинальная лимфодиссекция при раке легкого является не только лечебной, но и диагностической манипуляцией, так как позволяет адекватно стадировать заболевание, а следовательно, и проводить адекватное адъювантное лечение [4, 5, 9]. По данным ряда авторов [3, 4], частота послеоперационных осложнений и летальность после расширенных операций остаются невысокими (16—20% и 1—4% соответственно). В современной литературе недостаточно внимания уделяется исследованию возможностей расширения лимфодиссекции в лечении рака легкого. В то же время расширение медиастинальной лимфодиссекции позволит использовать различные механизмы воздействия на опухоль и метастазы в регионарных лимфатических узлах для улучшения результатов лечения рака легкого.
В основу работы положен анализ непосредственных и отдаленных результатов лечения 300 больных немелкоклеточным и мелкоклеточным раком легкого в период с 1995 по 2006 г. Из 300 оперативных вмешательств 150 (50,0%) составили «расширенные» операции, которые сопровождались систематической медиастинальной билатеральной лимфодис-секцией по принципиальным соображениям. Другим 150 (50,0%) больным выполнены «типичные» операции без систематической медиастинальной билатеральной лимфодиссекции. Мужчин среди них было 281 (93,7%), женщин — 19 (6,3%). Возраст пациентов варьировал от 31 до 78 лет. Большинство больных (40,3%) были старше 50 лет, пациентов старше 60 лет было 33,7%. В возрасте 70 лет оперированы 2,7% больных.
Обе группы сопоставимы друг с другом по стадиям и сопутствующей патологии. У 55 (18,3%) больных была I стадия, у 103 (34,3%) — II стадия и у 142 (47,6%) — IIIA стадия. По гистологическому строению опухоли в целом имеющиеся различия в сформированных исследуемых группах оказались сопоставимы (р>0,05). Из общего числа операций пневмонэктомии составили 146 (48,7%), лоб- и билобэктомии — 154 (57,3%). При I стадии это соотношение было 9 (16,7%) против 45 (83,3%), при II стадии — 49 (41,2%) против 70 (58,8%) и при IIIA стадии — 88 (69,3%) против 39 (31,0%) соответственно. Из выполненных пневмонэктомий 93 (31,0%) были «расширенными», 53 (17,7%) — «типичными». Среди лобэктомий 57 (19,0%) были выполнены в «расширенном» объеме, 97 (32,3%) явились «типичными». Комбинированных операций выполнено 65 (22%).
Результаты и их обсуждение
Средняя продолжительность операции с систематической медиастинальной билатеральной лим-фодиссекцией (группа «расширенных» операций) составила 228,5 мин (от 185 до 255 мин), в группе без систематической медиастинальной лимфодиссекции (группа «типичных» операций) составила 190 мин (175—205 мин). Различия по продолжительности операций в группах недостоверны (р>0,05).
Средний объем кровопотери в группе «расширенных» операций составил 655,5 мл (610— 700 мл), в группе «типичных» операций — 575 мл (450—700 мл) (р>0,05). Таким образом, выполнение расширенной лимфодиссекции не привело к увеличению продолжительности операции и объема кровопотери.
Всего осложнения возникли у 58 (19,3%) пациентов, погибли 22 пациента, летальность составила 7,3%.
В группе «расширенных» операций осложнения зарегистрированы у 32 (21,3%) из 150 больных. Умерло 10 пациентов, летальность составила 6,7%. В таблице представлены послеоперационные осложнения, наблюдавшиеся в нашей клинике после операций, выполненных в «расширенном» объеме, т.е. с систематической медиастинальной билатеральной лимфодиссекцией.
Из них «хирургические» составили 13,3%, «нехирургические» — 8,0%. Среди «нехирургических» осложнений доминировала легочно-сердечная недостаточность у 3,3% (5 из 150), пневмония — у 1,2% (2 из 150), острая сердечно-сосудистая недостаточность — у 2,0% (3 из 150) и нарушение сердечного ритма — у 1,2% (2 из 150) больных. В структуре «хирургических» осложнений после «расширенных» операций кровотечение наблюдалось у 2,0% (3 из 150) больных, несостоятельность шва бронха — у 4,0% (6 из 150), эмпиема плевры — у 2,0% (2 из 150), нагноение раны — у 4,7% (7 из 150), неполное расправление легкого не наблюдалось ни у одного больного.
В группе «типичных» операций зарегистрировано 28 (18,7%) осложнений. Структура осложнений сопоставима с группой «расширенных» операций (р>0,05).
Критическое осмысление «хирургических» послеоперационных осложнений убедило нас прежде всего в том, что их развитие связано с дефектами оперативной техники, неправильной оценкой инт-раоперационной ситуации, порой создания самим хирургом дополнительных сложностей. В меньшей степени, на наш взгляд, возникновение этих осложнений зависит от так называемых «общебиологических» причин. Представляется, что деление послеоперационных осложнений на « хирургические» и «нехирургические» практически оправданно, так как заставляет хирургов более внимательно относиться к выполнению технических приемов операции.
Анализ показывает, что общее число осложнений после расширенных операций на легких с выполнением систематической медиастинальной лимфодиссекции при раке остается достаточно высоким — 21,3%, что связано с категорией больных и травматичностью торакальных операций. Именно поэтому наибольшее число осложнений пневмонэк-томий (33%) остается достаточно частым: недостаточность швов бронха (4%), пневмония единственного легкого (1,3%), легочно-сердечная недостаточность (3,3%). Лоб- и билобэктомии сопровождаются практически идентичным числом осложнений (30,5%), и в структуре их значительное место занимает острая сердечно-сосудистая недостаточность и пневмония оставшейся доли (2,0%). Разница частоты осложнений в целом между пневмонэктомией и лобэктомией недостоверна.
Таким образом, оценивая частоту послеоперационных осложнений и летальность, следует отметить, что «расширенные» операции не влияют на их увеличение. В то же время можно наметить перспективы дальнейшего прогресса — это повышение техники оперирования, оптимизация предоперационной подготовки и послеоперационного ведения больных раком легкого.
Полнота и адекватность лимфодиссекции контролировалась соблюдением методики, многократно описанной в литературе [4, 9]. Но все же следует обратить внимание на то, что в группе, в которой выполнялась систематическая медиастинальная билатеральная лимфодиссекция, количество удаляемых лимфатических узлов оказывается больше, чем в группе «типичных» операций, и в основной группе в удаленных препаратах обнаружено больше метастатических лимфатических узлов.
Всего удалось проследить судьбу 254 (85,0%) пациентов из 300. Все группы по количеству прослеженных больных были сопоставимы друг с другом.
Основным критерием эффективности хирургического лечения больных раком легкого, наряду с рецидивированием заболевания, является 5-летняя выживаемость. После «расширенных» операций при I стадии (T1-2N0M0) 3- и 5-летняя выживаемость составила 80,4% и 80,4%, медиана равнялась 3937 дням (127 мес). При II стадии (T1-2N1M0 и T3N0M0) те же сроки прожили 80,3% и 70% соответственно, медиана составила 2149 дней (70 мес). При IIIA стадии (T1-2N2M0 и T3N2M0) 3- и 5-летняя выживаемость составила 71% и 50% соответственно, медиана равнялась 965 дням (32 мес). При сравнении общей выживаемости последняя достоверно была выше после операций с систематической медиа-стинальной лимфодиссекцией (р=0,03, log rank test) (рисунок). Так, 3- и 5-летняя общая кумулятивная выживаемость после «расширенных» операций составила 70% и 59%, после «типичных» — 30% и 9% соответственно. Медиана выживаемости равнялась 2100 дням (70 мес).
Использование систематической медиастинальной билатеральной лимфодиссекции при раке легкого не приводит к увеличению частоты послеоперационных осложнений и летальности, что определяет безопасность использования расширенных вмешательств в рамках совершенствования лечения рака легкого.
1. Важенин, А.В. Радиационная онкология: организация, тактика, пути развития / А.В. Важенин. — М.: Изд-во РАМН, 2003. — 236 с.
2. Давыдов, М.И. Принципы хирургического лечения злокачественных опухолей в торакоабдоминальной клинике / М.И. Давыдов // Вопросы онкологии. — 2002. — Т. 48, № 4/5. — С. 468—479.
3. Давыдов, М.И. Рак легкого / М.И. Давыдов, Б.Е. Полоцкий. — М.: Радикс, 1994. —210 с.
4. Стилиди, И.С. Хирургическое лечение рака легкого / И.С. Стилиди, М.Д. Тер-Ованесов // Практическая онкология. — 2000. — № 3. — С. 21—23.
5. Трахтенберг, А.Х. Рак легкого / А.Х. Трахтенберг. —М., 1987. —303 с.
6. Харченко, В.П. Рак легкого / В.П. Харченко, Н.В. Кузьмин. — М.: Медицина, 1994. —480 с.
7. De Pierre, A. Preoperative chemotherapy followed by surgery compared with primary surgery in resectable stage I (except T1N0), II and 111A non-small-cell lung cancer / A. de Pierre, В. Milleron, D. Moro-Sibiot [et al.] // J. Clin. Oncol. — 2002. — № 20. — P. 247—253.
8. Ginsberg, R. A non-small-cell lung cancer / R. Ginsberg, E. Vokes, A. Raben // Cancer principles and practice of oncology / eds. VT. Devita, S. Hellman, S.A. Rosenberg. — Philadelphia: Lippincott, 1997. — P. 858—911.
9. Ginsberg, R. Role of surgery in the treatment of stage I and II lung cancer / R. Ginsberg // Proc. ASCO. — 2001. — P. 460—464.
10. De Giacomo, Т. Thorascopic staging of 111B non-small-cell lung cancer before neoadjuvant therapy / Т. de Giacomo, Е. Rendina, F. Venuta [et al.] // Ann. Thorac. Surg. — 1997. — Vol. 64, № 5. — P. 1409.
11. Pistrers, K. Stage I/I I non-small-cell lung cancer: Is there a role forcombined-modality therapy? / K. Pistrers // Proc. ASCO. — 2002. — P. 465—470.
12. PORT Meta-analysis Trialists Group. Postoperative radiotherapy in non-small-cell lung cancer: systematic review and meta-analysis of individual patient data from nine controlled trials // Lancet. —1998. — Vol. 352. — P. 257—263.
13. Stefano, M. Mediastinoscopy as a standardized procedure for mediastinal lymph-node staging in non-small-cell carcinoma / M. Stefano [et al.] // Europ. J. Cardiothorac. Surg. — 2001. — Vol. 20.—P. 652—653.
14. Van Houlte, P. The role of radiotherapy and the value of combined treatment in lung cancer / P. van Houlte // Proc. ESMO. — 2002. — P. 91—98.
Лимфодиссекцией (или иначе лимфаденэктомией) называется хирургическое удаление лимфатических узлов при злокачественных опухолях. Лимфодиссекция не является самостоятельной операцией, а представляет собой часть хирургического противоопухолевого лечения.
Для чего проводится лимфодиссекция?
Злокачественные опухоли отличает способность образовывать метастазы, выходя за пределы первичного очага и начиная развиваться в других органах и тканях. Раковые клетки отделяются от первичной опухоли и распространяются по организму с током крови и лимфы, поражая в том числе и сами лимфатические узлы – сначала ближайшие.
Поэтому удаление вместе с первичной опухолью лимфатических узлов позволяет приостановить и даже предотвратить развитие метастазов. Результаты исследования удаленных при лимфодиссекции узлов помогают в составлении оптимальной программы дальнейшего лечения. Таким образом лимфодиссекция сочетает в себе непосредственно лечебную и диагностическую функции.
Показания к лимфодиссекции
Необходимость лимфодиссекции зависит от агрессивности конкретного заболевания и степени распространенности опухоли, то есть стадии рака.
Некоторые опухоли почти не метастазируют, поэтому при их лечении лимфодиссекция не применяется. Это, например, базальноклеточный рак. По той же причине в лимфодиссекции обычно нет необходимости на ранних стадиях рака.
Однако, для быстро метастазирующих видов рака лимфодиссекция является обязательной составляющей радикального лечения. При невозможности её проведения опухоль признается неоперабельной. Это касается, например, рака желудка, панкриатической карциномы, немелкоклеточной карциномы легкого.
В случае ряда заболеваний, — например, раке молочной железы, меланоме, плоскоклеточной карциноме кожи, — прежде чем проводить лимфодиссекцию, делают биопсию сторожевого лимфоузла, чтобы определить наличие в нем метастазов.
Сторожевым узлом называется ближайший на пути распространения опухоли лимфоузел. Чтобы обнаружить его, проводят картирование, выделяя пораженные ткани с помощью меченых изотопов или красящего вещества. После обнаружения сторожевой узел удаляется и передается на морфологическое исследование. Если в данном узле не выявлено следов поражения, то лимфодиссекцию не назначают, так как вероятность появления метастазов минимальна. Если же в сторожевом узле обнаружены опухолевые клетки, то без проведения лимфодиссекции прогноз ухудшается.
Медиастинальная лимфодиссекция что это
Научно-практический журнал для практикующих врачей и научных работников
ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ ЛИМФОДИССЕКЦИИ ПРИ РАКЕ ЛЕГКОГО И ПУТИ ИХ ПРОФИЛАКТИКИ
Липецкая областная клиническая больница
Реферат. До сих пор остаются достаточно высокими частота послеоперационных осложнений (25—30%) и летальность. Это обстоятельство связано с травматичностью легочных операций, требующих значительного напряжения компенсаторных механизмов и часто выполняющихся у лиц пожилого возраста с сопутствующими заболеваниями, ослабленных опухолевым и/или воспалительным процессом, с выраженными нарушениями гемодинамики, газообмена и метаболизма. В нашем исследовании различные осложнения зарегистрированы у 32 (21,3%) из 150 оперированных больных, которые сопровождались систематической медиастинальной билатеральной лимфодиссекцией. Из них «хирургические» составили 13,3%, «нехирургические» — 8,0%. Послеоперационная летальность изучалась на основании 3-месячного срока, прошедшего с момента оперативного вмешательства. Общая летальность в группе оперированных больных составила 6,7% (10 из 150).
Ключевые слова: рак легкого, лимфодиссекция, осложнения.
Систематическая медиастинальная билатеральная лимфодиссекция в настоящее время многими авторами рассматривается как неотъемлемая часть хирургического пособия при раке легкого [1—5, 7, 8, 10]. По их мнению, это увеличивает онкологическую выживаемость в 1,5—2 раза [1, 2, 4, 5]. Однако неоспорим тот факт, что по своей сущности медиастинальная лимфодиссекция, а тем более билатеральная, даже в идеальном своем исполнении, является хирургическим пособием крайней степени сложности, повышающим риск оперативного вмешательства в несколько раз. С ее производством потенциально возрастает опасность ранения крупных сосудов (аорты, верхней и нижней полых вен, подключичных сосудов) и ряда органов (трахеи, пищевода, грудного лимфатического протока, возвратных нервов и др.). Это не может не сказываться как на течении самой операции, делая ее более продолжительной и трудоемкой, так и послеоперационный период. В связи с этим ряд авторов [6, 9, 11—13] считают, что положительное влияние лимфодиссекции на отдаленные результаты лечения нивелируется значительным повышением числа послеоперационных осложнений и летальности. По их мнению, диссекция должна носить сугубо избирательный характер, и удалять следует только явно метастатически пораженные лимфатические узлы.
Такая противоречивость мнений в оценке выбора объема лимфодиссекции, влиянии ее непосредственно на процесс операции и течение послеоперационного периода явилась основанием к изучению собственного материала по этому вопросу.
Наши исследования основываются на опыте хирургического лечения 300 больных немелкоклеточным и мелкоклеточным раком легкого, оперированных в торакальном отделении Липецкой областной клинической больницы в период с 2000 по 2006 г. 150 пациентам в этой группе была выполнена операция (пневмонэктомия, лоб- и билобэктомия) без систематической билатеральной медиастинальной лим-фодиссекции. 150 пациентам (в рамках программы хирургического лечения рака легкого) выполнялась системная медиастинальная билатеральная лим-фодиссекция по принципиальным соображениям. Мужчин среди них было 281 (93,7%) и женщин — 19 (6,3%). Возраст пациентов варьировал от 31 до 78 лет. Большинство больных (40,3%) были старше 50 лет, пациентов старше 60 лет было 33,7%. В возрасте 70 лет оперированы 8 (2,7%) человек.
Оценка распространенности опухоли проводилась в соответствии с международной классификацией по системе TNM (5-е издание, 1997 г.) на основании данных обследования, операционных и морфологических находок.
У 55 (18,3%) больных была I стадия, у 103 (34,3%) — II стадия и у 142 (47,6%) — IIIA стадия.
Из 300 оперативных вмешательств 150 (50,0%) составили операции, которые сопровождались системной медиастинальной билатеральной лимфодиссекцией, по принципиальным соображениям — «расширенные». Другим 150 (50,0%) больным выполнены операции без систематической билатеральной медиастинальной лимфодиссекции — «типичные». В группе «расширенных» операций больные с I стадией составили 10 (6,7%) человек, II стадия установлена у 60 (40%) и IIIA — у 80 (53,3%) пациентов. Среди «типичных» операций I стадия диагностирована у 45 (30,0%), II — у 43 (28,7%) и IIIA — у 62 (41,3%) больных.
В большинстве наблюдений был отмечен плоскоклеточный рак — 158 (52,7%), в группе «расширенных» операций он составил 76 (25,2%) случаев, в группе «типичных» — 82 (27,4%) случая. Аденокарци-нома была выявлена у 102 (34,0%) больных: в группе «расширенных» операций — у 46 (15,3%) и в группе «типичных» — у 56 (18,3%). Смешанный рак был выявлен у 10 (3,3%) больных: в группе «расширенных» операций — у 8 (2,7%), в группе «типичных» — у 2 (0,7%). Мелкоклеточный рак был выявлен у 30 (10,0%) больных: в группе «расширенных» — у 20 (6,7%) больных, в группе «типичных» — у 10 (3,3%).
Центральный рак был установлен в 205 (68,3%) наблюдениях, периферический рак — в 95 (31,7%). Центральный рак встречался чаще в группе «расширенных» оперативных вмешательств, чем в «типичных» (37,0% и 31,3% соответственно). Аналогичная картина была выявлена при периферическом раке (13,0% и 18,7% соответственно). При I стадии частота центрального и периферического рака составила 9 (19,1%) и 38 (80,9%) больных соответственно, при II стадии — 44 (43,6%) и 57 (52,4%), а при IIIA стадии центральный рак отмечался у 152 (100%) больных.
Из общего числа операций пневмонэктомии составили 146 (48,7%), лоб- и билобэктомии — 154 (57,3%). При I стадии это соотношение было 9 (16,7%) против 45 (83,3%), при II стадии — 49 (41,2%) против 70 (58,8%) и при IIIA стадии — 88 (69,3%) против 39 (31,0%) соответственно. Из выполненных пневмон-эктомий 93 (31,0%) были «расширенные», 53 (17,7%) «типичными». Среди лобэктомий 57 (19,0%) были выполнены в «расширенном» объеме, 97 (32,3%) были «типичными».
При изучении особенностей регионарного ме-тастазирования маркировка лимфатических узлов проводилась интраоперационно, после удаления препарата. Удаленные лимфатические узлы подсчитыва-лись и маркировались соответственно регионарным группам [на основании карты регионарных зон мета-стазирования рака легкого (Naruke Т., 1978)]. Данные вносились в созданный в отделении протокол гистологического исследования и вместе с препаратом направлялись на микроскопическое исследование. У III (74,0%) пациентов диагностирован центральный и у 39 (26,0%) периферический рак. Верхнедолевые локализации справа составили 26,7% (40 из 150), слева — 53,3% (50 из 150). В нижних долях опухоль локализовалась справа в 24,0% (36 из 150), слева — в 16,0% (24 из 150).
Таким образом, у подавляющего числа больных раковый процесс носил довольно распространенный характер. Производство систематической медиасти-нальной билатеральной лимфодиссекции у подавляющего числа больных являлось онкологически обоснованным.
Хирургическое вмешательство выполнялось из бокового доступа. Он включал в себя пневмонэктомию, лоб- и билобэктомию с систематической билатеральной медиастинальной лимфодиссекцией.
Систематическая медиастинальная билатеральная лимфодиссекция характеризовалась удалением в максимальном объеме клетчатки заднего средостения, включавшей параэзофагеальную, превертебральную, парааортальную, бифуркационную, паратрахеальную зоны аортального окна и лимфатические узлы, тра-хеобронхиальные, вдоль контралатеральной поверхности трахеи, главного бронха и непосредственно в куполе плевральной полости. Лимфодиссекция считалась адекватной, если все органы заднего средостения были полностью обнажены и лишены окружающей их клетчатки. У 28 больных объем вмешательства был расширен за счет дополнительной резекции вовлеченных в опухолевый процесс органов (перикарда — у 15, непарной вены — у 8, левого предсердия — у 5). Средняя длительность операции составила (255+35,1) мин, т.е. от 185 до 360 мин.
Результаты и их обсуждение
Выполнение хирургического вмешательства всегда начинали с боковой торакотомии. Лимфодиссекция в грудной полости и средостении разработана недостаточно полно, и ее выполнение нередко сопряжено с нарушением целости собственных пищеводных сосудов, что располагает к излишней кровопотере во время операции и развитию гемоторакса в послеоперационном периоде. С целью снижения значимости этого фактора лигирование пищеводных артерий производили превентивно, непосредственно у места их отхождения. Для этого мобилизация параэзофагеальной клетчатки от аорты на всем протяжении велась исключительно в адвентициальном слое. По мере отслойки клетчатки последнюю порционно пережимали вблизи аорты, пересекали и лигировали. Такой прием мобилизации клетчатки, делает его более безопасным.
Что же касается бронхиальных артерий — еще одного частого источника кровотечения, чаще представленных одним стволом, то они всегда коагулировались превентивно в верхней точке бифуркационного угла или даже несколько выше его, спереди, по мере диссекции соответствующего лимфатического коллектора. Обращали повышенное внимание на достижение должного гемостаза и выше непарной вены, зоны действия нижних щитовидных и подключичных артерий.
При соблюдении анатомичности в препаровке тканей и методических приемов ее выполнения кровопотеря носила минимальный объем, в среднем (520,0+21,6) мл. Исключение составили двое больных, у которых имело место повреждение аорты. В одном случае это было связано с интимным прилежанием опухоли к сосуду, а в другом — при иссечении пораженных задних медиастинальных лимфатических узлов. В первом наблюдении кровопотеря составила 1200 мл, а во втором — 2300 мл.
Адекватная билатеральная мобилизация клетчатки средостения нередко влечет за собой повреждение грудного лимфатического протока. При этом частота его ранения повышается с обширностью и локализацией опухолевого процесса и стремлением к максимальному радикализму вмешательства. Чаще всего это происходит на уровне V—VI грудных позвонков. Однако суть проблемы заключается не столько в профилактике данного явления, сколько в его своевременном распознавании. Накопленный достаточно большой клинический опыт убедил нас в том, что диагностика повреждения грудного лимфатического протока во время операции является реальной и напрямую связана с опытностью хирурга. Если мобилизация препарата в зоне анатомического расположения протока производится преимущественно острым путем (ножницами), мелкими порциями, в строго отработанной последовательности, то в момент нарушения целости протока в рану из его просвета начинает поступать лимфа — прозрачная опалесцирующая жидкость. При внимательном отношении к этому этапу операции не заметить момент травмы протока невозможно. Мы наблюдали его повреждение у 5 больных. У 3 из них оно было диагностировано в момент раскрытия его просвета. Наши тактические действия сводились к лигированию протока в зоне повреждения и на протяжении выше и ниже этого участка. Во всех наблюдениях был достигнут полный клинический эффект. У двух других больных травма протока в процессе операции не была выявлена. Гладко протекали и первые 2-е сут после операции. Однако соответственно на 3-и и 5-е сут по дренажам стала поступать хилезная жидкость в объеме 1000—1500 мл/сут. Вероятной причиной развития хилоторакса мы считаем изменение технологии производства операции: впервые при лигировании превертебральной клетчатки была применена коагуляция. Время отторжения коагуляцион-ного струпа совпало с развитием хилоторакса.
Следующим наиболее тяжелым осложнением, напрямую связанным с диссекцией, является трав-матизация возвратного нерва (одного или обоих). Как правило, предпосылки к этому возникают при поражении лимфатических узлов зоны аортального окна или непосредственно из клетчатки купола плевральной полости. Такой опухолевый процесс мы наблюдали у 7 оперированных больных. У 5 из них опухоль врастала в лимфатические узлы аортального окна, а у 2 — имелись крупные метастазы в куполе плевральной полости. Стремясь к радикализму хирургического вмешательства, у 4 больных повредили возвратный нерв, что повлекло за собой парез правой (у 3) или левой (у 1) голосовой связки. От этого осложнения мы не потеряли ни одного пациента. Однако послеоперационный период у этих больных характеризовался более тяжелым течением и требовал более частого применения санационной бронхоскопии ввиду нарушения дренажной функции бронхов и возможности аспирации. Кроме того, в дальнейшем у этих пациентов заметно страдало качество жизни.
Неотъемлемой частью диссекции является нарушение целости контралатеральной медиастинальной плевры в наддиафрагмальной зоне и в зоне бифуркации трахеи. Это имело место у 30 оперированных нами больных. Обусловлено такое явление наличием в этой зоне большого слоя рыхлой параэзофагеаль-ной, парабронхиальной клетчатки и более близким анатомическим расположением контралатеральной медиастинальной плевры. Стремление к максимальному удалению клетчатки и нечетко выраженная граница между ней и плеврой, как правило, и приводит к рассечению последней. Только после этого хирург становится уверенным в точных границах дальнейшей диссекции. Раскрытие левой плевральной полости заметно не сказывалось на характере течения послеоперационного периода, однако требовались 2—3-кратные пункции для удаления скапливающейся в ней геморрагической жидкости или дополнительного дренирования контралатерального гемиторакса.
В структуре «хирургических» осложнений после «расширенных» операций кровотечение наблюдалось у 2,0% (3 из 150) больных, несостоятельность шва бронха — у 4,0% (6 из 150), эмпиема плевры — у 2,0% (2 из 150), нагноение раны — у 4,7% (7 из 150) и неполное расправление легкого не наблюдалось ни у одного больного.
Из «нехирургических» осложнений наиболее частым являлась пневмония, развившаяся у 2 (1,3%) больных. При этом мы не можем связать ее каким-либо образом с лимфодиссекцией, так как и в контрольной группе она наблюдалась даже несколько чаще [у 15 (10%) из 150 оперированных].
В равной степени в обеих группах больных наблюдали развитие острой сердечно-сосудистой недостаточности. Так, в основной группе она развилась у 5 (3,3%) пациентов, а в контрольной — у 7 (4,7%) из 150. Как правило, она носила вторичный характер и возникала как закономерное следствие неконтролируемого течения каких-либо других осложнений и почти всегда гнойно-воспалительных со стороны органов грудной полости.
Критическое осмысление «хирургических» послеоперационных осложнений убедило нас, прежде всего, в том, что их развитие связано с дефектами оперативной техники; неправильной оценкой интраопе-рационной ситуации; порой создания самим хирургом дополнительных сложностей. В меньшей степени, на наш взгляд, возникновение этих осложнений зависит от так называемых «общебиологических» причин. Представляется, что деление послеоперационных осложнений на «хирургические» и «нехирургические» практически оправданно, так как заставляет хирургов более внимательно относиться к выполнению технических приемов операции.
В общей сложности послеоперационная летальность в основной группе больных составила 6,7% (умерли 10 из 150 оперированных), а в контрольной — 20% (умерли 30 из 150 пациентов).
Таким образом, систематическая медиастинальная билатеральная лимфодиссекция при раке легкого, продиктованная онкологической необходимостью, превращает и без того более высокой степени сложности операцию, в потенциально связанную со многими жизнеопасными осложнениями. Вместе с тем последовательная отработанность всех звеньев единой цепи хирургического вмешательства и постоянное совершенствование профилактических мероприятий позволили возможные негативные явления лимфодиссекции свести до минимума без какого-либо отрицательного их влияния на непосредственные результаты лечения.
1. Систематическая медиастинальная билатеральная лимфодиссекция является морфологически обоснованной и неотъемлемой частью радикального хирургического вмешательства при раке легкого. При этом границы лимфодиссекции должны охватывать зоны не только фактического, но и возможного регионарного метастазирования.
2. Лимфодиссекция вносит ряд специфических особенностей в течение интра- и послеоперационного этапов. Вместе с тем при адекватной профилактике возможных осложнений не повышаются травматичность хирургического вмешательства, уровень послеоперационных осложнений и летальность.
3. Ведущими факторами, определяющими непосредственные результаты оперативного лечения рака легкого, являются техническое совершенство исполнения хирургического вмешательства, оптимальность анестезиологического пособия и адекватность ведения послеоперационного периода.
1. Давыдов, М.И. Современные аспекты эпидемиологии, семиотики и лечения рака легкого / М.И. Давыдов, Б.Е. Полоцкий // Терапевт. архив. — 1990. — Т. 62, № 10. — С. 58—63.
2. Давыдов, М.и. Рак легкого / М.И. Давыдов, Б.Е. Полоцкий. — М.: Радикс, 1994. — С. 216.
3. Двойрин, В.В. Статистика рака легкого в России / В.В. Двойрин, Н.Н. Трапезников // Вестник Онкологического научного центра им. Н.Н. Блохина. — 1996. — № 2. — С. 3—12.
4. Трахтенберг, А.Х. Рак легкого / А.Х. Трахтенберг. — М.: Медицина, 1987. — 304 с.
5. Bergmans, T. A prospective study of infections in lung cancer patients admitted to the hospital / T. Bergmans, J.P. Sculier, J. Klastersky // Chest. — 2003. — Vol. 124, № 1. — Р. 114—120.
6. Bernet,F. Age does not influence early and late tumor-related outcome for bronchogenic carcinoma [see comments] / F. Bernet, R. Brodbeck, M.O. Guenin, G. Schupfer // Ann. Thorac. Surg. — 2000. — Vol. 69, № 3. — Р. 913—918.
7. Brown, J.S. Age and the treatment of lung cancer / J.S. Brown, D. Eraut, C. Trask // Thorax. — 1996. — Vol. 51. — Р. 564—568.
8. Harvey, J.C. Lung cancer and other selected topics in thoracic oncology / J.C. Harvey, E.J. Beattie // Semin. Surg. Oncol. — 1993. — № 9. — Р. 71—162.
9. Martin, J. Long-term results of combined-modality therapy in resectable non-small-cell lung can cer / J. Martin, R.J. Ginsberg, E.S. Venkatraman [et al.] // Clin. Oncol. — 2002. — Vol. 15, № 20 (8). — Р. 1989—1995.
10. Minami, H. Lung cancer treated surgically in patients Опубликовано в №3 2010