меланоциты что это аномальные
Как образуется меланома
Генотипирование индивидуальных меланоцитов кожи выявило пути их злокачественной трансформации
Рис. 1. Схема обсуждаемой работы. Слева – эпидермис человека состоит из нескольких типов клеток, но подавляющее большинство из них – кератиноциты разной степени «зрелости». Древовидные меланоциты в основном распределены по одиночке в базальном слое эпидермиса. При помощи своих разветвленных отростков они распределяют пигмент меланин по окружающим кератиноцитам для защиты от солнечного ультрафиолета. Справа – ученые выделяли индивидуальные меланоциты из образцов кожи доноров, подращивали их в культуральной среде до образования небольших колоний, а затем проводили амплификацию и полное секвенирование геномов. Параллельно проводили амплификацию и секвенирование РНК. Результаты сопоставляли, и истинными мутациями признавали только те, которые обнаруживались и в ДНК, и в РНК. Анализ этих мутаций позволил установить, какие из них приводят к злокачественной трансформации меланоцитов. Рисунок из популярного синопсиса к обсуждаемой статье в Nature.
Меланомы относятся к самым агрессивным и смертоносным формам рака. При этом ученые пока знают очень мало о ранних стадиях формирования меланомы. Один из способов разобраться с этим – проследить за тем, как копятся мутации в отдельных меланоцитах (клетках эпидермиса, отвечающих за пигментацию кожи). Американские ученые разработали для этого новый метод, который позволил с минимумом ошибок сравнить геномы индивидуальных меланоцитов с разных участков кожи нескольких доноров. Как и следовало ожидать, в фенотипически нормальных меланоцитах, регулярно подвергавшихся мутагенному действию солнечных лучей (например, с лица или шеи), накапливалось больше мутаций, чем в меланоцитах, взятых с почти всегда защищенных от солнца участков тела. Но неожиданно оказалось, что меланоциты с рук, бедер или спины (участков кожи, которые получают в течение жизни промежуточную дозу солнечного ультрафиолета) имели еще больше мутаций. Установлено, что в нормальных меланоцитах есть много мутаций, считающихся онкогенными, но среди них нет «сильных» онкогенных мутаций, свойственных меланомам. Также ученые представили общую схему путей дополнительного мутагенеза, превращающего нормальные меланоциты, несущие «слабые» мутации, в злокачественные, из которых впоследствии развиваются меланомы.
Эпидермис – внешний и самый тонкий (его толщина всего около 0,1 мм) слой кожи человека. В основном (примерно на 90%) он состоит из кератиноцитов. Эти клетки появляются в самом глубоком – базальном – слое эпидермиса в результате дифференциации стволовых клеток (благодаря чему кожа постоянно обновляется). Основные функции кератиноцитов – защитная и структурная. В течение своей жизни (которая длится 1,5–2 месяца, см. K. M. Halprin, 1972. Epidermal „turnover time“ – a re-examination) кератиноцит смещается к внешней границе эпидермиса. При этом он постепенно уплощается и, если выразиться совсем кратко, «твердеет». Достигнув поверхности кожи кератиноцит, представляет собой уже всего лишь роговую чешуйку, которая довольно быстро отшелушивается, уступая место следующим.
Другой важный тип клеток эпидермиса – меланоциты. Они производят пигмент меланин, отвечающий за цвет нашей кожи. При помощи меланосом меланин распределяется по окружающим кератиноцитам и запасается в них, выполняя свою роль – защищать клетки кожи от ультрафиолета (в первую очередь – солнечного). В норме меланоциты живут в базальном слое эпидермиса.
В течение жизни в соматических клетках организма возникают и накапливаются случайные мутации. В результате в каждой клетке формируется уникальный набор мутаций. Абсолютное большинство этих мутаций нейтральны и не оказывают какого-либо значительного влияния на качества клетки, но некоторые могут затронуть ключевые гены, контролирующих поведение клетки, и направить ее по пути злокачественного перерождения – неконтролируемого деления, в результате которого возникают раковые опухоли.
Основным фактором, провоцирующим раки кожи, является ультрафиолетовая область солнечного света. Клетки эпидермиса, призванные защищать организм от УФ-излучения, от него же и страдают. Отчасти это воздействие нивелируется постоянным обновлением кератиноцитов. Но с возрастом мутации все равно копятся, а риск развития онкологических заболеваний растет. И если раковые опухоли, происходящие из кератиноцитов (например, базалиомы и сквамозно-клеточные карциномы), лечатся весьма успешно, то с меланомами, возникающими из меланоцитов, дело обстоит гораздо хуже. Меланомы весьма агрессивны, склонны рано образовывать метастазы в отдаленных органах и тканях, и поэтому часто заканчиваются летальным исходом. Ранняя диагностика меланомы осложняется тем, что на начальных стадиях развития опухоли она похожа на безобидные родинки, образованные локальным разрастанием нормальных меланоцитов. Меланомы тоже, как правило, вызываются солнечным ультрафиолетом, но это не единственная причина. Например, некоторые родинки могут перерождаться в опухоль, если в них произойдут определенные мутации, не связанные с УФ-облучением. По степени накопления связанных с солнечным облучением повреждений (cumulative sun damage, CSD) ВОЗ делит меланомы на два основных подтипа: с низким уровнем CSD (low-CSD) и с высоким уровнем CSD (high-CSD). И те, и другие являются очень агрессивными и часто смертельными.
В кератиноцитах работает специальная программа, зависящая от белка р53. После облучения большой дозой ультрафиолета она запускает апоптоз, приводящий к отслаиванию участков эпидермиса после, например, ожога солнечным ультрафиолетом. Ген TP53, кодирующий этот белок, тоже может повредиться из-за мутаций. Клоны кератиноцитов с мутантным TP53, несмотря на постоянное обновление кожи, могут оставаться в ее структуре и потенциально развиться в рак. Такова в общих чертах схема развития опухолей из кератиноцитов.
В то же время механизмы, приводящие к началу злокачественной трансформации меланоцитов в меланомы, не известны даже в такой степени. Расшифровка того, где именно происходят мутации и с какой скоростью они копятся в предраковых меланоцитах нормальной кожи, может дать важную информацию о ранних стадиях трансформации – до того, как станет очевидной неопластическая пролиферация и превращение нормальных клеток в раковые и их неконтролируемое размножение. Именно такую задачу попытались решить американские ученые под руководством Хантера Шэйна (A. Hunter Shain) из Калифорнийского университета в Сан-Франциско.
Ранее неоднократно предпринимались исследования онкогенных мутаций на небольших фрагментах различных органов и тканей, в том числе кожи (см., например, I. Martincorena et al., 2015. High burden and pervasive positive selection of somatic mutations in normal human skin). Для меланоцитов такой подход невозможен, так как они представлены редкими вкраплениями среди кератиноцитов, и требуется проводить генотипирование на отдельных клетках. Но прямое секвенирование генома индивидуальных клеток требует предварительной амплификации клеточной ДНК, и при этом обычно теряются большие фрагменты генома и накапливается много ошибок, неизбежных при амплификации даже высокоточными ДНК-полимеразами. Альтернативный подход предусматривает предварительное размножение единичных клеток in vitro с целью увеличить количество анализируемой ДНК. Но при этом возникают мутации, которых не было в исходных клетках. Недостатки этих подходов не позволили использовать в обсуждаемой работе, поскольку ученые хотели как можно точнее определить разницу в мутагенезе между отдельными меланоцитами. В итоге ученые совместили оба подхода, чтобы взять из каждого лучшее.
В экспериментах использовались 19 небольших фрагментов нормальной по морфологии кожи от шести уже скончавшихся доноров европейского происхождения в возрасте от 63 до 85 лет. У двоих из них был рак кожи, у четверых – нет. Всего было исследовано 133 меланоцита. Фрагменты брали из разных по степени подверженности солнечному излучению участков кожи. К участкам с высоким уровнем облучения относили, например, лицо, шею и кожу головы у лысых людей; к участкам со средним уровнем облучения – кожу спины и бедер; к участкам с низким уровнем – кожу с тех частей тела, которые почти всегда скрыты под одеждой у большинства людей. Полученные из кожи клетки эпидермиса немного подращивали в культуральной среде, выделяли из них индивидуальные меланоциты и культивировали их лишь кратковременно, сводя к минимуму возможность возникновения дополнительных мутаций. При культивировании 38% выделенных меланоцитов образовали небольшие колонии (от 2 до 3000 клеток, в среднем – 184). Большинство из них были достаточного размера для дальнейшего анализа. Из колоний меланоцитов выделяли, амплифицировали, секвенировали и ДНК, и РНК. Это позволило получить и сопоставить и генотип (ДНК), и проявляющийся фенотип меланоцитов (РНК), исключая ошибки амплификации. Дополнительным критерием для элиминации ошибок служило наличие нормальных полиморфизмов структуры ДНК (нейтральных вариаций нуклеотидной последовательности) вблизи предполагаемых мутаций (рис. 2).
Рис. 2. Методы, которыми ученые отделяли истинные мутации от артефактов амплификации. Сначала выделялись только те мутации, которые обнаруживались и в ДНК, и в РНК (слева). Затем, для дополнительной проверки истинности мутаций, ученые определяли, с какими однонуклеотидными полиморфизмами (SNP) они связаны (справа) – проверку проходили только те мутации, которые однозначно соответствовали конкретным вариантам полиморфизма. Рисунок из обсуждаемой статьи в Nature.
По результатам секвенирования ДНК и РНК для каждого клона сравнивали результаты по 509 генам, наиболее часто встречающихся в различных злокачественных опухолях, считая их онкогенами, которые могут быть связаны и с меланомой. В среднем частота мутаций составляла 7,9 на мегабазу (МБ), но эта величина сильно варьировала: разброс был от менее чем 0,82 до 32,3 мутации на МБ.
Как и ожидалось, меланоциты из наиболее защищенных от солнца участков кожи имели значительно меньше мутаций, чем из «наиболее облученных». Но неожиданно оказалось, что меланоциты с «промежуточной» дозой облучения имеют еще больше мутаций (рис. 3, слева).
Рис. 3. Слева – меланоциты, взятые с участков кожи, которые нерегулярно подвергаются воздействию солнечного ультрафиолета (например, кожа бедер или спины; intermittently sun exposed), имели больше мутаций, чем меланоциты как с наиболее подверженных облучению участков кожи (лицо, шея; chronically sun exposed), так и с наиболее защищенных (область паха; sun shielded). Справа – некоторые меланоциты из участков здоровой кожи вблизи меланомы могли иметь больше мутаций, чем клетки самой меланомы. Графики из обсуждаемой статьи в Nature.
Достоверного объяснения этому наблюдению пока нет. Возможно, оно связано с разной скоростью мутирования в геномах меланоцитов различных частей тела или с их ускоренной гибелью и возобновлением на экспонируемых на солнце частях тела. Но оно хорошо согласуется с известным фактом, что меланомы на иногда экспонируемых на солнце частях тела возникают непропорционально чаще по сравнению с другими формами рака кожи.
Частота мутаций у различных доноров сильно варьировала. Более того, в образцах от доноров, болевших раком кожи, наблюдалось следующее: в некоторых меланоцитах из участков здоровой кожи, прилежащих к меланоме, частота мутаций была заметно выше, чем в меланоме как таковой (рис. 3, справа). Такую ситуацию нельзя назвать типичной. Например, при колоректальных раках частота мутаций в опухолях намного выше, чем в прилежащих тканях.
Еще одной неожиданностью стал большой разброс в частоте мутаций в индивидуальных меланоцитах, выделенных из одного маленького (площадью примерно 3 см 2 ) участка кожи. Чтобы найти причины этих различий, ученые сравнили уровни экспрессии ряда генов в таких меланоцитах. Наиболее убедительная корреляция была получена для гена MDM2, продукт которого вызывает деградацию главного противоопухолевого и противомутационного белка р53. В меланоцитах с усиленной экспрессией MDM2 наблюдалось достоверно больше мутаций, чем в их соседях с нормальным уровнем. Но возможные причины указанных различий различным уровнем экспрессии MDM2 не ограничиваются, и для раскрытия этих причин требуются дальнейшие исследования.
Сравнение набора мутаций в меланомах и меланоцитах из соседних с опухолями участков нормальной кожи выявило их существенные различия. Следовательно, заключили исследователи, клетки опухоли не «перескакивают» в участки окружающей их кожи и наоборот.
Далее авторы проанализировали возникновение в меланоцитах мутаций, для которых ранее была показана их роль как драйверов злокачественного перерождения клеток при других раках. Большинство таких мутаций было связано с сигнальным путем МАРК, управляющего выживанием, активацией подвижности и, главное, активацией деления клеток. Но в основном это были так называемые «слабые» онкогенные мутации. Так, среди них не было очень часто встречающейся в меланомах «сильной» мутации BRAFV600E – главного драйвера развития low-CSD меланом. Мутации, найденные в нормальных меланоцитах, являются сравнительно слабыми активаторами пути МАРК и не могут быть активными драйверами онкогенеза. Для формирования high-CSD меланом, для которых они свойственны, нужны дополнительные мутации-драйверы.
Рис. 4. Схема возможных путей возникновения меланомы. Рисунок из обсуждаемой статьи в Nature.
Также были обнаружены мутации в генах, контролирующих клеточный цикл, и в генах, контролирующих модификации хроматина. Как таковые эти мутации не могут самостоятельно индуцировать неопластический процесс, но могут ускорить его в клетках с мутациями в генах пути МАРК. Примечательно, что в меланоцитах не было найдено мутаций в промоторе гена TERT (обратной транскриптазы, компонента теломеразы). Несмотря на то, что такая мутация часто встречается в меланомах, она вряд ли как-то стимулирует процесс неопластической трансформации меланоцитов.
Полученные результаты представляют собой чрезвычайно подробные данные по структуре геномов нормальных меланоцитов. Также они позволили получить детальную информацию по мутагенезу, вызываемому солнечным ультрафиолетом, и о путях возникновения меланом. Разработанный методической подход для анализа геномов индивидуальных меланоцитов может быть использован для анализа геномов индивидуальных клеток других органов и тканей.
Меланоциты что это аномальные
Меланоциты — крупные отростчатые клетки, располагающиеся в базальном слое эпидермиса, родственники клеток нервной системы. Они отвечают не только за цвет и защиту нашей кожи от солнечных ожогов, но вносят существенный вклад в реакцию на практически любые стрессовые воздействия, работая в содружестве с всеми остальными клетками кожи и нейроиммунной системой.
Несмотря на то, что за последние десятилетия ученые узнали много нового об особенностях жизни меланоцитов, мы до сих пор точно не знаем, сколько они живут. Точнее, не знаем, сколько живут меланоциты эпидермиса, срок жизни меланоцитов волосяных фолликулов нам известен, и он относительно небольшой — 3–5 лет. Что касается меланоцитов эпидермиса, известно, что после 30 лет их количество уменьшается примерно на 10–20% каждое десятилетие, т.е. живут они как минимум десятки лет.
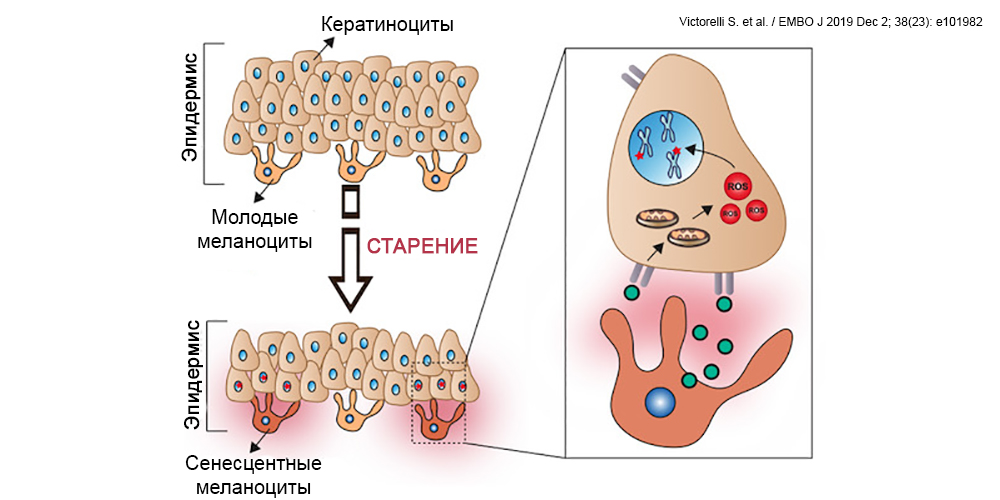
Однако клеточная гибель — не единственный вариант, который ожидает «повидавшего жизнь» меланоцита. Также, как и многие другие клетки, меланоциты, которые накопили критическое количество повреждений и которые защитные системы клетки более не хотят допускать к делению, могут либо умереть, либо перейти в так называемое сенесцентное состояние. Это состояние, в котором они не способны более делиться и таким образом передавать дефектный геном, однако могут продолжать выполнять некоторые из своих функций, хотя и гораздо хуже, чем молодые коллеги. Проблема в том, что сенесцентные клетки также приобретают ассоциированный со старением секреторный фенотип (senescence associated secretory phenotype, SASP). Этот фенотип («образ жизни») связан с выделением во внеклеточную среду множества провоспалительных факторов, которые ускоряют старение тканей и приводят к развитию различных заболеваний. Этот процесс наиболее изучен у дермальных фибробластов, и нам известно негативное влияние сенесцентных фибробластов на состояние внеклеточного матрикса. Новое исследование ученых из США и Великобритании показало, что меланоциты в коже зрелых людей также приобретают сенесцентный фенотип. Более того, именно меланоциты предлагается считать основными виновниками старения эпидермиса.
Так, в экспериментальных моделях секретируемые сенесцентными меланоцитами агенты нарушали деление базальных кератиноцитов, таким образом тормозя обновление клеток эпидермиса, а также вызывали уплощение дермоэпидермального соединения, что приводило к состоянию, аналогичному возрастной атрофии эпидермиса. И вовлечены сюда были механизмы, связанные с негативным воздействием активных форм кислорода на теломеры кератиноцитов. Более того, удаление сенесцентных меланоцитов приводило к восстановлению пролиферации эпидермальных клеток.
Надо отметить, что эти данные были получены не на живых людях, а на кожных эквивалентах. Однако исследование очень интересное и еще раз говорит нам о важности использования солнцезащитных средств, ведь именно ультрафиолет — важнейший фактор, обуславливающий повреждение меланоцитов.
Подробно об особенностях жизнедеятельности меланоцитов, нюансах меланогенеза, а также средствах, которые используются для профилактики и коррекции пигментных дефектов (в том числе солнцезащитных) вы можете прочитать в новой книге из серии Моя специальность косметология «Пигментация в практике косметолога», которая совсем скоро выйдет в свет. Перед началом солнечного сезона это как никогда важная информация. Следите за нашими обновлениями!
Источник:
Victorelli S. et al. Senescent human melanocytes drive skin ageing via paracrine telomere dysfunction. EMBO J 2019 Dec 2; 38(23): e101982.
Меланоцитарные невусы
В статье представлены варианты, клинические проявления, особенности течения, диагностические критерии различных типов меланоцитарных невусов.
Повышенное внимание врачей всех специальностей к меланоцитарным невусам (МН) объясняется поздней диагностикой и плохим прогнозом развивающейся на их фоне меланомы — одной из наиболее злокачественных опухолей человека. Составляя в структуре злокачественных новообразований кожи (ЗНК) менее 10%, меланома ответственна за 80% случаев смерти, приходящихся на всю группу ЗНК /1/. С другой стороны, своевременно начатое лечение меланомы (на стадии «горизонтального» роста) позволяет добиться 10-летнего безрецидивного периода жизни пациентов в 90% случаев /7/.
Известно, что меланома примерно в 50% случаев возникает на фоне МН, что может быть обусловлено общим генетическим дефектом — утратой гетерозиготности в локусе 9р21 хромосомы /16/ с мутацией в онкогене nRAS /20/ как в ткани меланомы, так и МН, на фоне которого она развилась.
Важнейшим фактором развития меланомы на фоне МН является воздействие на кожу человека избыточной дозы УФИ, приводящей не только к повреждению кератиноцитов и меланоцитов, но и к иммуносупрессии, обусловленной прежде всего подавлением NК-клеток. Кроме того, факторами риска развития меланомы являются: фенотип кожи I-II (склонность к солнечным ожогам кожи, рыжие волосы, голубые глаза, светлая кожа), 3 и более эпизодов солнечных ожогов кожи в течение жизни, наличие веснушек и лентиго или 3 и более атипичных МН, семейные случаи меланомы у близких родственников /1/.
МН отмечаются у ¾ представителей европеоидной расы /18/ и являются доброкачественными опухолями меланогенной системы. Лишь некоторые из них трансформируются в меланому (меланомоопасные МН) или являются маркером повышенного риска ее развития. /4,11,12,19/. Выявление их с целью профилактики развития меланомы имеет исключительно важное значение для врачей всех специальностей.
Подавляющее большинство МН являются приобретенными. Их делят на обычные и особые типы.
Среди обычных МН выделяют пограничные, сложные (эпидермо-дермальные) и внутридермальные формы/15)/. Они возникают после рождения ребенка и имеют характерную динамику: вначале за счет пролиферации невусных клеток вдоль границы эпидермиса и дермы происходит формирование пограничного МН; со временем невусные клетки продвигаются в дерму, формируя смешанный МН; пограничный компонент с возрастом может исчезать, оставляя только дермальный (внутридермальный МН) компонент/3, 5, 6, 9/. Эволюцию МН связывают с фазами инволюции меланоцита: меланоцит — невусная клетка — фиброзная ткань /10/.
Клинически пограничный МН проявляется равномерно пигментированным (от светло-коричневого до темно-коричневого) пятном диаметром 1-5 мм округлой или овальной формы с гладкой поверхностью и четкими границами, располагающимися на любом участке кожи и существующими примерно до 35-летнего возраста. Смешанный МН представляет собой пигментированную папулу, иногда с папилломатозом, редко достигающую 1см в диаметре. Внутридермальный МН характеризуется куполообразной или папилломатозной папулой, которая по форме может напоминать ежевичную ягоду (рис.1.), иметь ножку или форму моллюсковидного элемента на широком основании (рис.2); его поверхность покрыта волосами, диаметр редко превышает 1см, а окраска варьирует от светло-коричневой до черной. Редко встречается депигментированный МН белесоватой или розово-красной окраски.
Рис. 1. Внутридермальный меланоцитарный невус в виде ежевики.

Отмечена зависимость клинической картины обычных МН от локализации и расположения в них невусных клеток. Так, на ладонях и подошвах сложный и интрадермальный МН (из-за большой толщины рогового слоя) не возвышаются над уровнем кожи; приподнятые над уровнем кожи МН имеют выраженный интрадермальный невусный компонент, а плоские — пограничный компонент; чем больше МН приподнят над уровнем кожи, тем он менее пигментирован.
Обычные МН растут пропорционально росту тела человека, после рождения их количество нарастает, достигая максимума в пубертатный период, а после 50 лет постепенно уменьшается, причем к 7-9 десятилетиям жизни они, как правило, исчезают. Регресс обычных МН обусловлен дегенерацией образующих его клеток с постепенным их замещением фиброзной и жировой тканью /10,24/. Внезапный регресс таких МН происходит очень редко /29/.
Представления о том, что к меланомоопасным МН следует относить пограничные и смешанные формы (как сохранившие в своей структуре пограничный компонент, в том числе локализованные в области ладоней и подошв, наружных половых органов, ногтевого ложа) в настоящее время пересмотрены. Так, МН ладоней и подошв, составляющий 4-9% от всех МН, в настоящее время не относят к меланомоопасным в связи с тем, что в меланому трансформируются только диспластические невусы такой локализации /17/. МН ногтевого ложа, так называемая продольная (линейная) меланонихия в виде пигментированных линий, идущих вдоль ногтевой пластинки, может быть не только пограничным, смешанным МН или акрально-лентигинозной меланомой, но и, причем нередко, так называемым «меланотическим пятном» (образованным повышенным содержанием меланина в клетках базального слоя эпидермиса без увеличения количества меланоцитов)/28/. Хотя подногтевая меланома встречается не только у взрослых, но и у детей, продольная меланонихия у детей почти всегда является доброкачественным процессом /21/.
Обычные МН наружных половых органов чаще наблюдаются у женщин молодого возраста в области вульвы и промежности, реже- в области мужских половых органов, но атипичные гистологические признаки в них обнаруживаются крайне редко (в 0,02% случае) /27/. С другой стороны, получены убедительные данные о том, что меланома может развиться как в ткани внутридермального МН, так и непосредственно под ним/30/.
Ввиду возможности развития меланомы на фоне внутридермального МН, а также из-за сложности клинического отличия пограничного и смешанного МН от диспластического невуса, во избежание озлокачествления при обычных МН не следует подвергать их постоянному трению одеждой, контакту с раздражающими веществами, недопустима механическая эпиляция волос с их поверхности /25/.
К меланомоопасным МН относят врожденные и диспластические невусы. Врожденные МН — доброкачественные пигментные опухоли, состоящие из невусных клеток-производных меланобластов,. возникающие в результате нарушения дифференцировки меланобластов в период между 10-неделей и 6-мес внутриутробной жизни. Встречаются у 1% детей европеоидной расы, обнаруживаются при рождении или в течение первого года жизни ребенка и бывают разных размеров: от мельчайших до гигантских. В любом из них может развиться меланома. Клинически они светло или темно коричневого цвета, несколько приподняты над уровнем кожи и иногда покрыты волосами (рост волос начинается не сразу), имеют округлую или овальную форму. Границы их четкие или размытые, форма правильная или неправильная, поверхность с сохраненным кожным рисунком или бугристая, морщинистая, складчатая, дольчатая, покрытая сосочками, напоминающими мозговые извилины (утрата кожного рисунка происходит при вовлечении в патологический процесс сетчатого слоя дермы (голубой врожденный МН), цвет — светло- или темно-коричневый. Они локализуются на любом участке кожи и в 5% случаев бывают множественными (в таком случае один из них бывает крупным). Более крупные невусы при пальпации имеют мягкую консистенцию.
Врожденные МН могут быть мелкими ( до1,5см), крупными ( до 20 см) и гигантскими. Врожденные МН практически неотличимы от приобретенных обычных МН, единственное различие — диаметр более 1,5 см (у приобретенных МН такого диаметра не бывает), поэтому в настоящее время предложено МН диаметром более 1,5см расценивать как врожденный МН или диспластический невус /2/. Крупные и гигантские врожденные МН, в отличие от мелких врожденных МН, в 95% случаев одиночных, обычно представлены крупным или очень крупным МН, занимающим часть анатомической области или всю ее (туловище, конечность, голову и шею), но в сочетании с множеством мелких МН (рис.3).
Рис. 3. Врожденный меланоцитарный невус.
При этом невусные клетки образуют в эпидермисе и дерме упорядоченные скопления в виде пластов, гнезд или тяжей. Наличие невусных клеток в нижней трети сетчатого слоя дермы или в подкожной клетчатке указывает на врожденный характер МН /19/ Невусные клетки обнаруживаются, в отличие от приобретенных МН, также в придатках кожи, пучках нервных волокон, мышцах, поднимающих волос, в стенках кровеносных и лимфатических сосудов. В крупных и гигантских врожденных МН невусные клетки иногда проникают в мышцы, кости, твердую мозговую оболочку.
В отличие от приобретенных МН, врожденные МН не исчезают спонтанно. Риск развития меланомы на фоне мелких врожденных невусов составляет 1-5%, гигантских — 6,3%, (причем в 50% случаев меланомы развиваются в возрасте 3-5лет). Прогноз при меланоме, растущей из крупного врожденного МН всегда неблагоприятный, поскольку ее выявляют обычно на поздних стадиях развития.
Диспластический невус (ДН) (син.: невус Кларка, атипичный невус) — приобретенное пигментное новообразование, характеризующееся гистологически беспорядочной пролиферацией атипичных меланоцитов. Встречается у 5% населения /8/ (в том числе у 30-50% больных со спородической и у всех больных с семейной меланомой) и возникает на клинически непораженной коже или на фоне сложного или (изредка) пограничного МН. ДН появляются позже, чем приобретенные МН — незадолго до начала полового созревания или на протяжении жизни вплоть до старости. Развитию их способствует инсоляция. Для них не характерна спонтанная инволюция. ДН могут быть спорадическими (30-50% случаев) или наследственными, передаваясь по аутосомно-доминантному типу (синдром ДН или синдром семейного атипичного МН). Синдром ДН и семейная меланома обусловлены мутациями различных генов, чаще всего — локализованных в сегментах хромосомы 1р36 и 9р21 /19/. Клоны мутантных меланоцитов могут активизироваться под действием фотонов солнечного света.
ДН занимает промежуточное положение между приобретенным МН и поверхностно распространяющейся меланомой /2/ и клинически проявляется: пятном с отдельными приподнятыми над уровнем кожи участками (папула на фоне пятна), крупными (более 15 мм в диаметре) размерами, неравномерной (пестрой, напоминает яичницу — глазунью или мишень) окраской, асимметрией, неправильными границами (края отчасти нечеткие, неровные) (рис.4).
Рис. 4. Диспластический невус

Гистологически ДН характеризуется: гиперплазией и пролиферацией меланоцитов, которые в виде веретенообразных клеток располагаются в один ряд вдоль базального слоя эпидермиса (лентигинозная меланоцитарная дисплазия) или в виде эпителиоидных клеток образуют рассеянные гнезда неправильной формы (эпителиоидноклеточная меланоцитарная дисплазия); атипичными меланоцитами (крупный размер клеток, полиморфизм клеток и их ядер, гиперхромазия ядер); характерны также гнезда меланоцитов: рассеянные, неправильной формы, образуют «перемычки» между межсосочковыми выростами эпидермиса; меланоциты веретенообразной формы ориентированы параллельно поверхности кожи; наблюдается разрастание коллагеновых волокон в сосочках дермы и фиброз (непостоянный признак)/19/.
В связи с проблемой формирования меланомы при меланомоопасных МН важно учитывать, что ее цитологическая диагностика недостаточно достоверна, поэтому с целью диагностики и дифференциальной диагностики проводится диагностическая биопсия новообразования.
Эксцизионная биопсия с целью проведения гистологического исследования — надежного метода выявления меланомы, безопасна и рекомендуется для МН менее чем 1,5см в диаметре и проводится отступя на 2мм от его края /4.12/.
Инцизионная (частичная) биопсия проводится онкологом при очень крупных (врожденных) МН /4/. В частности, при внезапном появлении продольной меланонихии для исключения акрально-лентигинозной меланомы или болезни Боуэна матрицы ногтя (также вызывающей продольную меланонихию) проводят биопсию 3-4мм пробойником (через ногтевую пластинку и матрицу до фаланговой кости) /26/.
Поверхностная биопсия («срезание», кюретаж и др.) недопустима, т.к. не дает возможность определения глубины опухолевой инвазии /19/.
Дифференциальная диагностика МН с различными дерматозами и новообразованиями кожи представлена в табл.1.
К дифференциальной диагностике меланоцитарного невуса
| Форма МН | Дерматоз / опухоль кожи |
| Пограничный | Веснушки, лентиго простое, лентиго солнечное ( старческое), пятна типа « кофе с молоком», врожденный МН, пятнистый невус, пигментная ксеродерма, дисплстический невус, меланоз Дюбрея. |
| Смешанный | Себорейный кератоз, саркома Капоши |
| Внутридермальный | Дерматофиброма, вульгарная бородавка, трихоэпителиома, ювенильнавя ксантома, сирингома, контагиозный моллюск, добавочный сосок, пиогенная гранулема, нейрофиброма, акрохордон, базалиома кистозная |
| Врожденный | Диспластический невус, голубой невус, невус Беккера, бородавчатый эпидермальный невус, пятна цвета «кофе с молоком» |
| Диспластический невус | Врожденный МН, меланоз Дюбрея, невус Шпитца, базалиома пигментированная |
Наиболее подробно следует остановиться на дифференциальной диагностике МН с меланозом предраковым ограниченным Дюбрея и некоторыми формами меланомы.
Меланоз предраковый ограниченный Дюбрейля (син.: меланотическая веснушка Хатчинсона), в отличие от внутридермального МН, имеет более крупный (свыше 20мм) диаметр, неправильные очертания, неравномерную пигментацию; он возникает на открытых участках кожи (чаще на щеках у лиц пожилого возраста) и характеризуется медленным прогрессированием в меланому; при гистологическом исследовании выявляется структура меланомы in situ.
Акрально-лентигинозная меланома, в отличие от внутридермальногго МН, характеризуется бляшкой коричневого или черного цвета с нечеткими контурами, неравномерной окраски/2/.
Десмопластическая (амеланотическая) меланома, в отличие от внутридермального МН, выглядит как непигментированное пятно или папула, напоминающая шрам или рубец, а в фазе «вертикального роста» характеризуется плотным узлом, чаще развивается в области головы и шеи у лиц 6-7-го десятилетия жизни, может возникнуть в ассоциации с акрально-лентигинозной меланомой или de novo /14/; микроскопически состоит из веретенообразных клеток, расположенных между тонкими прослойками коллагена, которые часто сформированы в пучки.
Дифференциальную диагностику внутридермального МН с поверхностно распространяющейся и узловой формами меланомы проводят по правилу «ФИГАРО»:
Ф — форма. Для меланомы характерна выпуклая форма (что лучше всего видно при боковом освещении). Меланома in situ и акрально-лентигинозная меланома бывают плоскими.
И — изменение размеров. Ускорение роста- один из самых важных признаков меланомы.
Г- границы неправильные. Опухоль имеет «изрезанные» края.
А- асимметрия-одна половина опухоли не похожа на другую.
Р- размеры крупные (обычно более 6см)
О- окраска неравномерная — беспорядочно разбросанные коричневые, черные серые, розовые и белые участки/9/.
Наиболее подозрительными на меланому следует считать темно-коричневые и черные МН у людей со светлым цветом кожи. С подозрением нужно относиться и к МН с синюшными, красноватыми и белыми участками на поверхности. Однако, изменение окраски МН может быть обусловлено факторами, не связанными с его злокачественной трансформацией: беременностью, пубертатным периодом, приемом глюкокортикоидных гормонов, воздействием внешних факторов, включая солнечное облучение. В таких случаях все МН или МН той локализации, на которые воздействовали внешние факторы, меняются одновременно. Лишь изменения отдельного МН требуют онкологической настороженности.
При сборе анамнеза врач-дерматолог должен исключить и другие причины внезапного изменения МН, не связанные с его трансформацией в меланому. Так, внезапное изменение цвета, поверхности или размера при наличии боли, зуда, изъязвления и кровотечения, могут быть обусловлены формированием в МН кистозного расширения волосяного фолликула, эпидермальной кисты, развитием в нем фолликулита, а также травмой, кровоизлиянием, сдавливанием или тромбозом сосудов кожи. При подобных изменениях требуется динамическое наблюдение с серийным фотографированием элементов до тех пор, пока не пройдут последствия травмы или воспаления (обычно 7-10 дней), а в некоторых случаях требуется гистологическое исследование.
Из инструментальных методов исключения меланомы в настоящее время применяют эпилюминисцентную микроскопию — неинвазивный метод исследования образований кожи в специальной иммерсионной среде с помощью дерматоскопа, а также метод компьютерной диагностики, при котором зафиксированные с помощью цифровой видеокамеры изображения сохраняются в памяти компьютера и по определенным признакам сравнивается с имеющейся базой данных /1/.
Точность гистологической диагностики меланогенных опухолей кожи повышается при использовании метода «диагностической плоидометрии» /10/.
Лечебная тактика
Хотя в подавляющем большинстве случаев приобретенные МН не требуют лечения, при ряде условий оно все же предпринимается.
Показанием к иссечению обычных МН могут быть:
— желание пациента удалить его по косметическим соображениям, однако следует учитывать, что в гистологических препаратах «обезображивающих МН» часто выявляются атипичные клетки/25/;
— расположение в трудных для самоконтроля местах (волосистая часть головы, промежность и т.д.), это в первую очередь касается гиперпигментированных МН и при наличии в личном или семейном анамнезе ДН;
— наличие признаков атипии в МН: неравномерное распространение пигмента, зазубренность и нечеткость его границ, сравнительно крупный размеры ( более 5мм);
— атипичная эволюция МН, включая внезапное изменение размера и формы /13/;
— МН с наличием высокого риска озлокачествления (злокачественное лентиго, гигантский врожденный МН); ДН, в том числе в составе пятнистого МН; профилактическое удаление предотвращает возможность возникновения меланомы и при значительном количестве МН /25/;
-хотя особенности анатомического расположения не рассматриваются в качестве показания к удалению МН, тем не менее, интенсивно пигментированные МН акральной локализации в области конечностей, а также на слизистой оболочке следует удалять, также как и МН подногтевой области и конъюнктивы, поскольку возможность ДН такой локализации должна вызывать настороженность в отношении его трансформации в меланому /22/.
При частом повторном раздражении элемента его лучше удалить, чем пропустить меланому или другую злокачественную опухоль /11/; в то же время МН, находящиеся под ремнем, лифчиком, воротником можно не удалять в обязательном порядке, если они выглядят доброкачественно /25/;
Исходя из этого, МН может быть удален хирургически при: быстром изменении элемента, атипичной клинической картине, подозрительной на меланому, по косметическим показаниям, повторной травме элемента /13/.
Показанием к немедленному иссечению МН является наличие хотя бы одного из 7 признаков внезапного (в течение одного или нескольких месяцев) его изменения:
Удаление МН должно быть полным и проводиться хирургически с обязательным гистологическим исследованием. После частичного удаления МН репигментируется и рецидивирует, формируя псевдомеланому /23/. Другие методы удаления (электрокоагуляция, криодеструкция, дермабразия, лазер) при пигментированных образованиях кожи и слизистых оболочек не должны проводиться, т.к. не обеспечивают документальной верификации диагноза /12 /.
Приступая к лечению МН, следует учитывать, что при нерадикальном его удалении косметический исход зачастую непредсказуем, т.к. лечение может привести к развитию рецидива с менее благоприятными чем до лечения последствиями /25/.
Все мелкие врожденные МН, выглядящие необычно (неравномерная окраска, неправильные очертания и т.д.), подлежат хирургическому удалению до достижения больным возраста 12 лет. Гигантский врожденный МН удаляют как можно раньше. Для закрытия дефекта используют полнослойные кожный лоскуты. При больших размерах прибегают к экспандерной пластике или пластике местными тканями.
Лечение ДН должно проводиться онкологом.
Профилактика меланомы заключается в раннем и активном выявлении предмеланомных поражений (в первую очередь ДН и злокачественного лентиго), необходимости выделения пациентов с их наличием в «группу риска» с постоянным динамическим наблюдением за макроскопическими изменениями этих пятен.
Больные ДН должны быть проинформированы о признаках трансформации этих МН в меланому и самостоятельно регулярно контролировать характер отдельных элементов. Им рекомендуется избегать пребывания на солнце, использовать при выходе на улицу солнцезащитные кремы (Aнтгелиос XL60+).
В.А.Молочков
Московский областной научно-исследовательский клинический институт им М.Ф.Владимирского)
Молочков Владимир Алексеевич — доктор мед.наук, профессор, руководитель клиники дерматовенерологии и дерматоонкологии
1. Демидов Л.В., Харкевич Г.Ю. Маркина И.Т. и др. Меланома и другие злокачественные новообразования кожи/Энциклопедия клинической онкологи. Руководство для практических врачей /М.И.Давыдов и др.-М.:РЛС-2005.-С.341-364;
2. Борисова Г.Н., Кудрявцева Г.Т. //Вестн. дерматол.-2006.-№3.-С.43-45;
3. Дерматоонкология /Под ред. Г.А.Галил-оглы и др.-Медицина для всех-2005;
4. Макин И.Л.. Пшенистов К.П. Избранные вопросы пластической хирургии-1999.-№1-Ярославль-ДИА-пресс;
5. Молочков В.А. //Эстетическая медицина-2005.-№3-С.266-270;
6. Молочков В.А. //Российский журнал кожных и венерических болезней-1998.-№2.-С.68-76;
8. Пальцев М.А., Потекаев Н.Н., Казанцева И.А. и др. Клинико-морфологическая диагностика заболеваний кожи (атлас)-М.:Медицина-2004;
9. Фицпатрик Т., Эллинг Д.Л. Секреты дерматологии /Пер. с англ.-М.С-Пб- БИНОМ-Невский диалект-1999;
11. Чиссов В.И., Романова О.А., Моисеев Г.Ф. Ранняя диагностика меланомы. — М.: Юлана Трейд, 1998;
12. Anderson R.G. //Select. Read. Plast. Surg.-1992.-Vol.7.-P.1-35;
13. Barnhill R.L., Lewellin K. Benigh Melanocytic Neoplasm /In: Dermatology /Ed. J.Bolognia et al.-Mosby-Edinburg-2003.-P.1757-1787;
14. Barnbill R.L., Mihm M.C. Histopathology and precursor lesions /In: Cutaneous melanoma, 3ed/Ed. C.M. Balch et al.-St.Louise, Quality Medical.-1998.-P.103-133;
15. Bhawan J.//Cutan Pathol.-1979.-Vol.6.-P.153;
16. Bogdan I., Smolle J., Kerl H. et al.//Melanoma Res.-2003.-Vol.13.-P.213-217:
17. Сlemente C., Zurrida S., Bartoli D. et al. //Histopathology-1998.-Vol.27.-P.549-555;