мембранная экспрессия в опухолевых клетках что это такое
Диагностика экспрессии PD-L1
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
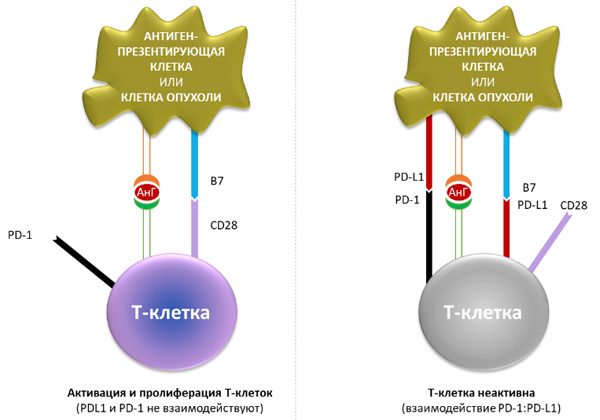
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.
Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
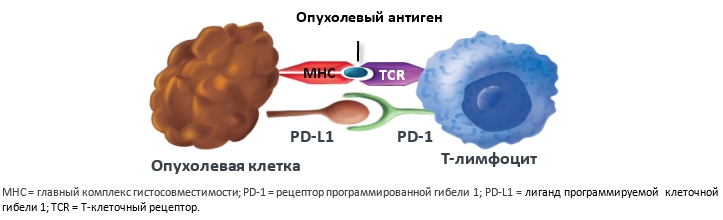
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
НМРЛ: методы определения экспрессии PD-L1
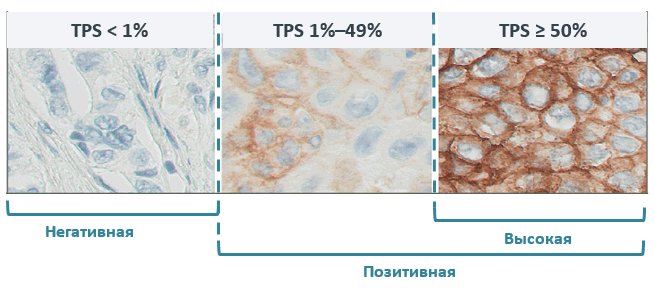
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
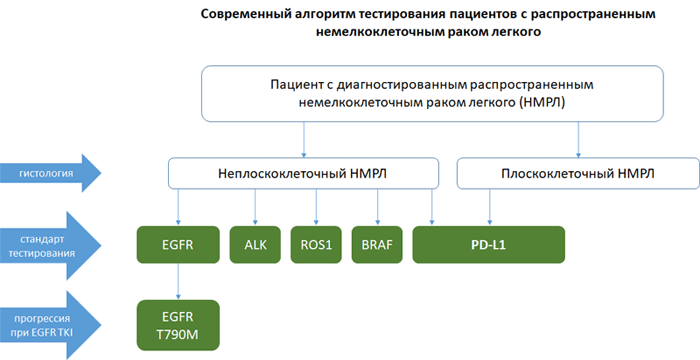
Алгоритм тестирования при распространенном НМРЛ
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
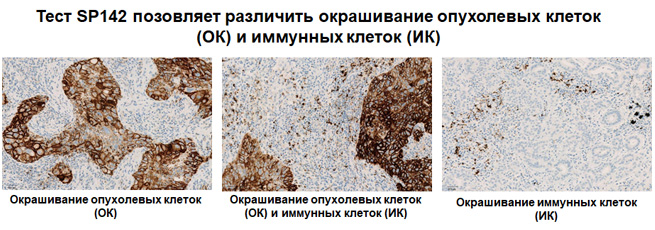
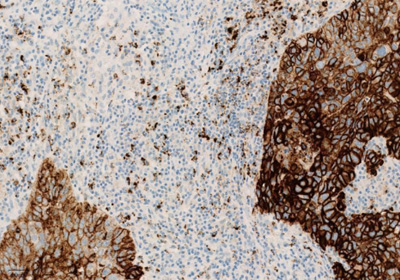
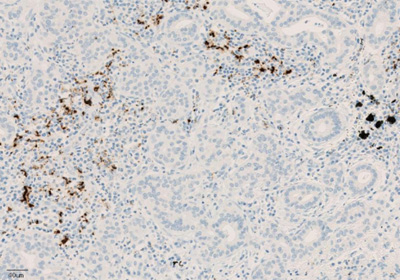
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Мембранная экспрессия в опухолевых клетках что это такое
PD-L1− это химическое вещество, лиганд, экспрессируемый опухолевыми клетками. На поверхности иммунокомпетентных клеток (Т-лимфоцитов) присутствует белок PD-1 (сокр. от Programmed cell Death-1). Когда Т-лимфоцит пытается прикрепиться к раковой клетке, чтобы разрушить ее, протеин PD-1 связывается с имеющимся на ее поверхности лигандом PD-L1. В результате функционирование иммунных клеток ингибируется: тормозится пролиферация, не происходит выделение цитокинов, губительных для злокачественных клеток. Таким образом, раковая опухоль отражает иммунную атаку и продолжает свой дальнейший рост. Оценка уровня экспрессии молекулы PD-L1 рассматривается как потенциальный биомаркер прогноза эффективности и продолжительности лечения злокачественных новообразований.
Лиганд PD-L1, лиганд рецептора программируемой клеточной смерти 1.
Какой биоматериал можно использовать для исследования?
Образец ткани (в парафиновом блоке).
Общая информация об исследовании
В онкологии иммуногистохимическое исследование помогает выявить молекулярные структуры опухолевых клеток, ассоциированные со степенью дифференцировки, способностью их к инвазии и метастазированию, чувствительностью к химиотерапии, иммунотерапии, с особенностями течения и прогнозом заболевания у конкретного пациента; определить источник метастазирования при невыясненном первичном очаге, прогноз опухолевого процесса на дооперационном этапе и коррекцию схемы лечения; выбрать адекватную патогенетическую и таргетную терапию, определить наличие в опухолевых клетках различные точки приложения.
Доказано, что антитела к белкам PD-1 и PD-L1 борются с раком путем высвобождения Т-клеток организма, особого типа иммунных клеток. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Не так давно исследователи обнаружили, что раковые клетки научились использовать эту иммунную защиту для своих собственных целей. Опухолевые клетки разворачивают производство PD-L1-белков, которые распознаются PD-1-рецепторами, ингибируя атаку Т-клеток на опухоли. Больные раком лечатся антителами, блокирующими PD-1-рецепторы или фиксирующимися на обязательном партнере PD-L1, чтобы выключить «противоуничтожающий» сигнал и позволить Т-клеткам атаковать.
Также было обнаружено, что активация PD-1 ингибирует антираковую активность других иммунных клеток, макрофагов, и, когда PD-1 или PD-L1 рецепторы блокируются антителами, это заставляет эти макрофагиальные клетки атаковать рак.
В современной онкологии иммуногистохимическое исследование, в частности определение рецептора PD-L1 в ткани опухоли, играет важнейшую роль, так как при помощи этого онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Заключение о позитивности/негативности опухоли по рецептору PD-L1.
Избыточная экспрессия PD-L1 выявляется в клетках более чем 50% опухолей человека, причем наиболее характерна для следующих новообразований:
— глиобластома и смешанная глиома (в 100% случаев),
— назофарингеальная карцинома (68-100%),
— множественная миелома (93%),
— опухоли мочевого пузыря (28-100%),
— немелкоклеточный рак легкого (35-95%),
— аденокарцинома кишечника (53%),
— гепатоцеллюлярная карцинома (45-93%),
— рак поджелудочной железы (39%),
— злокачественные опухоли желудка и пищевода (42%).
Повышенная экспрессия PD-L1 в опухоли ассоциирована с неблагоприятным прогнозом при различных типах рака, включая рак почки, рак мочевого пузыря, рак пищевода, рак желудка, рак поджелудочной железы, рак печени, рак яичников.
Кто назначает исследование?
Исследование PD-L1
Для чего определяют PD-L1 и при каких опухолях?
Иммунотерапия является достаточно эффективным инструментом в борьбе с опухолями, особенно на поздних стадиях. Определять наличие PD-L1 в опухолевых клетках нужно заранее, чтобы узнать, будет ли работать терапия моноклональными антителами или нет.
Экспрессию PD-L1 определяют при:
В зависимости от уровня экспрессии PD-L1, результат может быть:
Что такое Т-лимфоциты и как они связаны с PD-L1?
Т-лимфоциты- это специальные клетки, которые уничтожают клетки-мишени (опухолевые, мутированые и др.), регулируют иммунный ответ. В том числе, они формируют иммунную память.
На поверхности Т-лимфоцитов есть белок PD1, который является рецептором.
На поверхности других клеток (как иммунных так и опухолевых) есть специальные молекулы (лиганды), в данном случае они называются PD-L1 и PD-L2. Эти структуры подходят друг к другу как “ключ и замок”.
Когда происходит их взаимодействие, “ключ вошел в замок”, Т-лимфоциты прекращают образовываться, снижается их активность и выживаемость. В ходе чего они перестают осуществлять свои основные функции защиты.
Поэтому этот путь PD1 — PD-L1 очень важен в противоопухолевом, трансплантационном иммунитете, аллергии и различный иммунопатологических состояниях.
Опухолевые клетки научились использовать этот механизм в свою пользу, чтобы обмануть иммунитет. Они “вооружаются” большим количеством PD-L1 и PD-L2, которые связываются с Т-лимфоцитами, тем самым активируют путь “обмана”. В ходе данной реакции иммунитет перестает видеть опухолевые клетки.
Иммунотерапия и PD-L1
В современной онкологии имеется понятие иммунотерапии рака.
В 2014 году были одобрены определенные препараты (моноклональные антитела), которые влияют на данный путь. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету «увидеть» опухоль и уничтожить её. Доказано, что антитела к белкам PD1 и PD-L1 борются с раком путем высвобождения Т-клеток организма. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Как происходит исследование?
Нужно предоставить материал, который может быть биопсийным или операционным, в лабораторию UNIM. После чего он будет исследован методом иммуногистохимии.
Одним из обязательных условий является наличие достаточного материала (не менее 100 опухолевых клеток), чтобы адекватно оценить результат.
В ходе проведения исследования реакция будет оценена компетентным врачом-патоморфологом, после чего будет дан ответ.
Вести науки
Экспрессия PD-L1 связана с худшей выживаемостью при злокачественной мезотелиоме плевры
В настоящее время существует необходимость выявления прогностических биомаркеров для разработки подхода к лечению злокачественной мезотелиомы плевры (ЗМП), основанного на определении риска. Экспрессия лиганд‑1 программируемой гибели клеток (PD-L1) изучалась как прогностический биомаркер в ряде опухолей, учитывая его важную роль в уклонении от противоопухолевого иммунного ответа. В четырех ранее опубликованных анализах было обнаружено, что позитивность PD-L1 является неблагоприятным прогностическим фактором выживания при ЗМП. Это исследование направлено на дальнейшее изучение взаимосвязи между экспрессией PD-L1 в тканях мезотелиомы и результатами выживания.
Были проанализированы клинические данные пациентов ЗМП из одного учреждения в период с 2006 по 2016 год). Позитивность PD-L1 определялась как >1% мембранного окрашивания, независимо от интенсивности.
Были проанализированы данные пятидесяти восьми пациентов. Средний возраст составил 73 года, большинство из них были мужчинами (49, 84%) и имели ECOG между 0 и 2 (46, 79%). Наиболее распространенным гистопатологическим подтипом был эпителиоид (42, 72%), двухфазный подтип (9, 16%) и саркоматоид (7, 12%). Тридцать один пациент (53%) получил лучший поддерживающий уход, а двадцать семь пациентов (47%) получили химиотерапию или комбинированное лечение. Сорок два пациента (72,4%) имели положительную экспрессию PD-L1. Среднее время выживания для группы отрицательного PD-L1 составило 15,5 месяца и 6 месяцев для группы положительного PD-L1. Положительная экспрессия PD-L1 независимо коррелирует с худшим прогнозом (ОР = 2,02, 95%ДИ, 1,005-4,057, p = 0,0844).
Анализ показал более высокий процент пациентов с ЗМП с положительным PD-L1 (> 1%) по сравнению с другими исследованиями. Высокая положительная экспрессия PD-L1 ассоциировалась со статистически значимо более низким средним временем выживания.
Источник: PubMed
Nguyen BH1, Montgomery R2,3, Fadia M2,3, Wang J4, Ali S1,3.
PD-L1 expression associated with worse survival outcome in malignant pleural mesothelioma. // Asia Pac J Clin Oncol. 2018 Feb;14(1):69-73. doi: 10.1111/ajco.12788. Epub 2017 Nov 3.
Мембранная экспрессия в опухолевых клетках что это такое
Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия
Введение
Появление новых иммуноонкологических препаратов открыло новые возможности в лечении пациентов с диссеминированными онкологическими заболеваниями. Внедренные в клиническую практику ингибиторы контрольных точек (ИКТ) продемонстрировали высокую эффективность и приемлемую токсичность не только в лечении распространенных форм сóлидных опухолей (преимущественно меланомы кожи, немелкоклеточного рака легкого – НМРЛ, рака почки), но и в адъювантом режиме [1, 2].
В настоящее время активно исследуется роль неоадъювантной иммунотерапии. Несмотря на значительное улучшение общей выживаемости (ОВ) при использовании ИКТ, их эффективность все еще остается ограниченной для широкого применения разными категориями пациентов.
От 50 до 60% пациентов обладают первичной резистентностью к терапии ИКТ. Первичная или адаптивная резистентность характеризуется нарушениями сигнальных механизмов, утратой экспрессии главного комплекса гистосовместимости (HLA) и др. К внешним механизмам резистентности относят иммунные контрольные точки, утрату активности Т-лимфоцитов, высвобождение цитокинов и их метаболитов в опухолевом микроокружении. Использование биомаркеров позволит эффективнее применять иммуноонкологические препараты с целью преодоления устойчивости опухоли к иммунному надзору организма [3].
Немаловажным вопросом в современной онкологии является дилемма выбора между вариантами лекарственной терапии. Например, проблемы выбора в адъювантной терапии распространенной BRAF-позитивной меланомы кожи. Таргетная или иммунотерапия принесет больше пользы конкретному пациенту? Существуют ли предиктивные биомаркеры, способные помочь нам решить этот вопрос?
Количество исследованных биомаркеров, которые могут быть потенциально использованы в качестве предиктора ответа на иммунотерапию, увеличивается, тем не менее убедительной доказательной базой обладают только некоторые из них. В настоящее время назначение ИКТ иммунного ответа большинству пациентов основывается на уже показавших свою эффективность биомаркерах, таких как экспрессия PD-L1, микросателлитная нестабильность и наличие дефектов репарации ДНК (MSI/dMMR). Однако, даже несмотря на наличие предиктивных факторов, в ряде случаев иммунотерапия оказывается неэффективной.
Таким образом, поиск универсальных маркеров, предсказывающих ответ на терапию современными иммуноонкологическими препаратами, остается приоритетной задачей, что подтверждается все бóльшим числом исследований по изучению различных молекулярных факторов.
В данной статье рассмотрены как биомаркеры, уже показавшие свою эффективность и применяемые в клинической практике, так и биомаркеры, проходящие апробацию в клинических исследованиях с высоким потенциалом.
PD-L1-экспрессия
Физиологическая роль сигнального пути PD-1 заключается в предотвращении развития чрезмерно сильного иммунного ответа на собственный тканевой антиген. При активации рецептора PD-1 его специфическими лигандами (PD-L1, PD-L2) запускаются процессы апоптоза цитотоксических лимфоцитов. Таким образом, взаимодействие PD-1/PD-L1 в естественных условиях необходимо для предотвращения гиперактивации иммунной системы в ответ на проникновение чужеродного агента и ограничения повреждения клеток в результате развития иммунного ответа. Связь PD-L1-лиганда с его рецептором PD-1 ингибирует сигнал на опухолевых клетках и клетках опухолевого микроокружения, тем самым приводит к увеличению иммуносупрессивного эффекта и способствует подавлению противоопухолевого иммунного ответа [4].
Экспрессия PD-L1 в опухолевом микроокружении коррелирует с позитивным ответом на ИКТ в лечении больных меланомой кожи, НМРЛ и др. При раке желудка вместе с микросателлитной нестабильностью уровень PD-L1-экспрессии служит предиктором ОВ. Изучаются различные механизмы активации экспрессии PD-L1 и ее связь с агрессивным фенотипом некоторых опухолей, в т.ч. при редких неблагоприятных гистологических формах и висцеральных метастазах, как это показано для рака предстательной железы. Вместе с тем гиперэкспрессия PD-L1 в опухолевых клетках служит одним из ключевых механизмов феномена «ускользания» опухоли от противоопухолевого иммунного надзора и может быть предиктором агрессивного фенотипа при некоторых типах опухоли [5].
Экспрессию PD-L1 определяют с помощью иммуногистохимического (ИГХ) метода. Одним из наиболее важных вопросов как для онкологов, так и для патоморфологов считается возможный алгоритм оценки экспрессии PD-L1 с целью определения чувствительности опухолевых клеток к PD-1-ингибиторам:
Для других сóлидных опухолей этот алгоритм достоверно не установлен и требует дальнейшего изучения. Остается неопределенным и оптимальное пороговое значение данного биомаркера как предиктора ответа на иммунотерапию, что диктует необходимость дальнейших исследований.
Пембролизумаб остается единственным ИКТ иммунного ответа, утвержденным в качестве первой линии монотерапии пациентов с уровнем экспрессии PD-L1(+) 50% или выше, по данным исследования KEYNOTE-024 [7]. Результаты исследования KEYNOTE-042 продемонстрировали значительное увеличение ОВ в группе терапии пембролизумабом по сравнению с химиотерапией на основе платины не только пациентов с экспрессией PD-L1≥50%, но и в группе пациентов с PD-L1(+)>20% [8].
При анализе клинических исследований, на которых базировалось FDA (Food and Drug Administration) при утверждении иммуноонкологических препаратов, выявлено, что предиктивная роль PD-L1 была установлена только в 28,9% случаев. Основываясь на уровне экспресии PD-L1, ряд иммунотерапевтических препаратов получил регистрацию в следующих нозологиях: рак мочевого пузыря (атезолизумаб, пембролизумаб, дурвалумаб), НМРЛ (пембролизумаб), трижды негативный рак молочной железы (атезолизумаб+nab-паклитаксел), рак шейки матки (пембролизумаб) и рак желудка (пембролизумаб). Пороговые значения PD-L1 были переменными как внутри, так и между типами опухолей и составляли 1%, 5 и 50% [9]. Таким образом, экспрессия PD-L1 остается одним из немногих биомаркеров, основываясь на результатах которого мы назначаем иммуноонкологические препараты пациентам с различными сóлидными опухолями (НМРЛ, рак мочевого пузыря, рак шейки матки и др.).
MSI/dMMR
Следствием повышенной частоты возникновения мутаций в геноме является микросателлитная нестабильность (MSI), в первую очередь связанная с нарушением системы репарации ДНК. В опухолевых клетках появляются дополнительные аллели микросателлитов, которые по длине отличаются от аллелей в нормальных тканях. Это возникает при изменении длины микросателлитных последовательностей в результате делеции или вставки нескольких нуклеотидов. Ранние результаты исследований показали, что большинство случаев MSI – это спорадический колоректальный рак (КРР), вызванный эпигенетической инактивацией экспрессии генов у потомства из-за метилирования промотора hMLH1 без мутации гена, а меньшая часть связана с развитием наследственных синдромов, таких как, например, синдром Линча. Синдром Линча – это аутосомнодоминантный синдром, возникающий за счет инактивирующих мутаций в генах репарации неспаренных оснований ДНК (MLH1, MSH2, значительно реже – MSH6, PMS2 и др.) [10].
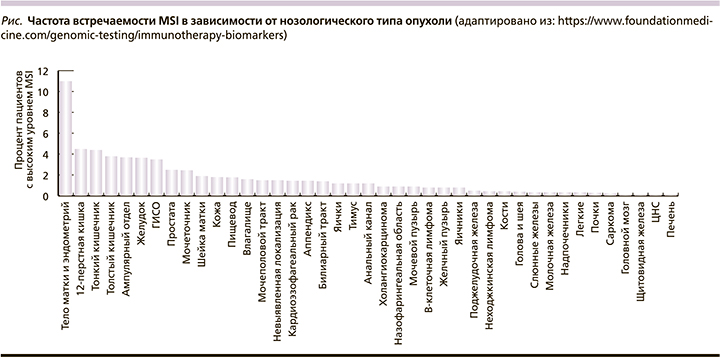
Опухоли с MSI или дефицитом репарации ДНК (dMMR) характеризуются высокой мутационной нагрузкой, массой неоантигенных эпитопов, обильной инфильтрацией цитотоксических CD8+-Т-лимфоцитов, что может служить объяснением более высокой эффективности иммунотерапии в данной когорте больных. Частота встречаемости MSI варьируется в зависимости от нозологического типа опухоли (см. рисунок).
Анализ на MSI может быть выполнен посредством нескольких методик: полногеномное секвенирование, полимеразная цепная реакция (ПЦР) с капиллярным электрофорезом, ИГХ и др. Однако «золотым» стандартом признана именно ПЦР с капиллярным электрофорезом с точностью до 100% [10, 11].
Ранние исследования ИКТ у пациентов с КРР показали, что значительное число больных резистентны к терапии анти-PD-1/PD-L1-ингибиторами. Однако подгруппа пациентов с высоким уровнем MSI-H оказалась тесно связанной с высокой экспрессией PD-1/PD-L1 и продемонстрировала длительные ответы при терапии ингибиторами PD-1. Исследования с изучением других типов рака с фенотипом MSI-H были сходными [12].
Регистрация пембролизумаба для лечения больных с высоким уровнем MSI была основана на анализе данных пяти клинических исследований.
В анализ одного из них были включены 149 пациентов с MSI-Н или наличием dMMR, 90 из них – пациенты с КРР и 59 пациентов с другими нозологическими формами. Среди всех пациентов частота общего ответа (ЧОО) составила 39,6% (48 – частичный ответ [ЧО] и 11 – полный ответ [ПО]). Длительность ответа среди 78% респондентов составила от 6 месяцев и более. Частота общего ответа (ОО) равнялась 36% у пациентов с КРР и 46% у пациентов с другими типами опухоли [9]. В более позднем клиническом исследовании II фазы CheckMate-142 у пациентов с метастатическим КРР и высоким уровнем MSI подтверждена противоопухолевая эффективность другого моноклонального антитела, направленного на PD-1, – ниволумаба. Общая частота ответа на лечение ниволумабом в группе из 74 пациентов с MSI-H составила 31,1%, медиана выживаемости без прогрессирования (ВБП) заболевания – 9,6 месяца, безрецидивная выживаемость в течение года – 48,4% [13].
Таким образом, в настоящее время становится понятным, что MSI является предиктивным маркером ответа на иммунотерапию при многих типах опухолей вне зависимости от гистологического подтипа, что во многом основано на генетическом многообразии опухолевой клетки.
Мутационная нагрузка опухоли (TMB от англ. Tumor Mutational burden) – это число мутаций, содержащихся в одной мегабазе кодирующего генома опухолевых клеток. Мутационная нагрузка анализируется с помощью полноэкзомного или полногеномного секвенирования биопсийного или парафинизированного материала, полученного из опухолевого образца пациента. Высокий уровень ТМВ ассоциируется с высокой экспрессией неоантигенов, которые распознаются иммунной системой в опухолевой клетке как чужеродные (трансплантационные) тканевые антигены.
За последние несколько лет проведено много исследований, в ходе которых установлено, что самые высокие уровни TMB определяются при таких заболеваниях, как меланома, НМРЛ, другие плоскоклеточные карциномы. Рак молочной железы, рак почки и рак яичников характеризуются промежуточными уровнями TMB. При этом среди пациентов с НМРЛ наблюдается высокая степень вариабельности уровня TMB, обусловленная наличием такого фактора, как курение. Кроме того, показано, что повышение эффективности ИКТ, ассоциированное с увеличением ОВ и ВБП, наблюдается у пациентов с высоким уровнем TMB. Подгрупповой анализ подтвердил, что наибольшую прогностическую ценность TMB показала при НМРЛ и меланоме [14].
Связь между MSI и TMB достаточно сложная и не имеет линейной зависимости, в то время как экспрессия PD-1 позволяет прогнозировать эффективность иммунотерапии вне зависимости от TMB, однако в совокупности они обладают гораздо большей прогностической ценностью [15].
По данным исследования CheckMate026 (иммунотерапия НМРЛ) выявлено, что среди пациентов с высоким уровнем TMB ЧОО была выше в группе ниволумаба по сравнению с группой химиотерапии (47% против 28), а ВБП заболевания была более длительной (медиана 9,7 против 5,8 месяца); коэффициент риска для прогрессирования заболевания или смерти составил 0,62 (95% доверительный интервал [ДИ] от 0,38 до 1,00). ОВ была сопоставимой между изучаемыми группами пациентов вне зависимости от уровня TMB. Связь между TMB и уровнем экспрессии PD-L1 не была обнаружена. Однако в группе пациентов, получавших иммунотерапию с высоким уровнем TMB и экспрессией PD-L1≥50%, ЧОО была значительно выше (75%) по сравнению с пациентами, имевшими один из этих факторов (32% среди пациентов только с высокой опухолевой нагрузкой и 34% среди тех, у кого уровень экспрессии PD-L1 составлял ≥50%) [16].
Изучение влияния двух ключевых биомаркеров (уровень экспрессии PD-L1 и TMB) продолжено в исследовании CheckMate-227 (ниволумаб+ипилимумаб в лечении распространенного НМРЛ). Комбинированная иммунотерапия показала свои преимущества в когорте пациентов с уровнем TMB>10 мут/мб в увеличении ВБП. Показатели однолетней выживаемости достигли 45% по сравнению с 8% в группе химиотерапии. Медиана ВБП составила 7,7 месяца по сравнению с 5,3 – в группе пациентов, получавших химиотерапию. В качестве вторичной контрольной точки оценивалась ОВ в зависимости от уровня экспрессии PD-L1 и TMB. В исследуемых группах статистически значимого различия не установлено [17].
Использование TMB в качестве рутинного предиктивного биомаркера в настоящее время невозможно. Даже, несмотря на то что большинство исследований показало, что высокий уровень TMB можно интерпретировать как положительный прогностический фактор у пациентов, получающих ИКТ, установление точного порогового значения уровня TMB все еще остается сложной задачей, которую следует выполнять до внедрения данного биомаркера в клиническую практику. Тем не менее первые шаги в этом направлении уже сделаны группой FoundationMedicine – уровни TMB разграничены следующим образом: высокий >20 мут/мб, средний – 6–19 и низкий 2,0 связано со снижением ОВ у пациентов с меланомой II стадии [20]. Уровень НЛИ >3,36 является независимым предиктором увеличения частоты смертности от рака молочной железы [21]. Кроме того, установлено, что НЛИ служит предиктором плохого ответа не только на иммунотерапию, но и на другие стандартные методы лечения онкологических заболеваний, такие как химио- и лучевая терапия.
По данным мета-анализа по оценке прогностической роли НЛИ у больных метастатическими формами рака (в исследование включены 40 559 пациентов) установлено, что повышение уровня НЛИ ассоциировано с уменьшением ОВ у большинства сóлидных опухолей. Несмотря на попытки авторов установить оптимальное значение данного индекса (медиана индекса – 4,0), оказалось, что для каждого типа заболевания НЛИ различен и установить общее пороговое значение становится невозможным. Вместе с тем очевидно, что более высокие значения НЛИ будут предвестником худшего прогноза, чем более низкие [22].
Данные выводы связаны с тем, что воспаление играет важную роль в прогрессировании опухолевого процесса. Нейтрофилы способны продуцировать ряд хемокинов и цитокинов, подавляющих активность лимфоцитов и натуральных клеток-киллеров. Взаимодействие опухолевых клеток с нейтрофилами вызывает воспалительный ответ, что приводит к пролиферации, инфильтрации и метастазированию опухолевых клеток. Как показатель воспаления и противоопухолевого иммунного ответа НЛИ в крови играет ключевую роль на различных стадиях заболевания. Высокий НЛИ указывает на повышение концентрации цитокинов, участвующих в системном воспалительном ответе, например, таких, как TGF-β, который может усиливать иммуносупрессию, ангиогенез и образование перитуморальной стромы. Более того, он может способствовать увеличению числа нейтрофилов и уменьшению числа лимфоцитов. Кроме того, некоторые исследования показали, что лимфопения была связана с иммуносупрессией, которая в свою очередь была предиктором первичной лимфоидной инфильтрации опухоли [23].
Циркулирующая опухолевая ДНК (цоДНК)
Исследование внеклеточной ДНК у онкологических больных началось во второй половине XX столетия и продолжается по сей день. Наличие фрагментированных частей опухолевой ДНК в крови может быть объяснено высвобождением ДНК из ядра опухолевой клетки в процессе клеточной смерти (апоптоз и некроз) или активным высвобождением из живых опухолевых клеток. Количество опухолевой ДНК в периферической крови зависит от опухолевой массы в организме пациента: с увеличением объема опухоли одновременно нарастает и число опухолевых клеток, подвергшихся апоптозу и некрозу, что в свою очередь увеличивает количество цоДНК.
В настоящее время существует два базовых подхода к определению цоДНК для ее использования в качестве биомаркера опухолевого процесса. При одном из них изначально определяются генетические аберрации, присутствующие в опухоли пациента (т.е. требуется предварительное проведение рутинной биопсии), после чего среди циркулирующей ДНК ведется поиск фрагментов, которые содержат выявленные в биоптате опухоли генетические изменения. При альтернативном подходе с этой же целью используют заранее определенный набор мутаций, характерных для данного типа опухолей без предварительного анализа опухолевой ткани конкретного пациента. Число методик, которые позволяют определить цоДНК в крови пациента, увеличилось с ростом технологического прогресса: секвенирование нового поколения (NGS – next generation sequencing), персонализированный анализ реаранжировки окончаний (PARE – personalized analysis of rearranged ends), цифровое кариотипирование, цифровая капельная ПЦР и др. [24–26].
Ряд ранних исследований продемонстрировал, что высокий уровень циркулирующих опухолевых ДНК на фоне терапии ингибиторами PD-1 ассоциирован с худшим ответом на лечение и ухудшением как ОВ, так и ВБП у пациентов с меланомой.
В дополнение: у 9 пациентов выявлено псевдопрогрессирование опухолевого процесса. Во всех случаях псевдопрогрессирования циркулирующая опухолевая ДНК не обнаружена. Напротив, у 20 пациентов с истинным прогрессированием только у 2 был неблагоприятный профиль экспрессии данного маркера, остальные же демонстрировали высокий уровень цоДНК [26].
По данным последних исследований, циркулирующая опухолевая ДНК обладает сильным прогностическим значением и может служить маркером рецидива заболевания при многих типах опухолей после первичного радикального лечения. Анализ циркулирующей ДНК проводился методом «глубокого секвенирования» (CAPP-Seq) для 218 образцов, полученных от 65 пациентов после химиолучевой терапии по поводу местнораспространенного НМРЛ, из них 28 пациентов получали консолидирующую иммунотерапию. Пациенты, у которых циркулирующая опухолевая ДНК после химиолучевой терапии не была обнаружена, имели хорошие результаты независимо от того, получали ли они поддерживающую терапию, или нет. Напротив, у пациентов с циркулирующей опухолевой ДНК из группы высокого риска (наличие циркулирующей опухолевой ДНК после первичного лечения), которые получали консолидирующую иммунотерапию, отдаленные результаты лечения были значительно лучше, чем у пациентов, ее не получавших. Кроме того, наблюдая за динамикой данного биомаркера, уже на предварительном этапе можно предположить, как пациенты ответят на иммунотерапию. Результаты исследования показывают, что терапия ИКТ в консолидирующем режиме улучшает отдаленные результаты лечения для пациентов с НМРЛ и наличием циркулирующих опухолевых ДНК [27].
Таким образом, циркулирующая опухолевая ДНК ассоциирована с высоким уровнем TMB и может служить предиктором ответа на иммунотерапию, а также может быть использована с целью дифференциальной диагностики между псевдопрогрессированием и истинным прогрессированием [26]. Однако внедрение данного биомаркера в клиническую практику сдерживается отсутствием стандартных методов анализа цоДНК и их высокой стоимостью.
Биомаркеры, требующие более детального изучения и проведения большего количества рандомизированных исследований
Опухоль-инфильтрирующие CD8+-T-лимфоциты (TILs – Tumor Infiltrating Lymphocytes) способны распознавать опухолевые антигены и осуществлять прямой лизис клеток-мишеней. Однако, по данным многих авторов, эти клетки находятся в дремлющем состоянии и активируются под влиянием специфической противоопухолевой терапии [28]. Согласно рекомендациям международной рабочей группы по изучению TILs, исследование проводят на окрашенных гематоксилином и эозином срезах образцов опухолевой ткани толщиной 4–5 мкм, сделанных из парафиновых блоков, что подчеркивает доступность материала для исследования. В настоящее время существуют данные о том, что важно не столько наличие выраженной лимфоидной инфильтрации, сколько соотношение CD8+/CD4+-клеток (эффекторы/хелперы), ввиду того что CD8+-T-лимфоциты могут утрачивать способность обеспечивать полноценный иммунный ответ в отсутствие поддержки CD4+-клеток [29].
В ранних исследованиях опухоль-инфильтрирующие Т-лимфоциты уже показали свою прогностическую значимость при многих сóлидных опухолях, таких как меланома кожи, КРР, рак молочной железы и др. [28–30].
P.C. Tumeh et al. (2014) установили предиктивную ценность данного биомаркера и показали, что присутствие CD8+-Т-лимфоцитов было связано с высокой экспрессией PD-1/PD-L1 и коррелировало с увеличением ЧОО у пациентов с меланомой кожи на терапию ИКТ. Увеличение CD8+-TILs от исходного уровня после терапии анти-PD-1-ингибиторами также служило благоприятным признаком и ассоциировано с лучшими и более длительными ответами на лечение [31].
Ряд авторов описывают важную роль микробиома кишечника как компонента формирования иммунного ответа. Бóльшая часть исследований по определению предиктивной и прогностической роли кишечного микробиома выполнена на мышиных моделях. Несколько исследований людей показали, что различный состав кишечной микробиоты по-разному ассоциирован с ответом на ИКТ. Пациенты с меланомой кожи, чья исходная микробиота была обогащена Faecali bacterium и Firmicutes, имели лучшие показатели ОВ и ВБП по сравнению с группой больных, чья исходная микробиота была обогащена бактериоидами после монотерапии CTLA-4-ингибитором [33, 34]. По данным ретроспективного анализа 568 пациентов с местнораспространенной и метастатической меланомой кожи, пациенты, получавшие антибактериальную терапию за 3 месяца до начала иммунотерапии, обладают худшими показателями ОВ по сравнению с группой больных, не получавших антибактериальной терапии (медиана ОВ составила 27,4 против 43,7 месяца). Также в группе пациентов, получавших антибактериальную терапию, отмечена более высокая частота развития иммуноопосредованного колита по сравнению с контрольной группой (частота встречаемости явления в течение 1 года 9,8% против 4,6) [35].
В исследовании COMBI-AD изучалась эффективность таргетной терапии в адьювантном режиме у пациентов с местнораспространенной BRAF-позитивной меланомой кожи. В качестве предиктивного маркера исследователями были выбраны ТМВ и интерферон-γ. Установлено, что у пациентов с высоким уровнем ТМВ и интерферона-γ ВБП значительно ниже, чем в группе пациентов с низкой экспрессией. Это может послужить основанием для оптимального выбора режима адъювантной терапии в данной когорте больных: при низкой экспрессии данных маркеров предпочтительнее таргетная терапия, при высоком – иммунотерапия [36].
Заключение
Проблема поиска предиктивных и прогностических биомаркеров в иммуноонкологии стоит достаточно остро. Универсальных маркеров нет. В настоящее время изучается широкий спектр потенциальных биомаркеров, большинство из которых основано на опухолевой ткани. Предиктивная и прогностическая роль таких маркеров, как экспрессия PD-L1, MSI и TMB, достаточно высока, что демонстрируется во многих рандомизированных клинических исследованиях. Высокий уровень TMB и экспрессии PD-L1 достоверно демонстрирует увеличение ЧОО и ОВ при терапии ИКТ.
Роль других биомаркеров и их связь с имеющимися более чувствительными маркерами еще предстоит установить в клинических исследованиях. Основной проблемой таких исследований является гетерогенность изучаемой популяции. Прогностическая ценность биомаркера может варьироваться даже внутри нозологических подтипов одной локализации (акральная меланома, увеальная меланома, меланома кожи), что установлено в подгрупповом анализе. Пороговое значение определенного биомаркера при различных нозологиях может также сильно различаться, что затрудняет его применение в рутинной клинической практике. Также стоит отметить, что для некоторых биомаркеров, уже ставших рутинными, например, экспрессия PD-L1, MSI, существуют разные методы оценки пороговых значений, что следует учитывать при анализе результатов. Принимая во внимание все изложенное, становится понятной целесообразность проведения дальнейших клинических исследований по изучению предиктивных и прогностических маркеров в иммуноонкологии.
Литература
1. Madorsky Rowdo F.P., Baron A., Urrutia M., Mordoh J. Immunotherapy in cancer: a combat between tumors and the immune system; you win some, you lose some. Front Immunol. 2015;6:127. Doi: 10.3389/fimmu.2015.00127.
2. Romano E., Kusio-Kobialka M., Foukas P.G., et al. Ipilimumab-dependent cell-mediated cytotoxicity of regulatory T cells ex vivo by nonclassical monocytes in melanoma patients. Proc Natl Acad Sci USA. 2015;112:6140–45. Doi: 10.1073/pnas.1417320112.
3. Sharma P., et al. Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy. Cell. 2017;168(4):707–23. Doi: 10.1016/j.cell.2017.01.017.
4. Qin W., Hu L., Zhang X., et al. The Diverse Function of PD-1/PD-L Pathway Beyond Cancer. Front. Immunol. 2019;10:2298. Doi: 10.3389/fimmu.2019.02298.
5. Patel S.P., Kurzrock R. PD-L1 Expression as a Predictive Biomarker in Cancer Immunotherapy. Mol Cancer Ther. 2015;14(4):847–56. Doi: 10.1158/1535-7163.MCT-14-0983.
6. Особенности определения уровня экспрессии PD-L1 для различных типов опухолей, онкологический конгресс.
7. Reck M., Rodríguez-Abreu D., Robinson A.G., et al. Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non–Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50% or Greater. J Clin Oncol. 2019;37:7:537–46. Doi: 10.1200/JCO.18.00149.
8. Tony Shu-kam Mok, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet. 2019;393(10183):1819–30. Doi: 10.1016/S0140-6736(18)32409-7.
9. Davis A.A., Patel V.G. The role of PD-L1 expression as a predictive biomarker: an analysis of all US Food and Drug Administration (FDA) approvals of immune checkpoint inhibitors. J Immunother Cancer 2019;7:278. Doi: 10.1186/s40425-019-0768-9.
10. Kai Li, Haiqing Luo, Lianfang Huang, et al. Microsatellite instability: a review of what the oncologist should know. Cancer Cell. Int. 2020;20:16. Doi: 10.1186/s12935-019-1091-8.
11. Arulananda S., Thapa B., Walkiewicz M., et al. Mismatch repair protein defects and microsatellite instability in malignant pleural mesothelioma. J Thorac Oncol. 2018;13(10):1588–94. Doi: 10.1016/j.jtho.2018.07.015.
12. Boland C.R., Goel A. Microsatellite instability in colorectal cancer. Gastroenterol. 2010;138(6):2073–87.e3. Doi: 10.1053/j.gastro.2009.12.064.
13. Overman M.J., et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet. Oncology. 2017;18(9):1182–91. Doi: 10.1016/S1470-2045(17)30422-9.
14. Wu Yongfeng, Xu Jinming, Du Chengli, et al. The Predictive Value of Tumor Mutation Burden on Efficacy of Immune Checkpoint Inhibitors in Cancers: A Systematic Review and Meta-Analysis. Front Oncol. 2019;9:1161. Doi: 10.3389/fonc.2019.01161.
15. Schrock A.B., et al. Tumor mutational burden is predictive of response to immune checkpoint inhibitors in MSI-high metastatic colorectal cancer. Ann Oncol. 2019;30(7):1096–103. Doi.org/10.1093/annonc/mdz134.
16. Carbone D.P., et.al. First-Line Nivolumab in Stage IV or Recurrent Non–Small-Cell Lung Cancer. N Engl J Med. 2017;376:2415–26. Doi: 10.1056/NEJMoa1613493.
17. Hellmann M.D., et al. Nivolumab plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 2019;381:2020–31. Doi: 10.1056/NEJMoa1910231.
18. Биомаркеры иммунотерапии.
19. Chua W., Charles K., Baracos V., et al. Neutrophil/lymphocyte ratio predicts chemotherapy outcomes in patients with advanced colorectal cancer. Br J Cancer. 2011;104:1288–95. Doi: 10.1038/bjc.2011.100.
20. Lino-Silva L.S., Salcedo-Hernández R.A., García-Pérez L., et al. Basal neutrophil-to-lymphocyte ratio is associated with overall survival in melanoma. Melanoma Res. 2017;27(2):140–44. Doi: 10.1097/CMR.0000000000000333.
21. Koh C., Bhoo-Pathy N., Ng K., et al. Utility of pre-treatment neutrophil–lymphocyte ratio and platelet–lymphocyte ratio as prognostic factors in breast cancer. Br J Cancer. 2015;113:150–58. Doi: 10.1038/bjc.2015.183.
22. Templeton A.J., McNamara M.G., ŠЕuga B., et al. Prognostic Role of Neutrophil-to-Lymphocyte Ratio in Solid Tumors: A Systematic Review and Meta-Analysis. JNCI: J Nat Cancer Inst. 2014;106(6):124. Doi: 10.1093/jnci/dju124.
23. Zubing Mei, et al. Prognostic role of pretreatment blood neutrophil-to-lymphocyte ratio in advanced cancer survivors: A systematic review and meta-Analysis of 66 cohort studies. May 2017. Cancer Treatment Reviews 58. Doi: 10.1016/j.ctrv.2017.05.005.
24. Жуков Н.В., Зарецкий А.Р., Лукьянов С.А., Румянцев С.А. Исследование циркулирующей опухолевой ДНК (жидкая биопсия). Перспективы использования в онкологии. Онкогематология. 2014;9(4):28–36.
25. Xiao Han, Junyun Wang, Yingli Sun, et al. Circulating Tumor DNA as Biomarkers for Cancer Detection. Genom Proteom Bioinform. 2017;15(2):59–72. Doi: 10.1016/j.gpb.2016.12.004.
26. Lee J.H., et al. Association Between Circulating Tumor DNA and Pseudoprogression in Patients With Metastatic Melanoma Treated With Anti-Programmed Cell Death 1 Antibodies. JAMA. Oncol. 2018;4(5):717–21. Doi: 10.1001/jamaoncol.2017.5332.
27. Moding E.J., Liu Y., Nabet B.Y., et al. Circulating tumor DNA dynamics predict benefit from consolidation immunotherapy in locally advanced non-small-cell lung cancer. Nat Cancer. 2020;1:176–83. Doi: 10.1038/s43018-019-0011-0
28. Стенина М.Б., Царева Е.В., Жаров А.А., Тюляндин С.А. Инфильтрирующие опухоль лимфоциты: биологическая суть и клиническое значение при раке молочной железы. Российский онкологический журнал. 2016;21(1–2):92–100.
29. Naito Y., Saito K., Shiiba K., et al. CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer. Cancer Res. 1998;58:3491–94.
30. Taylor R.C., Patel A., Panageas K.S., et al. Tumorinfiltrating lymphocytes predict sentinel lymph node positivity in patients with cutaneous melanoma. J Clin Oncol. 2007;25:869–75. Doi: 10.1200/JCO.2006.08.9755.
31. Tumeh P.C., et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 2014;515(7528):568–71. Doi: 10.1038/nature13954.
32. Farhood B., Najafi M., Mortezaee K. CD8+ cytotoxic T lymphocytes in cancer immunotherapy: A review. J Cell Physiol. 2019;234(6):8509–21. Doi: 10.1002/jcp.27782.
33. Chaput N., Lepage P., Coutzac C., et al. Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab. Ann Oncol. 2017;28:1368–79. Doi: 10.1093/annonc/mdx108.
34. Семиглазова Т.Ю., Бриш Н.А., Галунова Т.Ю. и др. Роль кишечной микробиоты в формировании ответа на иммунотерапию злокачественных новообразований: состояние проблемы. Медицинский совет. 2018;10:128–33.
35. Mohiuddin J.J., et al. Association of antibiotic exposure with survival and toxicity in patients with melanoma receiving immunotherapy, JNCI: J Nat Cancer Inst. 2020 Apr 15;djaa057. Doi: 10.1093/jnci/djaa057.
36. Dummer R., et al. Adjuvant dabrafenib plus trametinib versus placebo in patients with resected, BRAFV600-mutant, stage III melanoma (COMBI-AD): exploratory biomarker analyses from a randomised, phase 3 trial. Lancet Oncol. 2020;21(3):358–72. Doi: 10.1016/S1470-2045(20)30062-0.