метод ослепления предполагает что
Слепое исследование
В наших статьях часто можно встретить термин “двойное слепое исследование” или просто “слепое исследование”. Что же там слепого? Кто должен быть слеп? Кого следует ослепить для проведения исследования и почему это важно? Если есть слепое и двойное слепое исследования, то есть ли тройное слепое?
Зачем нужно ослепление?
К СВЕДЕНИЮ: Рандомизированные контролируемые исследования являются золотым стандартом получения научных данных о новых медицинских вмешательствах. Это означает, что выпуская новый лекарственный препарат на рынок, фармацевтическая компания обязана проверить как эффективность, так и безопасность своего препарата, проведя рандомизированное контролируемое исследование (РКИ). Подробнее: РАНДОМИЗИРОВАННОЕ КОНТРОЛИРУЕМОЕ ИССЛЕДОВАНИЕ В МЕДИЦИНЕ
Первый слепой эксперимент был проведен Французской королевской комиссией по магнетизму животных в 1784 году для исследования месмеризма.
В ходе исследований исследователи завязывали глаза месмеристам и просили их идентифицировать объекты, которые другие месмеристы ранее “заполняли жизненной жидкостью”. Испытуемые не смогли этого сделать.
Другой пример ослепления, использованный вне научных кругов:
В 1817 году был проведен первый слепой эксперимент по сравнению музыкальных качеств скрипки Страдивари и другой скрипки. Скрипач играл на каждом инструменте, а группа ученых и музыкантов слушала из другой комнаты, чтобы избежать предубеждений в своих выводах.
Кого же ослепляют в рамках медицинских исследований?
К СВЕДЕНИЮ: несмотря на широкое распространение, термины “слепой (слепое)” или “ослепление”, считаются неэтичными и все чаще используется термин “маскированный”, т.е. “маскированное исследование”, “двойная маскировка” и т.д.
Ослепление испытуемых
Исследование медицинских вмешательств, будь то лечебных или диагностических, предполагает наличие контроля. Т.е. все исследуемые делятся как минимум на две группы:
Ослепление исследуемых значит, что исследуемый не знает, к какой группе он относится, ему неизвестно, получает ли он лечение или, например, плацебо. Ослепление исследуемых важно по множеству причин:
Ослепление исследователей
Очевидно, что исследователь может быть заинтересован в результате исследования, и здесь даже не важно, с каким знаком, положительным или отрицательным. Важно нейтрализовать любое субъективное влияние исследователя на результат исследования. Соответственно, если исследователь не знает, к какой группе относится тот или иной пациент, то с высокой долей вероятности он будет относиться к ним одинаково.
Ослепление аналитиков
Наблюдательная часть исследования завершена, пришло время анализа. Как не допустить ошибок в анализе у желающих подогнать решение под ответ? Все очень просто, и здесь ослепляем (маскируем). Анализирующий не знает, результаты какой группы он анализирует, экспериментальной или контрольной. Таким образом, влияние аналитика на результат сводится к нулю.
Кого еще можно ослепить?
Ослепить можно практически всех. Медперсонал, ухаживающий за больными, чтобы исключить влияние повышенного внимания к тем, кто получает плацебо. Параклинические службы, проводящие дополнительные исследования. Службы, контролирующие исследования, и проч и проч и проч.
Слепое, двойное слепое, тройное слепое…
Итак, если мы ослепили один тип участников исследования, то это исследование называется слепым. Обычно под слепым исследованием подразумевается ослепление испытуемых (т.е. пациентов), но строго говоря, не важно, кто из участников ослеплен. Поэтому, при чтении исследований важно не ограничиваться констатацией факта о том, что исследование слепое, а понять, кто именно был ослеплен.
Двойное слепое исследование предполагает, что ослеплены два типа участников исследования. Обычно это исследуемый и исследователь.
Тройное слепое исследование, соответственно, ослепление трех типов участников исследования. Обычно это исследуемый (пациенты), исследователь (врачи) и аналитики.
Повторим: при чтении результатов исследования нельзя ограничиваться только названием типа исследования, нужно разобраться, кто и как был ослеплен.
К СВЕДЕНИЮ: В систематическом обзоре 250 рандомизированных клинических исследований исследователи наблюдали значительную разницу в величине предполагаемого лечебного эффекта между исследованиями, в которых сообщалось об двойном ослеплении, и исследованиях без двойного ослепления. Результаты этого систематического обзора были подтверждены и другими исследованиями.
Критическая оценка ослепления
К СВЕДЕНИЮ: Метаанализ, проведенный 2018 году, показал, что оценка ослепления проводилась только в 23 из 408 рандомизированных контролируемых исследований хронической боли. В результате анализа объединенных данных исследование пришло к выводу, что общее качество ослепления было плохим, а ослепление было «неудачным»
Зачастую формально слепое исследование таковым не является:
Метод ослепления предполагает что
Доказательная медицина запись закреплена
Высшей Школы Онкологии, учащаяся программы Harvard Medical School «Global Clinical Scholars Research Training Program».
Слепое исследование может помочь отличить результат лечения от результата самовнушения. Это особенно важно в случае, когда оцениваются субъективные ощущения пациента. К примеру, пациенты, которые знают, что они в экспериментальной группе, склонны преувеличивать побочные эффекты препарата.
«Заслепление» врача поможет избавиться от ситуации, когда врач более пристально наблюдает за группой, получающей экспериментальное лечение. Повышенное внимание может отразиться на результатах лечения. В таком случае мы не сможем понять, вызвана разница в группах этим вниманием или эффектом от препарата.
В случае, когда все знают, в какую группу попал пациент, исследование называют «открытым» или «open-label».
Основные типы исследований, при которых проводится «ослепление»:
Безусловно, даже при наличии «двойного заслепления» врач знает о потенциальных побочных эффектах препарата. Пациенты из экспериментальной и контрольной групп в любом случае получат нужное лечение.
В ситуации, когда незнание врача о том, в какой группе находится пациент, опасно для жизни или здоровья пациента, возможно «расслепление» (undlinding, unmasking). Решение о расслеплении принимается совместно с исследователями.
Не забудьте подписаться на страницу Полины Шило.
В её блоге Вас ждет еженедельный обзор новостей из топ-3 медицинских журналов:
— New England Journal of Medicine (NEJM)
— The Lancet
— The Journal of the American Medical Association (JAMA).
Терминология медицинских исследований
Чем клинические испытания разных фаз отличаются друг от друга? Что называют двойным ослеплением? Что такое статистическая значимость? Мы подготовили небольшой справочник с основными терминами и определениями, используемыми в медицине.
Доклинические (неклинические) испытания — исследования, не предполагающие участия людей, с которых начинается разработка препарата. После выбора биологической мишени начинается поиск молекулы, которая может на нее влиять. Сначала исследования проводят на клеточных линиях или первичных культурах клеток, но поскольку организм не является простой суммой частей, эти исследования не могут заменить экспериментов на целых организмах. На более поздних этапах доклинического поиска тесты проводятся на нескольких типах лабораторных животных.
Клиническое испытание (КИ) — научное исследование на людях, которое проводится с целью оценки эффективности и безопасности метода лечения или диагностики. Клинические испытания являются необходимым этапом разработки препарата, который предшествует его регистрации и широкому медицинскому применению. КИ могут проводиться только после того, как будет получено разрешение от регулирующих организаций (например, Минздрава) на проведение экспериментов на человеке, с учетом уже имеющихся данных об эффективности и безопасности, полученных на доклинической стадии.
Выделяют до четырех этапов клинических испытаний новых лекарственных препаратов, три из которых проводят до выхода препарата на рынок — их называют испытаниями I, II и III фазы (далее КИ I,II и III фазы). Испытания IV фазы (постмаркетинговые) проводятся уже после начала широкого применения препарата.
КИ I фазы — исследование безопасности для человека вещества-кандидата, успешно прошедшего доклинические испытания. Большинство испытаний I фазы проводят на нескольких десятках здоровых человек — добровольцах, получающих оплату за участие в исследовании. Участников делят на группы, получающие разные дозы вещества или плацебо. В КИ I фазы определяют максимально переносимую дозу — наибольшую дозу, не приводящую к токсическим эффектам, а также описывают эти эффекты (данные пригодятся при планировании следующих фаз). Дизайн исследований I фазы не предполагает лечение пациента, и вероятность, что вещество-кандидат на самом деле станет лекарством, на этом этапе очень мала.
КИ II фазы — первая проверка гипотезы, что выбранное вещество может лечить людей. В испытаниях II фазы участвуют несколько сотен пациентов с целевым заболеванием, которых тщательно отбирают, чтобы получить достаточно однородную группу и не пропустить полезный эффект. Также в клинических испытаниях II фазы определяют оптимальные схемы лечения, на основе которых будет планироваться следующий этап. Для этого пациентов делят на несколько групп, получающих разные дозировки, и сравнивают результат. В среднем не более 30% проектов переходят от этой фазы к следующей.
КИ III фазы — исследование, направленное на подтверждение гипотезы, что выбранный в КИ II фазы режим лечения эффективен для большой и разнообразной группы пациентов и может реально применяться на практике. В испытаниях III фазы участвуют до нескольких тысяч пациентов, а продолжаются они от двух до пятнадцати лет. Последнее время клинические испытания III фазы обычно бывают многоцентровыми, то есть их проводят не в одной клинике. Это позволяет увеличить количество участников, добавить в выборку людей разного этнического состава и уровня жизни, а также сравнить результаты между центрами. После завершения фазы III можно подавать документы на регистрацию лекарства, и, если регистрирующую организацию устроят предоставленные данные, оно будет зарегистрировано. С этого момента его можно продавать.
Постмаркетинговые исследования или КИ IV фазы — испытания, проводящиеся после регистрации препарата и начала его продажи. Целью исследований IV фазы является получение более подробной информации о безопасности и эффективности препарата в различных лекарственных формах и дозах, при длительном применении у различных групп пациентов, что позволяет более полно оценить стратегию использования препарата и выявить отдаленные результаты лечения. В исследованиях принимает участие очень большое количество пациентов, что позволяет выявить ранее неизвестные и редко встречающиеся нежелательные эффекты.
Контролируемое КИ — это сравнительное испытание, в котором исследуемый метод лечения сравнивают со стандартным способом лечения, например, с препаратом, уже вышедшим на рынок. Пациенты в первой группе получают терапию исследуемым препаратом, пациенты во второй – стандартным (или получают плацебо, если стандартного способа лечения еще не существует), эта группа называется контрольной.
Конечные точки или исходы — параметры, по которым будет оценен результат КИ. Их необходимо выбирать до начала испытаний.
Клинически значимые исходы (еще их называют истинными или твердыми конечными точками) — это то, что важно для пациента: продолжительность жизни, ее качество, отсутствие тяжелых осложнений. Например, если мы изучаем лекарство от сердечно-сосудистых заболеваний, то возможными клинически значимыми исходами будут частота инфарктов миокарда и продолжительность жизни.
Суррогатные исходы (их также называют биомаркерами, суррогатными или мягкими конечными точками) — это результаты анализов или приборных исследований, которые взаимосвязаны с интересующими нас параметрами, то есть могут предсказать изменения клинически значимых исходов. Они необходимы в тех случаях, когда оценка истинных конечных точек затруднена или невозможна. В примере с лекарством от сердечно-сосудистых заболеваний анализ истинных конечных точек сильно увеличит продолжительность и стоимость исследования. В качестве альтернативы можно ориентироваться на изменения уровня холестерина или результаты ЭКГ, которые и будут являться суррогатными конечными точками. К сожалению, на практике суррогатные исходы не всегда правильно предсказывают изменения истинных конечных точек.
Плацебо — все, что выглядит и воспринимается пациентом как медицинское вмешательство, хотя на самом деле им не является. Например, в качестве плацебо может выступать таблетка, по цвету, форме и вкусу полностью идентичная тестируемому лекарственному препарату, но не содержащая активное вещество. Сейчас плацебо используют в основном в клинических испытаниях, чтобы скрыть от пациентов контрольной группы, что они не получают лечения. Такие испытания называются плацебо-контролируемыми.
Эффект плацебо — субъективное улучшение самочувствие, вызванное ожиданием улучшения от лечения, даже если пациент вместо лекарства получил плацебо (но не знает об этом).
Эффект ноцебо — вызванное негативными ожиданиями субъективное ухудшение самочувствия. В силу этических ограничений эффект ноцебо изучен меньше, чем эффект плацебо. Однако доказано, что негативные ожидания могут менять субъективные симптомы в худшую сторону.
Рандомизированное КИ — исследование, в котором распределение пациентов по контрольным и экспериментальным группам проведено случайным образом.
Ослепление — способ проведения исследования, при котором пациенты не знают, находятся ли они в контрольной группе или получают лечение. В противном случае ожидания участников будут отличаться, что может повлиять на их субъективное самочувствие, в результате чего по окончании эксперимента может быть сделан ошибочный вывод.
Двойное ослепление (двойной слепой метод) — ослепление и пациентов, и врачей. Хотя двойное ослепление считается обязательной составляющей качественного клинического испытания, его применение не всегда возможно: например, в случае хирургического или психотерапевтического вмешательства врач всегда знает, в какой группе оказался пациент. В таких случаях необходимо разделение ролей лечащего врача и того, кто оценивает результаты лечения, чтобы ослепить его. Ситуацию, когда ослеплены не только врач и пациент, но и другие участники эксперимента, например тот, кто анализирует данные, иногда называют тройным ослеплением.
Наблюдательное исследование проводится, если эксперимент трудно выполним. Например, мы хотим изучить, как занятия спортом влияют на продолжительность жизни. Гипотетически рандомизированный эксперимент был бы лучшим способом найти ответ. Но даже если мы наберем юных добровольцев, разделим на две группы и скажем одной из них всю жизнь заниматься спортом, а другой — не делать этого никогда, стоит ли рассчитывать, что все будут послушно выполнять предписания в течение всей жизни? Реалистичнее изучить разницу в здоровье тех, кто по собственному выбору длительно придерживался того или иного образа жизни. Наблюдательные исследования бывают разных типов: когортные, случай-контроль, экологические и другие.
Когортные исследования отслеживают когорты — группы людей, имеющих некоторую общую характеристику, например, подверженных какому‑то фактору риска. Контрольная когорта формируется из тех, кто фактору риска не подвергался. Отобрав когорты, исследователи в течение какого‑то времени смотрят, что происходит с их здоровьем. Если заболевание возникает в исследуемой когорте чаще, чем в контрольной, можно предположить связь между фактором риска и болезнью.
Когортные исследования бывают двух основных типов:
Исследование случай-контроль направлено, в отличие от когортных исследований, не на изучение фактора риска, а на тех пациентов, у которых уже есть болезнь. Их сравнивают с контрольной группой, состоящей из тех, у кого болезни нет. Исследователи опрашивают тех и других и сравнивают их истории, чтобы определить, как отличалось их прошлое, чтобы сделать вывод о возможных причинах заболевания. Исследования случай-контроль хорошо подходят для того, чтобы установить неизвестные факторы риска.
Абсолютный риск (АР) — соотношение случаев болезни в группе к количеству человек в группе, или, проще говоря, шансы человека заболеть.
Относительный риск (ОР) — отношение абсолютного риска для подверженного воздействию фактора человека к абсолютному риску для неподверженного. Или, проще говоря, во сколько раз увеличивается риск для человека, если он подвергнут данному воздействию. Если относительный риск больше единицы, то воздействие вредно. Если меньше, то оно дает защитный эффект. Если значение очень близко к единице, то, как правило, его можно игнорировать.
Заболеваемость — отношение числа заболевших в группе к числу людей в этой группе.
Смертность — отношение числа умерших в группе к числу людей в этой группе.
Клинические рекомендации (гайдлайны) и протоколы лечения — это регулярно обновляемые документы, которые описывают актуальные подходы к диагностике и лечению конкретных болезней. Их создают специально собранные группы экспертов, которые оценивают и суммируют существующие данные, а также ранжируют методы лечения на основе убедительности доказательств в их пользу. В идеальной ситуации клинические рекомендации выступают в роли связующего звена между врачом и научными публикациями, своевременно и объективно систематизируя новейшие данные.
Систематический обзор — обзор существующей литературы или исследований, содержащий детальное описание методики поиска и критериев включения публикаций в обзор. Это необходимо для повышения прозрачности и объективности сделанных выводов. Доказательность систематических обзоров выше, чем у отдельных КИ, поскольку они суммируют выводы всех исследований надлежащего качества на эту тему. Систематический обзор часто включает метаанализ.
Метаанализ — статистическая процедура, которая суммирует данные из нескольких исследований и делает на их основании общий статистический вывод.
Кокрейновский обзор — систематический обзор, подготовленный сообществом Кокрейн (ранее — Кокрейновское сотрудничество), некоммерческой организации, созданной в 1939 году и названной в честь Арчи Кокрейна, помогающей врачам, пациентам, законодателям и управляющим медицинской помощью организациям принимать основанные на научных доказательствах решения. Кокрейн объединяет несколько десятков экспертных групп и более 30 тысяч добровольцев по всему миру. Репутация Кокрейна столь высока, что организация является официальным партнером ВОЗ, имеет право назначать своего представителя для участия в заседаниях и выступать на них с заявлениями.
Ошибка первого рода — ложная тревога, ложное или ложноположительное срабатывание. Ошибки первого рода возникают, например, если тест, предназначенный для диагностики заболеваний, дает положительный результат (то есть показывает наличие заболевания у пациента), когда на самом деле пациент этим заболеванием не страдает. Такой результат называют ложноположительным.
Ошибка второго рода — пропуск цели или события, ложноотрицательное срабатывание. Ошибку второго рода можно проиллюстрировать примером, когда диагностический тест дает отрицательный результат (то есть показывает отсутствие заболевания у пациента), хотя на самом деле человек болен. Этот результат называют ложноотрицательным.
Доверительные интервалы — обозначают диапазон, в котором с определенной надежностью (не вероятностью!), обычно 95%, лежит результат. Например, выживаемость среди пациентов, принимавших исследуемый препарат, была на 10% выше (95% ДИ 7 13), где 10% — обнаруженный эффект, 7 (процентов) — нижняя граница доверительного интервала, 13 — верхняя граница доверительного интервала.
Статистическая значимость — один из критериев оценки полученных в ходе эксперимента данных. Исторически сложилось, что определяемые в тестах на статистическую значимость P-значения используют, чтобы решить, случайны обнаруженные различия между группами или нет. Если значение меньше порогового (часто это p
Нулевая гипотеза — это предположение, что между изучаемыми явлениями не существует связи, а отличия в контролируемых экспериментах носят случайный характер. Она является гипотезой по умолчанию, и только если эксперимент опровергает ее, у нас появляются основания предполагать, что связь все‑таки есть.
Биодоступность — способность действующего вещества достигать своей мишени в организме человека, например, определенного рецептора. Биодоступность определяется скоростью, с которой действующее вещество достигает своей мишени, и количеством этого вещества (доли от содержащегося в форме дозирования).
Оригинальный (инновационный) препарат — препарат, впервые выпущенный на рынок компанией, проводившей все клинические исследования для его регистрации и получившей патент.
Дженерик — препарат, химически идентичный инновационному (запатентованному) лекарству, которое впервые вышло на рынок. Дженерический препарат выходит на рынок после окончания срока действия патента или других исключительных прав на оригинальное лекарство. От инновационного препарата он отличается (если выполнены все условия производства ) только внешним видом таблетки, названием и упаковкой, так как должен быть проверен на биоэквивалентность.
Прагматические клинические исследования
Полный текст:
Аннотация
Прагматические исследования позволяют объединить преимущества наблюдательного исследования в реальной клинической практике с научной строгостью рандомизированного клинического исследования (РКИ) и тем самым дать более эффективные ответы на вопросы реальной клинической практики.
Цель. Оценка различий в проведении классических РКИ и прагматических клинических исследований (ПКИ), а также анализ особенностей, касающихся их проведения на разных этапах.
Методология. Проведён анализ ряда публикаций в период с 1999 по 2017 гг. на предмет выявления данных, посвящённых ПКИ.
Результаты. В проведении классических РКИ и ПКИ имеются существенные различия. Прежде всего, в ПКИ используют более гибкие критерии включения и отличается подход к выбору центра исследования. Также процедура получения информированного согласия имеет существенные отличия от таковой при классическом РКИ; предложены альтернативные варианты, однако единый подход пока не выработан. При проведении ПКИ требуются минимальные вмешательства монитора в рутинную медицинскую практику, что, однако, может привести к нарушению сбора отчётности. Вариантом решения может стать удалённый сбор данных.
Выводы. ПКИ представляют собой огромный потенциал для исследования эффективности лекарственных препаратов в условиях реальной клинической практики. Однако, несмотря на значительное увеличение количества таких исследований, всё ещё существует достаточное количество моментов, требующих урегулирования.
Ключевые слова
##article.ConflictsofInterestDisclosure##:
##article.articleInfo##:
Депонировано (дата): 26.09.2020
##article.reviewInfo##:
##article.editorialComment##:
Для цитирования:
Шевченко О.Р., Колбин А.С. Прагматические клинические исследования. Качественная Клиническая Практика. 2020;(3):52-60. https://doi.org/10.37489/2588-0519-2020-3-52-60
For citation:
Shevchenko O.R., Kolbin A.S. Pragmatic clinical trials. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(3):52-60. (In Russ.) https://doi.org/10.37489/2588-0519-2020-3-52-60
Актуальность
Рандомизированные клинические исследования (РКИ) проводят с середины прошлого века, и их роль в современной медицине сложно переоценить. Основываясь на данных классического РКИ, под которым подразумевается двойное слепое рандомизированное плацебо-контролируемое исследование, можно судить о действенности (англ. efficacy) лекарственного препарата (ЛП). Данный вид исследований чаще всего используют при проведении предрегистраци-онных интервенционных клинических исследований [1]. Однако, даже если данные, полученные в ходе качественно проведённого РКИ, валидны, это не гарантирует получения такого же результата у пациентов, не соответствующих субъектам, подобранным по строгим критериям для участия в исследовании. В связи с этим, существует всё больше запросов на получение информации об эффективности ЛП в условиях реальной клинической практики (англ. Real-World Data, RWD).
Одно из определений RWD — «данные, относящиеся к системе здравоохранения, которые собирают из различных источников вне рамок предре-гистрационных рандомизированных клинических исследований» [2].
После анализа таких данных получают доказательства реального мира (англ. Real-World Evidence, RWE), с получением данных об эффективности (англ. effectiveness) [3].
В медицинском сообществе сложилось мнение, что основным источником данных RWD являются наблюдательные исследования [2, 4]. Как классическое РКИ, так и наблюдательные исследования имеют ограничения в предоставлении данных о сравнительной эффективности ЛП.
Недавнее метаэпидемиологическое исследование показало, что после проведённого РКИ можно получить совершенно разные ответы на одни и те же клинические вопросы в результате рутинного сбора данных о состоянии здоровья, что, несмотря на трудности в устранении статистических погрешностей, может привести к переоценке эффекта лечения [5]. Также при проведении РКИ минусом является исследование ограниченных групп населения в строго подобранных и контролируемых условиях, оптимизированных для демонстрации действия ЛП [6].
В случае с наблюдательными исследованиями нельзя исключить наличие систематических ошибок ( англ. bias), особенно, касающихся несопоставимости между группами пациентов [5].
Необходимо отметить, что в настоящий момент огромное количество данных о состоянии здоровья пациентов хранится на компьютерах, мобильных устройствах и других гаджетах. Эти данные могли бы быть полезны, чтобы лучше спланировать проведение клинических исследований.
Многими экспертами в качестве дополнительного источника данных о RWD предлагается рассматривать прагматические клинические исследования (ПКИ, англ. pragmatic clinical trials), которые позволяют объединить преимущества наблюдательного исследования в реальной клинической практике с научной строгостью рандомизированного клинического исследования, и тем самым более точно ответить на вопросы реальной клинической практики.
Цель: анализ особенностей проведения прагматических клинических исследования.
Методология
Был проведён систематический анализ данных литературы в период с 1967 по 2019 гг. на предмет выявления информации, посвящённой ПКИ. В ходе проведения поискового анализа использовали следующие критерии включения и исключения.
Критерии включения: в анализ вошли публикации, в которых описывали исследования по эффективности, сравнительной эффективности (наблюдательные исследования, прагматические клинические исследования).
Критерии исключения: в анализ не вошли клинические исследования, посвящённые обсуждению действенности и сравнительной действенности.
Ключевые слова поиска: клинические исследования; прагматические клинические исследования; реальная клиническая практика; исследования сравнительной эффективности.
Результаты
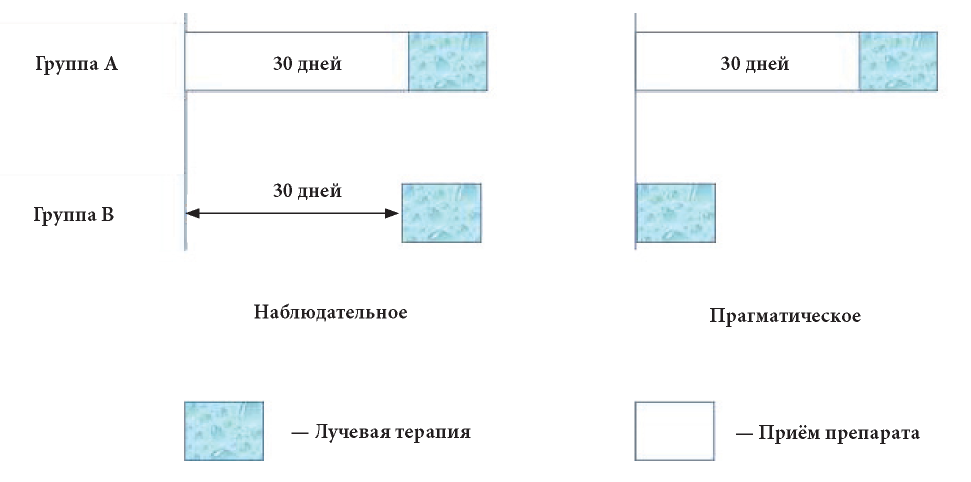
История. Впервые прагматические клинические исследования были предложены и описаны Schwartz D. и Lellouch J. в 1967 году [7]. В этой статье авторы представили два сценария испытаний по борьбе с раком, в которых исследовали лекарственный препарат, повышающий чувствительность к радиотерапии. Предположив, что ЛП следует вводить на протяжении 30 дней до радиотерапии, группы сравнения можно было сформировать двумя способами, которые представлены на рис. 1.
Рис. 1. Наблюдательный и прагматический подход в исследованиях [4]
Как видно из данных, представленных на рис. 1, чтобы при наблюдательном исследовании лучевая терапия проводилась в одно и то же время в каждой группе, в группе сравнения (Группа Б) лучевой терапии предшествует «пустой» период в 30 дней (приём препарата и другие вмешательства не осуществляются). Во втором случае (прагматическое исследование) лучевая терапия Группы Б могла быть начата одновременно с приёмом лекарственного препарата Группой А. Ни один из этих вариантов процедур нельзя было назвать «лучшим» по отношению к другому. Первый (наблюдательное исследование) позволял сравнивать две группы, которые похожи с точки зрения лучевой терапии и которые отличались только наличием или отсутствием ЛП. Была проведена оценка сенсибилизирующего действия лекарственного препарата. Вторая процедура (прагматическое исследование) позволила сравнить две процедуры в тех условиях, в которых они наиболее вероятно будут применяться на практике. Таким образом, это два абсолютно разных подхода к исследованию ЛП.
CONSORT. По мере роста количества клинических исследований также возросла необходимость обеспечения чёткого представления результатов. Для достижения этой цели были созданы Единые стандарты представления результатов исследований (англ. Consolidated Standards of Reporting Trials, CONSORT) и выпущен контрольный лист CONSORT, состоящий из 22 пунктов. В 2008 году было выпущено расширение заявления CONSORT для прагматических клинических исследований, которое не изменило основные пункты контрольного листа, однако внесло дополнения в 8 из них [8]. Расширения затронули такие пункты, как: исходные данные, участники исследования, вмешательства, результаты, размер выборки, ослепление, набор участников и обобщение результатов. Для каждого из восьми пунктов представлены стандартный текст CONSORT и дополнительные указания, пример хорошей отчётности по данному пункту и объяснение проблем. Важно отметить, что эти предложения следует рассматривать как дополнение к общим указаниям в основном пояснительном документе CONSORT и, при необходимости, к другим указаниям CONSORT. Эти расширения представлены вместе с иллюстративными примерами отчётности и объяснением каждого расширения.
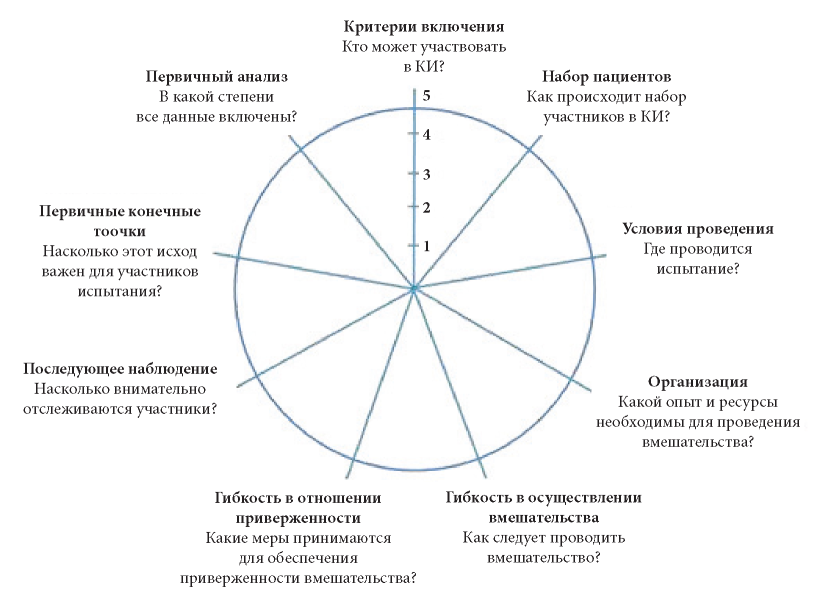
Колесо PRECIS-2. При планировании проведения исследования сравнительной эффективности существующей методологии или лекарственного препарата следует сделать выбор в пользу прагматического или наблюдательного подхода, поскольку они представляют собой две противоположные стороны одного континуума. С этой целью в 2005—2008 гг. команда из 25 международных экспертов и методистов разработала инструмент PRECIS ( англ. Pr agmatic- E xplanatory C ontinuum I ndicator S ummary) [9]. Далее первоначальная версия была усовершенствована, чтобы на этапе разработки исследований выбрать наиболее верный подход в соответствии с планируемой целью. Так, разработчиками было представлено «колесо» PRECIS-2 (рис. 2).
Рис. 2. Модель (колесо) PRECIS-2 [10]
Как видно из данных, представленных на рис. 2, представлен инструмент, который поможет выбрать наиболее соответствующий целям исследования подход. Модель (колесо) PRECIS-2 имеет 9 пунктов, каждый из которых оценивается по пятибалльной шкале, где 1 — «очень наблюдательные», идеальные условия, а 5 — «очень прагматичные условия», соответствующие реальной клинической практике. Целью «очень прагматичного» подхода в данном случае считается максимальное применение вмешательства для обычной помощи в реальной клинической практике и его эффективность, в то время как «очень наблюдательный» подход демонстрирует эффект вмешательства с помощью ожидаемого механизма, однако вопросу о том, будет ли этот результат достигнут в реальных условиях, уделяется минимальное внимание. К примеру, при выборе центра проведения исследования обычные стационары, осуществляющие рутинную медицинскую деятельность, будут соответствовать 5 баллам (прагматичный подход), в то время как специализированные для проведения исследований центры наберут 1 балл. Таким образом, используя это колесо решений, исследователям и клиницистам будет легче понять, соответствуют ли проектные решения их предполагаемому назначению.
Отличия в проведении ПКИ от классического РКИ. В табл. 1 суммированы и представлены основные отличия классического РКИ от прагматического.
Отличия классического рандомизированного клинического исследования от прагматического клинического исследования
Классическое рандомизированное клиническое исследование
Прагматическое клиническое исследование
По строгим критериям
В условиях реальной клинической практики
в проведении исследований
стандартная утверждённая форма
Возможно использовать упрощённую форму
о нежелательных реакциях
Стандартная форма отчётности
Различные источники, форма отчётности гибкая
При проведении ПКИ и РКИ есть существенные различия в методологии. В первую очередь, в ПКИ исследование осуществляется квалифицированными врачами, которые, однако, могут не иметь опыта в клинических исследованиях. При этом исследуется обширная группа пациентов, многие из которых не попали бы в РКИ в связи со строгими критериями включения. Таким образом, эти исследования могут помочь выяснить эффективность ЛП, например, у пожилых пациентов.
Несмотря на очевидные преимущества в получении реальных данных при проведении ПКИ, существуют определённые ограничения, которые необходимо разрешить.
Выбор центра исследования и протокола. Одним из серьёзных моментов при планировании ПКИ является выбор центра. Так, пациенты, которые регистрируются в одном центре, где планируется исследование, могут параллельно получать помощь и наблюдаться в других медицинских организациях, включая стационары, специализированные учреждения и амбулаторное звено. Это поднимает вопрос о необходимости качественного сбора всех соответствующих источников данных для получения полноценной информации о состоянии здоровья пациента [11]. При планировании ПКИ необходимым является участие гетерогенных центров, чтобы в исследовании приняли участие различные группы пациентов, и результаты были более представительны. Ещё одним важным вопросом до начала исследования является разработка протокола с учётом рутинной клинической практики, чтобы минимизировать вмешательства в ход рутинного лечебного процесса для наибольшей достоверности данных. Решить эту проблему можно путём привлечения врачей и персонала на ранней стадии разработки протокола [12].
Включение пациентов в исследование. Для включения пациента в классическое РКИ существуют строгие критерии отбора. Однако эти пациенты могут быть несопоставимы с пациентами из «реального мира», у которых присутствуют коморбидные патологии, тяжёлое течение заболевания, а также различные факторы риска [13]. С целью получения данных об эффекте исследуемого ЛП на более широкой популяции, в ПКИ используют более мягкие критерии включения. Количество критериев исключения желательно свести к минимуму. Однако, как и в других исследованиях, пациенты с абсолютными противопоказаниями не включаются в исследование. Традиционно возникают сложности с участием уязвимой группы населения. Однако принадлежность к таковой не должна являться критерием исключения. С учётом факта исследования уже зарегистрированного лекарственного препарата в ПКИ допускают участие таких пациентов с условием предоставления дополнительных мер защиты [14].
Уязвимые группы традиционно исключаются из предрегистрационных клинических исследований, поскольку они в меньшей степени способны защищать свои собственные интересы. Тем не менее, систематическое исключение из ПКИ препятствует нашему пониманию реальных преимуществ и вреда лекарственных препаратов, используемых этими группами.
Принадлежность к уязвимому населению сама по себе не должна быть критерием исключения из ПКИ, чтобы обеспечить равный доступ к знаниям, полученным в результате исследований. Предоставление этим группам возможности участвовать в ПКИ с помощью новых вмешательств даёт дополнительную выгоду от доступа к потенциально выгодному лечению. В настоящее время поощряется ответственное включение уязвимых лиц в ПКИ, если дополнительная защита обеспечивается там, где это считается необходимым, исходя из ожидаемых рисков, последствий и характеристик населения [14][15].
Рандомизация. Значительным отличием ПКИ от классического РКИ является и процедура рандомизации. Распределение пациентов в ПКИ осуществляется лечащим врачом (по возрастной группе, социальным признакам и так далее), а пациент обладает информацией о том, какой лекарственный препарат он принимает, или какое вмешательство осуществляется. Связанные с лечением процедуры исследования в ПКИ не должны менять рутинную медицинскую практику, поэтому решения о выборе дозировки ЛП, совместном вмешательстве и лечении нежелательных явлений оставляют на усмотрение лечащего врача [16, ][17]. Плацебо и другие методы ослепления пациентов и врачей для назначенной группы лечения, как правило, в ПКИ не используются, поскольку знание применяемого вмешательства, а также ожидания или изменения поведения, связанные с этими знаниями, являются частью эффекта лечения в реальной жизни. Кроме того, любые меры, принимаемые для содействия соблюдению режима лечения, должны отражать рутинную медицинскую практику [10][17].
Дизайн, где пациенты не имеют возможности выбрать предпочтительное вмешательство, часто рассматривается как барьер для участия в испытаниях [18], поэтому были предложены модификации процесса рандомизации. Одной из таких стал дизайн Зелена (предложен статистиком Высшей школы здравоохранения Гарварда Марвином Зеленом). В этой схеме пациенты рандомизируются либо в группу лечения, либо в контрольную группу прежде, чем дать информированное согласие. Поскольку группа, к которой относится данный пациент, известна, согласие может быть получено условно. Другим методом выступает кластерная рандомизация, предусматривающая назначение одинакового вмешательства определённой группе участников.
Информированное согласие. Одним из пунктов, ограничивающих участие пациента в ПКИ, является обширная и длительная процедура информированного согласия. При планировании таких исследований необходимо учитывать ограниченное количество визитов пациента в центр, что делает трудным проведение традиционной процедуры в условиях реальной медицинской практики. Также, в связи с ограниченным временем на приём пациента врачу представляется затруднительным длительное информирование пациента. Вышеперечисленное может привести к меньшему числу включённых пациентов в планируемое исследование, и менее репрезентативной выборке [19]. Учитывая это, был предложен ряд альтернатив для традиционного информированного согласия при проведении ПКИ, в которых сравниваются доказавшие свою действенность методы [20].
Интегрированное согласие. Модель предполагает обсуждение с пациентом предлагаемой терапии, существующих альтернатив, использование рандомизации, а также потенциальный вред и преимущества сравниваемого лечения [21]. Согласие пациента может быть получено устно или письменно. Врач документирует беседу и её результаты в электронную медицинскую карту (ЭМК).
Таргетированное согласие. Такая форма предлагается для сведения к минимуму вмешательства в реальную медицинскую практику при сравнении известных методов лечения [22]. Пациенту предлагается письменная форма согласия с указанием следующих данных: процедура и продолжительность исследования, инструкции по приёму ЛП, доступность исследуемого лечения для пациента вне рамок исследования, меры конфиденциальности, контактная информация и заявление об отказе от участия в исследовании в любое время без последствий. Разница с интегрированным согласием заключается в отсутствии информации о рандомизации [23].
Освещаемый подход. В этом случае используются общие уведомления, размещаемые на видных местах, информирующие пациентов о том, что они могут участвовать в сравнительных исследованиях эффективности со стандартными известными вмешательствами. Далее пациент сам может выразить желание об участии без явной процедуры письменного согласия, с учётом наличия минимальных рисков и информирования пациентов о возможном проведении в структуре здравоохранения интегрированных в практику исследований [24].
Отказ от согласия. В этом случае участники не проинформированы об исследовании и не принимают активного решения относительно участия. Теоретически такой вариант возможен для тех ПКИ, в которых все виды лечения, предлагаемые в исследовании, могут быть предложены за пределами испытания без специального информированного согласия, при этом лечение не связано с более чем минимальным дополнительным риском по сравнению с любой из альтернатив [25].
Отслеживание нежелательных лекарственных реакций. В ПКИ количество визитов пациента в центр и структурированный сбор данных сведены к минимуму, с целью минимизации вмешательства в рутинную медицинскую практику. Порядок отчётности о нежелательных явлениях (НЯ) и нежелательных лекарственных реакциях (НР) может оказать сильное вмешательство в этот процесс. В случае с прагматическими, порядок сбора отчётности может нарушаться, вследствие редкого посещения пациентов исследовательского центра. Также возникшая НР может привести к госпитализации пациента в другую клинику или обращению к другому специалисту, не связанному с исследовательским центром [26]. Поскольку в ПКИ задействованы врачи, которые могут не иметь опыта участия в исследованиях, у них может не быть опыта заполнения отчётности о НЯ, а также у них может быть недостаточная квалификация, чтобы связать возникновение НЯ с приёмом ЛП [27]. Решением в данном случае может стать применение ЭМК, однако данные системы должны быть валидированы для использования в исследовании [28]. Изменениям подвержен и традиционный подход к мониторингу клинического исследования. С учётом более широких критериев включения, число пациентов с рисками возрастает, однако частые визиты монитора нарушают рутинный медицинский процесс. Также мониторы могут не иметь полного доступа к ЭМК, что затруднит сбор данных. Вариантами решения данной проблемы может стать удалённый сбор данных, что избавит от необходимости регулярного посещения исследовательского центра [29]. Помимо этого, на этапе разработки протокола конкретного ПКИ требуется решить, какие данные и как часто будут необходимы для регулярной отчётности, а также каким образом обеспечить доступ к этим данным.
Преимущества и недостатки прагматических клинических исследований показаны в табл. 2.
Преимущества и недостатки прагматических клинических исследований