методом иммуноблоттинга определяют что
Методом иммуноблоттинга определяют что
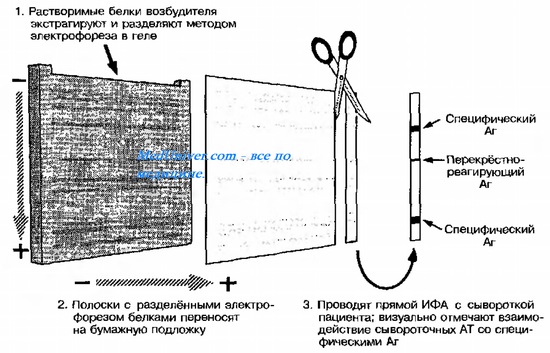
Иммуноблотинг [от англ. blot, пятно] — метод идентификации Аг (или AT) с помощью соответствующих известных сывороток (или Аг). На практике применяют для идентификации Аг ВИЧ. Первоначально электрофорезом в полиакриловом геле выделяют Аг вируса (на практике эту процедуру не проводят, а используют коммерческий реагент). Затем на полосы преципитата накладывают носитель (нитроцеллюлозную плёнку или активированную бумагу) и продолжают электрофорез. После чего на плёнку наносят сыворотку пациента и инкубируют.
После отмывания несвязавшихся AT (при их наличии) проводят ИФА — на плёнку наносят антисыворотку к Ig человека, меченную ферментом, и хромогенный субстрат, изменяющий окраску при взаимодействии с ферментом. При наличии комплексов Аг-АТ-антисыворотка к lg на носителе появляются окрашенные пятна (рис. 10-20).
Реакция иммунофлюоресценции (РИФ)
Реакция иммунофлюоресценции (РИФ) разработана А. Кунсом (1941) и основана на применении AT, меченных флюорохромными красителями. Такие AT, связывая различные Аг, вызывают свечение иммунных комплексов в УФ-лучах люминесцентного микроскопа. На практике применяют несколько вариантов РИФ.
— Вернуться в оглавление раздела «Микробиология.»
Методом иммуноблоттинга определяют что
Исследование предназначено для качественного определения антител к антигенам боррелий в сыворотке крови человека для диагностики клещевого боррелиоза (болезни Лайма) и ассоциированных заболеваний: хронической мигрирующей эритемы, доброкачественного кожного лимфаденоза, атрофического хронического акродерматита, артрита, кардита, лимфоцитарного менингорадикулоневрита, нейроборрелиоза. Первыми в крови появляются иммуноглобулины M (IgM). Они выявляются через 2-3 недели после укуса клеща, достигая максимума через 6 недель, затем их уровень постепенно снижается в течение нескольких месяцев и даже лет. Исследование антител IgM оптимально проводить для диагностики недавнего заражения (в течение 1-2 месяцев после первых симптомов).
Антитела класса IgM к Borrelia burgdorferi (вестерн-блот), иммуноглобулины класса M к возбудителю боррелиоза (болезни Лайма, клещевого боррелиоза, лайм-боррелиоза).
Синонимы английские
Lyme Disease Antibody (IgM), Western Blot.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Тест выявляет антитела к Borrelia burgdorferi. Эта бактерия относится к группе спирохет и вызывает у человека клещевой боррелиоз (болезнь Лайма).
Человек заражается, если его укусил клещ, который сам был инфицирован B. burgdorferi. Иксодовые клещи, переносчики боррелиоза, – это самая распространенная группа клещей, в умеренном поясе Северного полушария они встречаются повсеместно. Чаще всего заражение людей происходит в период активности клещей – весной и летом.
Инкубационный период боррелиоза составляет несколько недель. На ранних стадиях могут наблюдаться следующие симптомы: усталость, озноб, головные боли. Также при боррелиозе иногда возникает характерная сыпь – мигрирующая эритема (кольцевидное покраснение кожи, которое постепенно расширяется). Если болезнь не лечить, то могут возникнуть серьезные проблемы: боль в суставах, менингит, онемение конечностей, паралич лицевого нерва, расстройства памяти и (в редких случаях) поражения глаз и сердца. Лечение болезни, как правило, эффективно.
При инфицировании лимфоциты человека начинают вырабатывать антитела – специальные белки (иммуноглобулины), которые должны нейтрализовать бактерии. Иммуноглобулины M (IgM) появляются в крови первыми, через несколько дней после заражения. Однако выявить их удается обычно на более поздних сроках (через 2-3 недели). Примерно через 6 недель концентрация IgM достигает максимума и затем постепенно уменьшается (в течение нескольких месяцев и даже лет).
Антитела другого типа – иммуноглобулины G (IgG) – появляются обычно немного позже и сохраняются в крови дольше. Однако и IgG, и IgM могут присутствовать у человека, который уже выздоровел.
Таким образом, антитела IgM лучше всего подходят для диагностики недавнего заражения (тест на них имеет смысл в течение 1-2 месяцев после первых симптомов).
Анализ на антитела рекомендуется проводить в два этапа. Первый шаг – это определение титра антител IgM и IgG (обычно с помощью ИФА). Второй шаг – белковый иммуноблот (вестерн-блотинг).
Если с помощью ИФА получен отрицательный результат, то его не проверяют, считая достоверным. Если же результат ИФА был положительный или неточный, то тест проводят еще и с помощью иммуноблота. Иммуноблот более специфичен, чем ИФА, и позволяет отсечь некоторые ложноположительные результаты. Исследование обладает высокой специфичностью (98 %) и чувствительностью (95 %), является более точным по сравнению с ИФА, при тестировании используется рекомбинантный высокоиммуногенный белок VlsE, выделенный из Borrelia burgdorferi, обладающий наибольшей чувствительностью по сравнению с другими антигенами для выявления IgG.
При проведении иммуноблота выявляются антитела к нескольким разным белкам B. burgdorferi. Результат этого теста – качественный, то есть он должен быть однозначным: либо антитела есть, либо их нет. Однако распространена ситуация, когда некоторые белки связались с антителами, а некоторые нет. В таком случае интерпретация результатов исследования зависит от того, какую именно тест-систему используют в диагностической лаборатории. Дело в том, что набор белков для иммуноблота может быть разным. Поэтому каждая фирма-производитель предлагает свои критерии оценки (например, результат считается положительным, если 2 из 3 важнейших белков связались с антителами). Поэтому интерпретацию результатов теста проводят сотрудники диагностической лаборатории, которые знают, какую именно методику использовать, и они же делают окончательный вывод, заражен ли пациент боррелиозом.
Для чего используется исследование?
Когда назначается исследование?
* Перед анализом после укуса клеща должно пройти более 2 недель.
Методом иммуноблоттинга определяют что
Исследование, направленное на диагностику антител к Treponema pallidum класса IgG методом иммуноблотинга в целях диагностики или подтверждения сифилиса, а также для дифференциальной диагностики свежеприобретенного и давнего инфицирования T. рallidum.
Антитела класса IgG к возбудителю сифилиса; иммуноглобулины класса G к антигенам Тreponema pallidum.
Синонимы английские
Syphilis IgG; anti-Treponema pallidum, IgG; anti-TP IgG; antibodies to Т. pallidum, IgG; immunoblotting.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Сифилис является одним из наиболее распространенных инфекционных заболеваний, передающимся преимущественно половым путем при непосредственном контакте с сифилитической язвой (твердым шанкром). Возможен и вертикальный путь передачи от инфицированной матери к плоду, а также через кровь и реже при контакте с контаминированными предметами. Источником инфекции является больной человек, возбудитель инфекции – Treponema pallidum (T. pallidum), семейство Spirochaetaceae, род Treponema.
Соответственно клиническому течению заболевания, классифицируют несколько стадий сифилиса: первичную, вторичную, латентную и третичную. Первичный сифилис возникает на 14-21-й день заражения и проявляется возникновением твердого шанкра в месте контакта и проникновения возбудителя. Твердый шанкр представляет собой одну или несколько безболезненных язв, исчезающих в течение 2-6 недель без лечения. Возможно также увеличение регионарных лимфатических узлов. Вторичный сифилис диагностируется на 4-8-й неделе от момента появления твердого шанкра или на 2-3-й месяц после заражения. Для него характерны следующие клинические проявления: розеолезно-папулезная сыпь преимущественно на ладонях и стопах, энантема на слизистых оболочках, слабость, лихорадка, головная боль, генерализованная лимфоаденопатия, тонзиллит, фарингит. Далее симптомы исчезают и инфекция переходит в латентную форму, возможно с возникновением рецидивов. При нелеченном заболевании развивается третичный сифилис, проявляющийся поражением нервной системы, сердечно-сосудистой системы, костно-суставного аппарата.
Клиническая лабораторная диагностика играет важную роль в диагностике сифилиса в сочетании с эпидемиологической и клинической картинами заболевания. Чаще всего используются серологические методы лабораторной диагностики, основанные на выявлении антител.
Различают нетрепонемные и трепонемные тесты. Нетрепонемные тесты направлены на выявление антител к кардиолипину, фосфолипиду, компоненту клеточной и митохондриальной мембран бактерий. Трепонемные тесты выявляют антитела, направленные конкретно против антигенов, компонентов бактерий T. pallidum. К ним относятся реакция пассивной гемагглютинации, реакция иммунофлуоресценции, метод иммуноферментного анализа и метод иммуноблотинга.
Метод иммуноблотинга используется в качестве теста второй линии для подтверждения скрининговых методов исследования или в качестве дополнительной диагностики сифилиса, при подозрении на наличие данного заболевания, но отрицательных результатах других исследований. Он основан на определении антител классов IgM и IgG к молекулам-антигенам, разделенным с помощью метода электрофореза в соответствии с их молекулярной массой. Диагностическая чувствительность метода составляет 99 %, диагностическая специфичность – 100 %.
Известно несколько липопротеинов-антигенов наружной клеточной мембраны T. рallidum, которые обладают наибольшей иммуногенностью и играют важную роль в серологической диагностике сифилиса методом иммуноблотинга. К ним относятся следующие специфичные мембранные белки: Tp15 (15 кДа), Tp17 (17 кДа), Tp45 (45 кДа), Tp47 (47 кДа). Иммуноглобулины класса G к T. pallidum появляются в крови через 3-4 недели после инфицирования. Их количество постепенно увеличивается, начиная преобладать на шестой неделе заболевания над уровнем иммуноглобулинов IgM. Антитрепонемные антитела класса IgG могут сохраняться на определённом уровне в течение месяцев и лет. Уровень данных антител нарастает в зависимости от длительности заболевания.
Антитела к антигенам трепонем класса IgG играют важную роль в диагностике первичного, вторичного, третичного и латентного сифилиса. Для подтверждения ранее диагностированного инфицирования T. pallidum рекомендуется определение антител класса IgG через один-два месяца после обнаружения антител класса IgM, но обязательно в свежем образце крови. По некоторым данным, антитела класса IgGк Tp17, Tp45 и Tp47 обнаруживаются при первичном сифилисе на его более поздних стадиях. Анти-Tp45 и анти-Tp47 IgG чаще встречаются при латентной форме сифилиса. Через 24 месяца после проведенной патогенетической терапии у пациентов с первичным и вторичным сифилисом антитела класса IgGметодом иммуноблотинга не детектируются.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Мембранный белок TpN47: отрицательный.
Мембранный белок TpN17: отрицательный.
Мембранный белок TpN15: отрицательный.
Что может влиять на результат?
35 Treponema pallidum, IgG, титр
40 Treponema pallidum, IgM, титр
49 Treponema pallidum, антитела
50 Сифилис RPR (антикардиолипиновый тест / микрореакция преципитации), титр
37 Treponema pallidum, IgG в ликворе
34 Сифилис РПГА (реакция пассивной гемагглютинации), титр
53 anti-Treponema pallidum, IgM (иммуноблот)
Кто назначает исследование?
Дерматолог, дерматовенеролог, гинеколог, уролог, инфекционист, терапевт, врач общей практики, педиатр.
Все о тесте на ВИЧ: когда делать и какой лучше?
Скрининговые и подтверждающие тесты. Иммуноблоттинг, ИФА и ПЦР. Точность экспресс-тестов и адреса для анонимного тестирования.
У каждого есть ВИЧ-статус, только у одних он положительный, а у других — отрицательный. Однако знать его необходимо, особенно в российских реалиях, когда в стране эпидемия, и уже более одного процента населения живет с вирусом.
Для диагностики вируса иммунодефицита человека существует несколько видов тестов, причем их классификация сложна лишь на первый взгляд, на самом деле она весьма логична. Главное — помнить, что, несмотря на высокую точность анализов, ни один тест не найдет вирус сразу после заражения.
Скрининговые (поисковые) тесты
Они помогают заподозрить инфекцию, но их результаты надо подтверждать другими анализами. Для скрининга используют тесты либо на антитела, либо на антигены/антитела.
ИФА (иммуноферментый анализ).
Этот метод служит не для обнаружения самого вируса, а антител, которые наша иммунная система вырабатывает для борьбы с ним.
Существует несколько поколений ИФА:
Современный ИФА четвертого поколения позволяет обнаружить антитела, появляющиеся в крови с 30-го (цифры согласно клиническим рекомендациям Минздрава) дня инфицирования (по данным Центра контроля и профилактики заболеваний в США CDC — c 23 по 90 день). Он проводит комбинированный анализ, одновременно проверяя: есть ли в крови белковые «обломки» ВИЧ (антигены), а также антитела.
За счет своей простоты и дешевизны этот метод используется чаще всего, в том числе на его основе работают экспресс-тесты.
Подтверждающие тесты
Как следует из названия, они позволяют наверняка убедиться в наличии или отсутствии вируса иммунодефицита у человека. Их минус в сложности и дороговизне.
Иммуноблоттинг помогает проверить результаты скрининговых анализов и уточнить, каким видом вируса инфицирован человек: ВИЧ-1, ВИЧ-2 или обоими. Этот метод обладает высокой точностью, чувствительностью, но дорог и сложен в исполнении. Он является комбинацией ИФА и электрофореза, что позволяет определить антитела к специфическим антигенам ВИЧ-1 (gp160, gp120, gp41).
ПЦР (полимеразная цепная реакция). Тест способен находить генетический материал ВИЧ (ДНК/РНК), то есть проверяет, есть ли непосредственно вирус в крови. Нуклеиновые кислоты могут обнаруживаться уже на 7-й день после инфицирования (по данным CDC — c 10 по 33 день).
Кроме того, ПЦР бывает качественным и количественным. В последнем случае можно отслеживать вирусную нагрузку (концентрацию вируса в крови и других биологических жидкостях) у людей с ВИЧ, оценивая эффект терапии.
А я могу сдать сразу иммуноблот или ПЦР, чтобы узнать свой ВИЧ-статус?
Иммуноблот используют специальные лаборатории центров по борьбе со СПИДом. Пробы крови направляются туда для перепроверки уже положительных первичных скрининговых анализов. Сразу сдать его не получится, даже в платных клиниках.
ПЦР, наоборот, можно сдать в любой момент, но только обратившись в коммерческую лабораторию. В СПИД-центрах его делают также для перепроверки ранее положительного теста. Да, ПЦР позволяет максимально быстро (в течение 7—10 дней после инфицирования) обнаружить ВИЧ, но и у него есть недостатки:
Точность большинства экспресс-тестов при хронической (длительно текущей) ВИЧ-инфекции достаточно высока (> 99 % чувствительности и специфичности), но все равно чуть ниже лабораторных анализов.
Сегодня среди них наиболее популярны тесты слюны (или околодесневой жидкости) и крови. Их можно либо купить самому, либо получить бесплатно в ВИЧ-сервисных организациях.
Важно помнить! Если такой тест оказался положительным, результат необходимо как можно быстрее перепроверить более точным методом.
Где я могу сделать тест на ВИЧ анонимно и бесплатно?
Можно пойти в местный СПИД-центр, кабинеты анонимного консультирования или в некоммерческие организации (например, фонд «СПИД.ЦЕНТР» Адрес: ул. Нижняя Сыромятническая д. 11 к 1, офис 313). Или в Центре-СПИД по Московской области (ул. Щепкина, 61/2, корп.8).
Анализ на ВИЧ бесплатный и анонимный, прикрепление к поликлинике и регистрация не требуются. После сдачи теста выдается идентификационный номер, по которому можно будет узнать результат.
Методом иммуноблоттинга определяют что
Иммуноблот антифосфолипидных антител – иммунологическое исследование, позволяющее в одном лабораторном тесте провести анализ на несколько аутоантител, ассоциированных с развитием антифосфолипидного синдрома.
APS Immunoblotting, Antiphospholipid Antibodies Assay, Western Blot Analysis for the detection of Antiphospholipid Syndrome.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Антифосфолипидный синдром – аутоиммунное заболевание, клинически характеризующееся артериальными и венозными тромбозами, акушерской патологией (прежде всего – привычное невынашивание беременности в I и II триместрах и преждевременные роды), тромбоцитопенией и связанное с циркуляцией в крови антифисфолипидных антител.
Антифосфолипидные антитела не только являются лабораторным маркером АФС, но и играют ведущую роль в патогенезе его клинических проявлений. АФЛА обладают способностью воздействовать на процессы, составляющие основу регуляции системы свертывания крови, сдвигая равновесие в ней в сторону гиперкоагуляции – то есть тромбообразования. Процесс тромбообразования включает взаимодействие АФЛА с фосфолипидами мембран тромбоцитов, эндотелия (клеток, выстилающих изнутри кровеносные сосуды) и связанными с фосфолипидами плазменными белками. При АФС потенциально могут поражаться сосуды любого калибра – от капиллярного русла до крупных артерий, что обуславливает чрезвычайно разнообразный спектр клинических проявлений заболевания.
Антифосфолипидные антитела представляют собой семейство иммуноглобулинов разных классов (IgA, IgM и IgG), которые распознают определенные участки молекул фосфолипидов. Однако, согласно последним исследованиям, выяснилось, что главными мишенями АФЛА являются не сами фосфолипиды, а связывающиеся с ними белки плазмы, так называемые кофакторы. Комплекс кофактор-фосфолипид формирует новую молекулярную последовательность, к которой вырабатываются специфические антитела.
Таким образом, АФЛА реагируют с гетерогенной группой фосфолипидов и белковых антигенов плазмы крови, к которым относятся:
Повышенный риск развития инфаркта миокарда на фоне АФС был подтвержден после обнаружения в спектре АФЛА антител к окисленным липопротеинам низкой плотности, играющих ведущую роль в патогенезе атеросклероза.
Используемые в настоящее время диагностические критерии антифосфолипидного синдрома, принятые в 2006 году в Сиднее, помимо двух клинических параметров (тромбозы и акушерская патология), включают также три лабораторных признака – волчаночный антикоагулянт (определяется в фосфолипид-зависимых тестах на свертывание крови), а также антитела к кардиолипину и антитела к β2-гликопротеину I классов IgM и IgG, определяемые методом иммуноферментного анализа.
Антитела к кардиолипину являются основной фракцией АФЛА, их присутствие обычно ассоциировано с развитием тромбозов и тромбоцитопений. Выявление повышенного титра антител к кардиолипину на фоне клинической картины тромбозов является основанием для постановки диагноза «АФС».
Антитела к β2-гликопротеину I. β2-гликопротеин I – белок сыворотки, обладающий естественной антикоагулянтной активностью. Циркулирующие АФЛА распознают антигенные структуры, формирующиеся при взаимодействии β2-гликопротеина I и кардиолипина. Антитела к кардиолипину и β2-гликопротеину I чаще обнаруживаются у пациентов с первичной формой АФС, а в клинической картине у них преобладают тромбозы глубоких вен и эмболия легочной артерии.
Несмотря на высокую специфичность, применение для диагностики АФС только этих лабораторных критериев не всегда достаточно – тесты могут быть отрицательными при наличии клинических проявлений антифосфолипидного синдрома. Поэтому при наличии у пациента симптомов АФС и отрицательных результатах критериальных лабораторных параметров дополнительно используют определение антител к другим фосфолипидам) и кофакторным белкам.
Антитела к аннексину V. Роль аннексина V особенно важна для предотвращения тромбообразования в сосудах плаценты. Этот блок представлен во многих тканях, но в основном на эндотелиальных клетках и в плаценте. Аннексин V играет роль в предотвращении свертывания крови, конкурируя с протромбином (фактор свертывания крови) за связывание с фосфатидилсерином на оболочке клеток эндотелия и трофобласта. Молекулы аннексина V формируют блокирующий слой, и на поверхности трофобласта не происходит тромбообразования. У больных АФС антитела к этому белку вытесняют его с поверхности эндотелиоцитов и клеток трофобласта, что приводит к тромбозам сосудов плаценты и потере беременности. Антитела к аннексину V чаще выявляют при вторичном антифосфолипидном синдроме (возникающем на фоне других аутоиммунных заболеваний), соответственно, в клинической картине таких пациенток чаще встречается синдром привычного невынашивания беременности.
Антитела к тромбину – один из наиболее чувствительных тестов для диагностики антифосфолипидного синдрома. Наличие этих антител ассоциировано с развитием тромбоэмболических осложнений примерно в 70 % случаев – это самый высокий показатель среди всех маркеров АФС.
Для исследования широкого спектра антифосфолипидных антител используется метод иммунного блотинга. В его основе лежит иммунологическое взаимодействие антитела со специфичным антигеном. Выпускаемые производителем тест-системы для иммуноблота содержат нитроцеллюлозные полоски, на которых фиксированы антигены фосфолипидов и кофакторных белков. На полоску наносят исследуемую сыворотку, при наличии в ней АФЛА они связываются каждый со своим антигеном. Визуализацию образованных иммунных комплексов проводят путем добавления специального фермента и красителя. При наличии в сыворотке антифосфолипидных антител на полоске в зонах, соответствующих отдельным антигенам, появятся окрашенные полосы – так фиксируется положительный результат. Интенсивность окраски полосы можно дополнительно описывать количеством плюсов – это косвенно отражает концентрацию и аффинность (степень сродства) антител.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Что может влиять на результат?
Около 5 % здоровых людей имеют повышенный титр АФЛА, чаще это лица пожилого возраста – с возрастом процент АФЛА-позитивных людей, не страдающих АФС, увеличивается. Частота выявления антифосфолипидных антител увеличивается также у больных воспалительными, аутоиммунными и инфекционными заболеваниями (сифилис, ВИЧ-инфекция, вирусный гепатит С, герпес-вирусная инфекция), злокачественными новообразованиями, а также на фоне приема некоторых лекарственных препаратов (психотропные средства, оральные контрацептивы). Таким образом, любой из лабораторных признаков при отсутствии клинических симптомов не является достаточным условием для постановки диагноза «АФС».
Помимо первичного антифосфолипидного синдрома, существует также вторичный, возникающий на фоне других заболеваний соединительной ткани. При этом у некоторых пациентов появление признаков АФС может предшествовать появлению симптомов первичного соединительнотканного заболевания (системная красная волчанка, узелковый периартериит, системная склеродермия, ревматоидный артрит). Поэтому при обследовании пациентов с предполагаемым АФС в программу диагностики следует включать определение антинуклеарного фактора в качестве скринингового теста.
Кто назначает исследование?
Гематолог, ревматолог, акушер-гинеколог, ангиохирург, пульмонолог, терапевт, врач общей практики.