методы дробной стерилизации чем обусловлено их применение
Методы стерилизации
Как проводится стерилизация?
Стерилизации подлежат все инструменты многократного использования, которые контактируют с кожей и слизистыми оболочками клиента и могут их травмировать, а также изделия, непосредственно контактирующие с кровью.
Исходя из этого утверждения, стерилизационной обработке подлежат:
Кроме того, в медицинских учреждениях обработке подвергаются белье, перевязочные материалы, медицинские тапочки и перчатки, дренажные трубки, зонды и пр.
Добиться полной стерильности инструментов можно лишь путем проведения последовательной обработки, включающей дезинфекцию, предстерилизационную очистку (ПСО) и стерилизацию. Каждый из этих этапов выполняет свою функцию. Нельзя приступать сразу же к стерилизации, игнорируя предварительное проведение дезинфекции и ПСО. Такой подход лишь помешает качественному проведению обеззараживания инструментов. А это чревато заражением инфекциями, как клиентов, так и сотрудников.
Методы стерилизации
Существует несколько методов. При выборе метода необходимо учитывать материал, из которого изготовлено изделие/инструмент, количество обрабатываемых изделий, финансовые возможности учреждения и прочие факторы.
Различают такие методы стерилизации изделий и инструментов:
Каждый из методов обладает своими преимуществами и недостатками.
Особенности физических методов стерилизации
Физические методы, по сути, представляют собой обработку инструментов высокой температурой. К этой категории относят паровую, воздушную и гласперленовую стерилизацию. Проведение физической стерилизации требует использования определенного оборудования. В целом, это наиболее часто используемый метод обработки, который помогает добиться качественного обеззараживания инструментов.
Суть паровой стерилизации заключается в обработке инструментария водяным паром, подаваемым под высоким давлением. Для этого используют паровые стерилизаторы — автоклавы. Это достаточно громоздкое и дорогое оборудование, которое могут себе позволить большие учреждения, например, больницы. Температурный режим в автоклавах варьирует в пределах 110-135°С, время обработки — всего лишь 5-20 минут. Это самый эффективный и быстрый метод стерилизации.
Воздушный метод обработки это не что иное, как обработка инструментов сухим горячим воздухом. Стоит отметить, что воздушные стерилизаторы (они же сухожаровые шкафы) меньше в размере и дешевле автоклавов. Поэтому большинство салонов красоты и студий ногтевого сервиса практикуют этот вид дезинфекции. Впрочем, у воздушного метода есть и свои относительные недостатки. Так, для стерилизации сухим воздухом требуются еще большие значения температуры — 160-180°С, а время стерилизации увеличивается до 30-150 минут.
Особенность проведения гласперленовой стерилизации заключается в использовании аппарата, заполненного кварцевыми шариками. При включении аппарата шарики нагреваются до 180-240°С, благодаря чему происходит оббезараживание. Гласперленовые стерилизаторы имеют небольшие размеры, а поэтому подходят для обеззараживания только мелких инструментов. Этот метод обладает существенными недостатками. Во-первых, в аппарат невозможно погрузить большой инструмент целиком, а значит, его обработка будет неполной. Во-вторых, не существует методов контроля работы гласперленовых стерилизаторов. Учитывая эти нюансы, контролирующие органы не рекомендуют использовать этот вид стерилизации в профессиональной деятельности.
Особенности химического метода стерилизации
Химический метод — обеззараживание инструментов и изделий различными химическими средствами. Этот метод особенно ценен для обработки изделий, изготовленных из термолабильных материалов (к примеру, из стекла, пластмасс или резины). В частности его применяют для стерилизации эндоскопов. Еще одним преимуществом метода можно назвать его дешевизну. Однако химический метод стерилизации достаточно трудоемкий, что можно расценивать как недостаток.
Для проведения стерилизации используют контейнер, который наполняют раствором химического средства. В наполненную емкость полностью погружают использованные инструменты, при этом они не должны лежать плотно друг к другу. Время экспозиции зависит от используемого химического средства и может составлять от 60 до 600 минут. По завершению обработки инструменты вынимают стерильными пинцетами и промывают в стерильной воде. Обработанные изделия хранят в стерильных контейнерах не более трех дней.
Особенности газового метода
Газовый метод в РФ нельзя назвать популярным. Обработка в газовых стерилизаторах производится при температурах до 80°С и с использованием газов: оксида этилена, озона, паров раствора формальдегида. Одной из причин непопулярности газовой стерилизации можно назвать дороговизну самого стерилизационного оборудования.
Газовую стерилизацию, главным образом, проводят для обработки термолабильных изделий из резины и пластмассы, инструментов с зеркальной поверхностью, оптических эндоскопов, кардиостимуляторов. Но стоит отметить и тот факт, что обработка газом требует значительного времени экспозиции. Так, время стерилизационной выдержки при обработке парами формальдегида составляет 120-180 минут, озоном — 240-960 минут. Еще одним недостатком метода является токсичность газов.
Контроль качества стерилизации
От соблюдения методики проведения стерилизации и исправности оборудования зависит качество обеззараживания инструментов. Оценить качество проведения позволяют методы контроля.
Проведение физического метода контроля невозможно без использования приборов, фиксирующих показатели температуры, давления и времени. Например, соответствие температурного режима нормам оценивают с помощью максимальных термометров, которые помещают в стерилизатор вместе с обрабатываемыми инструментами.
Химический метод контроля базируется на использовании специально разработанных химических полосок с индикаторами. Тест-полоски укладывают в стерилизаторе в определенных точках. После проведения стерилизационной обработки осматривают тест-полоски, которые при правильном проведении стерилизации меняют цвет. Если же тест-полоски не изменили цвет — значит, инструменты остались нестерильными.
Биологический метод контроля представляет собой использование биотестов. Это флаконы, обсемененные тест-микроорганизмами, которые во время проверки размещают в стерилизаторе. Далее биотесты подвергаются бактериологическому исследованию. Если на исследуемых образцах отсутствует рост культур — это говорит в пользу эффективного проведения стерилизации.
Контроль качества — это один из основных моментов, на который обращают внимание контролирующие органы. Стоит отметить, что руководителям медицинских учреждений и салонов красоты стоит внедрить эти методы контроля в свою будничную практику. Это позволит выявить и устранить возможные ошибки при проведении стерилизации, а также гарантировать клиентам стопроцентную стерильность используемых инструментов.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
ВНИМАНИЕ: Уважаемые клиенты и дистрибьюторы!
Стерилизация
Стерилизация — это обеспложивание, т. е. полное освобождение объектов внешней среды от микроорганизмов.
Стерилизацию проводят различными способами: физическими (воздействие высокой температуры, ультрафиолетовых лучей, использование бактериальных фильтров); химическими (использование различных антисептиков для консервирования питательных сред); биологическими (применение антибиотиков).
Целесообразность использования того или иного способов стерилизации обусловлена особенностями материала, подлежащего стерилизации, его физическими и химическими свойствами.
В лабораторной практике обычно применяют физические способы стерилизации.
Прокаливание в пламени горелки или спиртовки (фламбирование) — способ стерилизации, при котором происходит полное обеспложивание объекта, гак как погибают не только вегетативные клетки, но и споры микроорганизмов. Обычно прокаливают бактериологические петли, шпатели, предметные и покровные стекла, мелкие инструменты.
Стерилизацию сухим жаром проводят в сушильных шкафах (стерилизаторах), представляющих собой термостат с электрическим обогревом, в котором автоматически на заданием уровне может поддерживаться высокая температура. Этим способом стерилизуют лабораторную посуду, предварительно тщательно вымытую, высушенную и плотно завернутую в бумагу.
Стерильность сухим паром при 160-165 °С обеспечивается не менее чем за 90 мин, при 180 °С — не менее чем за 30 мин.
Жидкости (питательные среды, физиологический раствор и др.), предметы из резины и синтетических материалов стерилизовать сухим жаром нельзя, так как жидкости выкипают и выливаются, а резина и синтетические материалы разрушаются. Питательные среды и другие жидкости стерилизуют нагревом в парах воды.
Стерилизация паром может проводиться паром под давлением и текучим паром. Чаще применяют первый способ.
Стерилизацию паром под давлением производят в автоклаве. Способ основан на воздействии на стерилизуемые материалы насыщенного водяного пара под давлением, выше атмосферного. В результате такой обработки погибают вегетативные и споровые формы микроорганизмов.
Автоклав представляет собой двухстенный массивный котел, снаружи обшитый металлическим кожухом, с герметически закрывающейся крышкой, которая плотно прижимается к котлу откидывающимися болтами с барашками. За счет кипения воды и герметизации в автоклаве создается повышенное давление, позволяющее поднять температуру выше 100 °С.
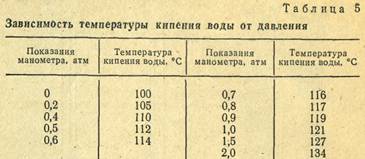
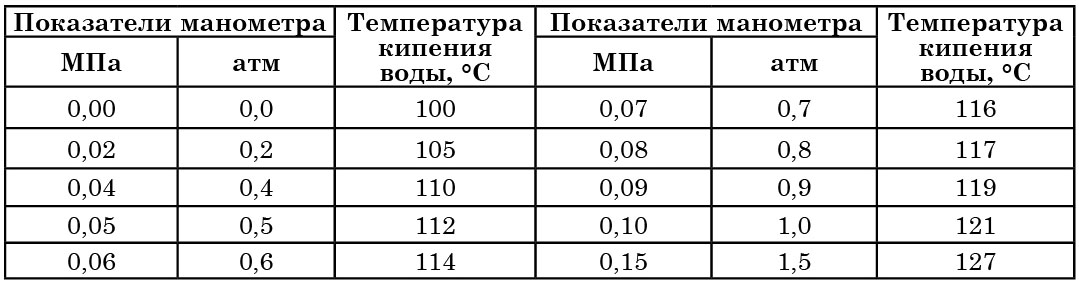
Каждому значению избыточного давления чистого водяного пара, которое фиксируется манометром, устанавливаемым на автоклаве, соответствует определенная температура кипения воды (табл. 5).
В автоклавах обрабатывают питательные среды, физиологический раствор, воду, лабораторные приборы и мелкое оборудование, имеющее резиновые детали, и др.
Температура и длительность автоклавирования питательных сред определяются их составом. Например, простые среды (мясопептонный агар, мясопептонный бульон) стерилизуют 20 мин при 120 °С. Однако при этой температуре нельзя стерилизовать среды, содержащие нативные белки, углеводы и другие легко изменяющиеся от нагревания вещества. Среды, имеющие углеводы, стерилизуют в автоклаве при температуре 112°С в течение 10-15 мин или дробно при 100 °С в кипятильнике Коха.
Различные жидкости, приборы, имеющие резиновые шланги, пробки, бактериологические фильтры и т. д. стерилизуют 20 мин при температуре 120 °С.
В автоклавах обезвреживают также инфицированный материал. Чашки и пробирки, содержащие культуры микробов, помещают в специальные металлические ведра или баки с отверстиями в крышке для проникновения пара и стерилизуют в автоклаве при температуре 120 °С в течение часа. Таким же образом стерилизуют инструменты после работы с бактериями, образующими споры.
К работе с автоклавом допускаются специально подготовленные люди, которые должны строго и точно выполнять правила, указанные в инструкции, прилагаемой к аппарату.
Различные питательные среды и другие материалы для заготовки впрок разливают в пробирки, колбы и закрывают ватными пробками. После обработки в автоклаве они хранятся длительное время, не подвергаясь порче, и используются по мере надобности.
В лабораторной практике для получения эффекта стерильности при температуре, не превышающей 100 °С, иногда пользуются кипятильником Коха. Это металлический цилиндрический сосуд, на дно которого наливается вода; над водой, на решете, помещают стерилизуемые предметы. При кипячении воды все предметы оказываются в атмосфере пара (при температуре 100 °С), вытекающего через неплотно закрывающуюся крышку, отчего и возникло выражение «стерилизация текучим паром».
Однократное прогревание текучим паром в течение часа не приводит к гибели споровых микробов. Достичь этого можно, прибегнув к двукратному повторному нагреванию, которое проводят с интервалом 24 ч по часу. Это так называемая дробная стерилизация.
Учитывая, что температура может существенно влиять на развитие психрофилов, мезофилов, термофилов, при выращивании каждой группы следует создавать необходимые температурные условия; их поддерживают в термостатах — лабораторных шкафах с двойными стенками, теплонагревательным элементом и терморегулятором.
Методы стерилизации



Цель процесса стерилизации состоит в полном удалении или уничтожении всех живых микроорганизмов и спор внутри или на поверхности предмета. Стерилизации подвергаются питательные среды, лабораторная посуда, инструменты, растворы и т. д. Можно выделить термическую и холодную стерилизацию.
К методам термической стерилизации относят: прокаливание и обжигание в пламени спиртовки; кипячение; сухожаровую (горячим паром) стерилизацию; стерилизацию насыщенным паром под давлением (автоклавирование); дробную стерилизацию (тиндализацию), пастеризацию.
Прокаливание и обжигание в пламени – наиболее быстрые и доступные методы стерилизации. Однако их использование ограничивается только термоустойчивыми материалами. Такими методами стерилизуют бактериологические петли, иглы, шпатели, пинцеты, предметные и покровные стекла, фарфоровые ступки и другие инструменты.
Кипячение – простейший способ стерилизации. Кипячением в дистиллированной воде стерилизуют мембранные фильтры. Режим стерилизации для мембранных фильтров – 30 – 60 мин с момента энергичного закипания воды. Металлические инструменты, мелкие стеклянные детали лучше всего кипятить в специальных закрытых приборах – стерилизаторах.
В микробиологической практике таким способом стерилизации пользуются редко в связи с тем, что продолжительное кипячение может повредить обрабатываемый материал, а сокращение времени кипячения может не обеспечить стерильности.
Дробная стерилизация (тиндализация или стерилизация текучим паром) используется для стерилизации питательных сред и растворов, которые портятся при использовании температур выше 100 °С. Метод разработан в 1877 году Дж. Тиндалем и согласно этому методу, жидкость доводят до 100 °С и продолжают выдерживать при этой температуре 10 мин. За это время все вегетативные клетки погибают, жизнеспособными остаются только споры. Затем жидкость охлаждают до температуры, оптимальной для прорастания спор (30 °С) и через несколько часов снова пропускают пар. Двух-трех подобных циклов обычно бывает достаточно для уничтожения всех имеющихся спор. Эффективность этого метода особенно велика потому, что нагревание обычно приводит к активации спор. Тиндализацию проводят либо с помощью пара, подаваемого от внешнего источника, либо в специальных аппаратах. Резервуар с кипящей водой расположен в нижней части аппарата, над ним расположена сетка с устанавливаемыми стерилизуемыми растворами.
Пастеризация заключается в однократном прогреве материала при температурах ниже 100 °С и направлена на уничтожение вегетативных клеток. Этот метод широко используется в пищевой промышленности для обработки продуктов, которые теряют вкусовую и пищевую ценность при кипячении: молока, ягодных и фруктовых сиропов, соков, вин, пива и т. д. В микробиологической практике пастеризацией пользуются для получения накопительных культур спорообразующих бактерий. В лабораторных условиях пастеризацию проводят либо на водяной бане, либо в ультратермостате при следующих режимах: 60 – 70 °С в течение 15 – 30 мин; 80 °С в течение 10 – 15 мин.
Сухожаровая стерилизация или стерилизация сухим горячим воздухомпроводится в сушильных шкафах. Режим стерилизации:
160 – 170 °С на протяжении 2 часов. При этом предполагается, что погибают как клетки, так и споры. Таким способом стерилизуют стеклянную посуду, инструменты и др.
Стерилизация насыщенным паром под давлением или автоклавирование – один из наиболее эффективных методов стерилизации, так как стерилизуемый объект подвергается одновременному воздействию как высокой температуры, так и повышенному давлению пара. Погибают как вегетативные клетки, так и споры микроорганизмов. Процесс проводится в специальных приборах – автоклавах, закрывающихся герметично. Основные используемые режимы стерилизации следующие: 15 – 30 мин при избыточном давлении 0,5 атм (температура достигает 110 – 112 °С); 15-45 мин при избыточном давлении 1,0 атм. (температура достигает 121 °С); 10 – 30 мин при избыточном давлении 1,5 атм. (температура достигает 126 °С). Таким способом стерилизуют питательные среды, растворы, посуду, инструменты, фильтры и т. д.
При холодной стерилизации используют химические вещества или проводят воздействие на объект факторами физической природы. Химические методы подавления жизнедеятельности микроорганизмов предполагают использование дезинфектантов и антисептиков, имеющих неспецифический эффект, либо использование антибиотиков и синтетических антимикробных препаратов с избирательным противомикробным действием. Дезинфицирующие вещества классифицируются по группам: кислоты или щелочи, галогены, тяжелые металлы, четвертичные аммониевые основания, фенольные соединения, альдегиды, кетоны, спирты, амины и перекиси. Устойчивость микроорганизмов к их действию может существенно меняться в зависимости от таких факторов как концентрация активного компонента, длительность контакта, рН, температура, влажность, и присутствие органического вещества. Химические средства неспецифического действия используются для обработки помещений, оборудования, различных предметов. Например, спирты используются в концентрации 60 – 70 % и эффективны в отношении вегетативных клеток. Фенолы и их производные применяются для дезинфекции помещений, дезинсекции.
Среди используемых летучих стерилизующих веществ можно указать на окись этилена, окись пропилена, озон, метилбромид, формальдегид, глютаровый альдегид. Указанные вещества могут быть использованы для стерилизации пластмассовых центрифужных пробирок, пластмассовых чашек Петри, оптических инструментов, сыворотки крови и др.
Стерилизация фильтрованием используется для веществ, которые не выдерживают термической обработки (растворов белков, углеводов, витаминов, углеводородов, антибиотиков, сыворотки). Способ заключается в пропускании жидкостей и газов через специальные мелкопористые фильтры (бактериальные), диаметр пор которых не превышает 0,45 – 0,2 мкм. Фильтры задерживают микроорганизмы благодаря поровой структуре их матрикса. Для пропускания раствора через фильтр требуется вакуум или давление. Существуют два основных типа фильтров – глубинные и мембранные. Глубинные состоят из волокнистых или гранулированных материалов, которые спрессованы, свиты или связаны в лабиринт проточных каналов. Частицы задерживаются в них в результате адсорбции и механического захвата в матриксе фильтра. Мембранные фильтры имеют непрерывную структуру и захват ими частиц определяется размером пор. Фильтры содержат различные природные (коалин, асбест, целлюлоза) или синтетические (производные целлюлозы) материалы. Различают фильтры: мембранные, получаемые на основе нитроцеллюлозы; асбестовые или фильтры Зейтца, получаемые на основе смеси асбеста и целлюлозы; фарфоровые или свечи Шамберлана, получаемые из смеси кварцевого песка и коалина, сплавленных между собой; стеклянные, полученные из стекла «Пирекс».
На практике проводят и контроль стерилизации, при котором о работе стерилизующих агентов и аппаратов судят по: 1) эффективности гибели спор в процессе стерилизации; 2) прямым измерением температуры и 3) с помощью химических индикаторов.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
ВНИМАНИЕ: Уважаемые клиенты и дистрибьюторы!
5. МЕТОДЫ СТЕРИЛИЗАЦИИ ПОСУДЫ И ПИТАТЕЛЬНЫХ СРЕД
Основываясь на влиянии внешних условий на микроорганизмы, в микробиологической практике разработан ряд приемов, приводящих микроорганизмы к гибели. Одним из таких приемов является стерилизация.
Под стерилизацией (обеспложиванием) понимают полное уничтожение микроорганизмов и их спор в питательных средах, посуде, на инструментах и других предметах лабораторного оборудования. Для их стерильности наиболее часто пользуются воздействием высокой температуры.
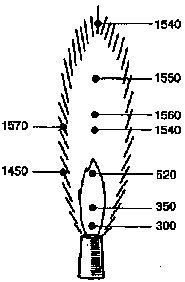
5.1. СТЕРИЛИЗАЦИЯ ОБЖИГАНИЕМ НА ПЛАМЕНИ ГОРЕЛКИ
Небольшие стеклянные (палочка, шпатель) и металлические (игла, петля, пинцет, скальпель) предметы проводят несколько раз через пламя горелки. Стерилизация достигается обугливанием находящихся на их поверхности микроорганизмов. Обжиганием на пламени пользуются и для стерилизации поверхности ватных пробок.
Рис. 14
Значение температуры в разных
участках пламени газовой горелки
5.2. СТЕРИЛИЗАЦИЯ КИПЯЧЕНИЕМ
Стерилизацию металлических инструментов и резиновых трубок проводят кипячением. Так как споры некоторых бактерий сохраняют жизнеспособность при кипячении в воде в течение нескольких часов, то рекомендуется стерилизацию кипячением проводить в 2%-ном растворе карбоната натрия в течение 10 мин. В этих условиях споры погибают.
5.3. СТЕРИЛИЗАЦИЯ СУХИМ ЖАРОМ
Сухим жаром стерилизуют стеклянную посуду. При этом пробирки, колбы предварительно закрывают ватными пробками. Чтобы избежать заражения простерилизованных предметов из воздуха, их перед стерилизацией заворачивают в оберточную бумагу и вынимают только перед работой.
Пипетки перед стерилизацией с концов закрывают ватой. Затем их обертывают длинными полосками бумаги шириной 3,5–4 см. Бумагу наматывают по спирали, начинная с конца пипетки, который будет погружен в среду. Концы обертки закрепляют ниткой. Тонкие пипетки обертывают бумагой вместе по несколько штук.
Чашки Петри заворачивают в бумагу в форме квадрата, сторона которого приблизительно равна трем диаметрам чашки. Чашку Петри помещают на середину листа, загибают его с двух противоположных сторон кверху так, чтобы края налегали друг на друга. Два свободных конца загибают вниз. При таком обертывании у чашек легко различать верх и низ.
Подготовленную таким образом посуду помещают в сушильный шкаф, в котором нагревают ее при температуре 160–170°С в течение 2 ч (с момента установления нужной температуры). При таком нагревании погибают не только бактерии, но и их споры.
Температуру в сушильном шкафу выше 175°С допускать не следует, так как при этом ватные пробки буреют, а бумажная обертка становится ломкой.
5.4. СТЕРИЛИЗАЦИЯ ТЕКУЧИМ ПАРОМ (ДРОБНАЯ СТЕРИЛИЗАЦИЯ), ИЛИ ТИНДАЛИЗАЦИЯ
Питательные среды, воду, резиновые трубки и другие предметы, портящиеся от действия сухого жара, и питательные среды, портящиеся под действием высокой температуры (среды, содержащие молоко, солод, желатину), обеспложивают действием текучего пара.
Стерилизацию текучим паром производят в кипятильнике Коха или в автоклаве с открытым вентилем. Воду в них доводят до кипения, и образующийся пар обтекает стерилизуемые объекты. Температура стерилизуемых питательных сред достигает 100°С. Нагревание в течение 30–45 мин приводит к гибели вегетативных клеток бактерий, но споры их не погибают. Затем жидкость охлаждают до температуры, благоприятной для прорастания спор (до 30°С). Нагревание приводит к активации спор и более быстрому их прорастанию. На следующий день нагревание повторяют. При этом погибают вегетативные клетки, развившиеся из спор. Для обеспечения полной стерильности жидкость оставляют еще на сутки и снова повторяют нагревание. Такую стерилизацию называют дробной или тиндализацией.
5.5. ПАСТЕРИЗАЦИЯ
В основе пастеризации лежит нагревание жидкостей до температуры меньше 100°С. Целью ее является уничтожение неспороносных бактерий в жидкостях, теряющих питательные свойства при кипячении (молоко, пиво, вино и др.). Осуществляется пастеризация путем нагревания жидкостей при 60°С в течение 30 мин, или при 75°С в течение 15 мин, или при 80°С в течение 10 мин.
5.6. ХОЛОДНАЯ СТЕРИЛИЗАЦИЯ
Органические жидкости, не выносящие нагревания, освобождают от бактерий, пропуская через стерильные мелкопористые фильтры. Эти фильтры задерживают микроорганизмы, их называют бактериальными фильтрами.
Бактериальные фильтры имеют разные номера. Фильтры № 1 имеют средний диаметр пор 0,3 мкм и являются наиболее надежными. Фильтры № 5 имеют самые большие отверстия пор, диаметром 1,2 мкм.
Перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в теплую дистиллированную воду и кипятят 30 мин, меняя 2– 3 раза воду.
5.7. СТЕРИЛИЗАЦИЯ ПАРОМ ПОД ДАВЛЕНИЕМ (АВТОКЛАВИРОВАНИЕ)
Наиболее надежным и универсальным методом стерилизации питательных сред и материалов является стерилизация их насыщенным паром под давлением. Производят ее в автоклаве, в котором стерилизуемые объекты нагревают чистым насыщенным паром при давлении выше атмосферного. Когда насыщенный пар встречается с более холодным объектом, он конденсируется, превращаясь в воду. При конденсации выделяется большое количество теплоты, и температура стерилизуемого объекта быстро повышается.
Полная стерилизация питательных сред при 120°С и давлении 0,1 МПа обеспечивается нагреванием в течение 20 мин.
5.7.1. ПРАВИЛА РАБОТЫ С АВТОКЛАВОМ
Стерилизация в автоклаве производится при повышенном давлении, поэтому работа с ним требует определенной осторожности. Исправность автоклава в определенные сроки проверяют специалисты, которые устанавливают следующий срок проверки.
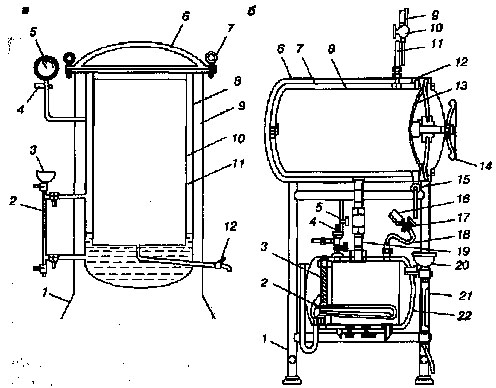
Системы автоклавов различаются, но все они имеют общие принципы устройства (рис. 15), и правила работы с ними однотипны.
Во внутренний котел автоклава (стерилизационную камеру) помещают материал, подлежащий стерилизации.
В водопаровую камеру наливают воду с таким расчетом, чтобы уровень ее в водомерной трубке был между верхней (максимальной) и нижней (минимальной) чертой.
Рис. 15
Устройство автоклавов:
а – вертикальный автоклав: 1 – подставка, 2 – водомерная трубка, 3 – воронка, 4 – предохранительный клапан, 5 – манометр, 6 – крышка, 7 – винтовые зажимы, 8 – котел, 9 – кожух, 10 – камера стерилизации, 11 – водопаровая камера, 12 – паровыпускной клапан;
б – горизонтальный автоклав: 1 – постамент, 2 – нагревательный элемент. 3 – крышка котла, 4 – предохранительный клапан, 5 – вентиль, 6 – кожух, 7 – паровая камера, 8 – стерилизационная камера, 9 – манометр паровой камеры, 10 – трехходовой кран, 11 – сифонная трубка паровой камеры, 12 – опорное кольцо, 13 – крышка паровой камеры, 14 – штурвал, 15 – впускной кран,
16 – манометр котелка, 17 – трехходовой кран котелка, 18 – сифонная трубка котелка, 19 – патрубок, 20 – воронка, 21 – водоуказательная колонка, 22 – котелок.
Крышку автоклава привинчивают болтами к корпусу. Завинчивают болты попарно, крест-накрест, чтобы избежать перекоса крышки, который может возникнуть при завинчивании болтов по кругу.
Открывают краны и включают источник обогрева. Когда пар из выпускного крана начинает выходить непрерывной струей, его закрывают и наблюдают за постепенным повышением давления в рабочей камере по манометру.
Отсчет времени стерилизации начинают с того момента, когда в автоклаве установится заданное давление.
Зависимость давления и температуры в камере автоклава
Между показаниями манометра и температурой кипения воды имеется определенная зависимость (табл. 5). Время от времени эти соотношения следует проверять. Нарушение их указывает на неисправность автоклава и на необходимость его ремонта.
Проверку осуществляют следующим образом: в стерилизационную камеру автоклава помещают 100 г бензойной кислоты с добавлением небольшого количества фуксина или метиленового синего. Если при показании манометра в 0,1 МПа бензойная кислота расплавится, образуя с красителем сплав, то, значит, автоклав дает нужную температуру (120°С).
После окончания заданного срока стерилизации источник нагрева выключают, перекрывают вентиль водопаровой камеры и только после этого постепенно открывают выпускной клапан. При быстром выпускании пара могут быть вырваны ватные пробки из стерилизуемой посуды.
После полного выхода пара отвинчивают болты крышки (снова крест-накрест) и открывают ее, ориентируя крышку на себя для защиты от выходящего пара.
Если во время стерилизации давление начинает подниматься выше заданного уровня, его регулируют, уменьшая нагрев или выпуская часть пара через предохранительный клапан. Последний должен быть отрегулирован так, чтобы при повышении давления излишек пара выходил автоматически.