методы определения подвижности бактерий чем обусловлено самостоятельное движение микроорганизмов
Подвижность бактерий, методы выявления подвижности.
Бактерии, образующие жгутики – подвижны. Поэтому о подвижности бактерий можно судить но наличию
Методы выявления подвижности:
1. Окраска жгутиков по Леффлеру.
2. Исследование интактной культуры:
б) метод ‘висячая капля» каплю бактерий наносят на середину покровного стекла, накладывают на него специальное предметное стекло с углублением, смазанным вокруг вазелином так, чтобы капля находилась в центре лунки, затем препарат осторожно переварачивают.
Далее культуру исследуют в тёмном поле микроскопа или фазовом контрасте.
11. Принципы систематики микробов. Систематическое положение микробов. Таксономические категории. Понятие и критерии вида.
Систематика устанавливает положение живых существ в органическом мире, а также разрабатывает принципы, методы, правила классификации, номенклатуры и идентификации микроорганизмов.
Подходы систематики: геносистематика, хемосистематика, феносистематика и др.
Номенклатура установление соподчинённости и связи между МБ.
Органический мир делится на: надцарства, царства, типы, классы, порядки, семейства, роды, виды,
одного предка, обладающих общим генофондом, экологическим единством и репродуктивной изоляцией.
Подвидовые категории: варианты у бактерий типы у вирусов.
Критерии вида:
а) морфологический; б) территориальные свойства(способность окрашиваться); в) биохимический, г)
серологический (антигенная структура); д) биологический; е) экологический, ж) географический
Классификация микроорганизмов:
I. надцарство Прокариот
1 царство бактерий
1.1. тип Скотобактерии
1.1.1. класс Бактерии
1.1.1.1. порядок Истинные бактерии
1.1 1.2 порядок Спирохеты
1.1.1.3 порядок Акгиномицеты
1.1.2.1. порядок Рикетти
1.1.2.2. порядок Хламидии
1.1.3. класс Моликутес
1.1.3.1. порядок Микоплазмы
III. Царство Вирусов
По классификации Берджи царство Прокариот делится на четыре отдела:
1. Gracilicutes-тонкостенные, грамотрицательные
3. Tenericutes лишены клеточной стенки(сюда включены микоплазмы)
Дата добавления: 2015-02-23 ; просмотров: 4591 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Подвижность бактерий, методы выявления подвижности



Бактерии, образующие жгутики – подвижны. Поэтому о подвижности бактерий можно судить но наличию
Методы выявления подвижности:
1. Окраска жгутиков по Леффлеру.
2. Исследование интактной культуры:
б) метод ‘висячая капля» каплю бактерий наносят на середину покровного стекла, накладывают на него специальное предметное стекло с углублением, смазанным вокруг вазелином так, чтобы капля находилась в центре лунки, затем препарат осторожно переварачивают.
Далее культуру исследуют в тёмном поле микроскопа или фазовом контрасте.
11. Принципы систематики микробов. Систематическое положение микробов. Таксономические категории. Понятие и критерии вида.
Систематика устанавливает положение живых существ в органическом мире, а также разрабатывает принципы, методы, правила классификации, номенклатуры и идентификации микроорганизмов.
Подходы систематики: геносистематика, хемосистематика, феносистематика и др.
Номенклатура установление соподчинённости и связи между МБ.
Органический мир делится на: надцарства, царства, типы, классы, порядки, семейства, роды, виды,
одного предка, обладающих общим генофондом, экологическим единством и репродуктивной изоляцией.
Подвидовые категории: варианты у бактерий типы у вирусов.
Критерии вида:
а) морфологический; б) территориальные свойства(способность окрашиваться); в) биохимический, г)
серологический (антигенная структура); д) биологический; е) экологический, ж) географический
Классификация микроорганизмов:
I. надцарство Прокариот
1 царство бактерий
1.1. тип Скотобактерии
1.1.1. класс Бактерии
1.1.1.1. порядок Истинные бактерии
1.1 1.2 порядок Спирохеты
1.1.1.3 порядок Акгиномицеты
1.1.2.1. порядок Рикетти
1.1.2.2. порядок Хламидии
1.1.3. класс Моликутес
1.1.3.1. порядок Микоплазмы
III. Царство Вирусов
По классификации Берджи царство Прокариот делится на четыре отдела:
1. Gracilicutes-тонкостенные, грамотрицательные
3. Tenericutes лишены клеточной стенки(сюда включены микоплазмы)
Методы контрастирования бактерий, обнаружения подвижности и спорообразования
Приготовления простых препаратов часто бывает недостаточно для обнаружения бактерий в светлом поле микроскопа.
В этом случае применяют иную методику микроскопических исследований (как правило, фазово-контрастную) или окрашивание бактерий.
Приготовление и окрашивание мазка. Использование фазово-контрастной методики предполагает наличие соответствующего микроскопа и приготовление свежих препаратов. Окрашивание состоит из следующих этапов.
Приготовление мазка. Раздавленный растительный материал (пораженная ткань) или культуру микроорганизмов с помощью петли переносят в каплю водопроводной воды на обезжиренном предметном стекле (для обезжиривания стекла выдерживают в хромпике или протирают бензином, ксилолом, смесью соляной кислоты со спиртом) и растирают равномерно по площади 3X1,5 см. При этом надо следить за тем, чтобы плотность бактериальной суспензии была не выше необходимой для слабого помутнения.
Воздушная сушка и фиксация. Полученный мазок высушивают на воздухе и фиксируют путем нагревания. Для этого предметное стекло берут пинцетом или каким-нибудь держателем и мазком вверх трижды медленно проводят через светящуюся часть пламени бунзеновской горелки.
Окрашивание. После фиксации предметное стекло кладут горизонтально на планшет для окрашивания и каплями наносят на мазок фильтрованный раствор соответствующего красителя. Красящий раствор должен покрывать все предметное стекло.
Методы окрашивания и красители. Для быстрого окрашивания бактериальных мазков пригодны основные анилиновые красители. Особенно рекомендуется окрашивание метиленовой синью по Лёффлеру. Вначале готовят насыщенный спиртовой раствор красителя, который можно хранить длительное время. Непосредственно перед окрашиванием 30 мл этого раствора смешивают с 70 мл 0,01%-ного раствора КОН. Время окрашивания составляет 5—8 мин.
При окрашивании карболфуксином по Цилю и Нильсену используется насыщенный спиртовой раствор основного фуксина. Для приготовления красящего раствора 1 часть маточного раствора смешивают с 5%-ным раствором фенола. Время окрашивания — 0,5—1 мин.
Удаление красящего раствора и очистка мазка. После окончания окрашивания красящему раствору дают стечь с предметного стекла, остатки смывают водопроводной водой. Мазок высушивают на воздухе или удаляют капельную жидкость фильтровальной бумагой. Следы красителя на рабочем столе или на руках можно удалить подкисленным спиртом.
Наблюдение. Окрашенные препараты рассматривают с применением иммерсионных объектов с высокой апертурой. Для этого пригодны ахроматы и апохроматы с увеличением 90 X — 100 X или аналогичные объективы. В качестве иммерсионной жидкости используется имеющееся в продаже иммерсионное масло с показателем преломления 1,515.
На окрашенных препаратах определяют: наличие бактерий в препарате; форму бактериальных клеток (округлая, палочковидная, нитевидная и др.); размеры клеток (длина, ширина); вид агрегации (отдельные клетки, группы, зооглеи и т. д.).
Окрашивание по Граму. При идентификации многих фитопатогенных бактерий решающим показателем является окрашивание по Граму. Этот дифференцирующий признак основан на различиях в строении оболочки бактериальных клеток. К грамположительным прежде всего относятся виды Corynebacterium, в то время как большинство других фитопатогениых бактерий реагирует на окрашивание отрицательно. Методика окрашивания состоит в следующем.
— Приготовление мазка на обезжиренном предметном стекле, его высушивание на воздухе и фиксирование нагреванием.
— Нанесение на мазок капли карболового раствора генцианвиолета (торговый препарат или 10 мл насыщенного спиртового раствора генциан-виолета + 90 мл 2,5%-ного фенола), инкубация в течение 2—5 мин.
— Сливание красящего раствора и нанесение на предметное стекло раствора Люголя (торговый препарат или 2 г KI растворить в небольшом количестве дистиллированной воды, добавить 1 г йода и довести объем до 300 мл).
— Промывка 96%-ным спиртом (в химическом стакане) до полного исчезновения следов краски.
— Высушивание (иногда не проводится).
— Контрастное окрашивание карбол-фуксином (маточный раствор или его разведения) в течение 1—2 сек. Карбол-фуксин можно заменить 1%-ным сафранином, увеличив время окрашивания до 3—5 мин.
Далее препарат тщательно промывают в водопроводной воде и высушивают на воздухе.
Результаты окрашивания по Граму можно установить только при хорошем освещении (принцип освещения по Кёлеру), используя иммерсионный объектив и полностью открыв диафрагму. Грамположительные микроорганизмы окрашиваются в темно-синий цвет, грамотрицательные — в бледно-розовый или светло-красный.
Примечание. Для контроля качества окрашивания, подбора концентраций красящих растворов и времени окрашивания настоятельно рекомендуется использовать какой-либо вид бактерий с четко выраженной грамположительной реакцией, например Escherichia coli.
Окрашивание жгутиков. При диагностике бактерий ключевую роль играет форма жгутиков. Их расположение и число можно определить с помощью электронного микроскопа или специального окрашивания. Из-за особой сложности этого процесса разработаны различные способы окрашивания жгутиков. Почти всегда после фиксирования препарата проводят специальную обработку каким-нибудь протравливающим раствором (как правило, содержащим таннин), который вызывает набухание белка жгутиков. Лишь затем приступают к окрашиванию.
Из имеющихся методов в качестве примера приведен относительно простой, но широко применяющийся вариант окрашивания по Лейфсону. Для ознакомления с другими методами окрашивания, например по Пепплеру, Грею, Лёффлеру, можно обратиться к специальной литературе.
Для окрашивания жгутиков используют молодые культуры бактерий, развивавшиеся от 8 до 24 ч при температуре, оптимальной для данного вида (25, 28, 32 или 37 °С). На обезжиренное предметное стекло наносят тонкий мазок, затем на еще влажный препарат — каплю свежеприготовленного и отфильтрованного раствора следующего состава: 1,5%-ный NaCl — 20 мл, 3%-ный таннин — 20 мл, 1,2%-ный спиртовой раствор парароз1аанилина — 20 мл. Далее препарат подсушивают на воздухе.
Время окрашивания — 20—30 мин. Препараты просматривают с иммерсионными объективами (апохромат или ахромат 20X или 100 X) при хорошем освещении. Вместо парарозаанилина можно использовать 1,2%-ный спиртовой раствор фуксина.
Определение подвижности. Признак подвижности имеет особое значение при дифференциации бактериальных возбудителей болезней. Для его определения рекомендованы следующие методы.
1. Небольшое количество исследуемой культуры переносят петлей в каплю водопроводной воды на чистом покровном стекле, которое затем кладут каплей вниз на предметное стекло с шлифованной лункой или на стеклянное кольцо, приклеенное к предметному стеклу. Этот способ носит название «наблюдение в висячей капле»,
2. Из свежей культуры готовят простой микроскопический препарат и рассматривают его при среднем увеличении (объектив 20Х или 40Х) и хорошем освещении. При этом микроскоп фокусируют на край капли и медленно передвигают препарат к ее середине. Вблизи краевой зоны подвижность бактерий видна лучше всего, причем подвижными можно считать только те бактерии, которые совершают направленное или вращательное движение. Дрожание почти на одном месте вызвано броуновским движением молекул и часто встречается у неподвижных бактерий.
Определение спорообразования. Выделив грамположительные бактерии, часто приходится устанавливать, способны ли они к спорообразованию. Как правило, спорообразующие бактерии не являются возбудителями болезней. Признак спорообразования можно установить физиологическим путем (по устойчивости спор к высокой температуре) или с помощью микроскопических препаратов.
Тест с нагреванием. Из двух-трехдневной культуры на косом агаре небольшую порцию исследуемого материала переносят в пробирку с 3 мл питательного бульона (pH 7,0), пробирку помещают на 10 мин в водяную баню при 70—80 °С и затем инкубируют при 28 °С в течение 24 ч. Контролем служит пробирка с инокулированным, но непрогретым бульоном. Если после инкубации появляется отчетливое помутнение бульона, исследуемая бактерия относится к числу спорообразующих.
Микроскопическое определение спорообразования. Споры в бактериальных клетках можно обнаружить в окрашенных препаратах. Во многих случаях для этого достаточно окрашивания метиленовой синью или карболфуксином, а также по Граму, но есть и специальные методы окрашивания спор.
1. Окрашивание по Виртцу: подсушенный на воздухе и фиксированный нагреванием мазок покрывают 5%-ным раствором малахитовой зелени, затем осторожно нагревают предметное стекло над пламенем горелки до полного испарения красителя.
Добавление и испарение красителя повторяют несколько раз до появления пленки с металлическим блеском. Избыток краски смывают 2—3 мин под струей водопроводной воды. Затем препарат помещают в стакан с водой еще на 4—5 мин. После высушивания на воздухе или фильтровальной бумагой проводят контрастное окрашивание 10%-ным раствором сафранина (10 мин), вновь промывают препарат водопроводной водой, осторожно обсушивают и просматривают с масляной иммерсией. Споры окрашиваются в зеленый цвет, вегетативные части клетки — в красный.
2. Окрашивание по Мёллеру: высушенный на воздухе и фиксированный теплом мазок покрывают карболфуксином, нагревают над слабым пламенем горелки до образования пузырьков и промывают 96%-ным спиртом до полного удаления остатков красителя. После промывания водопроводной водой и подсушивания препарат контрастно окрашивают метиленовой синью (1 часть маточного раствора и 9 частей дистиллированной воды) и просматривают с масляной иммерсией. Споры окрашиваются в красный цвет, вегетативные части клеток — в синий.
Более подробные описания методов окрашивания приведены в специальной литературе.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Определение подвижности микроорганизмов
Задание № 1 для самостоятельной подготовки студентов 111-112 групп по дисциплине «МИкробиология и Основы иммунологии» ( Направление 36.03.01 )
1. Повторить темы: «Простые и сложные способы окрашивания. Окраска по Граму»
2. Изучить самостоятельно тему: « Споры и капсулы. Окраска спор и капсул. Исследование бактерий на подвижность». Подготовиться к тестированному контролю.
Задание 1. Повторить Простые и сложные способы окрвшивания. Окраску по Граму.
Тема: Приготовление, фиксация и окраска препаратов. Микробиологические краски. Простые и сложные методы окрашивания микроорганизмов (по Граму)
2.1 Цель занятия. Овладеть методикой приготовления мазка-препарата для микроскопии из микробной взвеси. Приготовить, окрасить (фуксином или метиленовой синькой) и зарисовать препараты из микробных культур. Отработать методику простого и сложных методов окраски приготовленных препаратов.
Теоретический материал
2.3.1 Приготовление бактерийных препаратов для микроскопирования. Для обнаружения микроорганизмов в исследуемом материале и изучения их тинкториально-морфологических свойств, необходимо приготовить препараты, окрасить их и изучить под микроскопом.
Препараты для микроскопирования готовят на предметных стеклах. Материалом служат взвеси бактериальных культур, выросших на питательных средах, молоко, мясо. Из таких материалов готовят препараты-мазки. Из тканей различных органов – препараты-отпечатки.
Предметные стекла, используемые при этом, должны быть чистыми и хорошо обезжиренными. Стекла хранят в банках с притертыми пробками в смеси из равных частей этилового спирта и эфира или в 96,6% спирте ректификате. Возможно, обезжиривание предметных стекол кусочком мыла.
Нанесение микробной взвеси на стекло производят бактериологической петлей или пастеровской пипеткой. Бактериологические петли готовят из платиновых или нихромовых нитей в виде замкнутой петли, диаметром 2-3 мм.
Приготовление препарата для микроскопии складывается из следующих этапов:
1.Обезжиривание предметного стекла.
В правильно приготовленном препарате микробные клетки должны быть расположены в один слой.
Обезжиривание предметного стекла. Стекла, не бывшие в употреблении, сначала моют в воде, затем выдерживают в смеси спирта-эфира, фламбируют над пламенем горелки – это и есть обезжиривание. Новые стекла можно готовить путем кипячения 10 мин. в 1% растворе натрия гидрокарбоната (соды), промывания в дистиллированной воде с добавлением 0,5% соляной кислоты с целью нейтрализации и окончательного споласкивания в дистиллированной воде.
Приготовление мазка. Для приготовления мазка из культуры, выращенной на плотной питательной среде, на обезжиренное предметное стекло наносят бактериологической петлей небольшую каплю стерильного физиологического раствора. Затем петлю прокаливают до красна (стерилизуют фламбированием), внося ее в пламя горелки в вертикальном положении, после чего из пробирки с культурой вынимают пробку захватывая ее мизинцем и ладонью правой руки (рисунок 2.1).
Пробирку с культурой следует держать левой рукой, пробкой к себе. Вынув пробку, края пробирки обжигают и вносят в нее бактериологическую петлю. Прежде чем захватить небольшое количество культуры, петлю охлаждают, касаясь стенок пробирки. Петлю с культурой осторожно вынимают, еще раз обжигают края пробирки, а культуру вносят в приготовленную ранее каплю физраствора, тщательно размешивают и равномерно распределяют по стеклу в виде небольшого овала или круга (1,5-2 см в диаметре). По окончании приготовления мазка петлю вновь прокаливают.
Для приготовления мазка из бульонной культуры на предметное стекло петлей 1-2 раза наносят исследуемый материал и равномерно распределяют.
Приготовленный препарат высушивают на воздухе, просохший мазок фиксируют.
Пастеровскими пипетками делают мазки из жидкостей и бульонных культур. Пипетка должна быть стерильной. Над пламенем горелки отламывают запаянный конец и набирают материал. После нанесения капли культуры на предметное стекло и ее распределения пипетку отпускают в сосуд с дезинфицирующим раствором. Мазок высушивают при комнатной температуре.
Фиксация мазка. Фиксацию мазка проводят физическим и химическим способами.
Физический способ фиксации – над пламенем горелки. Для этого предметное стекло с мазком берут большим и указательным пальцами или пинцетом и проводят 3-4 раза над пламенем горелки, каждый раз, прикладывая стекло к коже руки. Ощущение жжения свидетельствует о том, что мазок фиксирован. При этом бактерии погибают, плотно прикрепляясь к стеклу. Этот способ нельзя применять при исследовании клетки.
Химический способ используют для фиксации мазков из крови и мазков-отпечатков, так как при действии высоких температур разрушаются клеточные элементы. Для этого препараты погружают в фиксирующую жидкость:
Рисунок 2.1 Схема приготовления препарата-мазка
1) Закрепить бактерий на стекле.
2) Умертвить микробные клетки, обезопасив себе работу.
3) Коагулировать белок клетки, после чего она лучше воспринимает краситель.
2.3.2 Окраска мазка. В микробиологической практике для окрашивания микробов используют анилиновые красители (основные, кислые и нейтральные). Наиболее часто употребляемыми красителями являются следующие:
-синие – метиловый синий, водный синий, опаловый синий;
-красные – фуксин основной, конго красный, сафранин, нейтральный красный, фуксин кислый;
-фиолетовые – метиловый фиолетовый, кристаллический фиолетовый, генцианвиолет;
-зеленые – малахитовый зеленый, бриллиантовый зеленый, светло-зеленый;
-желто-коричневые – хризоилин, везувин.
При простом методе окраски применяют только один краситель. Раствором краски покрывают охлажденный фиксированный мазок, выдерживают 2-5 минут, краску сливают, мазок промывают водой, высушивают фильтровальной бумагой и микроскопируют под иммерсией. Этот способ окраски позволяет обнаружить в материале микроорганизмы и дать некоторые представления об их морфологии.
При сложных методах окрашивания применяют несколько растворов красителей и реактивов. Они основаны на физико-химических различиях состава микробных клеток. Эти методы позволяют помимо морфологии бактерий, определить их тинкториальные особенности (различное окрашивание при использовании специальных методов) и наличие или отсутствие структурных элементов клетки (капсула, спора), что имеет важное дифференциально-диагностическое значение. Химический состав и строение клеточной стенки микробов различны, поэтому они окрашиваются одними и теми же красителями по-разному и неодинаково отдают их при последующем обесцвечивании этиловым спиртом, кислотами и другими реактивами. Части микробной клетки избирательно реагируют на красящие растворы. На этом свойстве основаны сложные (дифференциальные) методы окрашивания микробов. Для сложного окрашивания используют несколько красителей. В лабораторной практике применяют методы Грама, Циля–Нильсена, Козловского и др.
2.3.3 Окраска по Граму. Метод Грама (модификация по Синеву). Этот метод позволяет все микроорганизмы разделить на две группы: грамположительные (Гр+) и грамотрицательные (Гр–).
На фиксированный мазок помещают:
1.Кусочек фильтровальной бумаги, пропитанной 1%-ым спиртовым раствором генцианвиолета. Наносят на бумажку 2-3 капли воды и окрашивают 2-3 минуты. Бумагу снимают, мазок не промывают.
2.Наносят раствор Люголя на 2 минуты, смывают водой.
3.Обрабатывают 96%-ным этиловым спиртом в течение 20-30 секунд и тщательно смывают мазок водой.
4. Докрашивают мазок фуксином в течение 2-3 мин и промывают водой.
5. Высушивают на воздухе и микроскопируют.
Микроскопическая картина: грамположительные микроорганизмы окрашиваются в фиолетовый цвет, а грамотрицательные – в розовый.
Окраска микроорганизмов по этому методу зависит от химического состава клеточной стенки (наличие муреина и частично липида), цитоплазмы и pH среды.
2.3.4 Окраска по Цилю-Нильсену. На фиксированный мазок наносят:
небольшой кусок фильтровальной бумаги, на него наносят раствор карболового фуксина, снизу препарат подогревают над пламенем горелки до появления паров и оставляют на «мостике» 5-7 минут. Затем краску с бумагой убирают (не промывая). Наносят 3-5% раствор серной кислоты, окрашивают 5-7 минут, хорошо промывают водой. Затем добавляют раствор метиленовой сини (по Леффлеру), окрашивают 4-5 минут. Препарат промывают водой и высушивают фильтровальной бумагой.
Микроскопическая картина: кислото-спиртоустойчивые бактерии окрашиваются в красный цвет (не обесцвечиваются кислотой), некислотоустойчивые – в синий (окрасившись первоначально фуксином в красный цвет, легко обесцвечиваются кислотой и воспринимают дополнительную окраску метиленовой сини).
Задание
Задание 1. Приготовить препараты бактерий из бульонных и агаровых культур.
Задание 2. Окрасить препараты простым методом (фуксином или метиленовой синькой) и по Граму, зарисовать.
Вопросы для самоконтроля знаний
1.Красители, применяемые в микробиологии.
2.Способы и цели фиксации.
3.Порядок приготовления препарата для микроскопии и простой метод окраски.
4.Методика приготовления мазка.
5.Способы обработки предметных и покровных стекол.
6.Какие существуют методы фиксации?
7.Чем обуславливается различное окрашивание бактерий по Граму?
9. Каково действие спирта при окрашивании по Граму?
Тема: Методы окрашивания спор и капсул. Исследование бактерий
На подвижность
3.1 Цель занятия. Овладеть методами окрашивания препаратов на капсулы и споры. Приготовить, окрасить и зарисовать препараты из микробных культур на споры. Освоить методики определения подвижности микроорганизмов.
3.2 Материалы и оборудование. Рабочие растворы красок, спирт ректификат 96%, дистиллированная вода, фильтровальная бумага, предметные стекла, бактериологические петли, пинцеты, пробирки с микробными взвесями, микроскопы, сливные чашки, мостики, карандаши или чернила по стеклу, песочные или другие часы, горелки (спиртовки), спички, кедровое масло, окрашенные препараты на капсулы, таблицы и рисунки спор и капсул микробов.
Теоретический материал
3.3.1 Окраска спор. Все методы окраски спор основаны на обеспечении проникновения красителя через трудноокрашиваемую оболочку споры. Поэтому применяют протраву.
Окраска спор по Златогорову. На фиксированный мазок наносят:
1. Карболовый фуксин, окрашивают 5-10 мин.
2. 2% раствор серной кислоты, выдерживают 2-3 сек.
3. Раствор метиленовой сини, окрашивают 3-5 мин.
Микроскопическая картина: споры красного цвета, вегетативные формы – синие.
3.3.2 Окраска капсул. Тело микробной клетки покрыто рыхлым слизистым слоем. У некоторых видов микроорганизмов этот слой развивается очень сильно и тогда он называется капсулой.
Капсула – слизистый слой оболочки, муциноподобное вещество, высокомолекулярный полисахарид, который синтезируется в цитоплазме и секретируется на поверхности клеточной стенки (является производным наружного слоя оболочки).
Наличие капсулы является важным диагностическим признаком при идентификации и дифференциации возбудителей некоторых инфекций (сибирской язвы, пневмококковой пневмонии и др.) Патогенные микроорганизмы образуют капсулу в инфицированном организме. Она является фактором вирулентности и защищает бактериальную клетку от фагоцитоза и бактерицидного действия сыворотки крови. Размеры их чаще превышают тело микробной клетки. Химический состав капсул неоднородный: одни из них состоят из комплекса белков, другие – из полисахаридов. Капсула и остальная часть клетки окрашиваются неодинаково: первая как бы выполняет роль защиты и часто встречается у патогенных микроорганизмов.
Существует несколько методов окрашивания капсул
Капсульное вещество плохо окрашивается. Поэтому при приготовлении препарата для обнаружения капсулы выполняют следующие правила:
1. Мазок готовят из свежего материала, так как капсула быстро лизируется.
3.Промывать мазок водой следует слабо и кратковременно.
Окраска капсул по Михину. На фиксированный мазок наносят:
1.Метиленовый голубой Леффлера (лучше старый раствор), окрашивают 2-3 мин, при подогревании.
2.Смывают водой и высушивают.
Микроскопическая картина: тела микробных клеток темно-синего цвета, капсулы – светло-розового.
Окраска капсул по Ольту. На фиксированный мазок наносят:
1.Свежий горячий 2%-ный раствор сафранина, окрашивают 5-7 минут.
2.Быстро промыть водой и высушивают.
Микроскопическая картина: тело клетки окрашивается в красно-кирпичный цвет, капсула – в желто-оранжевый.
Определение подвижности микроорганизмов
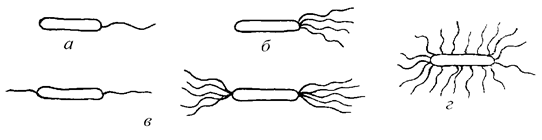
У подвижных видов органами передвижения являются жгутики, которые осуществляют вращательные движения. Расположение их на теле микробной клетки различное. Жгутики бывают различной длины. Их диаметр настолько мал, что они невидимы в световом микроскопе (менее 0,2 мкм). У разных групп бактерий количество и расположение жгутиков неодинаково. Жгутики плохо воспринимают красители. Методы сложной окраски искажают подлинный вид жгутиков, поэтому в лабораториях окраску жгутиков не осуществляют, а исследуют бактерии в живом состоянии.
В зависимости от расположения и количества жгутиков микроорганизмы подразделяют на:
Типы расположения жгутиков у бактерий
Для определения подвижности у бактерий необходимо использовать культуру не старше суточного возраста, так как старые культуры утрачивают способность передвигаться. Исследование проводят путем приготовления висячей или раздавленной капли.
Метод «висячая капля». Висячую каплю готовят на предметном стекле с углублением (луночкой). Край луночки смазывают тонким слоем вазелина и наносят на покровное стекло микроорганизмы. Если они выращены в жидкой среде, берут каплю такой культуры, если на плотной, то сначала на покровное стекло наносят каплю изотонического раствора натрия хлорида, а затем культуру микробов. Предметное стекло проворачивают на 180° и аккуратно опускают на покровное так, чтобы капля оказалась в центре углубления, после чего его возвращают в прежнее положение. В таком препарате капля подвешена с внутренней поверхности покровного стекла и находится в герметически закрытой влажной камере Это позволяет наблюдать за движением микробов в течение длительного времени. Препарат рассматривают в слегка затемненном поле (диафрагму сужают), что увеличивает контрастность неокрашенных форм.
Метод «раздавленная капля». Каплю бактериальной взвеси наносят на обычное предметное стекло, осторожно накрывают покровным стеклом и слегка придавливают пальцем. Микроскопию проводят, так же как и в методе «висячая капля».
Задание
Задание 1. Приготовить препараты бактерий из бульонных и агаровых культур.
Задание 2. Окрасить препараты на споры по методу Златогорова, зарисовать.
Задание 3. Определить подвижность предложенных культур микроорганизмов методами «висячая» и «раздавленная капля»
Вопросы для самоконтроля знаний
1. Какова особенность окраски препаратов на споры?
2. Какие применяют методы окрашивания капсул?
3. Как исследуют микроорганизмы на подвижность?
Дата добавления: 2020-04-25 ; просмотров: 697 ; Мы поможем в написании вашей работы!