метрономная терапия что это
Метрономная терапия: место в лечении злокачественных опухолей
Авторы: В.А. Чубенко, Л.А. Загорская, В.С. Чубенко, Ф.В. Моисеенко, Н.Х. Абдулоева, А.С. Жабина, М.М. Крамчанинов, К.В. Шелехова, А.А. Мелдо, Е.М. Зыков, А.А. Кудрявцев, Е.В. Напольская, В.М. Моисеенко
Одной из стратегий преодоления возможной резистентности на фоне современного лекарственного лечения является метрономная терапия злокачественных опухолей. Это хроническое непрерывное введение низких доз лекарственных препаратов с целью воздействия как на опухолевые клетки, так и на их микроокружение для того, чтобы изменить естественную историю роста злокачественных опухолей и увеличить продолжительность жизни больных.
Целью работы было изучить эффективность метрономного режима циклофосфамида и метотрексата у больных различными злокачественными опухолями.
Материалы и методы. Проанализирован опыт применения схемы метрономной терапии циклофосфамид и метотрексат за 3,5 года в Онкоцентре. Из 678 больных подавляющее большинство (377) составили пациенты старшей возрастной группы. При этом 343 больных находились в ослабленном и тяжелом состоянии (ECOG 2-4). МТ назначалась в различных линиях лечения, но в основном, при развитии резистентности к стандартной терапии (со 2-й и более). С точки зрения нозологии, больные были крайне гетерогенны (рак толстой кишки – 103, рак молочной железы – 84, опухоли головы и шеи – 80, рак легкого –78 и первично-множественные опухоли – 72). Степень распространения процесса занимала, как правило, 2 и более органов. Чаще встречались аденокарциномы и плоскоклеточный рак.
Результаты. Объективный ответ опухоли на лечение составил 8,1%. При этом стабилизация процесса – 68,9%. Прогрессирование было зарегистрировано в 23% случаях. Медиана времени до прогрессирования составила 7 месяцев. Схема метрономной терапии переносилась удовлетворительно и не имела выраженной клинически значимой токсичности.
Выводы. Работа демонстрирует клиническую эффективность применения метрономного режима циклофос-
фамид и метотрексат при различных злокачественных новообразованиях.
Внимание
Этот раздел сайта содержит профессиональную специализированную информацию.
Вы являетесь дипломированным медицинским специалистом?
Метрономная терапия что это
Клинический научно-практический центр специализированных видов медицинской помощи (онкологический), Санкт-Петербург, Россия
Введение
На сегодняшний день перспективным методом лекарственного лечения злокачественных новообразований являются стратегии, основанные на поиске и подавлении «триггерных» мишеней с учетом биологии роста опухоли [1]. К ним относятся следующие ингибиторы:
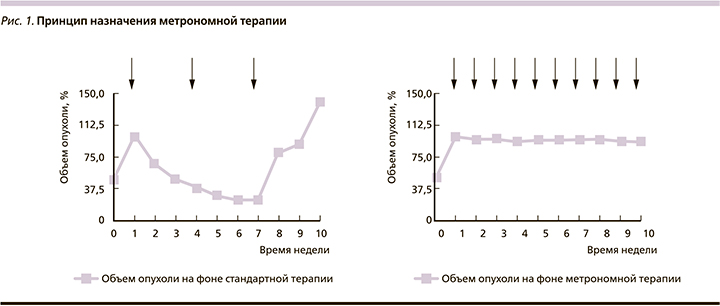
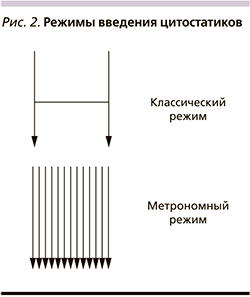
В итоге в арсенале клинического онколога принципиально имеются следующие возможности воздействия на злокачественные клетки: цитостатики, таргетная терапия, иммунотерапия и экспериментальные направления, целью которых служат регуляция метаболизма опухоли и эпигенетическая терапия. В результате подобные методы, безусловно, приводят к увеличению продолжительности жизни. Например, лекарственная терапия современными препаратами увеличивает медиану общей выживаемости больных раком молочной железы (РМЖ) с 32 до 50 месяцев [2],толстой кишки с 5–6 до 30 [3], желудка с 3–5 до 16 [4], легкого с 3,9 до 36 месяцев [5]. С другой стороны, иммунотерапевтические принципы лечения позволяют обсуждать 20%-ную возможность излечения. К сожалению, подобные успехи в большинстве своем характерны для определенной группы больных с учетом специфических предиктивных факторов [6]. В общей популяции подобная тенденция не столь выражена. Это обусловлено многими факторами, к которым относятся особенности кинетики роста, гетерогенность опухолевой популяции, опухолевая эволюция, репопуляция клеток, лекарственная резистентность, микроокружение или опухолевый матрикс, эпигенетические нарушения, тканевая иммуносупрессия, константы гомеостаза (pH, гликемия), стволовые клетки [7]. С целью возможности преодоления подобной резистентности опухолевых клеток разрабатываются новые стратегии терапии. К ним относится метрономная терапия (МТ) злокачественных опухолей. Это один из вариантов dose-dense терапии, в котором химиопрепараты назначаются через определенные короткие промежутки времени (часы, дни, недели) в низких (10–40% от терапевтической) дозах с целью увеличения продолжительности жизни больных неизлечимыми диссеминированными солидными опухолями [8]. Концепция применения метрономной терапии заключается в торможении роста злокачественных клеток, что теоретически снизит вероятность достижения «летального» объема опухоли и тем самым может повлиять на показатели выживаемости (рис. 1).
Метрономная терапия: от истоков к современности
История МТ началась с работ J. Folkman, который предположил возможность терапевтического воздействия на опухолевый ангиогенез [9]. В 1991 г. в лаборатории R. Kerbel было показано влияние цитостатиков на сосудистое русло в опухоли. В дальнейшем исследования Klement и Browder продемонстрировали возможность достижения значительного торможения роста опухоли низкими дозами химиопрепаратов на различных преклинических моделях. В то же время Hanahan предложил термин «метрономная терапия» [10].
Механизм действия МТ заключается в снижении пролиферации и ангиогенного потенциала эндотелиоцитов в опухоли, повышении экспрессии тромбоспондина-1, подавлении функции циркулирующих эндотелиальных клеток, блокаде мобилизации клеток-предшественниц эндотелиоцитов из костного мозга, а также в нормализации структуры сосудистой сети и в повышении перфузии опухолевой ткани.
Кроме того, обсуждается значительное влияние низких доз цитостатиков на регуляцию иммунной системы организма в виде повышения иммуногенности и возможности презентации антигенов, на мобилизацию антиген-презентирующих клеток, подавление функции Т-регуляторов и на повышение активности цитотоксических лимфоцитов. Несомнен факт их прямого воздействия на опухолевые клетки [11].
В качестве примера изучено антиангиогенное действие препаратов, связывающих микротрубочки. Оно заключается в повышении динамической нестабильности микротрубочек, нарушении переориентации центра организации микротрубочек, ослаблении сигнала от рецептора сосудистого эндотелиального фактора роста 2-го типа, пониженнии активации интегрина, ингибировании сигнала FAK/паксиллин/AKT, потере Hsp90, ингибировании активации eNOS, нарушении образования фокальных контактов, пониженной пролиферации и поляризации клеток, подавлении миграции клеток, разрушении связи микротрубочка+белок TIP, реорганизации актина в стресс-волокна, ингибировании сигнала Ras/Erk/Net (Elk3), повышении фосфорилирования MLC и сократимости актиномизина, изменении сигнала Rho-GTP-аза, разрушении VE-кадгерина, ингибировании сигнала VE-кадгерин/β-катенин/AKT, ингибировании образования трубочек, повышении проницаемости клеток, в регрессии капиллярных трубочек [12].
Эффективность МТ продемонстрирована во многих клинических исследованиях. Объективный ответ опухоли на лечение в среднем составлял 19–34% [15]. Мета-анализ 22 исследований метрономного режима при РМЖ, в который были включены 1360 больных, показал клиническую эффективность в 55% случаев, время до прогрессирования 6 месяцев — 56% больных и 2-летнюю общую выживаемость — 40% [15]. Среди особенностей подобных работ можно выделить следующие: в основном исследования I—II фаз, гетерогенность включенных пациентов, эмпирический выбор цитостатиков и режима, использование в качестве оценки эффективности лечения объективного ответа, а не общей выживаемости. В целом для МТ при РМЖ предпочтение отдавалось препаратам с высокой биодоступностью при применении внутрь и возможности частого внутривенного введения цитостатиков. В качестве примера назначение пожилым больным винорелбина внутрь в метрономном режиме приводило к увеличению времени до прогресирования болезни до 9,2 месяца [16].
Эффективность комбинации метрономного режима применения цитостатиков была продемонстрирована в исследовании VICTOR-2. В нем приняли участие 80 больных, из которых у 28 был диагностирован тройной негативный фенотип РМЖ. Капецитабин и винорелбин назначались в 1-й (35 больных) и 2-й линиях (45 больных) лечения. Частота объективного ответа составила 35,5 и 25,6% соответственно. Время до прогрессирования, превысившее 1 год, регистрировалось более чем у 20% больных. При этом клинически значимой токсичности практически не наблюдалось: фебрильная нейтропения была зарегистрирована у 0,4%, а слабость у 0,7% больных [17]. Низкая токсичность при применении метрономного режима применения цитостатиков послужила основанием исследования тройной комбинации препаратов в низких дозах при РМЖ. В исследовании VEX время до прогрессирования на фоне метрономного применения циклофосфамида, капецитабина и винорелбина в первой линии лечения составило 25,1 месяца [18]. Несмотря на активное изучение новых метрономных доз винорелбина, в клинические рекомендации лечения РМЖ в Российской Федерации входят следующие эффективные режимы его применения: 60 мг/м2 внутрь в 1-й, 8-й и 15-й дни; с 22-го дня — 80 мг/м2 1 раз в неделю.
По сравнению со стандартным режимом введения метрономный винорелбин демонстрирует схожую эффективность при более низкой токсичности. В исследовании XeNa объективный ответ опухоли составил 21,4 и 20,8%, клиническая эффективность — 37 и 41%, общая выживаемость — 660 и 701 день соответственно [19].
Заключение
Таким образом, МТ представляет собой новую парадигму лекарственного лечения в связи с интегрирующим воздействием как на опухолевые клетки, так и на их микроокружение. Данный подход демонстрирует клиническую эффективность определенной группы больных, резистентных к стандартной терапии. При этом длительная стабилизация процесса (более 6 месяцев), вероятно, может быть суррогатным маркером увеличения продолжительности жизни. С учетом механизма действия низких доз цитостатиков перспективным считается комбинация препаратов с различными терапевтическими опциями (иммунотерапия, антиангиогенная терапия).
На сегодняшний день подобная стратегия терапии требует изучения предиктивных маркеров. А с целью получения доказательной базы, безусловно, необходимо проведение масштабных рандомизированных исследований.
Литература
1. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74. Doi: 10.1016/j.cell.2011.02.013.
2. Engel, J., Schubert-Fritschle G., Emeny R., Hölzel D.Breast cancer: are long-term and intermittent endocrine therapies equally effective? J Cancer Res Clin Oncol. 2020 May 29. Doi: 10.1007/s00432-020-03264-0.
3. Aggarwal H., Sheffield K.M., Li L., et al. Primary tumor location and survival in colorectal cancer: A retrospective cohort study. World J Gastrointest Oncol. 2020;12(4):405–23. Doi: 10.4251/wjgo.v12.i4.405.
4. Yarema R., Оhorchak М., Hyrya P., et al. Gastric cancer with peritoneal metastases: Efficiency of standard treatment methods. World J Gastrointest Oncol. 2020;12(5):569–81. Doi: 10.4251/wjgo.v12.i5.569.
5. Xu E., David E.A., Ding L., et al. Sequence of biologic therapies and surgery affects survival in non-small cell lung cancer. J Surg Oncol. 2020. May 20. Doi: 10.1002/jso.25937.
6. Cristescu R., Mogg R., Ayers M., et al. Pan-tumor genomic biomarkers for PD-1 checkpoint blockade-based immunotherapy. Science. 2018;362(6411):eaar3593. Doi: 10.1126/science.aar3593.
7. Murciano-Goroff Y.R., Warner A.B., Wolchok J.D.The future of cancer immunotherapy: microenvironment-targeting combinations. Cell Res. 2020. Doi: 10.1038/s41422-020-0337-2.
8. Hanahan D., Bergers G., Bergsland E. Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J Clin Invest. 2000;105(8):1045–47. Doi: 10.1172/JCI9872.
9. Abdollahi A., Hlatky L., Huber P.E. Endostatin: the logic of antiangiogenic therapy. Drug Resist Updat. 2005;8(1–2):59–74. Doi: 10.1016/j.drup.2005.03.001.
10. Bocci G., Kerbel R.S. Pharmacokinetics of metronomic chemotherapy: a neglected but crucial aspect. Nat Rev Clin Oncol. 2016;13(11):659–73. Doi: 10.1038/nrclinonc.2016.64.
11. André N., et al. Metronomics: towards personalized chemotherapy? Nat Rev Clin Oncol. 2014. Doi: 10.1038/nrclinonc.2014.89.
12. Schwartz E.L. Antivascular actions of microtubule-binding drugs. Clin Cancer Res 2009;15(8):2594–601. Doi: 10.1158/1078-0432.CCR-08-2710.
13. Shaked Y., Pham E., Hariharan S. Evidence Implicating Immunological Host Effects in the Efficacy of Metronomic Low-Dose Chemotherapy. Cancer Res. 2016;76(20):5983–993. Doi: 10.1158/0008-5472.CAN-16-0136.
14. Briasoulis E., Aravantinos G., Kouvatseas G. Dose selection trial of metronomic oral vinorelbine monotherapy in patients with metastatic cancer: a hellenic cooperative oncology group clinical translational study. BMC Cancer. 2013;13(1):263. Doi: 10.1186/1471-2407-13-263.
15. Cazzaniga M.E., Munzone E., Bocci G. Pan-European Expert Meeting on the Use of Metronomic Chemotherapy in Advanced Breast Cancer Patients: The PENELOPE Project. Adv Ther. 2019;36(2):381–406. Doi: 10.1007/s12325-018-0844-4.
16. De Iuliis F., Salerno G., Taglieri L., et al. On and off metronomic oral vinorelbine in elderly women with advanced breast cancer. Tumori. 2015;101(1):30–5. Doi:10.5301/tj.5000207.
Метрономная химиотерапия
27.05.2019 | Статьи и новости | 2019-05-27 13 августа 2019
Метрономная химиотерапия, химиотерапия с низкими дозами: алопеция уменьшается до 1% — это надежда будущего.
Преимущества метрономной химиотерапии при лечении рака в Италии
Низкая токсичность, хороший иммунный ответ и мало побочных эффектов. Это преимущества метрономной химиотерапии, которая, как было показано, очень эффективна, особенно при распространенных формах рака.
При метрономной химиотерапии уменьшаются побочные эффекты, резко уменьшается даже выпадение волос, но при этом сохраняется или даже увеличивается эффективность лечения. Именно это и продемонстрировала метрономная химиотерапия — новый подход к лечению опухолей в клиниках Италии. Этот метод заключается в непрерывном введении лекарственных препаратов в низких дозах, а не в высоких дозах (максимально переносимых) для коротких циклов при интервалах 2 или 3 недели, как это делается при стандартной химиотерапии.
Стратегия, успешно апробированная в Италии при метастатическом раке молочной железы, одобренная европейскими директивами по этому новообразованию и которая с сегодняшнего дня будет приобретать все большее распространение благодаря новой Международной школе по метрономической химиотерапии.
Разные дозы, разные эффекты
Исследования показывают, что разные дозы и время введения одного и того же лекарственного средства вызывают разные воздействия на опухолевую клетку, но прежде всего на то, что ее окружает, то есть так называемую опухолевую микросреду. Поэтому, модулируя дозу и скорость введения, можно в конечном итоге оказывать различное действие: на сосуды опухоли, на стимуляцию иммунного ответа или на раковые стволовые клетки.
В отличие от обычной химиотерапии, которая оказывает сильное прямое воздействие на опухолевые клетки, основной целью метрономной терапии является, по сути, неоваскуляризация(т.е. образование новых кровеносных сосудов), которые питают опухоль. И одним из ее преимуществ является низкая токсичность для костного мозга. Ясно, что ключевой ролью в этом подходе является выбор правильной дозы препарата, что требует идентификации одного биомаркера.
Как функционирует метрономическая химиотерапия
Метрономика не только оказывает прямую токсичность на опухолевые клетки, но и влияет на их микроокружение, поскольку она ингибирует неопластический ангиогенез, другими словами, механизм образования новых кровеносных сосудов, отвечающих за рост опухоли и метастазирование.
Ее эффективность продемонстрирована при некоторых формах рака молочной железы, рака легких, лимфом, злокачественных новообразований у детей и во многих случаев опухолей на поздних стадиях. Она не только эффективна и имеет профиль низкой токсичности, она также способна модулировать иммунный ответ, уменьшая побочные эффекты — у менее чем 1% пациентов наблюдается алопеция и неврологическая токсичность менее чем у 5%. Не говоря уже об огромной экономии, которую предлагает оральная терапия в домашних условиях.
«Некоторым это может показаться второстепенным, но с помощью этой терапии я не потеряла свои волосы, как это могло бы случиться с традиционным химиотерапией», — говорит Антонелла Парма, пациентка, которая проходит курс лечения в течение 9 месяцев: «Кроме того, меня не заставляют часто проводить обследования крови. Я делаю свои проверки, когда я иду в больницу, чтобы забрать таблетки для терапии. В принципе, я могу продолжать жить обычной жизнью».
Метрономная терапия что это
Клинический научно-практический центр специализированных видов медицинской помощи (онкологический), Санкт-Петербург, Россия
Введение
На сегодняшний день перспективным методом лекарственного лечения злокачественных новообразований являются стратегии, основанные на поиске и подавлении «триггерных» мишеней с учетом биологии роста опухоли [1]. К ним относятся следующие ингибиторы:
В итоге в арсенале клинического онколога принципиально имеются следующие возможности воздействия на злокачественные клетки: цитостатики, таргетная терапия, иммунотерапия и экспериментальные направления, целью которых служат регуляция метаболизма опухоли и эпигенетическая терапия. В результате подобные методы, безусловно, приводят к увеличению продолжительности жизни. Например, лекарственная терапия современными препаратами увеличивает медиану общей выживаемости больных раком молочной железы (РМЖ) с 32 до 50 месяцев [2],толстой кишки с 5–6 до 30 [3], желудка с 3–5 до 16 [4], легкого с 3,9 до 36 месяцев [5]. С другой стороны, иммунотерапевтические принципы лечения позволяют обсуждать 20%-ную возможность излечения. К сожалению, подобные успехи в большинстве своем характерны для определенной группы больных с учетом специфических предиктивных факторов [6]. В общей популяции подобная тенденция не столь выражена. Это обусловлено многими факторами, к которым относятся особенности кинетики роста, гетерогенность опухолевой популяции, опухолевая эволюция, репопуляция клеток, лекарственная резистентность, микроокружение или опухолевый матрикс, эпигенетические нарушения, тканевая иммуносупрессия, константы гомеостаза (pH, гликемия), стволовые клетки [7]. С целью возможности преодоления подобной резистентности опухолевых клеток разрабатываются новые стратегии терапии. К ним относится метрономная терапия (МТ) злокачественных опухолей. Это один из вариантов dose-dense терапии, в котором химиопрепараты назначаются через определенные короткие промежутки времени (часы, дни, недели) в низких (10–40% от терапевтической) дозах с целью увеличения продолжительности жизни больных неизлечимыми диссеминированными солидными опухолями [8]. Концепция применения метрономной терапии заключается в торможении роста злокачественных клеток, что теоретически снизит вероятность достижения «летального» объема опухоли и тем самым может повлиять на показатели выживаемости (рис. 1).
Метрономная терапия: от истоков к современности
История МТ началась с работ J. Folkman, который предположил возможность терапевтического воздействия на опухолевый ангиогенез [9]. В 1991 г. в лаборатории R. Kerbel было показано влияние цитостатиков на сосудистое русло в опухоли. В дальнейшем исследования Klement и Browder продемонстрировали возможность достижения значительного торможения роста опухоли низкими дозами химиопрепаратов на различных преклинических моделях. В то же время Hanahan предложил термин «метрономная терапия» [10].
Механизм действия МТ заключается в снижении пролиферации и ангиогенного потенциала эндотелиоцитов в опухоли, повышении экспрессии тромбоспондина-1, подавлении функции циркулирующих эндотелиальных клеток, блокаде мобилизации клеток-предшественниц эндотелиоцитов из костного мозга, а также в нормализации структуры сосудистой сети и в повышении перфузии опухолевой ткани.
Кроме того, обсуждается значительное влияние низких доз цитостатиков на регуляцию иммунной системы организма в виде повышения иммуногенности и возможности презентации антигенов, на мобилизацию антиген-презентирующих клеток, подавление функции Т-регуляторов и на повышение активности цитотоксических лимфоцитов. Несомнен факт их прямого воздействия на опухолевые клетки [11].
В качестве примера изучено антиангиогенное действие препаратов, связывающих микротрубочки. Оно заключается в повышении динамической нестабильности микротрубочек, нарушении переориентации центра организации микротрубочек, ослаблении сигнала от рецептора сосудистого эндотелиального фактора роста 2-го типа, пониженнии активации интегрина, ингибировании сигнала FAK/паксиллин/AKT, потере Hsp90, ингибировании активации eNOS, нарушении образования фокальных контактов, пониженной пролиферации и поляризации клеток, подавлении миграции клеток, разрушении связи микротрубочка+белок TIP, реорганизации актина в стресс-волокна, ингибировании сигнала Ras/Erk/Net (Elk3), повышении фосфорилирования MLC и сократимости актиномизина, изменении сигнала Rho-GTP-аза, разрушении VE-кадгерина, ингибировании сигнала VE-кадгерин/β-катенин/AKT, ингибировании образования трубочек, повышении проницаемости клеток, в регрессии капиллярных трубочек [12].

Эффективность МТ продемонстрирована во многих клинических исследованиях. Объективный ответ опухоли на лечение в среднем составлял 19–34% [15]. Мета-анализ 22 исследований метрономного режима при РМЖ, в который были включены 1360 больных, показал клиническую эффективность в 55% случаев, время до прогрессирования 6 месяцев — 56% больных и 2-летнюю общую выживаемость — 40% [15]. Среди особенностей подобных работ можно выделить следующие: в основном исследования I—II фаз, гетерогенность включенных пациентов, эмпирический выбор цитостатиков и режима, использование в качестве оценки эффективности лечения объективного ответа, а не общей выживаемости. В целом для МТ при РМЖ предпочтение отдавалось препаратам с высокой биодоступностью при применении внутрь и возможности частого внутривенного введения цитостатиков. В качестве примера назначение пожилым больным винорелбина внутрь в метрономном режиме приводило к увеличению времени до прогресирования болезни до 9,2 месяца [16].
Эффективность комбинации метрономного режима применения цитостатиков была продемонстрирована в исследовании VICTOR-2. В нем приняли участие 80 больных, из которых у 28 был диагностирован тройной негативный фенотип РМЖ. Капецитабин и винорелбин назначались в 1-й (35 больных) и 2-й линиях (45 больных) лечения. Частота объективного ответа составила 35,5 и 25,6% соответственно. Время до прогрессирования, превысившее 1 год, регистрировалось более чем у 20% больных. При этом клинически значимой токсичности практически не наблюдалось: фебрильная нейтропения была зарегистрирована у 0,4%, а слабость у 0,7% больных [17]. Низкая токсичность при применении метрономного режима применения цитостатиков послужила основанием исследования тройной комбинации препаратов в низких дозах при РМЖ. В исследовании VEX время до прогрессирования на фоне метрономного применения циклофосфамида, капецитабина и винорелбина в первой линии лечения составило 25,1 месяца [18]. Несмотря на активное изучение новых метрономных доз винорелбина, в клинические рекомендации лечения РМЖ в Российской Федерации входят следующие эффективные режимы его применения: 60 мг/м2 внутрь в 1-й, 8-й и 15-й дни; с 22-го дня — 80 мг/м2 1 раз в неделю.
По сравнению со стандартным режимом введения метрономный винорелбин демонстрирует схожую эффективность при более низкой токсичности. В исследовании XeNa объективный ответ опухоли составил 21,4 и 20,8%, клиническая эффективность — 37 и 41%, общая выживаемость — 660 и 701 день соответственно [19].
Заключение
Таким образом, МТ представляет собой новую парадигму лекарственного лечения в связи с интегрирующим воздействием как на опухолевые клетки, так и на их микроокружение. Данный подход демонстрирует клиническую эффективность определенной группы больных, резистентных к стандартной терапии. При этом длительная стабилизация процесса (более 6 месяцев), вероятно, может быть суррогатным маркером увеличения продолжительности жизни. С учетом механизма действия низких доз цитостатиков перспективным считается комбинация препаратов с различными терапевтическими опциями (иммунотерапия, антиангиогенная терапия).
На сегодняшний день подобная стратегия терапии требует изучения предиктивных маркеров. А с целью получения доказательной базы, безусловно, необходимо проведение масштабных рандомизированных исследований.
Литература
1. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74. Doi: 10.1016/j.cell.2011.02.013.
2. Engel, J., Schubert-Fritschle G., Emeny R., Hölzel D.Breast cancer: are long-term and intermittent endocrine therapies equally effective? J Cancer Res Clin Oncol. 2020 May 29. Doi: 10.1007/s00432-020-03264-0.
3. Aggarwal H., Sheffield K.M., Li L., et al. Primary tumor location and survival in colorectal cancer: A retrospective cohort study. World J Gastrointest Oncol. 2020;12(4):405–23. Doi: 10.4251/wjgo.v12.i4.405.
4. Yarema R., Оhorchak М., Hyrya P., et al. Gastric cancer with peritoneal metastases: Efficiency of standard treatment methods. World J Gastrointest Oncol. 2020;12(5):569–81. Doi: 10.4251/wjgo.v12.i5.569.
5. Xu E., David E.A., Ding L., et al. Sequence of biologic therapies and surgery affects survival in non-small cell lung cancer. J Surg Oncol. 2020. May 20. Doi: 10.1002/jso.25937.
6. Cristescu R., Mogg R., Ayers M., et al. Pan-tumor genomic biomarkers for PD-1 checkpoint blockade-based immunotherapy. Science. 2018;362(6411):eaar3593. Doi: 10.1126/science.aar3593.
7. Murciano-Goroff Y.R., Warner A.B., Wolchok J.D.The future of cancer immunotherapy: microenvironment-targeting combinations. Cell Res. 2020. Doi: 10.1038/s41422-020-0337-2.
8. Hanahan D., Bergers G., Bergsland E. Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J Clin Invest. 2000;105(8):1045–47. Doi: 10.1172/JCI9872.
9. Abdollahi A., Hlatky L., Huber P.E. Endostatin: the logic of antiangiogenic therapy. Drug Resist Updat. 2005;8(1–2):59–74. Doi: 10.1016/j.drup.2005.03.001.
10. Bocci G., Kerbel R.S. Pharmacokinetics of metronomic chemotherapy: a neglected but crucial aspect. Nat Rev Clin Oncol. 2016;13(11):659–73. Doi: 10.1038/nrclinonc.2016.64.
11. André N., et al. Metronomics: towards personalized chemotherapy? Nat Rev Clin Oncol. 2014. Doi: 10.1038/nrclinonc.2014.89.
12. Schwartz E.L. Antivascular actions of microtubule-binding drugs. Clin Cancer Res 2009;15(8):2594–601. Doi: 10.1158/1078-0432.CCR-08-2710.
13. Shaked Y., Pham E., Hariharan S. Evidence Implicating Immunological Host Effects in the Efficacy of Metronomic Low-Dose Chemotherapy. Cancer Res. 2016;76(20):5983–993. Doi: 10.1158/0008-5472.CAN-16-0136.
14. Briasoulis E., Aravantinos G., Kouvatseas G. Dose selection trial of metronomic oral vinorelbine monotherapy in patients with metastatic cancer: a hellenic cooperative oncology group clinical translational study. BMC Cancer. 2013;13(1):263. Doi: 10.1186/1471-2407-13-263.
15. Cazzaniga M.E., Munzone E., Bocci G. Pan-European Expert Meeting on the Use of Metronomic Chemotherapy in Advanced Breast Cancer Patients: The PENELOPE Project. Adv Ther. 2019;36(2):381–406. Doi: 10.1007/s12325-018-0844-4.
16. De Iuliis F., Salerno G., Taglieri L., et al. On and off metronomic oral vinorelbine in elderly women with advanced breast cancer. Tumori. 2015;101(1):30–5. Doi:10.5301/tj.5000207.