миелодиспластический синдром неуточненный что это
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
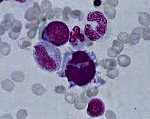
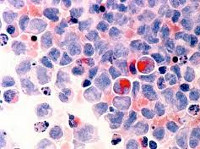
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Миелодиспластический синдром у взрослых
Общая информация
Краткое описание
Приложение 5
к приказу
Министерства здравоохранения
Республики Беларусь
КЛИНИЧЕСКИМ ПРОТОКОЛ
диагностики и лечения пациентов в возрасте старше 18 лет
с миелодиспластическим синдромом
1. Клинический протокол диагностики и лечения пациентов с заболеванием «миелодиспластический синдром» (далее-МДС) предназначен для оказания медицинской помощи в амбулаторных и стационарных условиях районных, областных и республиканских организаций здравоохранения, имеющих в своем составе гематологические отделения.
2. Возрастная категория: взрослое население.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЯ
5. Классификация МДС, принятая Всемирной организацией здравоохранения (далее-ВОЗ) в 2008 году базируется на цитоморфологических, кариотипических и клинических признаках заболевания.
Классификация миелодиспластических синдромов
сбалансированные аномалии: t(l 1; 16)(q23;p 13.3); t(3;21) (q26.2;q22.1); t(l;3) (рЗб.З; q21.1); t(2;l 1) (p21;q23); inv(3) (q21q26.2); t(6;9)(p23;q34);
сложный кариотип (3 или более хрмосомных аномалий) с вовлечением вышеупомянутых нарушений.
Диагностика
КРИТЕРИИ ДИАГНОЗА МДС
8. Вспомогательные критерии (С) (для пациентов, имеющих критерии А, но не имеющих критерии В).
8.1. Аномальный иммунный фенотип эритроидных или миелоидных клеток костного мозга, указывающий на их клональное происхождение (по результатам проточной цитометрии).
8.2. Молекулярно-генетические признаки наличия клональной клеточной популяции в костном мозге (по результатам HUMARA исследования или биологического микрочипирования).
8.3. Значительное и стабильное снижение колониеобразующей активности костного мозга и/или периферической крови.
Диагноз устанавливается при наличии 2 предварительных критериев (А) и не менее чем одного МДС-ассоциированных критериев (В). Вспомогательные
критерии (С) используются при отсутствии критериев В и наличии у пациента признаков клональной миелоидной пролиферации. Критерии группы С не входят в обязательный стандарт диагностики МДС.
Диагноз «идиопатическая цитопения неопределенного значения» применяется для обозначения случаев цитопении по одной и более клеточным линиям в течение > 6 месяцев при отсутствии критериев МДС и других причин цитопении. Такие пациенты должны наблюдаться и обследоваться гематологом с интервалом 1-6 месяцев.
Диагностические критерии разработаны ICWG (International Consensus Working Group), 2007 г.
Алгоритм диагностики МДС включает в себя клинические и лабораторные исследования, мультидисциплинарный подход с привлечением смежных специалистов и последовательно проводится на базе учреждений здравоохранения различного уровня с соблюдением преемственности на всех этапах. Это обусловлено полиэтиологичностью и гетерогенностью проявлений при данной патологии, стремлением к рационализации использования специального диагностического оборудования, минимизации диагностических ошибок.
Этапы диагностики МДС:
Лечение
КЛИНИЧЕСКИЕ ВАРИАНТЫ МДС
10. Определение клинического варианта МДС имеет значение для выбора тактики лечения.
10.1. 5ц-синдром: болеют преимущественно женщины, характерны вялотекущий характер заболевания, низкая вероятность трансформации в ОМЛ (10%), тяжелая макроцитарная анемия, нормальный или умерено сниженный уровень лейкоцитов и тромбоцитов, дисплазия мегакариоци- тарного ростка, отсутствие значительно повышения уровня бластных клеток в костном мозге; хороший ответ на леналидомид*.
10.2. Вторичный МДС: частота вторичного МДС нарастает в связи с успехами химиотерапии опухолей и воздействием загрязнения окружающей среды; для большинства пациентов характерны множественные хромосомные аберрации; прогноз хуже, чем при первичном МДС.
10.3. Гипопластический МДС:
до 15% случаев МДС характеризуются низкой клеточностью костного мозга при гистологическом исследовании (доля кроветворной ткани в препарате менее 30% у пациентов моложе 60 лет или менее 20% у пациентов 60 лет и старше);
дисплазия мегакариоцитов и клеток миелоидного ряда может отсутствовать;
возможны трудности в дифференциации от апластической анемии, для которой характерна более выраженная панцитопения, отсутствие типичных для МДС хромосомных аббераций и снижение содержания CD34+ клеток в костном мозге.
10.4. МДС с миелофиброзом: до 50% случаев всех вариантов МДС характеризуется фиброзом костного мозга (до 15% имеют выраженный фиброз); фиброз более характерен для вторичного МДС; характерны ги- перклеточность костного мозга, диффузный ретикулиновый фиброз его стромы и дисплазия не менее чем в 2 клеточных линиях; в периферической крови панцитопения, признаки клеточной дисплазии и лейкоэрит- робластоза; органомегалия нехарактерна; заболевание быстро прогрессирует; необходимо дифференцировать от острого мегакариобластного лейкоза, острого миелофиброза (острого панмиелоза с фиброзом), хронических миелопролиферативных заболеваний, метастатического рака, лимфом и волосатоклеточного лейкоза.
ЛЕЧЕНИЕ
11. Выбор терапии основан на диагнозе и группе риска по международной прогностической бальной системе (IPSS). В соответствии с международными рекомендациями для выбора терапевтической тактики пациентов с МДС подразделяют на 2 большие группы риска:
группу относительно низкого риска, включая в нее пациентов с низким и промежуточным 1 риском по системе IPSS;
группу высокого риска, включая в нее пациентов с промежуточным 2 и высоким риском по системе IPSS.
У пациентов из группы относительно низкого риска возможно применение только поддерживающей терапии либо терапии малой интенсивности. Интенсивная терапия показана пациентам группы высокого риска с учетом возраста, анамнеза заболевания, клинических проявлений, общего состояния и наличия признаков прогрессирования заболевания.
11.1. Поддерживающее лечение.
Поддерживающее лечение назначают с целью уменьшения проявлений заболевания и поддержания качества жизни. У пациентов из группы относительно низкого риска это может быть основным видом терапии.
11.1.1. Трансфузии донорских эритроцитов. Основным клиническим показанием для трансфузии донорских эритроцитов является не столько уровень гемоглобина, сколько степень адаптированности пациента к анемии.
11.1.2. Применение хелаторов железа.
Показаниями к применению хелаторов железа является переливание более 20-25 доз эритроцитной массы, уровень сывороточного ферритина более 2500 мкг/л, наличие дисфункции сердца (аритмия, сердечная недостаточность) и поражения печени.
Дефероксамин применяют в дозе 30-40 мг/кг в виде 12 часовых подкожных инфузий 5-7 раз в неделю (ночью). Дозу лекарственного средства снижают до 25 мг/кг при уровне ферритина ПО г/л, тромбоциты > 100 • 10 9 /л, нейтрофилы >1,0-10 9 /л, нет бластных клеток
время ремиссии, уменьшение абсолютного числа гранулоцитов, тромбоцитов, снижение концентрации НЬ на > 15 г/л или появление трансфузионной зависимости
Частичный: сокращение количества клеток, имеющих хромосомные аномалии на > 50 %
Гранулоциты (начальное количество 9 /л): прирост на 100 % и абсолютное количество > 0,5 • 10 9 /л
Прогноз
Для оценки прогноза и определения тактики лечения пациентов с МДС используют международную прогностическую бальную систему (далее IPSS).
Миелодиспластический синдром у взрослых. Клинические рекомендации.
Миелодиспластический синдром у взрослых
Оглавление
Ключевые слова
рефрактерная анемия с кольцевыми сидеробластами;
рефрактерная цитопения с множественной дисплазией;
рефрактерная анемия с избытком бластов;
острый миелоидный лейкоз;
малые дозы цитарабина;
трансплантация гемопоэтических стволовых клеток.
Список сокращений
аллогенная трансплантация гемопоэтических стволовых клеток
Всемирная организации здравоохранения
цитарабин в малых дозах/малые дозы цитарабина
минимальная резидуальная болезнь
острые миелоидные лейкозы
рефрактерная анемия с избытком бластов
рефрактерная анемия с кольцевыми сидеробластами
рефрактерная цитопения с мультилинейной дисплазией
трансплантация гемопоэтических стволовых клеток
трансплантация периферических стволовых клеток
классификация Франко-Американско-Британской группы экспертов
European Society for Blood and Marrow Transplantation
флуоресцентная гибридизация in situ
International Bone Marrow Transplant Registry Database
International Prognostic Scoring System
Revised International Prognostic Scoring System
WHO classification-based Prognostic Scoring System
Термины и определения
Миелодиспластические синдромы (МДС)-гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации гемопоэтической стволовой клетки и характеризующихся цитопенией, признаками дисмиелопоэза и высоким риском трансформации в острый лейкоз (ОЛ).
Отсутствие эффекта – летальный исход на фоне терапии или прогрессирование заболевания.
Рецидив –возрат количетсва бластных клеток к исходному; снижение на 50% и более числа тромбоцитов и нейтрофилов от максимальных значений во время ремиссии; снижение показателей Нв на 15 г/л и более, появление трансфузионной зависимости от эритроцитсодержащих компонентов.
Трансформация/прогрессия в ОМЛ констатируется при обнаружении в пунктате костного мозга или периферической крови более 20 % бластных клеток.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом цитогенетическими методами не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным. При уменьшении количества клеток с хромосомными нарушениями минимум на 50% оценивается как частичный цитогенетический ответ.
Полихимиотерапия — наиболее оправданное сочетание цитостатических препаратов, которое позволяет добиться максимально положительного эффекта, в частности полной ремиссии, у онкогематологических больных.
Иммуносупрессивная терапия—комплекс лечебных мероприятий, проводимых поэтапно в течение года и более, включающий антитимоцитарный глобулин, циклоспорин, и другие методы иммуносупрессивной терапии, позволяющий добиться максимально положительного эффекта и длительной выживаемости больных гипопластичными формами МДС.
Трансплантация гемопоэтических клеток крови—под этим термином объединены трансплантация гемопоэтических стволовых клеток костного мозга периферической крови, костного мозга и пуповинной (плацентарной) крови.
Эритроцитсодержащие компоненты— компоненты донорской крови, содержащие эритроциты ( эритроцитная масса, эритроцитная взвесь и т.д.).
Тромбоцитный концентрат – компонент донорской крови, содержащий тромбоциты.
1. Краткая информация
1.1 Определение
Миелодиспластические синдромы (МДС) представляют собой гетерогенную группу клональных заболеваний системы крови, характеризующихся цитопенией, признаками дисмиелопоэза и высоким риском трансформации в острые миелоидные лейкозы (ОМЛ).[1,2]
1.2 Этиология и патогенез
В 80-90 % случаев этиология МДС неизвестна, в 10-15 % развитию заболевания предшествовала цитостатическая и/или лучевая терапия, которая проводилась по поводу системного поражения соединительной ткани или другого онкогематологического или онкологического процесса. Среди факторов, воздействие которых увеличивает риск развития миелодиспластического синдрома, можно выделить курение, контакт с бензином, инсектицидами, пестицидами, органическими веществами.
Изучение патогенеза МДС на протяжении нескольких десятков лет позволило выделить несколько основополагающих этапов развития этих заболеваний. Воздействие повреждающих факторов на плюрипотентные стволовые гемопоэтические клетки (ГСК) приводит к формированию клонального кроветворения, включающего все клеточные линии, реактивное изменение стромального микроокружения и лимфатической системы, их взаимное воздействие с ГСК, что приводит к увеличению пролиферации и апоптоза в костном мозге. Появление новых мутацияй способствует дальнейшей клональной эволюции уже имеющегося патологического клона, что сопровождается уменьшением апоптоза и трансформацией в острый лейкоз.[1,2]
1.3 Эпидемиология
В Европе и США заболеваемость в общей популяции составляет около 4-5 случаев на 100 тыс. населения в год. Более 80 % пациентов – это люди старше 60 лет. После 60 лет частота увеличивается до 20-50 случаев на 100 тыс. человек в год. В целом в Европе ежегодно диагностируют примерно 25 тыс. новых случаев. Учитывая неуклонное «старение» населения Европы, полагают, что число пациентов с МДС будет в ближайшие десятилетия лишь возрастать.[1,2,3,4,5]
Статистических данных о заболеваемости и распространенности МДС в России нет.
1.4 Кодирование по МКБ 10
Миелодиспластические синдромы (D46)
D46.1 –Рефрактерная анемия с сидеробластами;
D46.7- Другие миелодиспластические синдромы
D46.9- Миелодиспластический синдром неуточненный
1.5 Классификация
Рефрактерная цитопения с однолинейной дисплазией:
— рефрактерная анемия (РА);
— рефрактерная нейтропения (РН);
— рефрактерная тромбоцитопения (РТ)
Рефрактерная анемия с «кольцевыми» сидеробластами (РАКС)
Рефрактерная цитопения с мультилинейной дисплазией (РЦМД
МДС с изолированной делецией (5q).
МДС неклассифицируемый (МДС-Н)
Критерии диагноза представлены в таблице №1.
Таблица №1. ВОЗ –классификация МДС.
Нозологическаяформа
Изменения в гемограмме
Изменения в костном мозге
Рефрактерная цитопения с однолинейной дисплазией:
рефрактерная анемия (РА);
рефрактерная нейтропения (РН);
рефрактерная тромбоцитопения (РТ)
Одно или 2-х ростковая цитопения1
Все критерии полной ремиссии соблюдаются за исключением того, что количество бластных клеток в костном мозге снизилось на 50% и более от исходного значения, но остается более 5%.
Клеточность и морфология не актуальны
Костный мозг: 5% и менее бластных клеток и их количество в процессе терапии снизилось на 50% и более от исходного значения
Периферическая кровь: если наблюдается гематологическое улучшение, его следует добавлять к костно-мозговому ответу
Отсутствие частичной ремиссии, но нет признаков прогрессирования в течение более 8 нед.
Летальный исход на фоне терапии или прогрессирование заболевания, характеризующиеся усугублением цитопении, увеличением количества бластных клеток в костном мозге или прогрессирование в более «продвинутый» морфологический вариант МДС по сравнению с тем вариантом, что был до терапии
Рецидив после полной или частичной ремиссии
Необходимо наличие хотя бы 1 из следующих признаков:
– процент бластных клеток вернулся к исходному значению до лечения;
– снижение на 50% и более от максимального количества гранулоцитов или тромбоцитов во время ремиссии/ответа;
– снижение концентрации Hb на 15 г/л и более или присоединение трансфузионной зависимости
Полный: исчезновение хромосомных изменений и отсутствие новых
Частичный: уменьшение количества клеток с хромосомными нарушениями минимум на 50%
Для больных с количеством бластных клеток:
менее 5% – увеличение на 50% и более, т.е. более 5%;
5–10% – увеличение на 50% и более, т.е. более 10%; 10–20% – увеличение на 50% и более, т.е. более 20%;
20–30% – увеличение на 50% и более, т.е. более 30%.
Наличие любого из следующих признаков:
– снижение количества гранулоцитов или тромбоцитов как минимум на 50% от максимального значения во время ремиссии/ответа;
– снижение концентрации Hb на 20 г/л и более;
– зависимость от трансфузионной терапии.
Гематологическое улучшение
Критерии ответа (ответ должен сохраняться не менее 8 нед)
Эритроидный ответ (исходно менее 110 г/л)
Повышение Hb на 15 г/л и более;
Снижение абсолютного числа единиц переливаемой эритроцитной массы, по крайней мере, на 4 единиц в течение 8 нед по сравнению с исходным числом переливаемых единиц за предшествующие 8 нед;
Прогрессия или рецидив после гематологического улучшения
Доказательство хотя бы одного из следующих признаков:
– снижение на 50% и более от максимального количества гранулоцитов или тромбоцитов;
– снижение Hb на 15 г/л и более;
Перед назначением какого-либо лечения и для оценки динамики развития МДС
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 2).
Комментарии: Взрослые пациенты с первичным МДС, из группы низкого риска по IPSS, с бессимптомной цитопенией не нуждаются в лечении и лишь требуют регулярного обследования. Пациенты из группы промежуточного-1 риска по IPSS, с бессимптомной цитопенией, без избытка бластов и неблагоприятных цитогенетических аномалий также не требуют лечения, и могут лишь наблюдаться (рекомендация уровня D). Выжидательная стратегия может измениться в будущем, в случае разработки безопасных методов лечения, способных влиять на прогноз. Необходимо подчеркнуть, что пациенты должны понимать, что безопасность наблюдательного подхода зависит от регулярности мониторинга. Целью динамического наблюдения является раннее распознавание признаков усугубления цитопении, увеличения числа бластных клеток в крови или костном мозге, а также оценка эволюции кариотипа.
3.1 Консервативное лечение
Рекомендуется проведение заместительной терапии эритроцитсодержащими компонентами [1,2,3,4,5]
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 2)
Комментарии: Данные о показаниях к использованию трансфузии эритроцитов при МДС носят ограниченный характер. Зависимость от заместительной терапии эритроцитной массой у больных МДС ассоциируется с плохим прогнозом и, как правило, объясняется более агрессивным характером течения болезни, собственно тяжелой анемией и токсичностью, связанной с трансфузиями. Уровень гемоглобина ниже 90 г/л для мужчин и 80 г/л для женщин является независимым фактором прогноза, связанным с сокращением ОВ и высоким риском фатальных сердечно-сосудистых осложнений. В одном недавно опубликованном проспективном исследовании 2 фазы было показало, что трансфузионная тактика, направленная на поддержание уровня гемоглобина в пределах 120 г/л оказывала такой же положительный эффект на качество жизни, как и лечение препаратами, стимулирующими эритропоэз.
Таким образом, цель заместительной терапии эритроцитной массой заключается в компенсировании симптомов анемии, связанных с ишемическим повреждением органов и улучшение качества жизни. Никакой конкретный уровень гемоглобина не может быть рекомендован в качестве порогового и определяющего показания к трансфузионной поддержке. Решение следует принимать на основании имеющихся у пациента симптомов и сопутствующих заболеваний. Формализуя вышесказанное можно, в общем, рекомендовать трансфузии эритроцитной массы всем пациентам с падением гемоглобина ниже 80 г/л и с клиническими симптомами умеренной анемии (рекомендация уровня D). Трансфузии донорских эритроцитов необходимо проводить с учетом фенотипа по резус-фактора.
Рекомендуется проведение заместительной терапии тромбоцитными концентратами [1,2,3,4,5]
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 2)
Комментарии: Уровень тромбоцитов, при котором у больных МДС возникают геморрагические осложнения, четко не определен и варьирует от пациента к пациенту. Имеющиеся данные о показаниях к трансфузии тромбоцитов при МДС крайне ограничены.
Профилактическая трансфузия тромбоцитов рекомендуется пациентам с уровнем тромбоцитов ниже 10,0 х 109/л или при уровне ниже 20,0 х 109/л при наличии любого фактора риска для развития кровотечения (лихорадка, инфекция, быстрое снижение тромбоцитов, инвазивные процедуры), при условии, что тромбоцитопения преходящая. Многолетняя тромбоцитопения не нуждается в регулярных профилактических трансфузиях тромбоцитов (рекомендация уровня D).
Рекомендуется проведение хелаторной терапии деферазироксом**[1,2,3,4,5]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: У пациентов, которым регулярно проводятся трансфузии эритроцитной массы неизменно развиваться вторичная перегрузка железом. Цельная кровь содержит около 0,47 мг/мл железа, в то время как чистые эритроцитные взвеси не менее 1,16 мг/мл. Получается, что одна единица эритроцитной массы содержит от 200 до 250 мг железа, а перегрузка может возникнуть уже после 20-25 переливаний. Вторичный гемосидероз внутренних органов и зависимость от трансфузионной поддержки отчетливо коррелируют с ограниченной выживаемостью. По европейским данным, касающимся судьбы почти 3 тыс. пациентов с МДС, медиана ОВ больных с исходной зависимостью от трансфузий составила 19 мес., при возникновении зависимости в процессе эволюции заболевания – 60 мес., в то время как, у больных которым она не требовалась – 96 мес. (p МДС.
Рекомендуется проведение курса индукционной терапии по программам ОМЛ с использованием различных сочетаний следующих препаратов:
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
В РФ наибольший опыт накоплен по проведению курсов 7+3 с идарубицином и FLAG-Например, программа, которая используется в ФГБУ ГНЦ МЗ РФ, состоит из трех курсов 7+3 (цитарабин 100 мг/м2 2 раза в день 1-7 дни, идарубицин 12 мг/м2 1-3 дни) с последующей трехлетней поддерживающей терапией по схеме 5+5 (цитарбин+6-меркаптопурин)
Рекомендует проведение курса малых доз цитарабина (МДЦ) **[1,2,3,4,5]
Уровень убедительности рекомендаций В (уровень достоверности доказательств –2)
Рекомендует проведение курса низких доз мелфалана **[1,2]
Уровень убедительности рекомендаций D (уровень достоверности доказательств –3)
Комментарии: Использование малых доз мелфалана было исследовано в двух проспективных когортных исследованиях, которые суммарно включали 42 пациента с МДС высокого риска. Общий ответ при этом составил 38-40%, а токсичность была минимальной. Вероятность ответа на терапию была самой высокой у пациентов с гипоклеточным костным мозгом, избытком бластов и нормальным кариотипом.
Рекомендует проведение терапии меркаптопурином **[1]
Уровень убедительности рекомендаций D (уровень достоверности доказательств –3)
Комментарии: У больных с МДС, протекающим с бластозом, возможно осуществление терапии меркаптопурином. Препарат назначают в дозе 60 мг/м2 per os за 2 приема в постоянном режиме с коррекцией дозы или отменой при развитии глубокой цитопении. При снижении числа лейкоцитов менее 3,0 х 109/л доза препарата снижается на 25%, менее 2,0 х 109/л на 50%, а при падении до уровня менее 1,5 х 109/л отменяется до восстановления показателей, когда лечение можно будет возобновить. Терапия меркаптопурином, как правило, рассматривается исключительно в качестве паллиативного подхода..[1,2]
Рекомендуется проведение терапии гипометилирующими препаратами: Азацитидин**, Децитабин [1,2,3,4,5]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
Комментарии: Азацитидин (5-азацитидин) и децитабин (5-аза-2?-дезоксицитидин) относятся к оригинальному классу химиотерапевтических препаратов – гипометилирующих агентов или ингибиторов ДНК-метилтрансферазы, фермента, отвечающего за метилирование вновь синтезируемой ДНК.
В свете отсутствия прямых сравнительных исследований между азацитидином и децитабином невозможно сделать окончательное суждение о преимуществе одного препарата по отношению к другому.
Терапия гипометилирующими агентами показана:
Азацитидин назначается в дозе 75 мг/м2 подкожно 1 раз в сутки в дни 1-7 каждые 28 дней. При отсутствии прогрессии заболевания эффективность терапии необходимо оценивать после 6 курса. При положительном ответе (полная, частичная или костномозговая ремиссия, гематологическое улучшение) терапию следует продолжить до момента развития выраженной гипоплазии кроветворения или прогрессии заболевания, при отсутствии эффекта или прогрессии показана смена тактики терапии. Децитабин можно использовать в 2 режимах введения:
мг/м2 в виде 60-минутной инфузии 1 раз в день в дни 1-5 каждые 28-35 дней или
мг/м2 х 3 раза в день в виде 3-часов в/в инфузии в дни 1-3, каждые 6 недель.
При отсутствии прогрессии заболевания эффективность терапии следует оценивать после 4 курсов. При положительном ответе (полная, частичная или костно-мозговая ремиссия, гематологическое улучшение) терапию следует продолжить до момента развития выраженной гипоплазии кроветворения или прогрессии заболевания.
Рекомендуется проведение комбинированной иммуносупрессивной терапии: антитимоцитарный иммуноглобулин (АТГ) **, —циклоспорин А (ЦСА)** [1,2,3,4,5]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Определенное сходство клинических и морфологических проявлений гипопластических форм МДС и апластической анемии, а также клинические наблюдения, касающиеся эффекта иммуносупрессивного воздействия у отдельных больных, легли в основу тестирования антитимоцитарного глобулина (АТГ) в качестве метода терапии в двух исследования 2 и 3-й фаз. По объединенным данным этих проектов ответили на терапию 30% больных с количеством бластных клеток в костном мозге менее 5%. В ситуации РАКС или РАИБ вероятность ответа незначительна. В конечном счете, возраст менее 60 лет, группа низкого риска по IPSS, гипоклеточная морфология костного мозга, небольшой период предшествующей трансфузионной терапии и экспрессия HLA-DR15 являются факторами вероятного ответа на иммуносупрессивную терапию (ИСТ). Наилучшие результаты дает комбинированная терапия АТГ и ЦСА.
На основе имеющихся данных, комбинированную ИСТ с помощью АТГ и орального приема циклоспорина А в течение 6 мес. следует рассматривать в качестве выбора для пациентов моложе 60-65лет, с количеством бластных клеток в костном мозге менее 5%, нормальным кариотипом или трисомией 8 хромосомы, гемотрансфузионной зависимостью менее 2 лет, которые не являются кандидатами на лечение ростовыми факторами, или терапия которыми оказалась неэффективной, с генотипом HLA-DR15, минимальным ПНГ-клоном (рекомендация уровня A).
Рекомендуется проведение терапии леналидомидом#** (в Российской Федерации препарат зарегистирован для лечения больных Множественной миеломой ) [1,2,3,4,5]
Уровень убедительности рекомендаций А (уровень достоверности доказательств –2)
Применение леналидомида наиболее оправдано у трансфузионнозависимых пациентов с МДС с del(5q) (максимум с одной благоприятной поломкой) или увеличения числа бластных клеток менее 10%, из группы низкого или промежуточного-1 риска по IPSS, которые не являются кандидатами на терапию эритропоэтинами или не получили эффекта от их применения. Леналидомид назначается в дозе 10 мг р.о. в 1-21 дни, каждые 28 дней. Оптимальная продолжительность терапии леналидомидов не определена, но, по всей видимости, должна быть ограничена временем до момента начала прогрессирования или 24 мес. общей продолжительности лечения в случае сохраняющегося ответа. В связи с тем, что Леналидомид в РФ не зарегистрирован с показаниями для больных МДС, то назначение его необходимо осуществлять по решению врачебной комиссии.
Рекомендуется проведение трансплантации аллогенных стволовых гемопоэтических клеток (алло-ТГСК) [1,2,3,4,5]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Рекомендации по проведению алло-ТГСК у пациентов с МДС опираются на проспективные рандомизированные и нерандомизированные, а также групповые исследования. По данным Международного регистра по трансплантации костного мозга (IBMTR). основанном на анализе 387 взрослых пациентов с МДС, которым была выполнена алло-ТГСК от HLA-идентичного сиблинга, кумулятивная смертность, связанная с трансплантацией, составила 32% в течение 1 года и 37% в течение 3 лет, кумулятивная частота рецидивов 17% и 23%, ОВ – 53% и 40%, соответственно. Фаза заболевания является существенным фактором, влияющим на прогноз. Количество бластных клеток в костном мозге и риск по IPSS показали обратную зависимость с безрецидивной выживаемостью после трансплантации. Выживаемость без прогрессирования (ВБП) у пациентов из группы низкого или промежуточного-1 риска IPSS в течение 5 лет составила 60%, промежуточного-2 – 36-44% и для высокого риска – 28-30%.
Проспективных данных по выбору самого оптимального времени для проведения трансплантации нет. Оптимальные сроки для выполнения алло-ТГСК от HLA-совместимого донора при МДС определены в анализе клинических решений IBMTR. В этом исследовании было показано, что продолжительность жизни у пациентов, из группы низкого или промежуточного-1 риска по IPSS, была выше, когда трансплантация был отсрочена во времени, но выполнялась до трансформации в ОМЛ. Напротив, для больных из групп промежуточного-2 и высокого риска, именно немедленная трансплантация существенно улучшает показатели выживаемости. Привлечение неродственного донора в случае отсутствия совместимого по системе HLA родственного донора не приводит к увеличению летальности.
Риск заболевания в соответствии с IPSS, возраст и наличие сопутствующей патологии, оцененное по индексу коморбидности ТГСК (HCT-CI) являются наиболее значимыми клиническими данными, при рассмотрении вопроса о проведении пациенту аллогенной ТГСК.
Возраст на момент трансплантации является одним из самых важных прогностических факторов. По данным EBMT смертность пациентов со всеми морфологическими вариантами МДС, связанная с трансплантацией, составила 30% для пациентов моложе 20 лет, 43% – 20-40 лет и 50% для таковых старше 40 лет.
Проведение аллогенной ТГСК должно быть совместным решением врача и пациента, поскольку его отношение к риску является определяющим.
3.2 Хирургическое лечение
Рекомендуется выполнение спленэктомии [1]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2)
Комментарии: Спленэктомия у больных МДС в странах ЕС применяется редко, в основном у больных с глубокой тромбоцитопенией. В РФ накоплен опыт выполнения спленэктомии у 33 больных МДС. Чаще операция проводилась при гипоклеточной морфологии костного мозга (75%). В 16 (48%) случаях до спленэктомии проводилась комбинированная иммуносупрессивная терапия. В 6 (18%) случаях документировано увеличение размеров селезенки более 15 х 8 см. Как эффект от проведения спленэктомии у 16 (48%) пациентов отмечено снижение зависимости от гемотрансфузий.
У больных МДС с гипоплазией кроветворения (РА/РАКС/РЦМД) из группы низкого и промежуточного-1 риска в возрасте старше 50 лет спленэктомия может быть включена в план диагностических мероприятий для исключения вторичного характера гипоплазии костного мозга: хронический активный гепатит, лимфома селезенки. При исключении другой патологии больным с подтвержденным диагнозом МДС начинают иммуносупрессивную терапию с помощью циклоспорина А (ЦСА). Спленэктомию включают в программу лечения больных МДС с гипоплазией кроветворения в любом возрасте, если комбинированная ИСТ (ЦСА+АТГ) неэффективна и нет признаков прогрессии МДС (повышение процента бластных клеток, повышение клеточности костного мозга и появление новых цитогенетических аномалий). Спленэктомию желательно выполнять лапароскопическим доступом.
4. Реабилитация
5. Профилактика и диспансерное наблюдение
5.1 Профилактика
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 4)
Комментарии: к вредным условиям труда относятся: работа, связанная с тяжелым физическим и значительным нервно-психическим напряжением, воздействием токсических агентов, вибрации; пребыванием на высоте, обслуживанием движущихся механизмов, вождением транспортных средств, диспетчерские профессии и т.п.
5.2 Динамическое наблюдение
Рекомендуется: Постоянное динамическое наблюдение у гематолога рекомендовано в течение всей жизни. [1]
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 4)
Комментарии: график диспансерного наблюдения не отработан, устанавливается индивидуально каждым врачом для каждого пациента в зависимости от варианта МДС, возраста пациента и наличия сопутствующей патологии.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Факторы, связанные с пациентом
Отдельные параметры, характеризующие соматический статус пациента, могут влиять на естественное течение болезни и принятие терапевтических решений. К таким факторам относятся возраст, соматический статус, сопутствующие заболевания, физические резервы, нутритивный и психический статус пациента.
Продвинутый возраст является при МДС независимым неблагоприятным прогностическим фактором. Коррекция на возраст при оценке вероятности долгосрочной выживаемости была предоставлена для большинства прогностических систем. Тем не менее, хронологический возраст может отличаться от биологического, что необходимо учитывать при выборе тактики терапии.
Проблемы, связанные с наличием сопутствующих заболеваний, по-разному проявляются у пациентов с МДС из групп низкого и высокого риска. У пациентов с МДС из группы низкого риска, сопутствующие заболевания влияют на прогноз, непосредственно увеличивая риск смерти, не связанной с трансформацией в острый лейкоз. И, наоборот, у пациентов из группы высокого риска, клиническое значение нетяжелой сопутствующей патологии не так велико по сравнению с неблагоприятным прогнозом самого МДС. Однако, и у этих больных, коморбидность влияет на результаты лечения, ограничивая выбор возможных вариантов терапии.
Для прогнозирования влияния сопутствующих заболеваний на конечные результаты при выполнении трансплантации аллогенных кроветворных клеток (алло-ТГСК) был разработан «Индекс коморбидности при трансплантации костного мозга» (HCT-CI). Указанный инструмент призван учесть сопутствующие заболевания, существующие перед проведением алло-ТГСК, и используется для прогнозирования результатов трансплантации и стратификации пациентов с МДС и ОМЛ. Помимо HCT-CI существует еще ряд оценочных систем, которые были протестированы у пациентов с МДС, в частности индексы общего профиля Чарльсон и индекс коморбидности взрослых.
С практических позиций наибольший интерес представляет МДС-специфичный индекс коморбидностей (MDS-CI), для определения которого необходимо оценить функциональное состояние и/или наличие поражения сердца, печени, почек и легких, активных или излеченных солидных опухолей (табл. 4).
Таблица 4. Шкала коморбидности для больных МДС (MDS-CI)
Сопутствующие заболевания
Баллы
Поражение печени средней и тяжелой степени: