миофибробластическая опухоль что это такое
Миофибробластическая опухоль что это такое
1. Аббревиатура:
• Воспалительная миофибробластическая опухоль (ВМО)
2. Синонимы:
• Воспалительная псевдоопухоль, плазмоклеточная гранулема, плазмоклеточная псевдоопухоль, воспалительная миофиброгистиоцитарная пролиферация, брыжеечно-сальниковая миксоидная гамартома, ксантоматозная псевдоопухоль, псевдосаркоматозная миофибробластная пролиферация, миофибробластома
3. Определение:
• Опухоль, состоящая из миофибробластных веретеновидных клеток и воспалительного инфильтрата, представленного плазматическими клетками, эозинофилами, лимфоцитами и гистиоцитами
1. Общая характеристика:
• Локализация:
о Образование может быть обнаружено в различных областях тела, чаще всего в легких и глазницах
о В 43% случаев внелегочные образования располагаются в брыжейке и сальнике
о Мягкие ткани, средостение, желудочно-кишечный тракт, мочевой пузырь, кожные покровы, нервы, кости, поджелудочная железа, надпочечники, молочные железы, полость рта, головной мозг, желудочки, мозговые оболочки, позвоночник, предстательная железа, мочеиспускательный канал, мошонка, лимфатические узлы
• Размер: 2-20 см (в среднем 6 см)
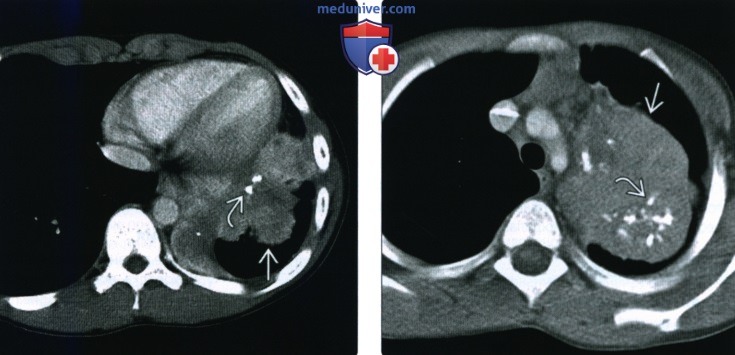
(Справа) У другого пациента при КТ с контрастным усилением в аксиальной плоскости в верхней доле левого легкого визуализируется крупная воспалительная миофибробластная опухоль, прилежащая к верхней границе средостения и содержащая множественные крупнозернистые кальцификаты. 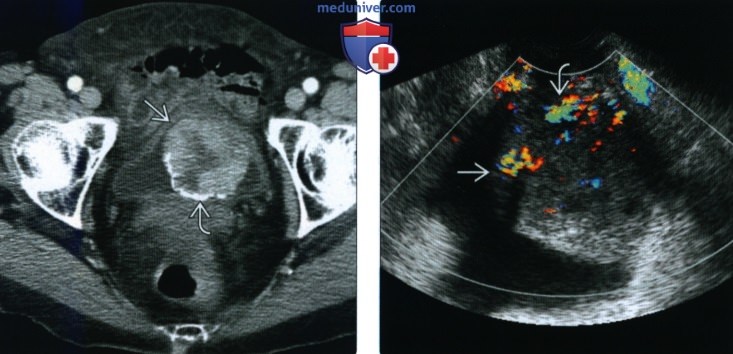
(Справа) При допплерографии малого таза по длинной оси в мочевом пузыре визуализируется крупное образование, с умеренно выраженной васкуляризацией. Дообследование позволило подтвердить отсутствие признаков инвазии стенки мочевого пузыря и лимфаденопатии. 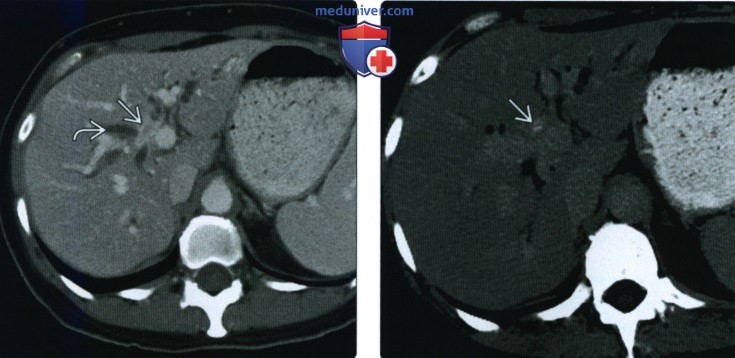
(Справа) У этого же пациента при КТ с контрастным усилением в аксиальной плоскости в отсроченной фазе сохраняется повышенное накопление контрастною препарата в выявленном образовании. Это образование было расценено как опухоль Клацкина, однако при хирургическом вмешательстве было подтверждено наличие воспалительной миофибробластной опухоли.
2. Рентгенография при воспалительной миофибробластической опухоли:
• Мягкотканное образование без специфических отличительных особенностей ± кальцификаты
3. КТ при воспалительной миофибробластической опухоли:
• Структура образования может быть гомогенной или гетерогенной
• Контур может быть инфильтрирующим
• Интенсивное контрастирование, сохраняющееся в отсроченной фазе исследования
4. МРТ при воспалительной миофибробластической опухоли:
• Мягкотканное образование как гомогенной, так и негомогенной структуры
• На Т1 ВИ характеризуется, как правило, изоинтенсивным сигналом по сравнению с мышцами или головным мозгом
• На Т2 ВИ в зависимости от выраженности фиброза может характеризоваться гипоинтенсивным сигналом
• Интенсивное контрастирование, сохраняющееся и в отсроченной фазе исследования
в) Дифференциальная диагностика воспалительной миофибробластической опухоли:
1. Воспалительная лейомиосаркома:
• При росте опухоли в виде пучка может иметь сходное гистологическое строение
• Сопровождается развитием паранеопластических синдромов
• Может быть обнаружена в различных областях тела
2. Гастроинтестинальная стромальная опухоль:
• По гистологическим особенностям может быть сходна с ВМО, если последняя локализуется в желудочно-кишечном тракте
• Положительная реакция на CD117 и CD34
• Отрицательная реакция на ALK
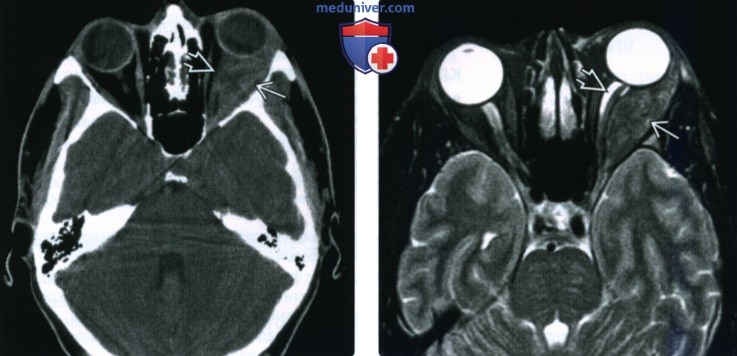
(Справа) У этого же пациента при МРТ в аксиальной плоскости в режиме STIR визуализируется поражение латеральной прямой мышцы глаза. Выявленное образование характеризуется относительно гипоинтенсивным сигналом, что указывает на наличие гиперклеточного инфильтрата или фиброза. Вследствие сдавливания влагалища зрительного нерва наблюдается скопление в нем ликвора. 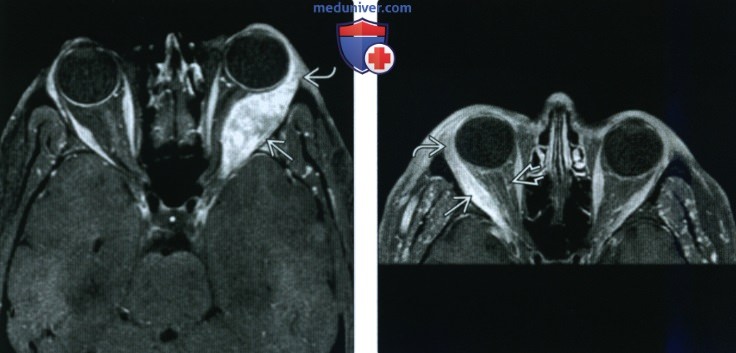
(Справа) При МРТ с контрастным усилением в аксиальной плоскости на Т1ВИ визуализируется изолированное утолщение латеральной прямой мышцы правого глаза, сопровождающееся поражением передних отделов ее сухожилия. Слабо выраженное неравномерное контрастирование области вдоль влагалища зрительною нерва указывает на воспалительный процесс в мышечной воронке глазницы. 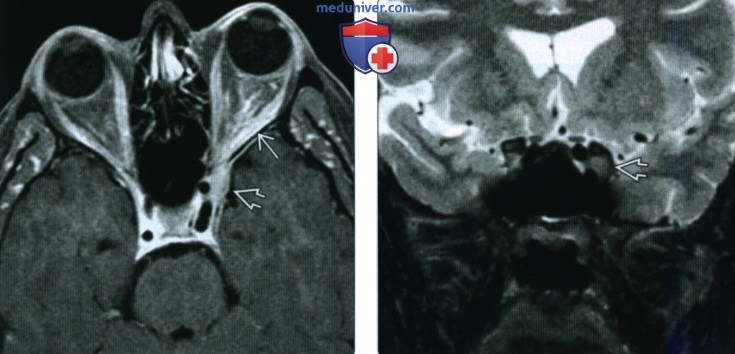
(Справа) У этого же пациента при МРТ в коронарной плоскости на Т2 ВИ выявленная в кавернозном синусе опухоль характеризуется гипоинтенсивным сигналом. Типоинтенсивный сигнал на Т2 ВИ в сочетании с контрастированием на Т1ВИ характерен для обызвествленной менингиомы и внутричерепной воспалительной миофибробластной опухоли.
1. Общая характеристика:
• Этиология:
о Не установлена
2. Макроскопические и хирургические особенности:
• Дольчатая опухоль от беловато-серого до коричнево-желтого или красного цвета:
о В центре может выявляться рубец
• Вариабельные плотность и структура поверхности опухоли на срезе: твердая, зернистая, эластичная, мясистая или миксоидная
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Лихорадка, ночная потливость, потеря веса
о Симптомы, возникающие при сдавливании органов:
— Боли в груди, одышка, кишечная непроходимость, увеличение окружности живота, обструкция выходного отверстия мочевого пузыря, частое мочеиспускание, гематурия
• Другие симптомы:
о Повышение СОЭ, анемия, тромбоцитоз, поликлональная гиперглобулинемия
о Аменорея при локализации опухоли в надпочечнике
о Тромбоз синусов твердой мозговой оболочки
о В редких случаях дерматомиозит или облитерирующий флебит
2. Демография:
• Возраст:
о Обычно встречается у лиц молодого возраста, в том числе и детей:
— Как правило, диагностируется в возрасте до 20 лет
— Образование может быть выявлено в любом возрасте
• Пол:
о Некоторое преобладание женского пола
3. Течение и прогноз:
• 15-25% внелегочных образований рецидивируют:
о Вероятность рецидива опухолей, располагающихся в головном мозге, составляет до 40%
• Метастазы выявляют менее чем в 5% случаев
• После удаления опухоли системные симптомы исчезают
4. Лечение:
• Радикальная резекция
• В редких случаях регистрируется положительный ответ на лечение нестероидными противовоспалительными препаратами и глюкокортикоидами
• Если после лечения возникают системные симптомы, необходимо дообследование для исключения рецидивирования или метастазирования
е) Список использованной литературы:
1. Cheng KJ et al: A case report of an inflammatory myofibroblastic tumor of the neck: A focus on the computed tomography and magnetic resonance imaging findings. Oncol Lett. 10(1):518-522, 2015
2. Chung EM et al: Solid tumors of the peritoneum, omentum, and mesentery in children: radiologic-pathologic correlation: from the radiologic pathology archives. Radiographics. 35(2):521-46, 2015
3. Hohne S et al: Inflammatory pseudotumor (IPT) and inflammatory myofibroblastic tumor (IMT): a representative literature review occasioned by a rare IMT of the transverse colon in a 9-year-old child. Tumori. 101(3):249-56, 2015
Редактор: Искандер Милевски. Дата публикации: 9.5.2021
Воспалительная миофибробластическая опухоль мочевого пузыря
А.С. Попко, К.Л. Локшин, Л.А. Шестакова, В.Н. Ширшов
Клинический госпиталь Лапино, ГК «Мать и дитя»; Москва, Россия
Клиническое течение ВМО весьма вариабельно. Иногда опухоль может медленно расти и никак не проявляться клинически. В некоторых ситуациях возможен быстрый инфильтративный рост в окружающие ткани и отдаленное метастазирование. На начальных этапах развития опухоли клиническая картина может проявляться потерей массы тела, лихорадкой, анемией и повышением в сыворотке крови концентрации белков острой фазы воспаления. В дальнейшем появляются симптомы сдавления тех органов и тканей, в которых она возникла. Лечение ВМО преимущественно оперативное. В случае технической невозможности выполнения операции при прогрессировании заболевания возможно применение лучевой или химиотерапии.
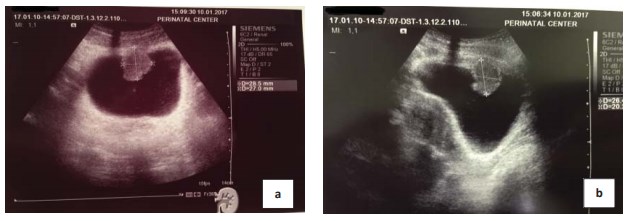
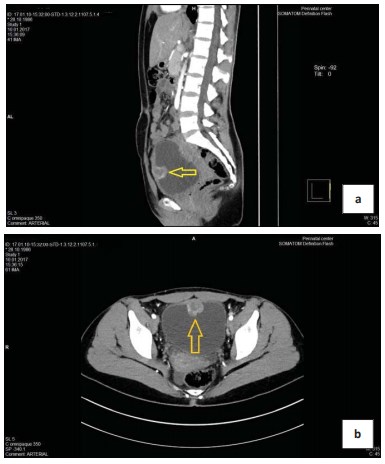
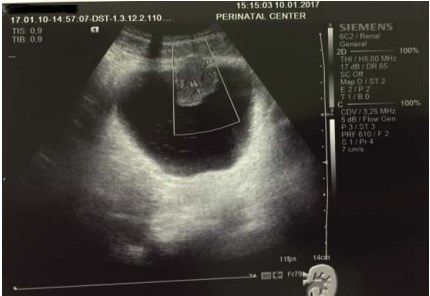
Пациентка К., 30 лет, обратилась к урологу в январе 2017 г. по поводу тотальной безболевой макрогематурии без сгустков (моча цвета мясных помоев), возникшей около 10 дней назад. При УЗИ (рис. 1) и КТ (рис. 2) было выявлено образование передней стенки мочевого пузыря, размерами до 29 мм. Образование обильно васкуляризировано (рис. 3). В общем анализе мочи: лейкоциты > 100 в поле зрения, эритроциты > 100 в поле зрения. В анализах крови и соматическом статусе — без отклонений от нормы. 18.01.17 выполнена цистоскопия, трансуретральная резекция (ТУР) мочевого пузыря с опухолью. При эндоскопическом исследовании опухоль расположена на передней стенке мочевого пузыря, плотная, бугристая на широком основании, покрыта ярко-розовой слизистой. При ТУР отмечается повышенная кровоточивость сосудов опухоли. Выполнена «холодная» щипковая биопсия стенки мочевого пузыря из ложа удаленной опухоли. Осложнений не было.
Рисунок 1. УЗИ мочевого пузыря a) поперечное сканирование b) продольное сканирование
Рисунок 2. Компьютерная томография a) мультипланарная реконструкция b) поперечный скан (стрелкой указана опухоль)
Рисунок 3. УЗИ мочевого пузыря, допплерография
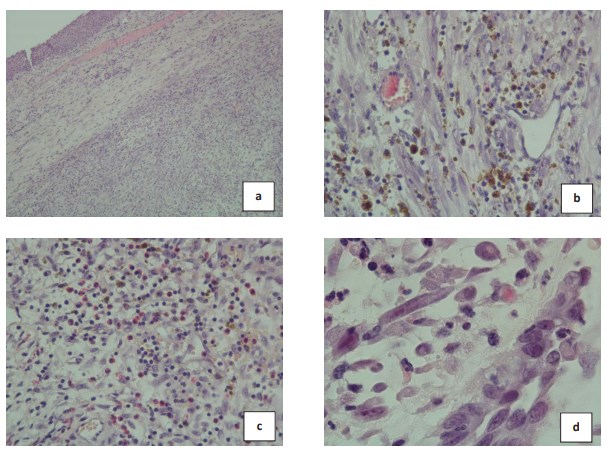
При морфологическом исследовании удаленной ткани выявлены множественные фрагменты опухоли из переплетающихся пучков мономорфных веретеновидных клеток с низкой митотической активностью, участкамимиксоматоза и отека, с зонами эрозий и изъязвлений, частично выстланные уротелием с реактивными изменениями. Отмечается диффузно-очаговая лимфо-плазмоцитарная инфильтрация с примесью большого количества нейтрофилов и эозинофилов. Морфологическая картина соответствует воспалительной миофибробластической опухоли мочевого пузыря (рис. 4). В биопсии из зоны основания опухоли элементов опухоли не обнаружено.
Рисунок 4. Воспалительная миофибробластическая опухоль мочевого пузыря. Окраска гематоксилином и эозином: a) фрагмент опухоли, выстланный уротелием. х40; b) среди клеток воспалительного инфильтрата определяются скопления гранул гемосидерина. х200; c) пролиферация миофибробластов сопровождается диффузно-очаговой лимфо-плазмоцитарной инфильтрацией, с примесью большого количества нейтрофилов и эозинофилов. х100; d) мономорфные веретеновидные миофибробласты с везикулярными ядрами, вперемешку с клетками воспалительного инфильтрата, расположены в рыхлой и миксоидной строме. х400
При контрольной цистоскопии через 3 и 9 месяцев данных за рецидив опухоли не получено, слизистая мочевого пузыря без патологических изменений. В анализах мочи без патологических сдвигов. В последующем планируется проведение динамического наблюдения, как и за больными с уротелиальной карциномой низкой степени злокачественности.
Заключение
В представленном клиническом наблюдении описан опыт успешного эндоскопического лечения пациентки с редким заболеванием — воспалительной миофибробластической опухолью мочевого пузыря.
Литература
Статья опубликована в журнале «Вестник урологии» №4 2017, стр. 79-83
Миофибробластическая опухоль что это такое
Миофибробластическая (МФБ) опухоль легкого относится к новообразованиям мезенхимальной природы и характеризуется пролиферацией миофибробластных клеток с миксоидной или коллагеновой стромой, представленной широким спектром клеток воспаления. Традиционно МФБ-опухоли рассматривались разными авторами как доброкачественные, однако по мере накопления опыта в лечении этой группы больных описаны такие свойства МФБ-опухолей, как способность к инвазивному росту, метастазированию, генетическая нестабильность.
Материал и методы
В отделении торакальной онкохирургии МНИОИ им. П.А. Герцена за период с 2011 по 2015 г. диагноз миофибробластическая опухоль легкого установлен 4 больным (см. таблицу).

Возраст пациентов колебался от 19 до 55 лет, медиана составила 34 года. У половины больных заболевание протекало бессимптомно, основным поводом для госпитализации являлась рентгенологическая картина образования в легком, сходная с таковой при первичном раке легкого либо при метастическом поражении. В 2 из 4 случаев больные предъявляли жалобы при поступлении: кровохарканье в случае № 2, приступообразный сухой кашель в случае № 3.
Спектр минимального предоперационного обследования включал мультиспиральную компьютерную томографию органов грудной клетки, фибробронхоскопию, ультразвуковое исследование органов брюшной полости, забрюшинного пространства, надключичных лимфатических узлов.
Морфологически верифицировать диагноз МФБ-опухоли на предоперационном этапе удалось у 2 из 4 пациентов. В случае № 1 пациентке проведено комбинированное лечение по поводу синовиальной саркомы мягких тканей правой ягодичной области. При контрольном обследовании визуализирован мягкотканный очаг в VIII сегменте левого легкого, окруженный зоной инфильтрации по типу матового стекла. Под контролем компьютерной томографии была выполнена пункция образования, иммуногистохимическим методом подтвержден диагноз МФБ-опухоли. В случае № 2 образование располагалось в левом главном бронхе и было доступно для эндобронхиальной биопсии.
В двух случаях МФБ-опухоль легкого сочеталась c другим онкологическим процессом. В случае № 3 направляющим диагнозом являлась аденокарцинома верхней доли правого легкого с отсевом в нижнюю долю правого легкого, по поводу чего было выполнено радикальное хирургическое лечение в объеме расширенной пневмонэктомии справа с медиастинальной лимфаденэктомией. Диагноз МФБ-опухоли, локализованной в нижней доле удаленного легкого, установлен при плановом патоморфологическом исследовании операционного материала. В случае № 4 в возрасте 3 лет пациентке было проведено комбинированное лечение по поводу нефробластомы левой почки в объеме нефрэктомии с последующей химиолучевой терапией. При контрольном обследовании визуализировалось солитарное очаговое образование с неровными контурами в VIII сегменте нижней доли левого легкого, трактуемое как периферический рак. Выполнена анатомическая резекция базальных сегментов, диагноз МФБ-опухоли установлен при плановом гистологическом исследовании.
Случаев интрапостоперационной летальности зафиксировано не было. Сроки наблюдения за пациентами после операции составили от 14 до 62 мес.
Представляем наиболее сложное с хирургических позиций клиническое наблюдение.
Клинический случай
Больной Т., 18 лет, поступил в МНИОИ им. П.А. Герцена 09.01.13 с жалобами на эпизоды кровохарканья.
Из анамнеза: в возрасте 11 лет впервые отмечены эпизоды кровохарканья, в связи с чем проведено обследование на базе РДКБ Москвы. Выявлена и морфологически подтверждена МФБ-опухоль левого главного бронха. После проведения эндоскопического удаления отмечалась редукция симптомов. При контрольной фибробронхоскопии в возрасте 12 лет выявлены продолженный рост опухоли, распространение на бифуркацию трахеи. Однако в связи с отсутствием клинической симптоматики лечение не проводилось. В возрасте 18 лет эпизоды кровохарканья возобновились, в связи с чем пациент обследован на базе МНИОИ им. П.А. Герцена.
При компьютерной томографии отмечено сужение левого главного бронха до 6 мм на протяжении 23 мм от уровня бифуркации трахеи (рис. 1). По задней полуокружности визуализируется мягкотканный компонент толщиной до 6 мм. Трахея и бронхи справа проходимы, не деформированы. Внутригрудные лимфатические узлы не изменены. Четко не прослеживается граница между стенкой пищевода и измененной стенкой левого главного бронха.

При внутрипросветном ультразвуковом исследовании пищевода связь образования со стенкой пищевода исключена.
При флюоресцентной фибробронхоскопии в дистальной части нижней трети трахеи, в области заднего треугольника карины и устья левого главного бронха определяется экзофитная опухоль ярко-красного цвета, овальной формы на широком основании, размером 1×1 см, мягкой консистенции, выраженно контактно кровоточива. Дистальнее в начальном отделе левого главного бронха по задней стенке определяется эндофитный опухолевый компонент (2-я часть опухоли) размером 1×1 см. Слизистая в этой зоне гиперемирована, с выраженными вторично-измененными сосудами подслизистого слоя. Общий размер опухолевого поражения 2,0×2,5 см. В области эндофитного компонента опухоли просвет левого главного бронха сужен на ½. Бронхи верхней и нижней доли левого легкого без особенностей.
По данным гистологического и иммуногистохимического исследования биоптата из левого главного бронха — воспалительная МФБ-опухоль: виментин, AsmM — положительная. ALK, десмин, p53 — отрицательная. ОЦК, S100 — положительная в части клеток опухоли (рис. 2).

Таким образом, установлен рецидив (после эндоскопического лечения) воспалительной МФБ-опухоли левого главного бронха с переходом на задний треугольник карины, дистальную часть нижней трети трахеи, осложненный стенозом левого главного бронха, кровохарканьем. Выработан хирургический план лечения. Предполагаемый объем операции: резекция бифуркации трахеи с последующим межбронхиальным анастомозом.
Операция (23.01.13). Дугообразная заднебоковая торакотомия справа в положении больного на животе (рис. 3). Выполнена поднадкостничная резекция IV ребра с формированием поднадкостнично-мышечного лоскута для укрытия в последующем анастомоза. Левый главный бронх пересечен отступя 3 полукольца от устья. В дистальный отдел левого главного бронха установлена армированная трубка для шунтирования дыхания, начата вентиляция левого легкого. При ревизии опухолевые изменения начинаются от устья левого главного бронха, переходят на задний треугольник карины и дистальную часть нижней трети трахеи (рис. 4). Произведена резекция бифуркации трахеи с участком левого и правого главных бронхов (рис. 5). Выявлено, что линия резекции левого главного бронха прошла по ткани опухоли, что требует досечения двух полуколец последнего и делает невозможным сформировать анастомоз между левым главным и промежуточным бронхом. В связи с этим показана пневмонэктомия слева. Сформирован анастомоз между правым главным бронхом и трахеей с укрытием поднадкостнично-мышечным лоскутом. После поворота больного на спину произведена переднебоковая торакотомия слева по пятому межреберью. Выполнена пневмонэктомия слева. Время операции составило 385 мин.



Послеоперационный период осложнился внутриплевральным кровотечением, свернувшимся гемотораксом, в связи с чем на 1-е послеоперационные сутки в экстренном порядке выполнены реторакотомия слева, удаление свернувшегося гемоторакса.
При плановом патоморфологическом исследовании — МФБ-опухоль с вовлечением проксимальных отделов мембранозной части стенки левого главного бронха на всю толщу и распространением на дистальные отделы мембранозной части стенки трахеи (рис. 6). Края резекции без опухолевого роста.

В последующем в связи с ограничением подвижности грудной клетки, анемией развилась нижнедолевая пневмония единственного правого легкого. На фоне антибиотикотерапии, сеансов эндобронхиальной лазеротерапии (в связи с некрозом по левой полуокружности трахеобронхиального анастомоза) отмечалась положительная динамика, клинико-рентгенологически подтверждено разрешение пневмонии. Больной выписан на 35-е сутки после операции.
Через 5 мес после операции в связи с грануляционным стенозом трахеобронхиального анастомоза был проведен 1 курс лазерной и аргоноплазменной реканализации просвета с хорошей положительной динамикой. Просвет анастомоза 12 мм. Повторных реканализаций не требовалось. Больной наблюдается больше 3 лет без признаков прогрессирования опухолевого процесса.
Обсуждение
Частота встречаемости МФБ-опухолей, по данным разных авторов, составляет 0,04—1% всех новообразований легкого [1—3]. Средний возраст пациентов 27—50 лет. Наблюдается два пика встречаемости — первый среди детей, второй среди взрослых старше 40 лет. По данным H. Lee и соавт. [4], включающим 15 пациентов, 26% пациентов были младше 18 лет, 53% — старше 40 лет. В Токийском национальном институте рака за 17-летний период (с 1985 по 2002 г.) МФБ-опухоли легких выявлены лишь у 9 (0,18%) пациентов из 4893, оперированных по поводу новообразований легких [1]. По данным из клиники Мейо, за почти что 50-летний период (с 1946 по 1993 г.) среди 56 400 торакальных операций диагноз МФБ-опухоли легких был установлен лишь у 23 больных [2].
Несмотря на то что МФБ-опухоли могут встречаться в средостении, гортани, органах желудочно-кишечного тракта, орбите, в органах мочевой системы и ретроперитонеально, легкие являются наиболее распространенной локализацией. В качестве основных этиопатогенетических звеньев развития МФБ-опухолей рассматриваются аутоиммунный механизм воспаления и связь с частыми респираторными заболеваниями. Считается, что около 30% случаев ассоциировано с пневмонитами, бронхитами, вызванными Mycoplasma, Nocardia, Actinomycetes, вирусом Эпштейна—Барр, герпеса [2, 3]. Однако у большинства пациентов проследить четкую связь заболевания с вышеуказанными причинами не удается.
По гистологическому строению МФБ-опухоли характеризуются наличием двух компонентов: 1) формирующие строму опухоли различные клетки иммунной системы — плазмоциты, гистиоциты, лимфоциты; 2) клетки мезенхимального происхождения — веретеновидные миофибробласты, фибробласты. В связи с большим разнообразием клеточной структуры ранее в литературе использовалось множество терминов, описывающих данный вид патологии: воспалительная псевдоопухоль, плазмоклеточная гранулема, ксантогранулема, фиброзная гистиоцитома, псевдосаркома. Общая черта, объединяющая эти заболевания, — строма опухоли, богатая клетками воспаления. Считалось, что все термины, представленные выше, являются равнозначными. Понятие «миофибробластическая опухоль» предложено G. Pettinato в 1990 г. [5]. Основанием для этого послужило выделение в отдельную группу образований, паренхима которых состояла преимущественно из веретеновидных миофибробластов. При иммуногистохимическом исследовании эти клетки чаще всего экспрессируют SMA и виментин. С более широким внедрением иммуногистохимического метода в практику было показано, что экспрессирующая SMA линия дифференцировки выявляется только в 56% случаев. Это позволило авторам выделить два подтипа в группе МФБ-опухолей: SMA-позитивные и SMA-отрицательные. SMA-позитивный расценивается как более агрессивный вариант, способный к инвазивному росту [3].
Обычно веретеновидные клетки характеризуются низкой митотической активностью, не имеют атипичных свойств. Клетки стромы представлены зрелыми формами, не дают моноклональных пролифератов. Встречаются как В-, так и Т-лимфоциты, что помогает в дифференциальном диагнозе с лимфомами [5].
В работе С. Coffin изучена экспрессия гена ALK на клетках МФБ-опухолей. Роль данного протоонкогена хорошо известна в развитии аденокарциномы легкого. Среди европейского населения частота экспрессии ALK при раке легкого составляет 5—7%, в то время как при МФБ-опухолях этот показатель достигает 50%. Гиперэкспрессия данного гена достоверно связана с риском локального рецидива после хирургического лечения. Однако связи с потенциалом к метастазированию отмечено не было. Среди пациентов старшего возраста с отдаленными метастазами чаще встречались варианты МФБ-опухолей, не экспрессирующие ALK. Авторы предположили, что наличие мутации ALK — благоприятный прогностический фактор [6].
Таким образом, МФБ-опухоли выделены из большой категории воспалительных псевдоопухолей как самостоятельная нозологическая единица со злокачественным потенциалом, усиливающимся при гиперэкспрессии SMA, ALK.
Макроскопически МФБ-опухоль не имеет капсулы, гомогенная, плотная. Иногда встречаются очаги некроза.
Чаще всего, особенно в старшем возрасте, течение заболевания бессимптомное. У детей клиническая картина обусловлена синдромом обструкции дыхательных путей, что приводит к частым респираторным заболеваниям. Основные симптомы в старшей возрастной группе — боль в груди, кровохарканье, анорексия, артралгия, симптом барабанных палочек. Часть этих симптомов может быть связана с повышенным синтезом интерлейкина-1а, продуцируемого макрофагами стромы. В лабораторных анализах встречаются железодефицитная анемия, тромбоцитоз, ускоренная СОЭ, гипергаммаглобулинемия. Описаны варианты эндобронхиального роста, приводящие к ателектазу сегментов или целого легкого [1]. Редким вариантом роста опухоли является инвазия в окружающие структуры средостения. В этом случае чаще всего поражаются тела позвонков, магистральные сосуды средостения [2, 7]. Внелегочная локализация характеризуется повышенным потенциалом к агрессивному течению, высокой частоте локального рецидива. Несмотря на общепринятое отношение к МФБ-опухолям как к доброкачественным, способность к инвазивному росту, локальному рецидиву, характеризует злокачественный потенциал заболевания [8].
Установление диагноза МФБ-опухоли на предоперационном этапе является сложной задачей. Характерные рентгенологические признаки сформированы G. Agrons [9]. При компьютерной томографии в 90% случаев опухоль представлена солитарным очагом, в 5% — множественными узлами. Как правило, образование с четкими, ровными контурами, отграниченное от окружающих тканей. Однако нередко выявляются спикулообразные контуры, напоминающие таковые при аденокарциноме легкого. Типичные размеры от 1 до 6 см в диаметре. Описаны случаи гигантских МФБ-опухолей, достигающих 36 см [10]. Наиболее распространена локализация в нижних долях. В редких случаях встречаются кальцификаты, наличие полости, медиастинальная лимфоаденопатия. В 10% случаев течение заболевания осложняется плевральным выпотом, в 8% — сегментарным ателектазом. В связи с высокой активностью опухоли при позитронно-эмиссионной томографии происходит активное накопление 18-FDG, что еще больше затрудняет дифференциальную диагностику с злокачественными новообразованиями легких. М. Patnana и соавт. [11] в обзоре, посвященном воспалительным псевдоопухолям, называет данное заболевание «великий подражатель», подчеркивая схожесть клинико-рентгенологической картины с раком легкого.
Морфологическая верификация очагов в легком методом тонкоигольной биопсии позволяет установить диагноз лишь в 6,3% случаев, что обусловлено особенностями данной опухоли [4].
Дифференциальный диагноз следует проводить с лимфомой, солитарной фиброзной опухолью, карциномой, склерозирующей гемангиомой, нейрофибромой, десмоидным фиброматозом, ангиомиофибробластомой, фибросаркомой, лейомиомой, злокачественной фиброзной гистиоцитомой. Такие признаки, как низкий митотический индекс, поликлональность лимфатических маркеров, отсутствие экспрессии CD34, позволяют предположить доброкачественный характер образования. Окончательный диагноз зачастую возможен только после полного гистологического исследования удаленной опухоли.
Золотым стандартом в лечении данной категории опухолей является хирургический метод. Объем оперативных вмешательств варьирует от сегментэктомии до комбинированной пневмонэктомии, порой с резекцией грудной стенки, магистральных сосудов средостения. При нерадикально выполненной операции риск рецидива достигает 60%. В наблюдении R. Cerfolio и соавт. [2] 4 из 23 пациентов поступили в клинику по поводу продолженного роста МФБ-опухоли легкого после предшествующего неполного хирургического удаления.
В связи с тем что у большей части пациентов оперативное вмешательство выполняется по поводу предполагаемого рака легкого, традиционно выполняется рутинная медиастинальная лимфаденэктомия, не показанная этой категории больных.
В случаях мультифокального поражения или нерезектабельности, обусловленной массивным вовлечением в процесс структур средостения, одним из методов лечения может являться введение высоких доз глюкокортикостероидов. Такой вариант терапии может выступать в качестве неоадъювантного, повышая возможность полного удаления опухоли. При низких резервах кардиореспираторной системы в случае эндобронхиального расположения опухоли возможно применение внутрипросветных методик, таких как лазерная деструкция, абляция, электрокаутеризация [12]. Эти методы широко применяются в лечении пациентов детского возраста, однако сопряжены с высоким процентом рецидивов.
В случае отказа от хирургического вмешательства в литературе имеются указания на применение методов лучевого воздействия на зону опухоли, однако эти исследования относятся к 70-м годам прошлого века и не получили большого распространения в связи с низкой эффективностью [10].
Известны случаи полной спонтанной регрессии опухоли. S. Bilaceroglu и соавт. [10] сообщают о 21-летней пациентке, поступившей в клинику с жалобами на отсутствие аппетита, потерю 6 кг массы тела за 6 мес. При обследовании, по данным компьютерной томографии, визуализировано два солитарных очага: в нижней доле правого легкого диаметром 6 см и в нижней доле левого легкого диаметром 2 см. По данным пункции под КТ-контролем подтвержден диагноз МФБ-опухоли. После выполненной на первом этапе нижней лобэктомии справа исследователи отметили полную инволюцию очага в контралатеральном легком.
Прогноз после радикально выполненного хирургического вмешательства благоприятный. 3-летняя выживаемость 82%, 5-летняя 74%. Основная причина летальности от прогрессирования заболевания кроется в неполном удалении опухолевого образования.
Заключение
Таким образом, миофибробластические опухоли легкого — чрезвычайно редкая патология, составляющая 0,04—1% от всех новообразований легких. Установить диагноз на предоперационном этапе сложно в связи с рентгенологической семиотикой периферически расположенных опухолей, схожей с таковой при аденокарциноме легкого. В случае центрального расположения миофибробластическая опухоль чаще проявляется клинически, ведущими симптомами являются кровохарканье, нарушение бронхиальной проводимости, обусловленное экзофитным компонентом опухоли. Опухоль характеризуется промежуточным злокачественным потенциалом, склонна к метастазированию, инвазивному росту в случае гиперэкспрессии SMA, ALK, подтвержденной иммуногистохимическим методом. Единственным методом полного излечения данной категории больных является полное удаление опухоли. Перибронхиальный рост затрудняет определение истинных границ распространения опухоли, вынуждая расширять объем оперативного вмешательства. Радикально выполненная операция определяет хорошую отдаленную выживаемость.