миопатия эрба что это
Прогрессирующая мышечная дистрофия Эрба–Рота
Частота 1,5 на 100 000 населения.
Что провоцирует / Причины прогресирующей мышечной дистофии Эрба-рота:
Наследуется по аутосомно-рецессивному типу.
Патогенез (что происходит?) во время прогресирующей мышечной дистофии Эрба-рота:
Соответствует первично-мышечному поражению.
Симптомы прогресирующей мышечной дистофии Эрба-рота:
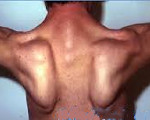
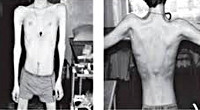
Первые признаки заболевания проявляются преимущественно в 14–16 лет, крайне редко – в 5–10-летнем возрасте. Начальными симптомами являются мышечная слабость, патологическая мышечная утомляемость при физической нагрузке, изменение походки по типу «утиной». Атрофии в начале болезни локализуются в проксимальных группах мышц нижних конечностей. Иногда миодистрофический процесс одновременно поражает мышцы тазового и плечевого пояса. В значительно более поздних стадиях в процесс вовлекаются мышцы спины и живота. Вследствие атрофии возникают лордоз, «крыловидные» лопатки, «осиная» талия. При вставании больные применяют вспомогательные приемы – вставание «лесенкой». Псевдогипертрофии мышц, контрактуры суставов, сухожильные ретракции, как правило, выражены умеренно. Уже в ранних стадиях болезни типично снижение коленных рефлексов и рефлексов с двуглавой и трехглавой мышц плеча.
Течение. Заболевание быстро прогрессирует. Инвалидизация наступает рано.
Диагностика прогресирующей мышечной дистофии Эрба-рота:
Диагноз ставится на основании данных генеалогического анализа (аутосомно-рецессивный тип наследования), особенностей клиники (начало болезни преимущественно в 14–16 лет, атрофии проксимальных групп мышц, умеренные псевдогипертрофии, быстрое прогрессирование), результатах игольчатой электромиографии и морфологических данных, позволяющих выявить первично-мышечный характер изменений.
Дифференцировать болезнь следует от прогрессирующей мышечной дистрофии Беккера, спинальной амиотрофии Кугельберга–Веландера.
К каким докторам следует обращаться если у Вас Прогрессирующая мышечная дистрофия Эрба–Рота:
Миопатии
Миопатии — группа заболеваний, основу которых составляют различные нарушения в метаболизме и строении мышечной ткани, приводящие к снижению силы пораженных мышц и ограничению двигательной активности. Типичными чертами миопатии являются: прогрессирующая мышечная слабость, развитие мышечных атрофий, снижение сухожильных рефлексов и тонуса мышц. Установить диагноз миопатии помогают электрофизиологические исследования, биохимические анализы крови и мочи, результаты молекулярно-генетического и гистохимического анализа образцов, полученных путем биопсии мышц. Лечение предполагает комплексное назначение метаболических препаратов курсами 3 раза в год.
Общие сведения
Миопатии относятся к группе нервно-мышечных заболеваний. Характеризуются дистрофическим поражением мышечной ткани (преимущественно скелетной мускулатуры) с выборочной атрофией отдельных волокон (миофибрилл) при полной функциональной сохранности анимальной нервной системы. Отличаются хроническим неуклонно прогрессирующим течением. Как правило, манифестация клинических проявлений миопатии приходится на детский и юношеский возраст. Большую часть случаев заболевания представляет генетическая патология — это так называемые первичные миопатии. Реже встречаются миопатии приобретенного генеза — вторичные или симптоматические.
Причины миопатий
В основе первичных миопатий лежат генетически детерминированные нарушения в функционировании митохондрий и ионных каналов миофибрилл, в синтезе мышечных белков или ферментов, регулирующих обмен веществ мышечной ткани. Наследование дефектного гена может происходить рецессивно, доминантно и сцеплено с Х-хромосомой. При этом внешние факторы зачастую выступают в роли триггеров, запускающих развитие болезни. Подобными «пусковыми» факторами могут являться разнообразные инфекции (хронический тонзиллит, частые ОРВИ, бактериальная пневмония, сальмонеллез, пиелонефрит и пр.), алиментарная дистрофия, тяжелые травмы (перелом костей таза, политравма, ЧМТ и др.), физическое перенапряжение, интоксикации.
Приобретенные миопатии могут развиваться на фоне эндокринных расстройств (гиперпаратиреоза, болезни Иценко-Кушинга, гиперальдостеронизма), хронических интоксикаций (токсикомании, наркомании, алкоголизма, профессиональных вредностей), мальабсорбции и авитаминозов, тяжелых хронических заболеваний (ХПН, хронической печеночной недостаточности, сердечной недостаточности, ХОБЛ), опухолевых процессов.
Патогенез
Наличие генетически детерминированных или приобретенных дефектов метаболитов, участвующих в обмене веществ и построении мышечных волокон, приводит к возникновению и прогрессированию дегенеративных изменений последних. Развивается атрофия миофибрилл, происходит их замещение жировой и соединительной тканью. Мышцы утрачивают способность к сокращению, что обуславливает мышечную слабость и ограничение возможности выполнять активные движения.
Последние исследования выявили у больных различными формами миопатий нарушения функционирования как центральных (на диэнцефальном уровне), так и периферических отделов вегетативной нервной системы, играющих не последнюю роль в патогенезе заболевания. Именно этим можно объяснить типичное для миопатий преимущественное поражение проксимальных отделов конечностей, имеющих более богатую вегетативную иннервацию.
Классификация
Специалистами в области неврологии разработано несколько классификаций миопатий. Наибольшую популярность среди клиницистов получил этиопатогенетический принцип разделения, согласно которому выделяют наследственные, воспалительные, метаболические, мембранные, паранеопластические и токсические миопатии. Среди наследственных миопатий наиболее распространены 3 вида: ювенильная/юношеская форма Эрба, псевдогипертрофическая форма Дюшена и плече-лопаточно-лицевая форма. Реже встречаются скапулоперонеальная, окулофарингеальная, дистальная и др. формы. Отдельной группой идут врожденные миопатии: болезнь центрального стержня, немалиновая и миотубулярная миопатия, диспропорция типов миофибрилл.
Симптомы миопатий
Большинство миопатий имеют постепенное начало с появления небольшой мышечной слабости в конечностях, более быстро возникающей усталости от ходьбы и другой физической нагрузки. В течение нескольких лет происходит нарастание слабости, появляются и прогрессируют мышечные атрофии, возникают деформации конечностей. Из-за значительной мышечной слабости пациенты с трудом поднимаются с пола и ходят по лестнице, не могут прыгать и бегать. Для того, чтобы встать со стула, им приходится использовать специальные приемы. Характерен вид больного: крыловидно отстоящие лопатки, опущенные плечи, выпяченный вперед живот и усиленный поясничный лордоз. Наблюдается «утиная походка» — пациент передвигается, раскачиваясь в стороны.
Патологические изменения при миопатиях происходят симметрично в мышцах конечностей и туловища. Как правило, мышечные атрофии наблюдаются в проксимальных отделах рук и ног. В связи с этим мышцы дистальных отделов конечностей могут выглядеть гипертрофированными. Такая миопатическая псевдогипертрофия наиболее заметна в мышцах голеней. Наряду с нарастанием мышечной слабости наблюдается постепенное угасание сухожильных рефлексов и прогрессирующее снижение мышечного тонуса, т. е. развивается и усугубляется периферический вялый паралич. Со временем результатом резкого ограничения активных движений становятся контрактуры суставов.
Миопатии могут сопровождаться поражением мимических мышц, что проявляется невозможностью вытянуть губы трубочкой, свистеть, нахмурить лоб или улыбнуться. Поражение круговой мышцы рта приводит к появлению дизартрии, связанной с затруднением произношения гласных звуков.
Клиника некоторых миопатий включает поражение дыхательной мускулатуры, приводящее к возникновению застойной пневмонии и развитию дыхательной недостаточности. Возможны патологические изменения сердечной мышцы с возникновением кардиомиопатии и сердечной недостаточности, мышц глотки и гортани с развитием дисфагии и миопатического пареза гортани.
Особенности отдельных форм миопатии
Ювенильная миопатия Эрба наследуется аутосомно-рецессивно. Патологические процессы начинают проявляться в возрасте 20-30 лет. В первую очередь они охватывают мышцы тазового пояса и бедер, затем быстро распространяются на другие мышечные группы. Вовлечение лицевой мускулатуры не характерно. Начало миопатии в более молодом возрасте приводит к ранней обездвиженности пациентов. При развитии заболевания в старшем возрасте его течение менее тяжелое: пациенты длительно сохраняют способность передвигаться.
Псевдогипертрофическая миопатия Дюшена наследуется рецессивно сцеплено с полом. Болеют исключительно мальчики. Как правило, манифестирует в течение первых 3-х лет жизни, реже — в период от 5 до 10 лет. Типично начало с атрофических изменений мышц тазового пояса и проксимальных отделов ног, сопровождающихся псевдогипертрофией икроножных мышц. Рано возникают контрактуры и искривление позвоночника (кифоз, сколиоз, гиперлордоз). Может наблюдаться олигофрения. Заболевание протекает с поражением дыхательных мышц и сердца (кардиомиопатия отмечается у 90% больных миопатией Дюшена), что является причиной раннего летального исхода.
Плече-лопаточно-лицевая миопатия Ландузи – Дежерина имеет аутосомно-доминантное наследование. Манифестирует в 10-20 лет с поражения мимических мышц. Постепенно слабость и атрофии охватывают мышцы надплечий, плеч и груди. Мышцы тазового пояса обычно не страдают. Характерно медленное течение с длительной сохранностью работоспособности, без сокращения продолжительности жизни.
Скапулоперонеальная миопатия — аутосомно-доминантное заболевание. Его особенностью является развитие атрофий в мышцах дистальных отделов ног и проксимальных отделов рук, а также наличие легких сенсорных нарушений дистальных отделов как нижних, так и верхних конечностей.
Окулофарингеальная миопатия характеризуется сочетанием поражения глазодвигательных мышц со слабостью мышц языка и глотки. Обычно манифестирует двусторонним птозом, затем присоединяются расстройства глотания. Особенностью этой миопатии является ее позднее начало — на 4-6-ом десятилетии жизни.
Дистальная поздняя миопатия наследуется аутосомно-доминантно. Отличается развитием слабости и атрофий в дистальных отделах конечностей: вначале в стопах и кистях, а затем в голенях и предплечьях. Характерно медленное течение.
Особенности клинических проявлений различных форм врожденных, наследственных и метаболических миопатий описаны в самостоятельных обзорах.
Диагностика
Биохимический анализ крови при миопатии показывает повышение содержания альдолазы, КФК, АЛТ, АСТ, ЛДГ и др. ферментов. В биохимическом анализе мочи показательным является увеличение концентрации креатинина. В установлении формы миопатии первостепенное значение имеет биопсия мышц. Морфологическое исследование образцов мышечной ткани выявляет наличие беспорядочно разбросанных атрофированных миофибрилл среди практически сохранных и гипертрофированных мышечных волокон, а также замещение участков мышечной ткани на соединительную или жировую. Постановка окончательного диагноза возможна только после сопоставления результатов гистохимических, иммунобиохимических и молекулярно-генетических исследований.
С целью диагностики поражений сердечной мышцы пациенту с миопатией могут быть назначены консультация кардиолога, ЭКГ, УЗИ сердца; при подозрении на возникновение пневмонии — консультация пульмонолога и рентгенография легких.
Лечение миопатий
В настоящее время патогенетическое лечение миопатий находится в состоянии научных экспериментов в области генной инженерии. В клинической практике применяется симптоматическая терапия, состоящая в основном в улучшении метаболизма мышечной ткани. С этой целью применяют витамины Е, В1, В6, В12, АТФ, неостигмин, аминокислоты (глютаминовую кислоту, гидролизат из мозга свиньи), антихолинэстеразные препараты (амбеноний, галантамин), анаболические стероиды (нандролона деканоат, метандиенон), препараты калия и кальция, тиаминпирофосфат. Комбинации из нескольких препаратов назначают курсом 1-1,5 мес. 3 раза в год.
Медикаментозное лечение миопатий дополняют физиотерапией (электрофорез с неостигмином, ионофорез с кальцием, ультразвук), легким массажем и ЛФК. Проведение ЛФК может осуществляться в бассейне. Комплекс упражнений должен быть подобран таким образом, чтобы избежать перегрузки ослабленной мускулатуры. В некоторых случаях пациенты нуждаются в консультации ортопеда и подборе средств ортопедической коррекции (корсетов, обуви).
Основу лечения приобретенных форм миопатий составляет терапия основного заболевания: коррекция эндокринных нарушений, устранение токсического воздействия и дезинтоксикация организма, ликвидация инфекционного процесса, перевод хронического заболевания в стадию устойчивой ремиссии и т. д.
Прогноз и профилактика
Наиболее неблагоприятны в прогностическом плане наследственные миопатии, проявляющиеся в раннем детском возрасте. В остальном прогноз зависит от формы миопатии, вовлеченности в процесс сердечной и дыхательных мышц. Прогноз вторичных миопатий более благоприятный при условии успешного лечения основного заболевания.
Профилактикой первичных миопатий служит тщательный сбор семейного анамнеза и обязательное консультирование у генетика пар, планирующих беременность. Профилактикой вторичных миопатий является исключение токсических воздействий на организм, своевременное лечение инфекционных и эндокринных заболеваний, коррекция метаболических нарушений.
Прогрессирующая мышечная дистрофия Эрба-Рота
Прогрессирующая мышечная дистрофия Эрба-Рота — аутосомно-рецессивная наследственная миодистрофия, отличающаяся полиморфизмом клинических проявлений и вариативностью скорости прогрессирования симптомов. Может носить нисходящий характер, т. е. начинаться со слабости в проксимальных отделах рук, но чаще имеет стандартный восходящий тип распространения мышечных изменений. Диагностика осуществляется методами неврологического осмотра, электрофизиологического тестирования, генеалогического исследования и генетического анализа, по показаниям проводится гистологический анализ биоптата мышечной ткани. Лечение только симптоматическое, позволяющее лишь продлить двигательную активность пациентов. Итог заболевания — полная обездвиженность.
Общие сведения
Причины миодистрофии Эрба-Рота
Субстратом дистрофии Эрба-Рота являются патологические метаболические и структурные изменения в мышечной ткани (миопатия). Они возникают в результате генетических мутаций, приводящих к недостатку или полному прекращению синтеза белков, являющихся необходимыми структурными компонентами миоцитов. На сегодняшний день генетике известно не менее 9 хромосомных локусов, аберрации в которых приводят к развитию миодистрофии Эрба-Рота. Чаще всего наблюдаются мутации в локусах 15q15-q21.1, 13q.
Около 30% генных аномалий возникают de novo, остальные носят семейный характер. Наследуется мышечная дистрофия Эрба-Рота аутосомно-рецессивно. Болеют как мальчики, так и девочки. Патология проявляется, если ребенок получает аномальный ген от каждого из родителей. В случае, когда оба родителя выступают носителями аберрантного гена, но сами не болеют, вероятность развития миодистрофии у ребенка составляет 25%.
Симптомы миодистрофии Эрба-Рота
Прогрессирующая мышечная дистрофия Эрба-Рота манифестирует в среднем в возрасте 13-16 лет. Однако известны отдельные случаи дебюта болезни в раннем детском возрасте и в возрасте после 20 лет. Мышечная слабость и атрофии возникают в первую очередь в мускулатуре тазового пояса и проксимальных отделов ног. Отмечаются затруднения ходьбы по лестнице, подъема из положения присев на корточки. Типичен симптом Говерса — если пациент сидел на полу, то для того, чтобы подняться, он использует собственное тело как опору.
Со временем дистрофические изменения распространяются на мышечные группы туловища и рук. Такой тип распространения миодистрофии носит название восходящий. Он наиболее типичен для большинства наследственных мышечных дистрофий. Однако в некоторых случаях дистрофии Эрба-Рота наблюдается нисходящий тип распространения патологического процесса, когда мышечная слабость возникает вначале в руках, затем в тазовом поясе, а через несколько лет в мышцах ног.
Тотальная гипотрофия мышц туловища приводит к тому, что у пациентов начинают выступать лопатки (т. н. «крыловидные лопатки»), талия становиться очень тонкой (т. н. «осиная талия»), усиливается поясничный лордоз, живот выпячивается вперед. Характерен симптом свободных надплечий — при попытке приподнять больного вверх, удерживая его за подмышки, плечи пациента свободно движутся вверх и голова будто бы «проваливается» между ними. Поражение лицевых мышц влечет за собой гипомимию (т. н. «лицо сфинкса»), неполное закрытие век, выворачивание и утолщение губ.
Миодистрофия Эрба-Рота сопровождается ранним угасанием коленных рефлексов, а также сухожильных рефлексов с плечевого бицепса и трицепса. Чувствительная сфера не нарушена. Псевдогипертрофии не столь характерны, как при мышечной дистрофии Беккера. Могут наблюдаться ретракции сухожилий и мышечные контрактуры, но они выражены в меньшей степени, чем аналогичные проявления мышечной дистрофии Дрейфуса. Со временем атрофия и слабость дыхательных мышц приводит к появлению прогрессирующей дыхательной недостаточности, возникает опасность развития застойной пневмонии. Миодистрофический процесс в гладкой мускулатуре обуславливает снижение кишечной перистальтики с тенденцией к запорам. Поражение сердечной мышцы влечет за собой возникновение кардиомиопатии, нарушений ритма, сердечной недостаточности.
Диагностика миодистрофии Эрба-Рота
Миодистрофия Эрба-Рота диагностируется неврологом и генетиком при сопоставлении данных анамнеза (возраст дебюта заболевания, последовательность развития симптомов), неврологического статуса пациента, ЭФИ нервно-мышечной системы, генеалогических данных, результатов анализа ДНК и микроскопического исследования мышечной ткани. Дифференцировать миодистрофию Эрба-Рота приходится от других форм этого заболевания (прогрессирующей дистрофии Дюшенна, миодистрофии Дрейфуса и Беккера), дерматомиозита, полимиозита, бокового амиотрофического склероза, токсической миопатии и др.
При неврологическом осмотре обращает на себя внимание снижение мышечной силы в мускулатуре проксимальных отделов ног и рук, гипотония и гипотрофия указанных мышц, гипорефлексия или полное выпадение локтевых и коленных рефлексов, сохранность всех видов чувствительности. ЭМГ и ЭНГ свидетельствуют о первичном поражении мышечной ткани при сохранности проведения импульсов по нервным стволам.
Генеалогическое исследование подтверждает аутосомно-рецессивный характер наследования. Исследование ДНК может выявить наличие генных мутаций. Однако отрицательный результат исследования не опровергает диагноз, поскольку не всякая мутация может быть обнаружена. Отрицательный анализ ДНК является показанием к биопсии мышц. В биоптате обнаруживаются различные по толщине мышечные волокна, уменьшенное число мышечных ядер, некротические и склеротические изменения.
Резкое повышение уровня креатинфосфокиназы характерно для начального периода дистрофии Эрба-Рота, затем происходит постепенное понижение этого показателя вплоть до нормальных цифр. Обзорная рентгенография грудной клетки позволяет выявить расширение границ сердца, наличие воспалительных изменений легочной ткани. ЭКГ зачастую определяет аритмию и нарушения проводимости. При помощи УЗИ сердца можно диагностировать кардиомиопатию. Для оценки степени сердечных нарушений требуется консультация кардиолога, при подозрении на пневмонию — консультация пульмонолога.
Лечение миодистрофии Эрба-Рота
Этиопатогенетическая терапия пока не разработана. Симптоматическое лечение направлено на как можно более длительное сохранение двигательной способности пациента. С этой целью применяют медикаментозные курсы, включающие АТФ, витамины Е и группы В, тиоктовую кислоту и др. Занятия лечебной физкультурой должны проводиться ежедневно и включать упражнения на все группы мышц. Регулярно назначаются курсы массажа и физиопроцедуры.
При поражении сердечной мышцы рекомендован инозин, сердечные гликозиды, антиаритмики. При развитии контрактур может потребоваться ортопедическое лечение. Выраженное снижение жизненной емкости легких из-за атрофии дыхательных мышц служит показанием к ИВЛ.
Прогноз и профилактика
Мышечная дистрофия Эрба-Рота может иметь различную тяжесть и скорость прогрессирования, что бывает выражено даже в пределах одной семьи. Описаны тяжелые дюшенноподобные варианты заболевания с ранним летальным исходом от дыхательной недостаточности, инфекционных поражений легких или сердечной недостаточности. В относительно легких вариантах миодистрофия может протекать без поражения сердечной мышцы, обездвиженность больных наступает лишь к 50-летнему возрасту. Профилактикой является своевременное генетическое консультирование семейных пар, планирующих зачатие ребенка; исключение близкородственных браков, в которых оба супруга могут стать носителями патологического гена.
О конечностно-поясных мышечных дистрофиях
Что такое конечностно-поясная мышечная дистрофия?
Конечностно-поясные мышечные дистрофии (КПМД) – многочисленная гетерогенная группа наследственных прогрессирующих мышечных дистрофий с разными типами наследования и сроками манифестации, для которых характерны преимущественное вовлечение мышц тазового и плечевого поясов, высокая концентрация сывороточной креатининфосфокиназы (КФК) и первично-мышечный уровень поражения по данным электромиографического (ЭМГ) исследования [1].
При КПМД наблюдается снижение сухожильных рефлексов, атрофия скелетных мышц преимущественно тазового и плечевого поясов конечностей. В более 85 % случаев заболеваний, манифестирующих после периода нормального моторного развития, при которых гены картированы на аутосомах, КПМД наследуется рецессивно [2].
Типы конечностно-поясной мышечной дистрофии
Гены — это коды (или рецепты), которые клетки используют для построения различных белков, необходимых для нашего тела. Гены, ассоциированные с КПМД, кодируют белки, которые играют важнейшую роль для нормального функционирования мышц. Если в одном из таких генов появляется мутация (дефект в виде отсутствующей или неверной информации), то клетки не могут производить белки для формирования здоровых мышц.
Классификации КПМД 1995/2017
Известная на данный момент классификация (номенклатура) КПМД (например, КПМД 2А, 2B) была разработана в 1995 году. В то время были описаны лишь несколько генов, ответственных за возникновение КПМД.
По классификации 1995-го года подтипы КПМД разделены на две большие группы: КПМД 1 и КПМД 2. КПМД 1-го типа наследуется по аутосомно-доминантному типу, т.е. для возникновения болезни требуется одна дефектная копия гена. КПМД 2-го типа наследуется по аутосомно-рецессивному типу, при котором болезнь возникает, если обе копии гена дефектные. Каждый из подтипов имеет свою букву. Иногда конечностно-поясную мышечную дистрофию называют определённым именем в зависимости от повреждённого белка, например, КПМД 2A (LGMD 2A) — кальпаинопатия, КПМД 2B (LGMD2B) — дисферлинопатия. Бывают и другие названия [3]. Буква в классификации 1995-го года добавлялась в подрядке открытия формы КПМД [4].
Доминантно-наследуемые типы КПМД менее распространены: зарегистрировано около 5-10% случаев из всей совокупности КПМД.
Распространённость КПМД по всему миру оценивается как 1 случай заболевания на 14 500 — 45 000 человек.
Наиболее распространённый подтип из зарегистрированных случаев — это КПМД 2А (LGMD2A) (26,5-30%), затем КПМД 2I (LGMD2I) (19%), хотя данные сильно отличаются среди различных популяций.
Подтипы КПМД часто группируются в зависимости от повреждённого белка [4].
На текущий момент открыто много новых генов, и для КПМД с рецессивным типом наследования уже не хватает букв в классификации 1995-го года. В марте 2017 года в Нидерландах прошла международная встреча специалистов по КПМД на базе Европейского нервно-мышечного центра (ENMC) для разработки новой системы классификации (номенклатуры) [5].
Классификация (номенклатура) КПМД 2017 года
Ниже таблица с новой классификацией (номенклатурой) КПМД, согласованной на встрече ENMC в 2017-м году. Номенклатуру 1995-го года также сохранила на этой странице (нажмите для быстрого перехода к ней). В старой номенклатуре есть дополнительная полезная информация (сопоставьте старые названия). Как-нибудь сделаю общую таблицу, чтобы было удобнее.
Предложенная формула для названий подтипов КПМД выглядит так [6]:
КПМД (LGMD), тип наследования «Р» — рецессивный или «Д» — доминантный (R или D на английском), номер в порядке открытия, повреждённый белок.
Внимание: русского перевода новой классификации пока нигде не видела, поэтому перевод предположительный.
| Предыдущее название | Ген | Новая номенклатура с 2017 | Причина исключения |
| LGMD 1A | Myot | Миофибриллярная миопатия (Myofibrillar myopathy) | Исключена. Дистальная слабость / Distal weakness |
| LGMD 1B | LMNA | Мышечная дистрофия Эмери-Дрейфуса (Emery–Dreifuss muscular dystrophy (EDMD)) | Исключена. Высокий риск сердечных аритмий; фенотип EDMD / High risk of cardiac arrhythmias; EDMD phenotype |
| LGMD 1C | CAV3 | Болезнь периодических мышечных спазмов (Rippling muscle disease) | Исключена. Основные клинические проявления болезни периодических мышечных спазмов и миалгии / Main clinical features rippling muscle disease and myalgia |
| LGMD 1D | DNAJB6 | КПМД D1 DNAJB6-связанная (LGMD D1 DNAJB6-related) | |
| LGMD 1E | DES | Миофибриллярная миопатия (Myofibrillar myopathy) | Исключена. В первую очередь, неверная связь; дистальная слабость и кардиомиопатия / Primarily false linkage; distal weakness and cardiomyopathy |
| LGMD 1F | TNP03 | КПМД D2 TNP03-связанная (LGMD D2 TNP03-related) | |
| LGMD 1G | HNRNPDL | КПМД D3 HNRNPDL-связанная (LGMD D3 HNRNPDL-related) | |
| LGMD 1H | ? | Не подтверждено (Not confirmed) | Исключена. Неверная связь / False linkage |
| LGMD 1i | CAPN | КПМД D4 кальпаин3-связанная (LGMD D4 calpain3-related) | |
| LGMD 2A | CAPN | КПМД R1 кальпаин3-связанная (LGMD R1 calpain3-related) | |
| LGMD 2B | DYSF | КПМД R2 дисферлин-связанная (LGMD R2 dysferlin-related) | |
| LGMD 2C | SGCG | КПМД R5 γ-саркогликан-связанная (LGMD R5 γ-sarcoglycan-related) * | |
| LGMD 2D | SGCA | КПМД R3 α-саркогликан-связанная (LGMD R3 α-sarcoglycan-related) | |
| LGMD 2E | SGCB | КПМД R4 β-саркогликан-связанная (LGMD R4 β-sarcoglycan-related) | |
| LGMD 2F | SGCD | КПМД R6 δ-саркогликан-связанная (LGMD R6 δ-sarcoglycan-related) | |
| LGMD 2G | TCAP | КПМД R7 телетонин-связанная (LGMD R7 telethonin-related) | |
| LGMD 2H | TRIM32 | КПМД R8 TRIM 32-связанная (LGMD R8 TRIM 32-related) | |
| LGMD 2i | FKRP | КПМД R9 FKRP-связанная (LGMD R9 FKRP-related) | |
| LGMD 2J | TTN | КПМД R10 титин-связанная (LGMD R10 titin-related) | |
| LGMD 2K | POMT1 | КПМД R11 POMT1-связанная (LGMD R11 POMT1-related) | |
| LGMD 2L | ANO5 | КПМД R12 аноктамин5-связанная (LGMD R12 anoctamin5-related) | |
| LGMD 2M | FKTN | КПМД R13 фукутин-связанная (LGMD R13 Fukutin-related) | |
| LGMD 2N | POMT2 | КПМД R14 POMT2-связанная (LGMD R14 POMT2-related) | |
| LGMD 2O | POMGnT1 | КПМД R15 POMGnT1-связанная (LGMD R15 POMGnT1-related) | |
| LGMD 2P | DAG1 | КПМД R16 α-дистрогликан-связанная (LGMD R16 α-dystroglycan-related) | |
| LGMD 2Q | PLEC | КПМД R17 плектин-связанная (LGMD R17 plectin-related) | |
| LGMD 2R | DES | Миофибриллярная миопатия (myofibrillar myopathy) | Исключена. Дистальная слабость / Distal weakness |
| LGMD 2S | TRAPPC11 | КПМД R18 TRAPPC11- связанная (LGMD R18 TRAPPC11-related) | |
| LGMD 2T | GMPPB | КПМД R19 GMPPB- связанная (LGMD R19 GMPPB-related) | |
| LGMD 2U | ISPD | КПМД R20 ISPD-связанная (LGMD R20 ISPD-related) | |
| LGMD 2V | GAA | Болезнь Помпе (Pompe disease) | Исключена. Известная нозологическая единица, гистологические изменения / Known disease entity, histological changes |
| LGMD 2W | PINCH2 | PINCH-2-связанная миопатия (PINCH-2 related myopathy) | Исключена. Описана в одной семье / Reported in one family |
| LGMD 2X | BVES | BVES-связанная миопатия (BVES related myopathy) | Исключена. Описана в одной семье / Reported in one family |
| LGMD 2Y | TOR1AIP1 | TOR1AIP1-связанная миопатия (TOR1AIP1 related myopathy) | Исключена. Описана в одной семье / Reported in one family |
| LGMD 2Z | POGLUT1 | КПМД R21 POGLUT1-связанная (LGMD R21 POGLUT1-related) | |
| Миопатия Бетлема рецессивная / Bethlem myopathy recessive | COL6A1, COL6A2, COL6A3 | КПМД R22 коллаген6-связанная (LGMD R22 collagen 6-related) | |
| Миопатия Бетлема доминантная / Bethlem myopathy dominant | COL6A1, COL6A2, COL6A3 | КПМД D5 коллаген6-связанная (LGMD D5 collagen 6-related) | |
| Laminin α2-related muscular dystrophy | LAMA2 | КПМД R23 ламинин α2-связанная (LGMD R23 laminin α2-related) | |
| POMGNT2-related muscular dystrophy | POMGNT2 | КПМД R24 POMGNT2-связанная (LGMD R24 POMGNT2-related) |
Классификация (номенклатура) КПМД 1995 года
Ниже приведена таблица типов из статьи «The Classification, Natural History and Treatment of the Limb Girdle Muscular Dystrophies» (Alexander Peter Murphy and Volker Straub). Я не стала дублировать указание источников, которые использовали авторы. Для их просмотра перейдите на сайт с оригиналом статьи (ссылка на статью прикреплена к её названию).
Поскольку в таблице идут медицинские термины, я привожу формулировки на английском языке из оригинала статьи, а перевод указываю в скобках. В таблице есть ссылки на англо- и русскоязычную Википедию (если находила соответствующие статьи) — привязывала их для собственного удобства. В оригинале статьи ссылок на Вики нет. Во многих местах сомневалась в правильности перевода функций белков, поэтому в особо сложных (для меня) местах оставила только английское описание. Если Вы знаете, как правильно перевести названия и функции белков, или если я перевела что-то неправильно, пожалуйста, напишите мне на почту lgmd.ru@gmail.com.
| LGMD (КПМД) | Gene/Locus (Ген/Локус) | Protein (Белок) | Suggested function of protein (Предполагаемая функция белка) |
| 1A | 5q 22 – 34 (TTID) | Myotilin (Миотилин) | Sarcomeric stabilisation of actin bundles (Саркомерная стабилизация актиновых пучков) |
| 1B | 1q 11–21 (LMNA) | Lamin A/C (Ламин А/С) | Nuclear membrane stabilisation and transcriptional regulation (Стабилизация ядерной мембраны и регулирование считывания генетической информации) |
| 1C | 3p25 (CAV3) | Caveolin 3 (Кавеолин-3) | Stabilisation of the sarcolemmal membrane, regulates cellular signal traffic |
| 1D | 7q (DNAJB6) | HSP40 | Molecular chaperone involved in proteomic and autophagic turnover Внимание: в классификации КПМД типы 1D и 1E были изменены. Подробнее читать на OMIM. |
| 1E | 6q23 (DES) | Desmin (Десмин) | intermediate filament regulating sarcomere and cytoskeletal architecture (промежуточная нить, регулирующая саркомерную и цитоскелетную архитектуру). Внимание: в классификации КПМД типы 1D и 1E были изменены. Подробнее читать на OMIM. |
| 1F | 7q32 (TNPO3) | Transportin 3 | Nuclear importing receptor (рецептор импорта ядерных белков) |
| 1G | 4q21 (HNRNPDL) | Heterogeneous Nuclear Ribonucleoprotein D-like protein | pre-mRNA processing (процессинг пре-мРНК) |
| 2A | 15q15–21 (CAPN3) | Calpain 3 (Кальпаин 3) | Implicated in cytoskeletal repair mechanisms, binds titin (участвует в механизмах восстановления цитоскелета, связывает титин) |
| 2B | 2p13 (DYSF) | Dysferlin (Дисферлин) | Regulation of vesicle fusion, receptor trafficking and repair of damaged membranes (Регуляция слияния везикул, передачи сигналов между рецепторами и восстановления повреждённых мембран) |
| 2C | 13q12 (SGCG) | γ-sarcoglycan (γ-саркогликан, гамма-саркогликан) | Connects the sarcolemma to the extracellular matrix, stabilisation of the dystroglycan complex (Соединяет сарколемму с внеклеточным матриксом, стабилизация дистрогликанового комплекса) |
| 2D | 17q 12–21 (SGCA) | α-sarcoglycan (α-саркогликан, альфа-саркогликан) | Connects the sarcolemma to the extracellular matrix, stabilisation of the dystroglycan complex (Соединяет сарколемму с внеклеточным матриксом, стабилизация дистрогликанового комплекса) |
| 2E | 4q12 (SGCB) | β-sarcoglycan (β-саркогликан, бета-саркогликан) | Connects the sarcolemma to the extracellular matrix, stabilisation of the dystroglycan complex (Соединяет сарколемму с внеклеточным матриксом, стабилизация дистрогликанового комплекса) |
| 2F | 5q33–34 (SGCD) | δ-sarcoglycan (δ-саркогликан, дельта-саркогликан) | Connects the sarcolemma to the extracellular matrix, stabilisation of the dystroglycan complex (Соединяет сарколемму с внеклеточным матриксом, стабилизация дистрогликанового комплекса) |
| 2G | 17q11-12 (TCAP) | Telethonin (Телетонин) | Binds to titin, T tubule organisation (Связывает с титином, организация T-тубул) |
| 2H | 9q31–34 (TRIM 32) | Tripartite Motif containing 32 | Binds to myosin (связывает с миозином), may ubiquitinate actin |
| 2I | 19q13 (FKRP) | Fukutin related protein (фукутинсвязанный белок) | Glycosylation of α-dystroglycan (Гликозилирование альфа-дистрогликана) |
| 2J | 2q (TTN) | Titin (Титин) | Multiple binding sites for other proteins, connects the Z line to the M line in the sarcomere (Множественное взаимодействие с другими белками, соединяет линию Z с линией M в саркомере) |
| 2K | 9q34 (POMT1) | Protein-O-mannosyl transferase1 | Involved in glycosylation of α-dystroglycan (вовлечён в гликозилирование альфа-дистрогликана) |
| 2L | 11p12-13 (ANO5) | Anoctamin 5 | Not completely understood – may act as a chloride channel (не до конца изучен — может действовать как хлоридный канал) |
| 2M | 9q31 (FKTN) | Fukutin (Фукутин) | Involved in glycosylation of α-dystroglycan (вовлечён в гликозилирование альфа-дистрогликана) |
| 2N | 14q24 (POMT2) | Protein-O-mannosyl transferase 2 | Involved in glycosylation of α-dystroglycan (вовлечён в гликозилирование альфа-дистрогликана) |
| 2O | 1p34 (POMGnT1) | Protein-O-linked mannose beta 1,2 Nacetylglucosaminyl | Involved in glycosylation of α-dystroglycan (вовлечён в гликозилирование альфа-дистрогликана) |
| 2P | 3p21 (DAG1) | Dystroglycan (Дистрогликан) | Key basement membrane receptor and component of the dystrophin-glycoprotein complex (Ключевой рецептор базальной мембраны и компонент дистрофин-гликопротеинового комплекса) |
| 2Q | 8q24 (PLEC1) | Plectin (Плектин) | Structural linkage between sarcomere and sarcolemma (Структурная связь между саркомером и сарколеммой) |
| 2R | 2q35 (DES) | Desmin (Десмин) | Intermediate filament regulating sarcomere and cytoskeletal architecture (Промежуточная нить, регулирующая саркомерную и цитоскелетную архитектуру |
| 2S | 4q35 (TRAPPC11) | Transport protein particle complex 11 | Membrane trafficking |
| 2T | 3p21 (GMPPB) | GDP-mannose pyrophosphorylase B | Involved in glycosylation of α-dystroglycan (вовлечён в гликозилирование альфа-дистрогликана) |
| 2U | 7p21 (ISPD) | Isoprenoid synthase domain | Aids in o-mannosylation of α-dystroglycan (помогает в о-маннозилировании альфа-дистрогликана) |
| 2V | 17q25 (GAA) | Alpha-1,4 glucosidase (альфа-1,4 глюкозидаза) | Lysosomal enzyme hydrolysing glycogen (Лизосомальный фермент, гидролизующий гликоген) |
| 2W | 2q14 (LIMS2) | Lim and senescent cell antigen-like domains 2 | Part of the integrin-actin cytoskeleton, signalling (Часть интегрин-актинового цитоскелета, передача сигналов) |
Следует знать, что пациентам с поздним началом болезни Помпе часто диагностируют КПМД. При этом для болезни Помпе разработана ферменто-заместительная терапия. Именно поэтому крайне важно генетически подтверждать свой тип нервно-мышечного заболевания. Ведь если человеку неверно определили диагноз и вместо болезни Помпе поставили одну из форм КПМД без генетического подтверждения, пациент лишается лечения, которое может поддержать мышечную функцию, а в некоторых случаях и частично вернуть потерянную силу. О том, как сдать анализ на болезнь Помпе, читайте в записи «Диагноз миопатия Эрба-Рота? Нет такого. Но есть болезнь Помпе с ферментозаместительной терапией».
Из-за того что симптомы болезни Помпе часто схожи с КПМД, заболевания, связанные с дефицитом альфа-1,4 глюкозидазы (к которым относится болезнь Помпе), даже были включены в номенклатуру КПМД 1995-го года с присвоением обозначения КПМД 2V (LGMD2V) [5]. Однако при пересмотре номенклатуры КПМД в 2017-м году болезнь Помпе была исключена из конечностно-поясных миодистрофий [6].