многослойный плоский эпителий шейки матки что это
Цитологическая диагностика заболеваний шейки матки
Цитологическое исследование мазков из шейки матки позволяет оценить состояние слизистой оболочки, наличие или отсутствие признаков патологических процессов (реактивных, предопухолевых, опухолей). При выявлении другими лабораторными методами инфекционного агента (вирус папилломы человека, бактериальные и паразитарные инфекции), цитологический метод позволяет оценить реакцию организма на инфекционный агент, наличие или отсутствие признаков повреждения, пролиферации, метаплазии или трансформации эпителия. Возможно также при исследовании мазка определить причину изменений эпителия (наличие воспаления с ориентировочным или уверенным определением патогенной микробиоты (микрофлоры), патологических процессов, связанных с гормональным, лекарственным, механическим, лучевым воздействием на организм женщины и шейку матки, состояний, чреватых опасностью возникновения дисплазии и рака шейки матки, а при их развитии установить правильный диагноз. В связи с этим цитологическое исследование применяют как при скрининге (мазки с визуально нормальной шейки матки), так и при наличии видимых при гинекологическом осмотре изменений слизистой оболочки.
Получение материала
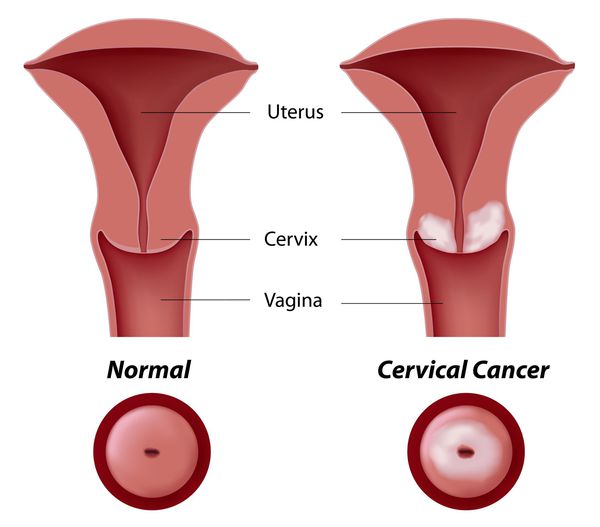
Рак шейки матки чаще всего развивается в зоне трансформации, ему предшествуют фоновые процессы и внутриэпителиальные поражения (дисплазия эпителия), которые могут располагаться на небольших участках, поэтому важно, чтобы материал был получен со всей поверхности шейки матки, особенно из зоны стыка плоского и цилиндрического эпителия. Число измененных клеток в мазке бывает различным, и если их мало, то увеличивается вероятность, что патологические изменения могут быть пропущены при просмотре препарата. Для эффективного цитологического исследования необходимо учитывать:
Материал из шейки матки должен брать врач-гинеколог или (при скрининге, профилактическом осмотре) хорошо обученная медицинская сестра (акушерка).
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90% опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны трансформации и только 10% из цилиндрического эпителия цервикального канала.
С диагностической целью материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и специальной щетки (типа Cytobrush). При проведении профилактического осмотра используют Cervex-Brush, различные модификации шпателя Эйра и другие приспособления для получения материала одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала.
Перед получением материала шейку матки обнажают в “зеркалах”, дополнительных манипуляций не проводят (шейку не смазывают, слизь не удаляют; если слизи много – ее аккуратно снимают ватным тампоном, не надавливая на шейку матки.). Щетку (шпатель Эйра) вводят в наружный зев шейки матки, осторожно направляя центральную часть приспособления по оси цервикального канала. Далее ее наконечник поворачивают на 360° (по часовой стрелке), достигая тем самым получения достаточного числа клеток из эктоцервикса и из зоны трансформации. Введение инструмента выполняют очень бережно, стараясь не повредить шейку матки. Затем щетку (шпатель) выводят из канала.
Приготовление препаратов
Перенос образца на предметное стекло (традиционный мазок) должен происходить быстро, без подсушивания и потери прилипших к инструменту слизи и клеток. Обязательно перенести на стекло материал с обеих сторон шпателя или щетки.
Если предполагается приготовление тонкослойного препарата с помощью метода жидкостной цитологии, головку щетки отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Фиксация мазков выполняется в зависимости от предполагаемого метода окрашивания.
Окрашивание по Папаниколау и гематоксилин-эозином наиболее информативны в оценке изменений эпителия шейки матки; любая модификация метода Романовского несколько уступает этим методам, однако при наличии опыта позволяет правильно оценить и характер патологических процессов в эпителии и микрофлору.
Клеточный состав мазков представлен слущенными клетками, находящимися на поверхности эпителиального пласта. При адекватном получении материала с поверхности слизистой оболочки шейки матки и из цервикального канала в мазок попадают клетки влагалищной порции шейки матки (многослойный плоский неороговевающий эпителий), зоны стыка или трансформации (цилиндрический и, при наличии плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цервикального канала (цилиндрический эпителий). Условно клетки многослойного плоского неороговевающего эпителия принято делить на четыре типа: поверхностные, промежуточные, парабазальные, базальные. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При атрофических изменениях на поверхности эпителиального пласта расположены менее зрелые клетки.
Интерпретация результатов цитологического исследования
Наиболее распространенная в настоящее время – классификация Bethesda (The Bethesda System), разработанная в США в 1988 г, в которую вносили несколько изменений. Классификация создана для более эффективной передачи информации из лаборатории врачам клинических специальностей и обеспечения стандартизации лечения диагностированных нарушений, а также последующего наблюдения за больными.
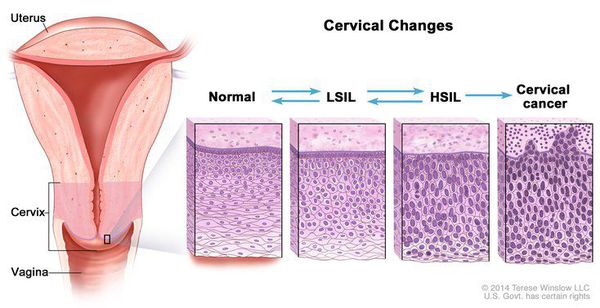
В классификации Bethesda выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions of low grade and high grade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени – умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак (cr in situ). В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передавае мые половым путем.
Для обозначения клеточных изменений, которые трудно дифференцировать между реактивными состояниями и дисплазией предложен термин ASCUS – atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Для клинициста этот термин мало информативен, однако он нацеливает врача на то, что данная пациентка нуждается в обследовании и/или в динамическом наблюдении. В классификацию Bethesda в настоящее время введен также термин NILM – no intraepithelial lesion or malignancy, объединяющий норму, доброкачественные изменения, реактивные изменения.
Так как данные классификации используются в практике врача-цитолога, ниже приведены параллели между классификацией Bethesda и классификацией, распространенной в России (Табл. 22). Цитологическое стандартизованное заключениепо материалу из шейки матки (форма № 446/у), утверждено приказом Минздрава России от 24.04.2003 № 174.
Причины получения неполноценного материала различны, поэтому цитолог перечисляет типы клеток, обнаруженные в мазках и по возможности указывает причину, по которой материал признан неполноценным.
Что такое лейкоплакия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Т. А., гинеколога со стажем в 13 лет.
Определение болезни. Причины заболевания
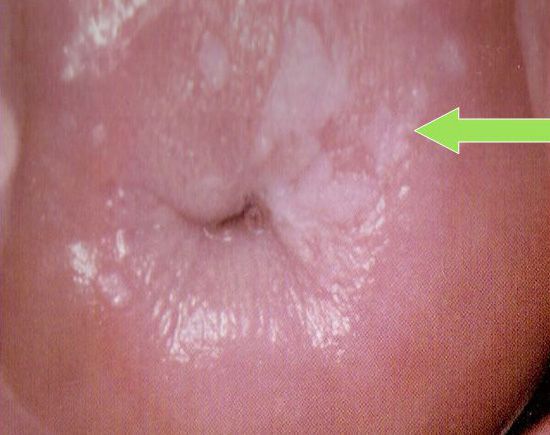
Лейкоплакия шейки матки — это утолщение и ороговение плоского эпителия слизистой оболочки шейки матки.
Термин «лейкоплакия» (в переводе с греческого — «белая бляшка») был предложен Швиммером в 1887 году для описания белесоватых участков слизистых оболочек щёк, которые расценивались как предраковые изменения. В отечественной литературе и клинической практике термин остаётся общепринятым до настоящего времени. За рубежом же предпочителен термин «дискератоз». [2]
Очаг лейкоплакии может располагаться на слизистой оболочке нижней губы, угла рта, дна полости рта, щёк, в аногенитальной области, на вульве, клиторе, во влагалище, на шейке матки, реже — в области головки полового члена, в окружности заднепроходного отверстия. [11]
Согласно статистике, частота лейкоплакии шейки матки составляет всего 0.7 на 100 000 случаев гинекологической заболеваемости, среди заболеваний шейки матки — 5.2%. [11]
Лейкоплакия шейки матки наиболее часто встречается в возрастной группе 17-39 лет. [9]
В большинстве стран Европы и США, где проводится организованный скрининг рака шейки матки, лейкоплакия шейки матки не попадает в активный поиск, пока цитологические мазки не выявят начальные степени дисплазии (предрака) шейки матки. В нашей стране тактика наблюдения и ведения лейкоплакии шейки матки более активная.
Причины развития лейкоплакии шейки матки делят на:
Под нарушением гормонального фона чаще подразумевают хроническое отсутствие овуляции, что приводит к дисбалансу эстрогена и прогестерона в организме с преобладанием первого. Относительно повышенные концентрации эстрогена, в свою очередь, действуют на органы-мишени (молочные железы, тело и шейка матки), приводя к гиперпластическим процессам (бесконтрольному увеличению числа клеток). [4] Часто у пациенток с лейкоплакией шейки матки диагностируют повышение уровня пролактина. Иммунные нарушения зачастую проявляются воспалительными процессами матки и ее придатков (вагиниты, сальпингоофориты, цервициты). [9] Отечественным исследованием выявлено повышение концентрации секреторного иммуноглобулина А (SIgA) у пациенток с такими фоновыми заболеваниями шейки матки, как эктопия цилиндрического эпителия и лейкоплакия шейки матки. [8]
Под химическими и травматическими воздействиями зачастую подразумевают интенсивное и неадекватное лечение по поводу «псевдоэрозии» шейки матки: приблизительно трети пациенток с лейкоплакией ранее проводилась диатермокоагуляция и другие деструктивные вмешательства на шейке матки. Немаловажным фактором развития лейкоплакии шейки матки является опущение и выпадение матки/шейки матки, которое сопровождается неизбежным нарушением влагалищной флоры и, при выраженных степенях, постоянным контрактом шейки матки с внешней средой. [5]
Симптомы лейкоплакии шейки матки
Зачастую заболевание протекает бессимптомно. Лишь около трети пациенток предъявляют жалобы на обильные бели и контактные кровяные выделения (после полового акта, использования тампонов, гинекологических осмотров).
Симптомы перерождения лейкоплакии в рак
Патогенез лейкоплакии шейки матки
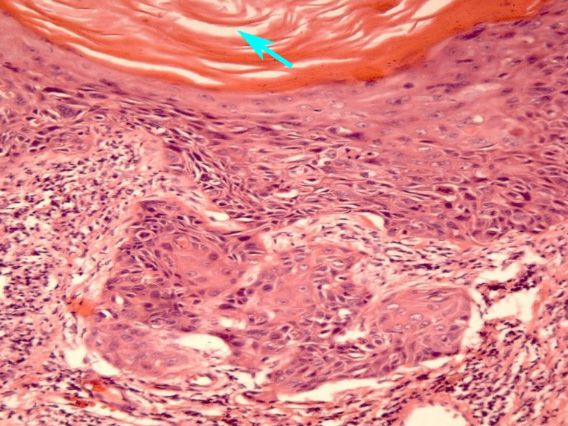
Механизм развития лейкоплакии в точности не выяснен. Считается, что под влиянием причинных факторов включаются механизмы ороговения в норме неороговевающего многослойного плоского эпителия шейки матки. На поверхности шейки матки формируются роговые чешуйки, клетки с деформированным ядром и внутриклеточными компонентами. [2]
Классификация и стадии развития лейкоплакии шейки матки
Согласно классификации Я.Б. Бохмана (1976), лейкоплакия, наряду с псевдоэрозией, эктропионом, полипом, эндометриозом шейки матки, цервицитами, истинной эрозией шейки матки, входит в группу фоновых заболеваний шейки матки, при которых не обнаруживается клеток с атипичными признаками, но длительное существование которых может послужить фактором риска развития предрака.
За рубежом лейкоплакию шейки матки с клеточным атипизмом относят к группе предраковой патологии шейки матки — ЦИН (цервикальной интраэпителиальной неоплазии, или дисплазии, шейки матки). [2]
Осложнения лейкоплакии шейки матки
Чем опасна лейкоплакия шейки матки
Лейкоплакия может распространяться с шейки матки на своды влагалища. Злокачественное перерождение клеток лейкоплакии наблюдается у 31,6% больных по данным отечественных авторов, 4,9-9% — по зарубежным данным. [11]
Диагностика лейкоплакии шейки матки
Комплексное обследование при лейкоплакии включает:
Кольпоскопия
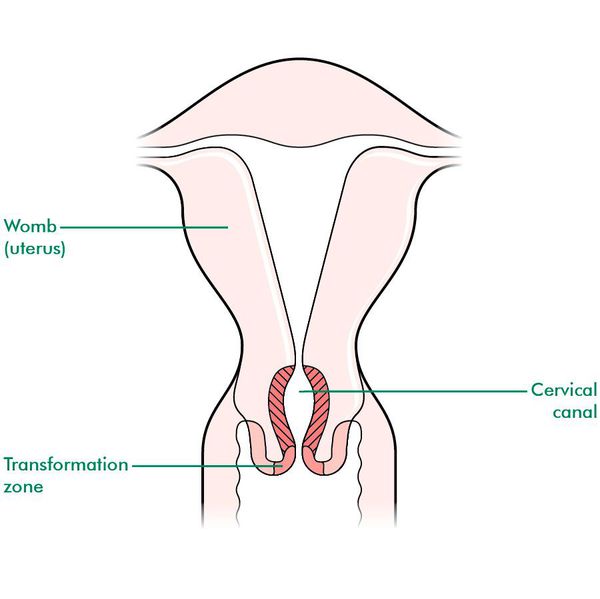
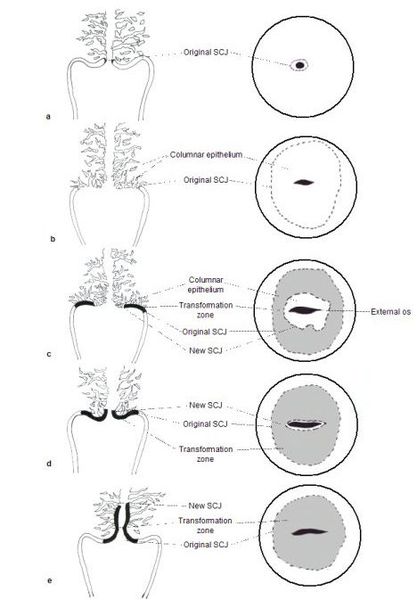
При кольпоскопии устанавливается тип зоны трансформации (переходной зоны стыка двух видов покровного эпителия шейки матки — многослойного плоского и цилиндрического), место расположения лейкоплакии.
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
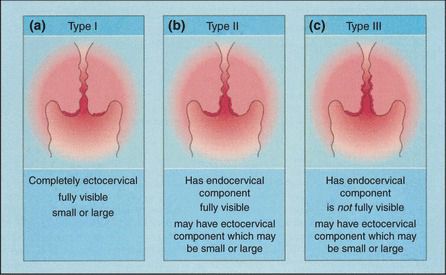
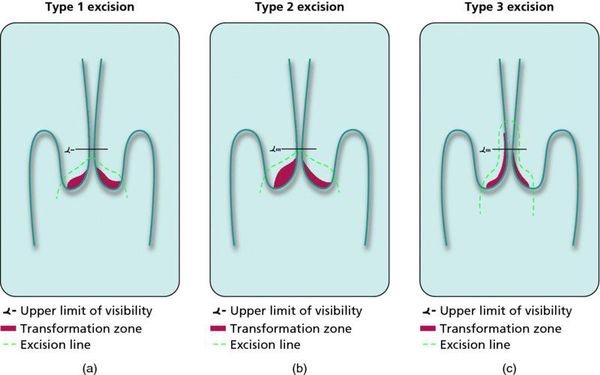
Зона трансформации 1 типа — переходная зона видна полностью. Это самый оптимальный и прогностически «благоприятный» вариант кольпоскопического заключения.
Зона трансформации 2 типа — переходная зона частично скрыта в канале шейки матки. Адекватно оценить такую картину сложно, так как наиболее измененные участки могут быть не видны и пропущены.
Зона трансформации 3 типа — переходная зона находится глубоко в канале шейки матки и оценить её кольпоскопически невозможно. Кольпоскопия в этом случае считается неинформативной, поскольку глубина залегания патологического очага остается неизвестной.
Цитологическое и гистологическое исследование
Сложность диагностики лейкоплакии при помощи простого цитологического соскоба с шейки матки заключается в невозможности оценки полноценного клеточного состава, так как из-за плотных роговых чешуек на поверхности многослойного плоского эпителия шейки матки в соскоб могут не попасть клетки из глубоких слоев. Таким образом может быть пропущена предраковая трансформация или даже рак шейки матки. [3] Именно поэтому основным методом диагностики лейкоплакии шейки матки является исследование ткани шейки матки, полученной при обязательно прицельной биопсии на фоне кольпоскопии. Зона трансформации 2 и 3 типа, определенные при кольпоскопии, могут послужить поводом для проведения не только биопсии, но и выскабливания слизистой канала шейки матки. Более щадящий метод оценки состояния слизистой канала шейки матки возможен при помощи микрокольпогистероскопии (офисная гистероскопия). Преимущество метода заключается в возможности нетравматичного прохождения канала шейки матки (цервикального канала) под визуальным контролем без анестезии. В процессе процедуры можно провести прицельную биопсию. При гистологическом исследовании лейкоплакия характеризуется терминами: кератоз, паракератоз, акантоз.
Бактериологическое исследование
Включает анализ влагалищного мазка и бактериальных посевов на флору и половые инфекции. Исследования важны тем, что при наличии воспаления шейки матки результаты цитологического и гистологического анализов могут быть искажены.
Анализ на ВПЧ
Исследование ДНК ВПЧ высокого онкогенного риска в соскобе с шейки матки и цервикального канала
В настоящее время изучают влияние вирусной инфекции на развитие лейкоплакии. Некоторые авторы считают, что процессы ороговения можно рассматривать как косвенный маркер папилломавирусной инфекции. Лейкоплакия, существующая вне инфицирования ВПЧ, зачастую не озлокачествляется. При сочетании с вирусом вероятность озлокачествления есть, но серьезных подтверждений этому факту пока нет. [12] [13]
Иммунограмма
Контроль уровня гормонов
Лечение лейкоплакии шейки матки
Консервативное лечение
Медикаментозное лечение при лейкоплакии включает:
В нашей стране лейкоплакию обычно подвергают деструкции — разрушению патологической ткани. Это обосновано, так как со временем лейкоплакия может трансформироваться, пациентка может заразиться ВПЧ и произойдёт перерождение ткани, что потребует новых биопсий и лишних визитов к врачу.
Хирургическое лечение
Наиболее часто применяемыми методами лечения лейкоплакии шейки матки являются:
Подготовка к операции включает:
Как проходят гинекологические операции
Манипуляции производят в первой половине менструального цикла (4-7 день от начала менструации). Для более точного определения патологической ткани процедура контролируется проведением кольпоскопии, а шейку матки обрабатывают раствором Люголя. Полное заживление и возвращение пациентки к привычной жизни (возможность половой жизни, использования вагинальных тампонов, посещение бассейна и прочее) зачастую ожидается через 28-40 дней после проведения процедуры. Коррекция гормональных нарушений и адекватная гормонотерапия, по некоторым данным, позволяет ускорить сроки заживления послеоперационной раны и снизить частоту повторного возникновения доброкачественных заболеваний шейки матки. [10]
При сочетании лейкоплакии с деформацией и гипертрофией шейки матки целесообразно проведение реконструктивно-пластических операций (пластика шейки матки) с целью восстановления анатомии цервикального канала. [14] [15]
Современные зарубежные исследователи расценивают лейкоплакию как доброкачественный физиологический процесс и в большинстве ситуаций рекомендуют профилактическое наблюдение.
Криодеструкция
Химическая коагуляция
Химическими коагулянтами, например Солковагином, лейкоплакию лечили в 90-х годах ХХ века. Эффективность лечения простой лейкоплакии шейки матки у молодых нерожавших женщин составляла около 70 %. Сейчас этот метод не применяют.
Антибиотикотерапия
Физиотерапия
Физиопроцедуры после операций на шейке матки, в том числе и при лейкоплакии, не проводятся.
Народные способы лечения
Беременность и лейкоплакия
При обнаружении лейкоплакии шейки матки у беременных обязательно лечат урогенитальную инфекцию, бактериальный вагиноз и восстанавливают микробиоценоз влагалища.
Реабилитация
Сразу после процедуры пациентку могут беспокоить тянущие боли внизу живота, однако они быстро проходят. Выделения чаще всего светлые слизистые или водянистые, редко с прожилками крови.
Кровянистые выделения после операции возникают редко. Но если они появились, беспокоят дольше 5–10 дней и/или менструации становятся обильнее и выделяются кровяные сгустки, то следует немедленно обратиться к врачу.
Также должна насторожить температуры тела свыше 37,5 °C, сильные боли внизу живота и гноевидные выделения из половых путей с резким неприятным запахом.
После операции в течение месяца рекомендуется:
Через две недели после операции врач проводит гинекологический осмотр, чтобы удостовериться, что пациентка восстанавливается. Слизистая полностью приходит в норму за 4–6 недель.
Наблюдение после лечения
Частота посещения доктора зависит от формы заболевания, эффективности лечения и наличия факторов риска, которые могут осложнить выздоровление: курение, ВИЧ-инфекция, заболевания, передаваемые половым путём, носительство онкогенных типов ВПЧ и т. п.
Диета
После лечения лейкоплакии следует придерживаться принципов правильного питания, специфическая диета не требуется.
Прогноз. Профилактика
При лейкоплакии шейки матки прогноз, как правило, благоприятный.
Принципы профилактики развития лейкоплакии шейки матки включают:
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Т. А., гинеколога со стажем в 13 лет.
Определение болезни. Причины заболевания
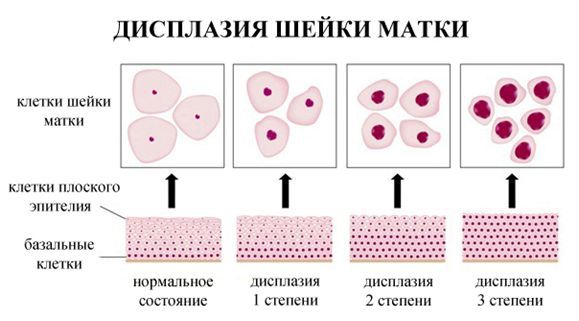
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
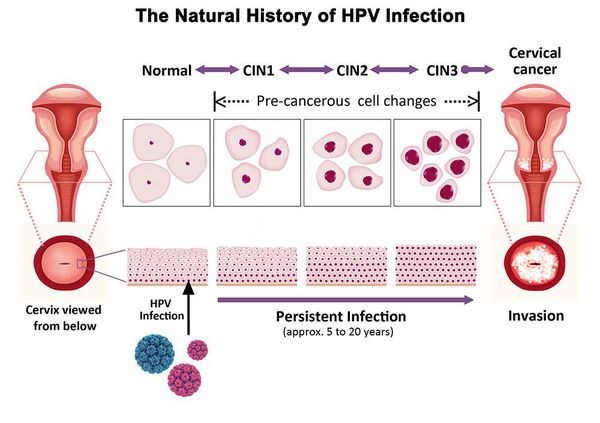
Основной фактор развития дисплазии и рака шейки матки — папилломавирусная инфекция (ПВИ), причем длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
Кроме того, была выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
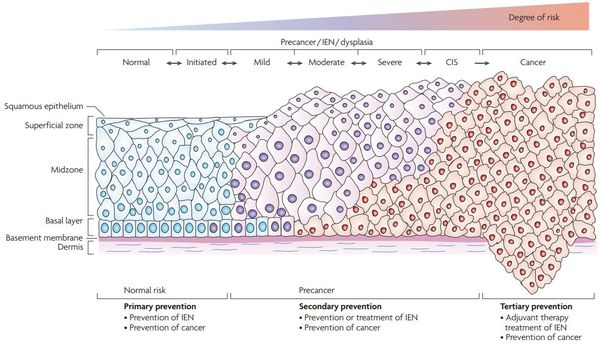
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
Классификация Папаниколау
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя шейки матки выделяют:
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
Осложнения дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
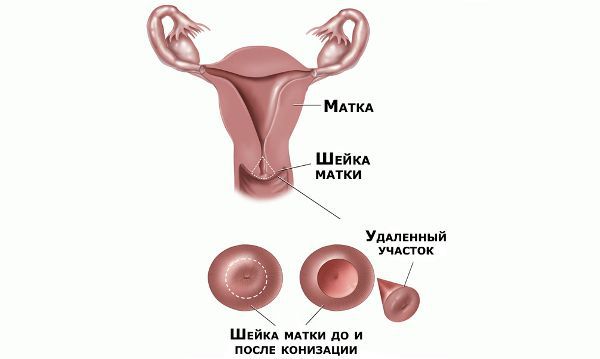
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
В России данная система включает последовательность действий:
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии. При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
Прогноз. Профилактика
При своевременном выявлении и лечении дисплазии шейки матки прогноз благоприятный. Основным фактором развития и прогрессирования дисплазии шейки матки является длительное инфицирование канцерогенными типами ВПЧ. Для предупреждения заражения ВПЧ существуют профилактические вакцины «Церварикс» (защита от 16, 18 типов ВПЧ), «Гардасил» (профилактика инфицирования 6, 11, 16, 18 типами вируса), в декабре 2014 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило использование вакцины «Гардасил9», защищающей от инфицирования 9 типами ВПЧ (6, 11, 16, 18, 31, 33, 45, 52, 58). Однако на российском рынке данный продукт ещё не доступен. «Церварикс» зарегистрирована для вакцинации женщин от 10 до 25 лет; «Гардасил» показана к применению детям и подросткам в возрасте от 9 до 15 лет и женщинам от 16 до 45 лет.
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения», осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.