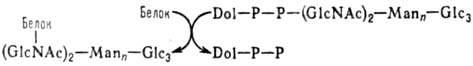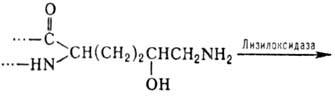модифицированный белок что это
МОДИФИКАЦИЯ БЕЛКОВ
Внеклеточные (секретируемые) белки, а также мн. белки цитоплазматич. мембраны и разл. внутриклеточных ком-партментов (обособленных участков клетки) подвергаются гликозилированию, в результате к-рого образуются глико-протеины. Наиб. сложно организованы маннозосодержащие цепи, присоединенные к полипептидам N-гликозидной связью. Начальная стадия формирования таких цепей протекает котрансляционно по схеме:
Dol-долихол (полипренол), DolЧРЧР-долихолпирофосфат, Glc-глюкоза, GlсNАс-N-ацетил-D-глюкозамин, Маn-манноза
Послед. стадии осуществляются посттрансляционно с участием неск. ферментов, локализованных в разных субклеточных компартментах. Так, для G-белка вируса везикулярного стоматита, гликозидные цепи к-рого построены из 15 углеводных остатков, установлена такая последовательность событий. Сначала в эндоплазматич. ретикулуме происходит в две стадии отделение терминальных остатков глюкозы с участием двух разных глюкозидаз. Затем ман-нозидазы (I и II) удаляют 6 остатков маннозы, а N-ацетил-D-глюкозаминтрансфераза осуществляет присоединение трех остатков GlcNAc к остаткам маннозы гликопротеина. Наконец, в комплексе Гольджи с этими остатками связываются с участием соответствующих трансфераз остатки фукозы, галактозы и сиаловой к-ты. Моносахаридные остатки могут подвергаться фосфорилированию, сульфированию и др. модификациям.
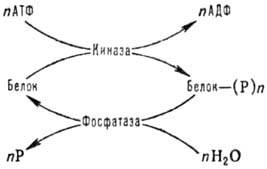
К наиб. распространенным модификациям внутриклеточных белков относятся фосфорилированис и дефосфорилиро-вание по группе ОН остатков серина, тирозина и треонина, к-рые осуществляются с участием ферментов протеинкиназ и фосфатаз по схеме:
Фосфорилирование сопровождается активацией или инактивацией ферментов, напр. гликозилтрансфераз, а также изменением физ.-хим. св-в неферментных белков. Обратимое фосфорилирование белков контролирует, напр., такие важные процессы, как транскрипция и трансляция, метаболизм липидов, глюконеогенез, мышечное сокращение.
Белки митохондрий и хлоропластов, кодируемые ядерными ДНК, имеют на N-конце избыточные аминокислотные последовательности, к-рые избирательно направляют полипептидные цепи в определенные компартменты органелл, после чего отщепляются в результате протеолиза с участием специфич. эндопептидаз. Избыточные последовательности предшественников митохондриальных белков существенно различаются по кол-ву аминокислотных остатков; их может быть от 22 до 80. Короткие последовательности характеризуются высоким (20-25%) содержанием положительно заряженных аминокислотных остатков, равномерно расположенных по полипептидной цепи. Длинные последовательности включают дополнительно участок, состоящий из гидрофобных аминокислот, к-рый «заякоревает» предшественник в липидном бислое митохондриальных мембран.
Известны предшественники для ряда гормонов (напр., для гастрина, глюкагона и инсулина), к-рые переходят в активную форму посредством расщепления полипептидной цепи в участках, содержащих два последовательно расположенных остатка основных аминокислот (аргинин и лизин). Расщепление осуществляется с участием специфич. эндопептидазы, действующей в ансамбле со вторым ферментом, имеющим карбоксипептидазную активность. Последний удаляет остатки концевых основных аминокислот, завершая превращ. пептида в активный гормон. К белкам, подвергающимся протеолитич. активации, относятся также протеиназы (пепсин, трипсин, химотрипсин), альбумины, проколлаген, белки системы свертывания крови и др. В нек-рых случаях неактивные формы ферментов (зимогены) необходимы для временной «консервации» ферментов. Так, зимогены трипсина и химотрипсина (соотв. трипсиноген и химотрипсиноген) синтезируются в поджелудочной железе, секретируются в тонкий кишечник и только там под действием специфич. ферментов превращ. в активную форму.
Широкий круг белков (гистоны, миозин, актин, рибо-сомальные белки и др.) метилируются посттрансляционно по остаткам лизина, аргинина и гистидина (N-метилирова-ние), а также по остаткам глутаминовой и аспарагиновой к-т (О-метилирование). В качестве метилирующего агента обычно выступает S-аденозилметионин.
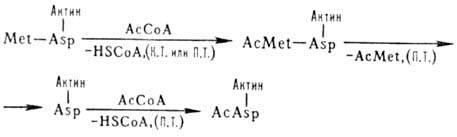
В нек-рых эукариотич. клетках более половины р-римых белков ацетилированы по N-концу. Этот процесс может осуществляться ко- и посттрансляционно (на схеме обозначено соотв. К. Т. и П. Т.), напр.:
Для пептидов, содержащих от 3 до 64 аминокислотных остатков и секретируемых в разл. органы(гастрин, секретин, холецистокинин и др.), обнаружено посттрансляц. амидиро-вание остатка С-концевой аминокислоты (за исключением концевых остатков аргинина и аспарагина).
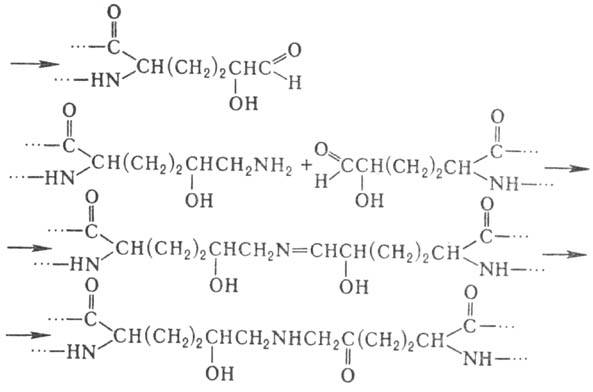
Нек-рые типы модификаций характерны для отдельных белков или небольших групп белков. В частности, в коллагене и неск. др. белках со сходными аминокислотными последовательностями обнаружены 4- и 3-гидроксипролин, а также 5-гидроксилизин. Гидроксилирование остатков про-лина и лизина протекает котрансляционно и имеет важное значение для формирования уникальной структуры коллагена. Гидроксилизин участвует в образовании ковалент-ных сшивок между полипептидными цепями коллагена по схеме:
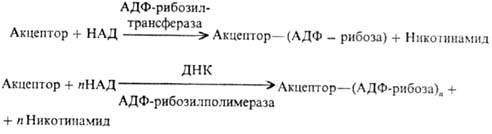
Ядерные белки (гистоны, негистоновые белки) подвергаются аденозиндифосфатрибозилированию и полиаденозин-дифосфатрибозилированию, в ходе к-рого аденозиндифос-фатрибозильные остатки переносятся от кофермента ни-котинамидадениндинуклеотида (НАД) к акцепторным белкам:
Эти две р-ции различны во мн. аспектах. В частности, полиаденозиндифосфатрибозилирование протекает в при-сут. ДНК. Большинство аденозиндифосфатрибозильных групп присоединяется к белкам посредством эфирной связи, образованной группой ОН в положении 5′ остатка рибозы и группой СООН С-концевой аминокислоты или глутаминовой к-ты, находящейся внутри полипептидной цепи.
Большое значение имеет карбоксилирование остатков глутаминовой к-ты с образованием g-карбоксиглутаминовой к-ты в предшественнике протромбина. Эта р-ция катализируется витамин К-зависимой карбоксилазой, локализованной в мембранах эндоплазматич. ретикулума. Аналогичная р-ция протекает при созревании нек-рых др. факторов свертывания крови.
Лит.: Основы биохимии, пер. с англ., т. 1, М., 1981, с. 277-80; Общая органическая химия, пер. с англ., т. 10, М., 1986, с. 543-70; The enzymology of post-translational modification of proteins, v. 1, L.-N. Y., 1980; The biochemistry of glycpproteins and proteoglycans, N. Y.-L., 1980; Cell biology. A comprehensive treatise, v. 4-Translation and the behavior of proteins, N. Y., 1980; Methods in enzymology, v. 106, N.Y., 1984; Hurt E.G., Loon A.P.G.M. van, «Trends in Biochem. Sci.», 1986, v. 11, № 5. n. 204-07. В. Н. Лузиков.
SUMO: японская борьба или уникальная посттрансляционная модификация?
SUMO: японская борьба или уникальная посттрансляционная модификация?
Японский борец сумо и кристаллическая структура его маленького конкурента — белка SUMO
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Все знают, что сумо — это вид единоборства родом из Японии, сильной страны с сильными людьми. Спортсмены-тяжеловесы, совершающие поединок, сопровождающийся многочисленными ритуалами, — вот первая и до недавних пор единственная ассоциация со словом «сумо», пока в 1990-х годах не появилось слово-омоним — SUMO, совпадающее в своем звучании при полном несоответствии значений. Кто же это, и о ком пойдет речь в данной статье? SUMO — это маленький белок, главный участник посттрансляционной модификации (под названием сумоилирование) разных белков в клетке от дрожжей до человека. Процесс сумоилирования является необходимым для регуляции широкого спектра клеточных процессов, включая экспрессию генов, клеточный цикл, локализацию белков и состояние хроматина.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Посттрансляционные модификации и функциональное разнообразие белков
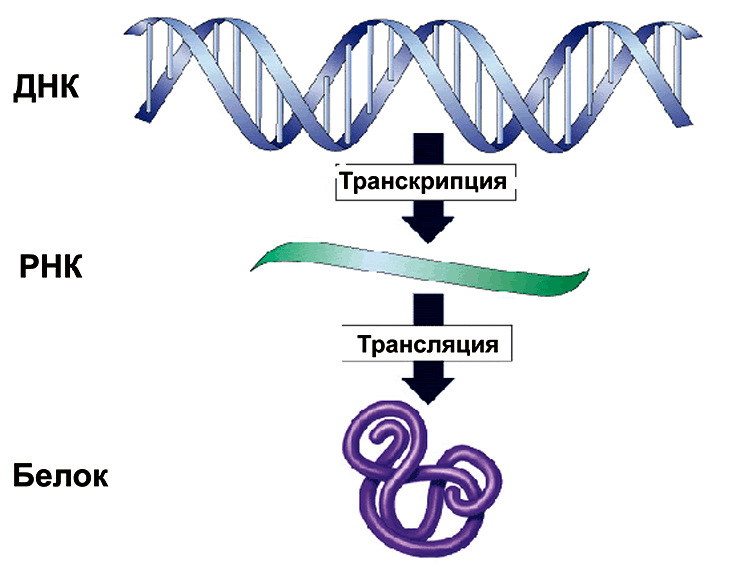
Каждая клетка любого организма содержит набор генетической информации, реализация которой в природе подчиняется центральной догме молекулярной биологии: информация передаётся от нуклеиновых кислот к белку, но не в обратном направлении. Правило было сформулировано Френсисом Криком еще в 1958 году [1]. Переход генетической информации от ДНК к РНК и от РНК к белку является универсальным для всех без исключения клеточных организмов, и лежит в основе биосинтеза макромолекул. Процесс перехода ДНК → РНК называется транскрипцией, а процесс перехода РНК → белок — трансляцией (рис. 1).
Рисунок 1. Центральная догма молекулярной биологии
Исходя из этих малых знаний можно предположить, что посттрансляционные модификации — это процесс регуляции на уровне белка. Зачем же они нужны клетке? Разве не достаточно перехода от ДНК к РНК и от РНК к белкам? Оказывается, что нет — этого недостаточно. В клетке любого организма присутствует огромное количество функционально различающихся белков: структурные белки (необходимы для строения клеточной стенки и мембран), ферменты (необходимы для каталитических процессов), регуляторные белки (исполняют роль регуляторов экспрессии генов, транскрипционные факторы) и т.д. Иногда один белок может выполнять разные функции в клетке одного и того же организма, и этому способствуют как раз посттрансляционные модификации (ПТМ).
ПТМ заключаются в ковалентной модификации белков, транслированных с РНК. Они играют ключевую роль в гетерогенности белков, в исключении идентичных белков, их деградации, тканеспецифичности, регуляции активности. Например, ПТМ осуществляемые на N-конце* полипептидной цепи, способствуют транспорту белков через биологические мембраны. N-гликозилирование белков происходит по карбоксамидному атому азота остатка аспарагина в последовательности Asn-X-Ser/Thr. Многие белки, а именно относящиеся к секреторным белкам прокариот и эукариот, а также белки, транспортируемые в клеточные органеллы — лизосомы, хлоропласты, митохондрии, — содержат моносахаридный остаток N-ацетилглюкозамина [2].
Звёздочками в верхнем индексе помечены термины, разъясненные в «Словарике» в конце статьи.
Благодаря ПТМ в клетках эукариот может достигаться большое разнообразие функционально активных белков и транскрипционных факторов. Так, 20 с небольшим тысяч генов, содержащихся в ДНК человека [3], транскрибируемых в РНК и транслируемых в белки, в результате ПТМ дают от 300 000 до миллиона функционально различных белков в клетке. Например, известный транскрипционный фактор р53, выполняющий роль опухолевого супрессора и принимающий участие в регуляции клеточного цикла, подвергается нескольким ПТМ, а именно — фосфорилированию, ацетилированию и гликозилированию. Данные ПТМ помогают белку р53 увеличить количество участков связывания с ДНК.
Таким образом, ПТМ необходимы для изменения конформации, клеточной локализации, активности ферментов и транскрипционных факторов, регуляции белок-белковых взаимодействий и контроля продолжительности «жизни» белков. ПТМ белков могут осуществляться несколькими способами. На сегодняшний день известно более 100 ПТМ. Наиболее распространенными и изученными являются:
Каждый тип ПТМ осуществляется специальными ферментами: известно 500 протеинкиназ (фосфорилирование), 150 фосфатаз, 500 протеаз, небольшое количество гистоновых* ацетилаз (ацетилирование) и деацетилаз (деацетилирование) [4].
Одной из самых распространенных ПТМ белков является фосфорилирование. Анализ белков в клеточной линии человека HeLa [5] показал, что фосфорилируется более чем 20 000 белков по более чем 6000 позициям (сайтам). Фосфорилирование важно для рецепторов, осуществляющих передачу сигнала извне клетки в цитоплазму и ядро. Интересно, что белки могут подвергаться нескольким ПТМ одновременно, и в этом случае одна ПТМ может как усиливать, так и ослаблять эффект другой модификации.
Вы можете спросить: «А как долго существуют белки в клетке, бесконечно ли их время жизни?». Белки в клетке не только все время синтезируются, но и расщепляются. (Аналогичная динамика наблюдается и для РНК [6].) Данный процесс осуществляется при участии белка убиквитина [7], а соответствующая ПТМ называется убиквитинилирование — ацилирование белков активированной С-концевой карбоксильной группой остатка глицина убиквитина. Убиквитинилирование приводит к деградации «меченого» белка с направлением его в протеасому.
В 1990-х годах в процессе изучения ядерного белка RanGAP1* была открыта новая убиквитин-подобная ПТМ — сумоилирование. Сумоилирование осуществляется с участием небольшого белка, названого SUMO (Small Ubiquitin-related MOdifier), который ковалентно присоединяется к аминокислоте лизину белковых субстратов за счет серии ферментативных реакций, подобных процессу убиквитинилирования. Правда, в отличие от убиквитинилирования, сумоилирование не приводит к деградации белков [8].
Сумоилирование — уникальная посттрансляционная модификация
Итак, что же это за уникальная посттрансляционная модификация? Какую роль выполняет в сумоилировании белок SUMO? Как было описано выше, сумоилирование осуществляется с участием небольшого убиквитин-подобного модифицирующиего белка SUMO, состоящего всего из
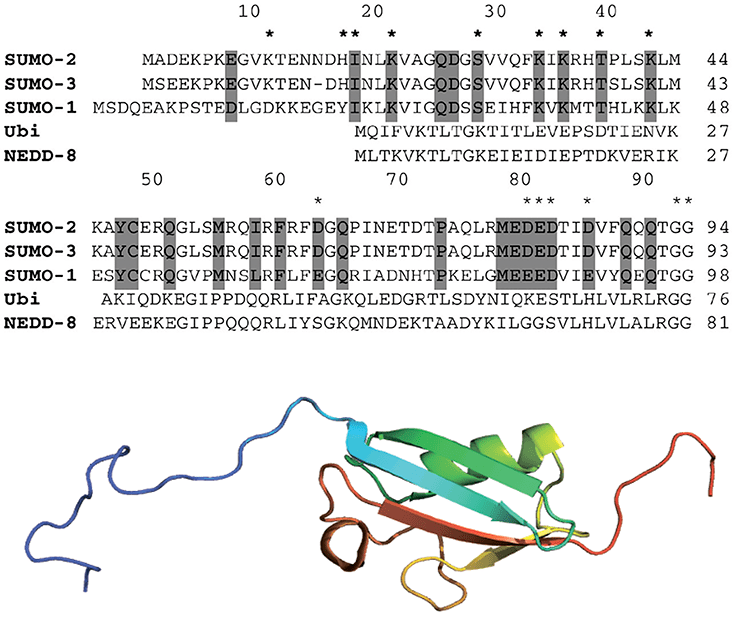
100 аминокислотных остатков (молекулярный вес ≈11–12 кДа) (рис. 2).
Рисунок 2. Строение белка SUMO. На верхнем рисунке представлена аминокислотная последовательность белков SUMO, а также показано выравнивание аминокислотных последовательностей с убиквитином. Серым цветом выделены гомологичные аминокислоты. На нижнем рисунке представлена пространственная структура белка SUMO1 человека. Синий конец — N-конец белка, красный — С-конец.
Сумоилирование является эволюционно высококонсервативным процессом от дрожжей до человека. SUMO экспрессируется во всех эукариотических организмах (дрожжи, растения, животные), но отсутствует у бактерий (однако присутствует у архей). У дрожжей, червей и насекомых экспрессируется одна изоформа* SUMO. У позвоночных животных определено несколько изоформ — SUMO1, SUMO2, SUMO3 (рис. 2), которые встречаются во всех тканях, и SUMO4, который является псевдогеном*. Несмотря на то, что механизм конъюгации SUMO идентичен для всех трех изоформ, разные формы белка характеризуются разными функциональными особенностями. Так, мышиные эмбрионы, лишенные SUMO1, погибают: это говорит о том, что SUMO2/3 не могут компенсировать отсутствие SUMO1 в клетках млекопитающих [8–10].
Давайте вместе рассмотрим процесс сумоилирования, насколько «силен» такой маленький белок, и можно ли его сравнить с тяжеловесными борцами сумо.
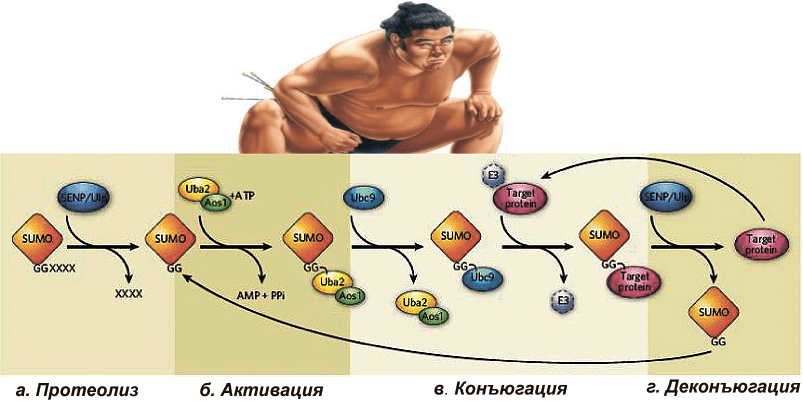
Вспомним центральную догму молекулярной биологии: ДНК → РНК → белок. Белок SUMO синтезируется по такому же принципу (ДНК → РНК → SUMO). Но только что синтезированный белок SUMO не может запустить процесс сумоилирования и осуществить конъюгацию белков-субстратов. Чтобы стать активным, ему сначала приходится подвергнуться протеолизу*.
Протеолиз белка SUMO осуществляется на С-конце полипептидной цепи, освобождая два остатка аминокислоты глицина — GG. Данная стадия процесса сумоилирования называется «созревание» и осуществляется SUMO-специфическими протеолитическими ферментами — SENP-протеазы у млекопитающих и Ulp-протеазы у дрожжей. Далее наш маленький белок SUMO активируется Е1-активирующим ферментом (гетеродимер Aos1/Uba2) и переносится на фермент Е2 (Ubc9). После этапа активации SUMO конъюгируется с субстратом в реакции, которая катализируется ферментами Е3 (рис. 3). Как и в случае убиквитинилирования, на молекулу белка-субстрата может переноситься как один остаток SUMO (моносумоилирование), так и несколько (полисумоилирование).
Помимо сумоилирования, бывает и десумоилирование. В данном случае SUMO высвобождается из субстрата в реакции, катализируемой семейством изопептидаз, названных SENP — SUMO-специфические протеолитические ферменты (рис. 3).
Рисунок 3. SUMO: ковалентная модификация белков. a — Протеолиз или «созревание» — SUMO подвергается протеолизу SENP/Ulp протеазами. б — «Активация» SUMO ферментами Uba/Aos1. в — «Конъюгация» SUMO с белком-субстратом. г — «SUMO-деконъюгация».
Таким, образом, маленький белок SUMO прибегает к помощи многих дополнительных белков-ферментов, а иногда даже «зазывает напарников», как в случае полисумоилирования. В такой ситуации можно сказать, что наш SUMO уступает профессиональным борцам сумо. Но так ли это на самом деле, мы можем оценить, только рассмотрев функциональную значимость данной посттрансляционной модификации.
Функциональная значимость SUMO и сумоилирования
Интересен тот факт, что сумоилирование может быть вовлечено в патогенез многих нейродегенеративных заболеваний. Показано, что сумоилирование необходимо для ядерного транспорта фактора DJ-1, который подавляет транскрипционную активность апоптотического белка р53, и мутации в котором зачастую связаны с развитием ранней аутосомно-рецессивной формы болезни Паркинсона [12].
Сумоилирование может быть ассоциировано как с подавлением транскрипции, так и с активацией. Например, сумоилирование таких транскрипционных факторов, как Sp3, p300, c-jun, c-myb и Elk1 понижает их активационные свойства [13]. Сумоилирование транскрипционного фактора HIC1 по аминокислотному остатку лизина 314 не влияет на его ядерную локализацию, но усиливает репрессионные свойства белка [14].
Изучение ПТМ метил-ДНК-связывающих белков показало, что сумоилирование играет немаловажную роль в регуляции их активности. Так, например, сумоилирование метил-ДНК-связывающего белка MBD1, с одной стороны, не препятствует связыванию с метилированной ДНК, а с другой — наличие этой модификации приводит к потере репрессионной активности MBD1 [15].
Функциональная значимость полисумоилирования остается еще малоизученной. Тем не менее, была показана структурная роль SUMO-2/3 цепей в клетках млекопитающих. Был найден белок CENP-E, который подвергается полисумоилированию SUMO-2/3 и локализуется к кинетохорам*, что является важным для выравнивания хромосом в стадии метафазы во время митоза [9]. Существуют версии, что полисумоилирование может, как и убиквитинилирование, приводить к деградации белков. Так, например, показано, что опухолевый супрессор PML может подвергаться полисумоилированию и деградации 26S-протеасомой. Полисумоилирование может влиять на другие ПТМ за счет экранирования сайтов связывания белка-субстрата с ферментами, принимающими участие в ПТМ [9].
Подводя итоги знакомства с новым маленьким конкурентом борьбы сумо, можно смело говорить о его огромной значимости и необходимости для регуляции широкого спектра клеточных процессов во всех живых организмах от дрожжей до человека. Полученные знания о белке SUMO могут быть интересны не только для любителей японского искусства, но и для почитателей биологии.
МОДИФИКАЦИЯ СОЕВЫХ БЕЛКОВ И ЕЕ ИСПОЛЬЗОВАНИЕ ПРИ ПРОИЗВОДСТВЕ ПРОДУКТОВ ПИТАНИЯ
На сегодняшний день соя – одна из важнейших продовольственных культур, выращиванию, переработке и исследованиям, которой уделяется все большее внимания. Никакая из других культур не имеет такого удачного состава, который представлен высоким содержанием белков, липидов, витаминов и минеральных веществ. В соевом зерне также содержится ряд важных так называемых фитопитательных веществ, приносящих пользу здоровью человека. При этом соевое зерно должно рассматриваться как натуральное, естественное продовольственное сырье, такое же как пшеница, рис, ячмень и др. Соответственно, все продукты из соевого зерна следует рассматривать как натуральные, естественные продукты питания. Медико-биологическими исследованиями отечественных и зарубежных ученых установлено только положительное влияние соевых продуктов на здоровье человека [1].
Основное внимание в будущем будет уделяться новой технологии и методам приготовления составов, а также принципиально новым продуктам поликомпонентного состава. Произойдет революция в рецептуре продуктов, прежде всего в традиционно консервативной мясной индустрии. Устаревшие идеи отойдут в прошлое, а новые продукты питания будут составлять на основе доступных ингредиентов, усовершенствованных технологий, потребностей рынка и новых требований к питательным свойствам пищи. Эти новые тенденции открывают новые возможности для производителей белка сои [2].
Исходя из этого, белковые соевые продукты смогут сыграть важную роль в удовлетворении потребностей в питательных продуктах. Они разработаны для повышения питательности разнообразных продуктов поликомпонентного состава и могут быть использованы как частичный или полный заменитель мясных белков. Белки сои, благодаря их функциональным свойствам, могут дополнять или улучшать питательные качества готовой пищи, а также помогают снизить стоимость ее производства [3].
Целью данной работы является рассмотрение белковых продуктов, выделенных из сои, методов их выделения и способов модификации и использования в мясоперерабатывающей промышленности.
Способы модификации соевых белков
Функциональные свойства соевых белков могут быть модифицированы перед окончательной сушкой продукта путем подведения рН натриевой или кальциевой щелочью и применением механических нагрузок, химической модификацией боковых групп белка, а также с использованием гидролиза протеолитическими ферментами [4].
В процессе химической и ферментативной модификации можно получить так называемые белковые гидролизаты.
Белковыми гидролизатами называют продукты гидролитического расщепления белков, состоящие в основном из отдельных аминокислот, их натриевых солей и полипептидных остатков.
Ферментативная модификация
Преимущество ферментной модификации заключается в ее специфичности и, соответственно, в отсутствии нежелательных побочных реакций. Недостаток заключается в том, что атаке того или иного фермента подвергаются лишь определенные аминокислотные последовательности в белковой молекуле и поэтому ферментативная реакция способна привести лишь к достаточно ограниченной модификации [5].
Методы ферментной модификации, в частности протеолитические методы гидролиза, соевого белка предназначены для изменения структурообразующих свойств пищевых продуктов, с одной стороны, и для увеличения усвояемости белка растительного происхождения – с другой. Это позволяет разрабатывать новые продукты питания и добавки к ним, а также повышать пищевую ценность продуктов [6].
Для гидролиза белков используют ферменты, культивированные с помощью бактерий (протосублитин, рапидоза), и с помощью грибковых культур:протооризаны(Aspergillius,terricoba, Orisius), римопротелин (Actinomycesrimosus), протелин (Striptomiceusgriseys), Актиномицет 771 (Actinomyces 771), протогигролитин(Actinomyceshydroscompius) и др. Высокой ферментной активностью обладают также ферменты поджелудочных желез свиней и крупного рогатого скота.
Можно выделить главные особенности ферментативного гидролиза:
— специфичность расщепления белковой молекулы, в результате чего аминокислотный состав полученного гидролизата зависит оттипа фермента;
— мягкие условия гидролиза: нормальное давление и температура от 30 до 50°С, благодаря чему нет деструкции выделяемых аминокислот;
— ограниченная концентрация свободных аминокислот, которая в зависимости от гидролизующего фермента колеблется от 20 до 30%.
Оптимальное соотношение фермент: субстрат обычно составляет 1% в пересчете на 100% активное начало. Оптимальное количественное соотношение вода:субстрат составляет по литературным данным не менее, чем 3:1. Большое количество воды ведет к разбавлению продуктов гидролиза.
При ферментном гидролизе не происходит разрушение триптофана и наблюдается самая низкая рацемизация аминокислот.
В одном из методов ферментативного гидролиза соевого белка используют трехстадийную процедуру гидролиза. Белок суспендируют в воде в щелочных условиях и обрабатывают в щелочной среде щелочной протеиназой, которая дополнительно солюбилизирует белок и осуществляет гидролиз. Данную реакцию можно проводить до тех пор, пока скорость реакции не начнет уменьшаться, хотя не предполагается исключить более длительные времена.
После охлаждения первый гидролизат обрабатывают в нейтральных условиях нейтральной протеиназой для того, чтобы гидролизовать пептиды и все интактные белки, и получают второй гидролизат. Эту реакцию также можно проводить до тех пор, пока скорость реакции не начнет уменьшаться. Данный второй гидролиз также проводят для того, чтобы провести стадию выроста спор, и, таким образом, среду субстрата нужно только обработать теплом, чтобы инактивировать ферментный препарат и сделать мезофильные микроорганизмы нежизнеспособными.
После охлаждения второй гидролизат обрабатывают стерильным ферментным препаратом в стерильной системе в соответствии с вышеописанным настоящим изобретением для того, чтобы гидролизовать пептиды предпочтительно экзопептидазойи по меньшей мере до момента, когда скорость гидролиза начинает уменьшаться[7].
Химическая модификация
К химическим методам модификации относят также кислотный гидролиз, который будет рассмотрен как отдельный пункт, и щелочной гидролиз.
Использование при гидролизе щелочных реагентов позволяет получать протеинаты, наиболее распространенными среди которых являются протеинаты натрия, кальция и калия. Они обладаютразными функциональными свойствами. Известно, что жироудерживающая и водоудерживающая способности максимальны у соевых протеинатов калия. Пенообразующая способность – у протеината натрия, жироэмульгирующая способность – у соевых протеинатов кальция.То есть имеет место выраженное влияние катионов щелочных и щелочноземельных металлов на функциональные свойства протеинатов соевого белка [7].
К другим методам химической модификации также можно отнести такие методы, как ацилирование, ацетилирование и сукцинилирование.
После гидролиза растительных белков остаточные полипептиды можно видоизменять посредством реакции ацилирования. Эта химическая модификация заключается в реагировании различных ацилирующих агентов типа ангидридов моно- или дикарбоновых кислот, таких как ангидрид уксусной, янтарной, пропионовой, глутаминовой или яблочной кислот с полипептидами, имеющими функциональные группировки – аминные, кислородные или серосодержащие.
Устойчивость ацилированных белков к нагреву возрастает по мере увеличения суммарного отрицательного заряда. Это оказывает влияние и на гелеобразующую способность белков.
Сукцинилирование белков приводит к повышению суммарного отрицательного заряда молекулы благодаря ковалентному присоединению сукцинильной группы (остаток янтарной кислоты) к катионным аминогруппам остатков лизина. Степень сукцинилирования может дополнительно возрастать за счет других функциональных групп белка (гидроксильные группы остатков серина и треонина).
Сукцинилирование вызывает электростатическое отталкивание одноименно заряженных карбоксильных групп, что приводит к структурным изменениям в белках – распаду на субъединицы. Соответственно, варьируя степень модификации, можно достичь различных структурных состояний.
При ацетилировании происходит замещение нейтральными ацетильными группами в основных аминогруппах остатков лизина. В реакцию также вступают гидроксильные группы остатков серина, треонина и тирозина. Таким образом, в результате нейтрализации катионных аминогрупп возрастает суммарный отрицательный заряд молекулы. Возникающее при этом электростатическое отталкивание может вызвать диссоциацию молекулы на субъединицы.
Сукцинилирование и ацетилирование – наиболее распространенные методы химической модификации из числа используемых для изменения функциональных свойств растительных белков. Благодаря резкому изменению заряда и гидрофобности белков, с одной стороны, и их пространственной структуры, с другой, указанные процессы приводят к заметному изменению водорастворимости, гелеобразующей способности, эмульгирующих и пенообразующих свойств.
Также существует метод фосфорилирование, который преследует цель придать белкам хорошие структурно-функциональные свойства, присущие природным фосфопротеинам. Среди многих реагентов, пригодных для химического фосфорилирования белков, наибольшее значение приобрела хлорокись фосфора. Она способна взаимодействовать с белками различными способами, образуя помимо отрицательно заряженных N- или О-фосфорилированных соединений также и ковалентно сшитые продукты.
Активация хлорокисью фосфора функциональных групп в белках может быть использована для ковалентного присоединения незаменимых аминокислот, а значит для повышения биологической ценности белка. Фосфорилирование приводит при определенных степенях модификации к диссоциации белков на субъединицы, но одновременно с этим происходит образование внутри- и межмолекулярно сшитых продуктов.
Фосфорилирование приводит к улучшению растворимости, эмульгирующих и пенообразующих свойств соевых белков, а также к стабилизации структуры геля [5].
Способ модификации соевого белка кислотным гидролизом
Получение белкового гидролизата кислотным гидролизом.
Созревание гидролизата продолжается от одного месяца до полугода. В этот период гидролизат приобретает более нежный вкус и запах, а также более светлый цвет. Одновременно седиментируются часть хлорида натрия и некоторые плохо растворимые аминокислоты (главным образом алифатические разветвленные), которые удаляются в процессе последующей фильтрации. Конечный жидкий продукт содержит 30 – 40 % хлорида натрия.
Меняя основные параметры процесса (температуру, продолжительность воздействия кислот, давление), получают ингредиенты с различными вкусовыми характеристиками: вкус и аромат говядины, свинины, курицы пряной, говядины жареной, свинины жареной и др.
Значительная часть производства белковых гидролизатов приходится на сухие гидролизаты, при производстве которых активно используются распылительные, барабанные сушилки, а также операция гранулирования. Причем гранулированный гидролизат в сравнении с высушенным классическими методами лучше и быстрее регидратируется.
Готовый гидролизат представляет собой мелкодисперсный порошок от желтого до коричневого цвета.
Полученные таким способом гидролизаты содержат значительное количество летучих и нелетучих компонентов, которые влияют на их химические свойства и органолептические качества. Из нелетучих веществ основными являются свободные аминокислоты и хлорид натрия. Содержание отдельных аминокислот зависит от использованного сырья и условий гидролиза. Все гидролизаты содержат в наибольшем количестве глютамовую кислоту. В значительном количестве содержатся также аспараговая кислота, пролин, аргинин, аланин и лейцин. Наоборот, гидролизаты содержат очень мало гистидина, тирозина, изолейцина, гидроксипролина, серных аминокислот и практически не содержат триптофан.
Он стабилен как при высоких температурах варки, стерилизации продукта, так и при низких температурах замораживания.
Использование гидролизата удобно с технологической точки зрения, потому что он хорошо смешивается с сухими компонентами рецептуры.
Такой соевый гидролизат может быть использован при производстве колбасных изделий, мясных паштетов, рубленых полуфабрикатов из мяса говядины, свинины, птицы. Он позволяет улучшить и усилить вкусовые характеристики готового продукта, подчеркнуть его натуральный мясной вкус и аромат, которые сохраняются на протяжении всего срока хранения [8].
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ