жировые ворота лимфоузлов что такое
Воспаление лимфоузлов
Содержание статьи:
В большинстве случаев воспаление лимфатических узлов не является самостоятельным заболеванием, а возникает при патологических процессах в различных органах и системах организма. Чаще всего сопровождает инфекционные болезни. Однако длительно текущее воспаление лимфоузлов, неправильное лечение или его отсутствие могут привести к переходу лимфаденита в самостоятельную патологию и развитию серьезных осложнений.
Классификация лимфоузлов
Лимфоузлы, наряду с лимфатическими капиллярами, сосудами, стволами, протоками и некоторыми органами (селезенка, тимус, костный мозг, миндалины) – часть лимфатической системы организма.
Функции лимфатической системы:
Лимфатические узлы – образования округлой или овальной формы, размером от нескольких миллиметров до 1-2 сантиметров. Они играют в системе роль биологического фильтра. Проходя через лимфоузлы, лимфа очищается от бактерий, токсинов, которые захватываются и уничтожаются структурами узла – лимфоидными фолликулами и тяжами лимфоцитов. Кроме того, в лимфоузлах вырабатываются антитела – формируется «иммунная память», а также фагоциты и лимфоциты.
В организме имеются следующие группы лимфатических узлов:
Причины патологии
Неспецифический лимфаденит вызывается чаще всего гноеродными бактериями (стафилококки, стрептококки), продуктами их жизнедеятельности и распада тканей. Неспецифическое воспаление лимфоузлов часто сопутствует следующим патологиям:
Причина специфического лимфаденита – возбудители, вызывающие определенные инфекции. Этот вид воспаления сопровождает такие болезни, как:
Симптомы лимфаденита
Симптоматика зависит от того, в какой форме – острой или хронической – протекает воспаление лимфоузлов, а также от того, вызвано оно неспецифическими или специфическими бактериями.
Острая форма
Острая форма лимфаденита подразделяется на три фазы: катаральную, гиперпластическую (серозную) и гнойную.
Общие симптомы острого процесса:
Для катаральной фазы воспаления характерны незначительное увеличение пораженного лимфоузла, изменение его плотности, невыраженная болезненность, отсутствие общих симптомов.
В серозную фазу воспаление распространяется на окружающие ткани, усиливается болезненность, появляется гиперемия кожи в области поражения, нарастает общая симптоматика. Возможно вовлечение в процесс близлежащих сосудов – лимфангит.
Гнойная фаза характеризуется нарастанием интенсивности местных явлений – гиперемии, отека кожи над лимфатическим узлом, его контуры становятся неоднородными. Усиливается общая интоксикация. По мере нагноения лимфоузла и его гнойного расплавления на коже в области инфильтрата становится заметна флюктуация – чувство волнообразных колебаний при прощупывании.
Хроническая форма
Хроническое неспецифическое воспаление лимфоузлов протекает без остро выраженных проявлений. Лимфоузлы при этом состоянии увеличены, малоболезненные, плотные, не спаяны с окружающими тканями. Часто вследствие хронического течения болезни лимфоидная ткань разрастается либо замещается соединительной, происходит сморщивание лимфоузлов, которые перестают выполнять свои функции. Возможно появление очагов распада и некроза узла, развитие осложнений, связанных с расстройством лимфотока.
Особенности течения специфических процессов
Гонорейный лимфаденит протекает с увеличением и резкой болезненностью паховых лимфоузлов.
Для воспаления лимфоузлов при туберкулезе характерны лихорадка, симптомы интоксикации, периаденит (вовлечение в процесс прилежащей к узлу ткани), нередко – некротические изменения узлов.
Сифилитический лимфаденит отличается отсутствием нагноения. Воспаление одностороннее, при пальпации обнаруживается цепочка лимфоузлов, которые увеличены умеренно, не спаяны между собой и с кожей.
Диагностика
При появлении признаков воспаления лимфатических узлов следует обращаться к терапевту или педиатру, либо к хирургу. При наличии сопутствующих заболеваний привлекаются другие специалисты – инфекционист, дерматовенеролог, онколог.
Диагностика неспецифического лимфаденита обычно не представляет трудностей. Диагноз ставится на основании:
Для подтверждения воспаления лимфоузлов врач может назначить общий анализ крови, мочи, биохимический анализ крови.
При подозрении на специфический лимфаденит проводятся мероприятия для выявления первичного очага – анализ крови на сифилис, ВИЧ, проба Манту или диаскин-тест, посев крови на стерильность для выявления возбудителя.
В качестве дополнительных обследований назначаются:
При хроническом воспалении лимфатических узлов рекомендуется проведение пункционной биопсии узла или его иссечение с последующим гистологическим анализом.
Лечение воспаления лимфоузлов
При имеющемся первичном очаге инфекции требуется его устранение. Одновременно с этим назначаются:
Помимо медикаментозных методов для лечения лимфаденита применяется физиотерапия: УВЧ, ультрафиолетовое облучение, магнитотерапия, электрофорез, лазерное воздействие.
Пациенту с воспалением лимфатических узлов рекомендуется полноценное питание со сбалансированным содержанием белков, жиров и углеводов, обильным питьем. Необходимо потреблять достаточное количество витаминов, микроэлементов.
При неэффективности консервативной терапии, гнойном лимфадените, аденофлегмоне показано хирургическое лечение. Под местной или общей анестезией удаляется содержимое и ткани пораженного узла. Операционный материал отправляется на гистологическое исследование. В рану вставляется дренаж для оттока содержимого. Через несколько дней дренаж удаляется, края раны сшиваются.
Осложнения заболевания
Переход острого процесса в хроническую форму – нередкое осложнение воспаления лимфоузлов. Состояние долгое время не дает никаких симптомов, но при переохлаждении, ослаблении организма лимфоузел может воспалиться с развитием нагноения.
При длительно текущем остром лимфадените, обострении хронического процесса без должного лечения существует риск развития аденофлегмоны – разлитого гнойного воспаления жировой клетчатки вокруг пораженного лимфоузла. Аденофлегмона характеризуется тяжелым общим состоянием пациента, лихорадкой, интоксикацией, выраженной болью и отеком, плотным воспалительным инфильтратом в зоне воспаленного лимфатического узла. Состояние требует неотложной помощи.
Реже развиваются такие осложнения как абсцесс – нагноение пораженного лимфоузла с образованием четких границ, или флегмона – гнойное поражение, не имеющее четкого отграничения от окружающих тканей.
При тяжелом течении воспаления, ослабленном организме пациента, наличии сопутствующих заболеваний, отсутствии адекватной терапии существует опасность возникновения сепсиса. При нем возбудитель лимфаденита попадает в кровь, вызывает поражение любых органов, в тяжелых случаях – полиорганную недостаточность и летальный исход.
Застой лимфы при воспалении лимфатических узлов может спровоцировать развитие тромбофлебита, отеки, слоновость.
Профилактика лимфаденита
Поскольку заболевание часто вызывается неспецифическими возбудителями, то и специфической профилактики не существует. Важно придерживаться здорового образа жизни, отказаться от вредных привычек. Большое значение в поддержании иммунитета имеют сбалансированный рацион с достаточным потреблением белковой пищи, полиненасыщенных жиров, овощей, фруктов, полноценный сон, умеренная физическая активность.
Людям с хроническими заболеваниями необходимо периодически посещать врача и следить за состоянием здоровья. Всем без исключения рекомендуется раз в полгода проходить профилактический осмотр у стоматолога, так как именно заболевания зубов, десен, ротовой полости являются частой причиной лимфаденита.
При появлении первых признаков заболевания нельзя ждать, когда воспаление лимфоузлов пройдет самостоятельно. Следует как можно быстрее обратиться к врачу, чтобы не допустить развития осложнений и перехода болезни в хроническую форму.
Источники статьи:
Метастатическое поражение шейных лимфатических узлов
Шейные лимфатические узлы являются частым местом метастазирования злокачественных опухолей, первичный очаг которых располагается в области головы и шеи. К ним, например, относятся плоскоклеточный рак верхних отделов дыхательных путей, а также метастазы рака слюнных желез и щитовидной железы.
Наиболее распространенным клиническим признаком является увеличивающееся образование шеи, которое обычно обнаруживается пациентом или его врачом. При подозрении на метастатическое поражения лимфатических узлов шеи для диагностики и определения наилучшей тактики лечения потребуется осмотр врачом-онкологом, инструментальные методы и биопсия.
Иногда новообразования вне области головы и шеи могут неожиданно метастазировать в шейные лимфатические узлы, что требует особенно тщательной диагностики для выявления первичного очага.
Лечение будет зависеть от типа и локализации первичной опухоли, которая распространилась в лимфатические узлы шеи, и, скорее всего, будет включать в себя комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.
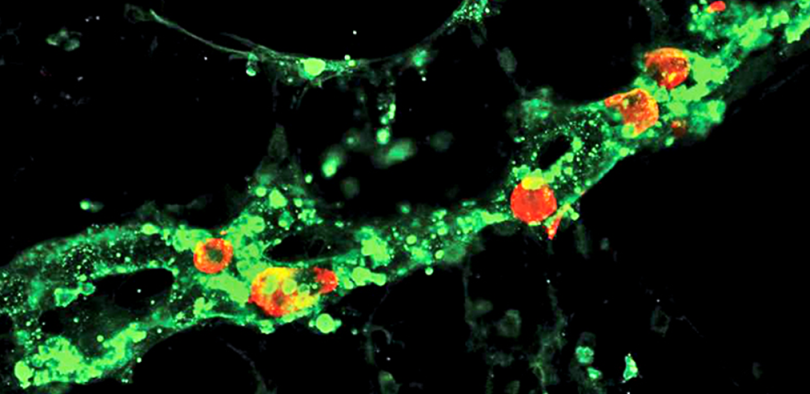
Иммунофлюоресцентная визуализация метастатических клеток меланомы (красные) внутри лимфатических сосудов (зеленые). Масштабная линейка: 100 мкм
(Science Advances/Michael Detmar Group ©)
Из чего состоит лимфатическая система шеи
Лимфатическая система шеи включает в себя сосуды и узлы.
Лимфатические капилляры — это тонкостенные структуры, состоящие из одного слоя эндотелиальных клеток. Они находятся во всех тканях организма и, объединяясь друг с другом, способствуют оттоку лимфатической жидкости в более крупные лимфатические сосуды.
Стенка лимфатических сосудов состоит из трех слоев: внутреннего слоя эндотелиальных клеток, среднего мышечного слоя и внешнего слоя соединительной ткани. В лимфатических сосудах гораздо больше клапанов, чем в венозных, при этом циркуляция лимфы полностью зависит от сжатия сосудов окружающими мышцами. Лимфатические сосуды дренируют лимфу в лимфатические узлы.
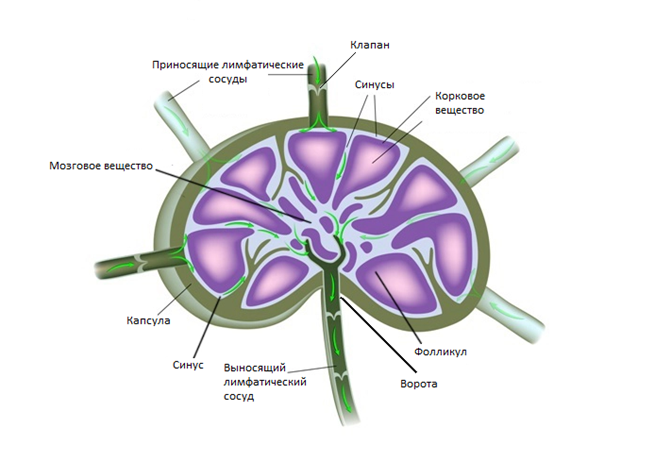
В среднем на каждой стороне шеи расположено до 75 лимфатических узлов. Снаружи узел покрывает капсула, под которой располагается субкапсулярные синусы – место куда попадает лимфатическая жидкость из приносящих лимфатических сосудов. Жидкость проходит сквозь ткань лимфатического узла, которая состоит из коркового и мозгового вещества, а затем выходит через ворота лимфатического узла и попадает в отводящие лимфатические сосуды. В итоге лимфа попадает в венозную систему в месте соустья внутренней яремной и подключичной вены.
Анатомическая структура лимфатического узла (Alila Medical Media/ Shutterstock ©)
Классификация лимфатических узлов шеи
На данный момент во всем мире рекомендована к использованию классификация Американского объединенного комитета по раку (American Joint Committee on Cancer (AJCC)) 8 издания от 2018 года:
Уровни лимфатических узлов шеи (Tenese Winslow LLC ©)
Диагностика
Осмотр
При пальпации шеи врач обращает внимание на расположение, размер, плотность и подвижность каждого узла. Особое внимание уделяется узлам, которые кажутся фиксированными к подлежащим сосудисто-нервным структурам и внутренним органам. Описание каждого узла становится важной частью медицинской документации, которая в дальнейшем может использоваться для оценки эффекта лечения.
Лучевые методы
Преимуществами УЗИ перед другими методами визуализации являются цена, скорость исследования и низкая лучевая нагрузка на пациента.
Ультразвуковыми признаками метастатического поражения лимфатических узлов может быть образование сферической формы, нарушение структуры, нечеткие границы, наличие центрального некроза и др.
Поскольку не всегда по УЗИ можно с уверенностью сказать является лимфатический узел пораженным или нет, иногда одновременно выполняют тонкоигольную аспирационную биопсию под ультразвуковым контролем с последующим цитологическим исследованием материала из этого узла. Результат цитологического исследования зависит от навыков врача УЗИ и качества образца (т.е. наличия достаточного количества репрезентативных клеток).
С появлением систем высокого разрешения и специальных контрастных веществ КТ позволяет обнаруживать лимфатические узлы, которые могли быть пропущены при иных методах диагностики.
Ценность МРТ – превосходная детализация мягких тканей. МРТ превосходит КТ в качестве предпочтительного исследования при оценке ряда новообразований головы и шеи, таких как основание языка и слюнные железы. Размер, наличие нескольких увеличенных узлов и центральный некроз – критерии, общие для протоколов исследования КТ и МРТ.
Этот новый метод визуализации все чаще используется для определения стадии опухолей головы и шеи. Метод основан на поглощении 2-фтор-2-дезокси-D-глюкозы (ФДГ) метаболически активными тканями. Исследование также может быть объединено с КТ, чтобы улучшить разрешение получаемого изображения и более точно определить расположение образования.
Биопсия
Биопсия — это удаление небольшого кусочка ткани для исследования под микроскопом или для тестирования в лаборатории на предмет наличия признаков злокачественности. В подавляющем большинстве случаев проводится тонкоигольная аспирационная биопсия. Врач, выполняющий биопсию, может использовать УЗИ или КТ для выполнения процедуры. Иногда тонкоигольная аспирационная биопсия не позволяет поставить окончательный диагноз, и требуются другие виды биопсии, такие как трепан-биопсия или эксцизионная биопсия.
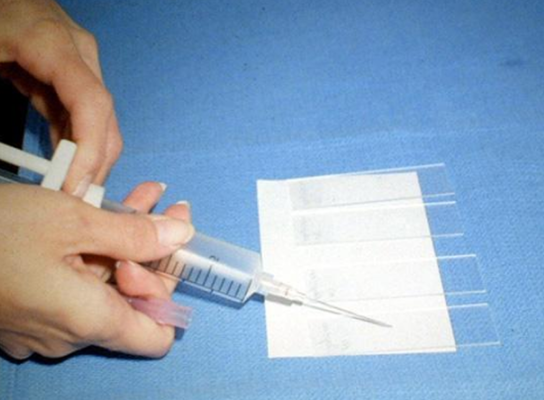 | 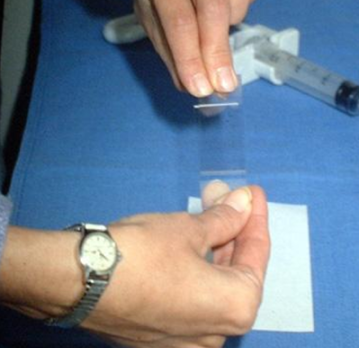 |
| Процесс приготовления предметных стекол для цитологического исследования. Материалом служит содержимое шприца после выполнения тонкоигольной аспирационной биопсии | |
План лечения
После определения диагноза и проведения всех диагностических исследований врач порекомендует оптимальный для пациента курс лечения. В конечном итоге лечение метастатического поражения лимфатических узлов зависит от типа и локализации первичной опухоли.
Существует три различных варианта лечения, которые могут быть использованы отдельно или в комбинации:
Хирургическое лечение
Хирургическое лечение обычно включает удаление лимфатических узлов шеи (лимфодиссекция) и последующее гистологическое исследование для точного определения стадии, так как это может существенно повлиять на дальнейшую тактику лечения. Хоть и не всегда, но чаще всего лимфодиссекция выполняется одновременно с удалением первичной опухоли.
Существуют различные виды лимфодиссекций:
Лучевая терапия
Лучевая терапия может быть назначена в качестве самостоятельного метода лечения в послеоперационном периоде, чтобы снизить вероятность рецидива либо в комбинации с химиотерапией в качестве самостоятельного или адъювантного лечения. Обычно адъювантная лучевая терапия необходима, если по результатам гистологического исследования обнаруживается несколько пораженных лимфатических узлов.
Химиотерапия
Химиотерапия обычно добавляется к лучевой терапии в качестве самостоятельного или адъювантного (послеоперационного) лечения. В некоторых случаях может использоваться индукционная химиотерапия с целью уменьшения объема образования и последующего хирургического вмешательства.
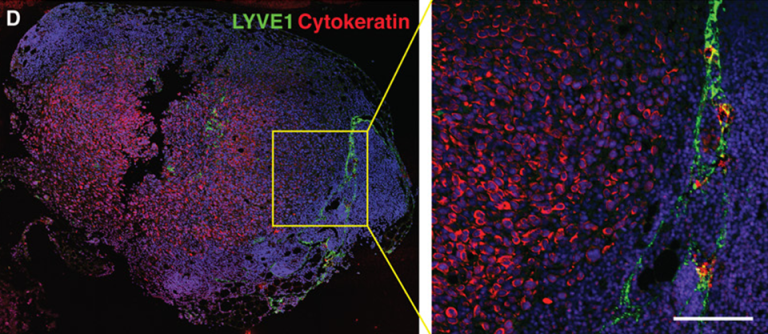
Иммунофлюоресцентная визуализация метастатически пораженного лимфатического узла с окраской на Цитокератин (красный) – маркер характерный для опухолевых клеток эпителиального происхождения. Масштабная линейка: 50 мкм
(Science Advances/Michael Detmar Group ©)
Прогноз
Метастазы в лимфатические узлы шеи могут возникать при онкологических заболеваниях различных локализаций, поэтому давать прогностические оценки для этой группы пациентов следует только после выявления первичной опухоли.
Факторы, влияющие на прогноз:
Наблюдение после лечения
Пациенты должны регулярно посещать своего специалиста по опухолям головы и шеи для оценки состояния на предмет любых признаков рецидива заболевания.
Стандартный график наблюдения
В первые 1–2 года осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяца, на сроке 3–5 лет – один раз в 6–12 месяцев. После 5 лет с момента операции посещать врача необходимо один раз в год или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Список литературы:
Авторская публикация:
Амиров Николай Сергеевич
Клинический ординатор НМИЦ онкологии им. Н.Н. Петрова
Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Жировые ворота лимфоузлов что такое
Текущий раздел: Авторефераты и литературные обзоры.
Обзор литературы из диссертации на соискание ученой степени кандидата медицинских наук.
Автор : Абассова Елена Васильевна.
Работа выполнена в ФГУ Российском научном центре рентгенорадиологии Росздрава (директор – академик РАМН, профессор В.П. Харченко).
Защита диссертации состоялось 27.06.05г. на заседании Диссертационного совета Д.208.081.01 при ФГУ Российского научного центра рентгенорадиологии Росздрава (117 997, Москва, ул. Профсоюзная 86).
Адрес документа для ссылки: h ttp://vestnik.rncrr.ru/vestnik/v5/papers/ lit abas_v5. htm
Резюме к литературному обзору.
На основании анализа отечественной и иностранной литературы ( всего 179 источников) показана эффективность ультразвуковой диагностики при выяснении причины увеличения лимфатических узлов. Определен круг вопросов, которые не нашли достаточного отражения в предыдущих исследованиях и составлен предварительный план изучения дополнительных возможностей ультразвукового исследования в диагностике природы лимфаденопатий.
1. Актуальность проблемы.
2. Анатомия лимфатического узла.
3. Возрастные особенности ЛУ.
4. Применение эхографии для исследования лимфатических узлов, историческая справка.
1. Актуальность проблемы.
Проблема дифференциальной диагностики природы увеличения лимфатических узлов (лимфаденопатий – ЛАП), в том числе у детей, является весьма актуальной. Это обусловлено многообразием нозологий, сопровождающихся ЛАП, а также сложностью дифференциальной диагностики ее причин [43, 149, 175]. Биопсия ЛУ была и остается завершающим этапом дифференциальной диагностики злокачественных и доброкачественных ЛАП, но показания к ее своевременному выполнению не определены и устанавливаются или эмпирически, или при развернутой клинической картине заболевания [113,120].
Вместе с тем, за последнее десятилетие достигнут значительный прогресс в методах визуализации. Среди них ведущим, несомненно, является эхография. Повышение разрешающей способности эхографии в В-режиме позволяет визуализировать ранее недоступные исследованию структуры. Несмотря на то, что эхография не может поставить гистологического диагноза, на основании ряда эхографических критериев, отображающих структуру ЛУ, можно планировать дальнейшие диагностические и терапевтические процедуры [119, 149]. Однако эхография в В-режиме на сегодняшний день не дает однозначных признаков злокачественности [43]. Современные высокочастотные ультразвуковые датчики позволяют приблизить эхоанатомию поверхностно расположенных ЛУ к их морфоструктуре [110, 119, 122, 138, 149, 179]. Теоретически это должно повысить разрешающую способность метода и более четко сформулировать показания к инвазивным методам диагностики.
На основании вышеизложенного нам представилось актуальным провести исследование по разработке эхосемиотики ЛУ в условиях применения новых ультразвуковых технологий в целях дифференциальной диагностики ЛАП.
Функции, выполняемые лимфатической системой, разнообразны.
Лимфатические капилляры собирают межтканевую жидкость вместе с находящимися там нормальными и патологическими клетками, микроорганизмами и антигенами, электролитами и коллоидами для фильтрации в ЛУ. В венозное русло лимфа попадает через грудной лимфатический проток и надключичную вену. Таким образом осуществляется дренажная функция лимфатической системы, а с учетом возвращения межтканевой жидкости в кровяное русло и реализация функции восстановления гомеостаза [11].
ЛУ сами выполняют жизненно важные функции, такие как продукция лимфоцитов, а также фильтрация лимфы и защита организма. Работая как фильтр, ЛУ обезвреживают микроорганизмы, образующиеся при воспалении продукты распада, обеспечивая защиту организм от распространения инфекции. Они могут быть барьером на пути распространения клеток злокачественной опухоли, а также служить местом развития первичной опухоли системы гемопоэза. Таким образом, увеличение размеров ЛУ может быть следствием 1) увеличения продукции нормальных лимфоцитов, макрофагов в ответ на занос в узел чужеродных элементов; 2) пролиферации клеток злокачественной опухоли; 3) жировой инфильтрации при заболеваниях липидного обмена; 4) замещения соединительной тканью после перенесенных хронических воспалительных заболеваний и инволюции. Вот почему не вызывает удивления реакция ЛУ на широкий спектр инфекционных, аутоиммунных и неопластических процессов [11] (Таблица 1.1).
В возрасте до 30 лет до 80% лимфаденопатий носят доброкачественный характер, в то время как после 50 лет только 40% из них являются доброкачественными [11].
Таблица 1.1. Некоторые из причин, вызывающих увеличение лимфатических узлов.
а – Вирусные инфекции.
б – Бактериальные инфекции.
в – Грибковые инфекции.
г – Инфекции простейшими микроорганизмами и паразитами.
2. Злокачественные опухоли
б – Метастазы солидных опухолей.
3. Аутоиммунные заболевания
4. Нарушения липидного обмена (болезнь Гоше, Неймана – Пика).
5. Заболевания неуточненной этиологии.
6. Конституциональная гиперплазия (тимико-лимфатический статус).
У детей иммунная система, частью которой являются ЛУ, особенно ранима и чувствительна к неблагоприятным факторам внешней среды, так как она находится в стадии структурного и функционального созревания и имеет большую функциональную нагрузку. В связи с этим у детей в детском возрасте часто затруднительно ответить на вопрос, является ли данная гиперплазия ЛУ проявлением патологического процесса, или это конституционально обусловленное состояние (И. В. Давыдовский) [6].
Максимальные размеры ЛУ в норме колеблются от едва видимых до 2-2,5 см. Они зависят от ряда факторов, одним из которых является возраст. У детей и подростков часто наблюдается гиперплазия групп ЛУ в зонах, наиболее подверженных антигенным воздействиям (шейно-надключичные, паховые). У взрослых происходит постепенная инволюция лимфоидной ткани и уменьшение размеров ЛУ. На размеры нормальных ЛУ влияют также особенности конституции и состояние функции гормональной системы [6].
По мнению некоторых авторов, средней границей нормы считается размер ЛУ до 1 см, за исключением паховых, для которых норма до 1,5 см [11].
Однако в человеческом организме существует несколько специфических ЛУ, размеры которых превышают 10мм [11], в том числе, югуло-дигастральный ЛУ (другое название – ЛУ Кютнера), расположенный в верхней трети шеи (его размеры часто достигают 30 мм в диаметре).
У большинства детей имеются мелкие пальпируемые ЛУ шейных, подмышечных и паховых групп, но как патологическое расценивается выявление задних околоушных, над-/подключичных групп [6].
2. Анатомия лимфатического узла.
Каждый ЛУ снаружи покрыт соединительнотканной капсулой, от которой внутрь органа отходят тонкие ответвления – капсулярные трабекулы. В том месте, где из ЛУ выходят выносящие лимфатические сосуды, узел имеет небольшое вдавление – ворота (hilum). В области ворот (хилуса) капсула довольно сильно утолщается, образуя воротное утолщение, вдающееся внутрь узла. От воротного утолщения в паренхиму ЛУ отходят соединительнотканные воротные трабекулы. Наиболее длинные из них соединяются с капсулярными трабекулами [2,3].
У ЛУ, к которым лимфа течет от конечностей (паховые, подмышечные), чаще встречаются одни ворота, у висцеральных – до 3-4 ворот. Через ворота в ЛУ входят артерии, нервы, выходят вены и выносящие лимфатические сосуды [2,3].
Внутри ЛУ, между трабекулами, находится ретикулярная строма. Она представлена ретикулярными волокнами и ретикулярными клетками, образующими трехмерную сеть с различными по величине и форме петлями. В петлях стромы располагаются клеточные элементы лимфоидной ткани [3].
Паренхиму ЛУ подразделяют на корковое и мозговое вещество. Корковое вещество занимает периферические отделы узла и содержит лимфоидные узелки. Кнутри от узелков, непосредственно на границе с мозговым веществом, выделяется полоска лимфоидной ткани – тимусзависимая зона, содержащая преимущественно Т-лимфоциты. В этой зоне находятся выстланные кубическим эндотелием посткапиллярные венулы, через стенки которых лимфоциты мигрируют в кровеносное русло [3].
Паренхима мозгового вещества представлена тяжами лимфоидной ткани. Они соединяются друг с другом с образованием сложных переплетений. Паренхима ЛУ пронизана густой сетью каналов – лимфатическими синусами, по которым лимфа течет через ЛУ. Под капсулой располагается подкапсульный (краевой) синус, уходящий своими концами непосредственно к воротам (хилусу) узла. От него в паренхиму ЛУ отходят промежуточные (в начале корковые, а затем мозговые) синусы, которые в области ворот органа переходят в воротный синус. В этот синус открывается так же и подкапсульный синус. В просвете синусов имеется мелкопетлистая сеть, выполняющая функцию фильтра [3].
В каждый ЛУ входит от 1-2 до 10 мелких ветвей от ближайших артерий, в последующем артериолы делятся на капилляры, формирующиеся из капилляров венулы сливаются в вены, направляющиеся к воротам ЛУ и покидающие узел вместе с выносящими лимфатическими сосудами. [3].
ЛУ почти всегда располагаются в жировой клетчатке в виде отдельных скоплений и групп. Они связаны между собой множеством анастомозов. Различают последовательный, параллельный, коллатеральный и комбинированные типы соединения ЛУ [17, 3].
Форма ЛУ также вариабельна. ЛУ небольших размеров имеют округлую и овальную форму, для средних по размеру ЛУ характерна округлая и бобовидная форма, ЛУ больших размеров могут иметь овальную, сегментарную и даже лентовидную форму. Форма ЛУ в значительной мере определяется его локализацией и окружением. Круглую форму ЛУ имеет, если на него нет давления окружающей ткани. К примеру, на шее ЛУ в норме овальные. В подмышечных зонах в норме ЛУ могут быть круглыми [10,3].
3. Возрастные особенности ЛУ.
У новорожденных детей капсула ЛУ еще очень нежная и тонкая, поэтому их трудно прощупать под кожей. К годовалому возрасту ЛУ уже можно прощупать почти у всех здоровых детей.
У большинства детей в возрасте 3-6 лет имеется некоторая гиперплазия периферического лимфоидного аппарата. Маслов М.С. [23] указывал, что «лимфатизм» присущ, в основном, всему детскому населению, и что в той или иной степени все дети до 7 лет являются лимфатиками. Воронцов И.М считает, что у детей раннего возраста могут быть различные виды лимфатизма, возникающего от перекармливания или из-за повторных вирусных инфекций. Однако при всех ситуациях истинный лимфатический диатез необходимо дифференцировать от акселерационного, алиментарного и иммунодефицитного лимфатизма [4]. Распространенность лимфатического диатеза у детей дошкольного возраста составляет 3-6%, а по другим данным достигает 13% [23].
Возрастные изменения инволютивного плана (уменьшение количества лимфоидной ткани, разрастание жировой) в ЛУ наблюдаются уже в юношеском возрасте. Разрастается соединительная ткань в строме и паренхиме узлов, появляются группы жировых клеток. Одновременно с этим уменьшается количество ЛУ в регионарных группах. Многие ЛУ небольших размеров полностью замещаются соединительной тканью и перестают существовать как органы иммунной системы. Рядом лежащие ЛУ срастаются друг с другом и образуют более крупные узлы сегментарной или лентовидной формы [10, 3].
В любом случае наличие у ребенка пальпируемых ЛУ, размеры которых превышают возрастные нормы, является показанием к уточнению их природы. На современном этапе с этой целью возможно использование технических средств, в первую очередь, эхографии.
4. Применение эхографии для исследования лимфатических узлов, историческая справка.
В 1975 году Willey впервые предложил использовать ультразвуковые датчики с частотой 5,0 МГц для оценки состояния шейных ЛУ [168]. До середины 90-х годов в литературе указывалось, что структура нормальных ЛУ не различима при эхографии. Неизмененные ЛУ зачастую не удавалось дифференцировать от окружающей жировой клетчатки, особенно при их размерах менее 5 мм [48, 66, 94, 105]. Скудность получаемой информации была обусловлена низкими возможностями используемой в то время аппаратуры. Появление более высокочастотных датчиков 7,5-13 МГц, и использование новых технологий позволяет сегодня не только выявлять пораженные ЛУ [124, 170], но и в большинстве случаев визуализировать нормальные [41, 49, 79, 138].
В своем исследовании мы использовали имеющуюся классификацию лимфатических узлов головы и шеи, согласно которой они делятся на следующие группы [11]:
1) глубокие шейные ЛУ;
2) лимфатические узлы заднего треугольника;
4) подбородочные ЛУ;
6) перипаротидные ЛУ.
Глубокие экстрависцеральные и ретрофарингеальные ЛУ шеи не могут быть выявлены при эхографии из-за недоступности своего расположения для данного диагностического метода. Большинство ЛУ околошейного региона дренируются цепочкой глубоких югулярных ЛУ. Только от затылочного ЛУ лимфа впадает непосредственно в добавочный спинальный лимфатический коллектор.
Согласно классификации Н. Rouvierre (1932), глубокие шейные ЛУ делятся на передние и латеральные группы [ цит. по 11].
Передние располагаются кпереди от внутренней яремной вены, в основном в верхней части шеи между двубрюшной мышцей и подъязычной костью.
Латеральные внутренние югулярные ЛУ собирают лимфу как непосредственно от органов и тканей, так и через систему других ЛУ. Этот лимфатический коллектор дренирует назальную ямку, миндалины, язык, твердое небо, щитовидную железу, ухо, подчелюстную и подъязычные слюнные железы.
Надключичную область исследуют при помощи линейного датчика 6-10 МГц. Для оценки состояния ЛУ этой региональной зоны УЗ датчик перемещают в проекции переднего надключичного треугольника. В поиске ЛУ обследуют зоны расположения таких сосудов, как общие сонные артерии, плечеголовная артерия и вена. Большую роль играет выявление в надключичной области ЛУ, расположенных на передней фасции (поверхностных). Надключичные ЛУ расцениваются как ЛУ второго порядка для верхних квадрантов молочной железы. В том случае, когда в надключичные ЛУ впадают лимфатические сосуды от верхних квадрантов молочных желез, они одновременно являются лимфатическими узлами первого и второго порядка [11].
При проведении ультразвукового исследования подмышечной области пациент располагается на спине с поднятой и одновременно отведенной в сторону рукой. Используются линейные и конвексные датчики 5- 10 МГц с учетом толщины подкожной клетчатки. Ориентиром в поиске ЛУ, как и в других регионах, являлись крупные сосудистые стволы: подмышечная вена и наружная грудная артерия.
К этим ЛУ лимфа оттекает от наружных квадрантов молочной железы, передних и боковых отделов грудной стенки и верхнего отдела передней брюшной стенки.
Для оценки состояния подключичных ЛУ линейный или конвексный датчик 5,0- 10 МГц (в зависимости от толщины мягких тканей передней грудной стенки и подкожной клетчатки) устанавливают по косой линии, соединяющей ключицу и подмышечную область.
Осмотр пахово-бедренной области производится линейным датчиком 6-10 МГц (в зависимости от толщины подкожной клетчатки), с перемещением датчика по ходу паховой складки и с ревизией области пахового сосудистого пучка. Также необходимо осматривать область внутреннего бедренного треугольника, а также и ЛУ, расположенные в подкожной клетчатке надлобковой области [11].
6. Ультразвуковая анатомия лимфатических узлов.
Эхография сегодня является самым доступным методом визуализации, позволяющим оценить состояние практически всех регионарных ЛУ, что существенно дополняет клинические данные о степени распространенности опухоли [40, 47, 81, 176].
Основополагающими работами при описании эхосемиотики ЛУ при исследовании в В-режиме явились работы исследователей, изучавших состояние ЛУ в области шеи [11, 21, 22, 42, 68, 89, 102, 119, 157, 163].
Неизмененный ЛУ в эхографическом изображении – это, как правило, овальной формы образование с диаметром по длинной оси от 5 до 10 мм, с ровными, хорошо очерченными контурами, гипоэхогенной краевой частью и гиперэхогенной сердцевиной. За норму принят размер поперечного диаметра ЛУ до 10мм [10], хотя, по данным ряда авторов, размеры нормальных ЛУ в различных областях могут быть разными. По мнению Goldberg В.В. [77] шейные ЛУ менее 5 мм в наибольшем измерении трудно выявить, а наибольший поперечный диаметр более 8 мм следует рассматривать как патологию. По данным van den Breckel [41], выявленные в области шеи лимфатические узлы с диаметром 7 мм и более подозрительны на наличие патологического процесса. Для югуло-дигастрального лимфатического узла этот размер в норме может превышать 8 мм. По мнению некоторых авторов, выявление множества лимфатических узлов с поперечным диаметром более 10 мм позволяет предположить наличие лимфомы, что требует морфологического исследования. [48, 41, 110] В литературе нет четких сведений в отношении размеров ЛУ в норме и при липоматозе.
По данным Bruneton с соавт. [44], частота выявления поверхностных шейных и подмышечных ЛУ с эхографическими признаками инволютивных (липоматозных) изменений у взрослого контингента пациентов с возрастом увеличивается. Эта точка зрения подтверждается и патологоанатомическими данными, свидетельствующими, что при нормальной возрастной инволюции, так же как и вследствие процессов рубцевания, фиброза и липоматоза (после банального воспаления), происходит изменение размеров и структуры ЛУ. Важно отметить, что липоматозные изменения чаще свойственны ЛУ подмышечной и паховой области [11, 103].
При ультразвуковой оценке доброкачественного или злокачественного характера изменения ЛУ, по данным литературы, необходимо учитывать семь параметров [11, 25, 26, 149]:
— форму (округлую или овальную);
— наличие или отсутствие изображения области ворот ЛУ;
— толщину (передне-задний размер) области ворот;
— эхоструктуру коры ЛУ;
— характер васкуляризации при цветовом допплеровском картировании (ЦДК);
— наличие или отсутствие экстракапсулярного распространения патологического процесса [49].
Остановимся на значении отдельных параметров.
1. При анализе характера поражения ЛУ важную роль играет оценка формы. Для этого используется соотношение П/ПЗ (поперечного и передне-заднего диаметров) (индекс Solbiati ) [89, 126, 135, 137, 138, 163, 164, 170]. Если индекс П/ПЗ менее 1,5, тогда точность эхографии в дифференциальной диагностике неизмененных или реактивно измененных ЛУ с пораженными опухолью относительно невелика – чувствительность 71%, специфичность 65% [60, 84, 119]. Если соотношение П/ПЗ становится равным 2, то чувствительность в возрастает до 81-95%, а специфичность – до 67-96% [63, 126, 135, 137, 138, 163, 164].
2. Второй параметр, который должен учитываться, – это наличие гиперэхогенной центральной линии-сердцевины или изображение ворот ЛУ. На основании сопоставления ультразвуковых и патологоанатомических данных можно говорить, что область ворот соответствует плотной сети лимфатических синусов. Лимфатические синусы сходятся в центральной части ЛУ, а пространство между ними занято соединительной тканью [69, 119, 126, 163].
Острое воспаление и злокачественные процессы вызывают прогрессивное истончение сердцевины, что приводит к полному исчезновению изображения ворот ЛУ.
В небольшом числе случаев (4-6%) область ворот может не выявляться в структуре абсолютно нормальных ЛУ [124]. Выявление ложного изображения ворот (гиперэхогенной структуры, имитирующей изображение ворот) ЛУ отмечено в 3-8% случаев. Ложное гиперэхогенное изображение ворот ЛУ может быть при метастазе высокодифференцированного плоскоклеточного рака. Такие же изменения могут являться следствием коагуляционного некроза с исходом в фиброз [38, 43, 45, 48]. Коагуляционный некроз в ЛУ (в виде анэхогенного участка) возникает как проявление ишемической дегенерации. Такая ишемия может сопровождать как воспалительный, так и злокачественный процесс в ЛУ. Некротические очаги прослеживаются в специфически пораженных ЛУ размером более 15-20 мм, но могут встречаться и в узлах меньших размеров. В пораженном ЛУ при его замещении опухолевой тканью процессы гипоксии начинаются с размеров опухоли в 3 мм [8, 118].
Гиперэхогенная зона в центральной части ЛУ на фоне коагуляционного некроза имеет более округлую форму и всегда сопровождается кистозными включениями вплоть до вовлечения в этот процесс всего объема узла. Все это позволяет отличить данную патологию от нормального изображения ворот ЛУ [41].
При одном и том же заболевании ЛУ могут иметь различную внутреннюю структуру [11]
— степень гипоэхогенности (вплоть до анэхогеного изображения) лимфом зависит от однородности расположения клеточных элементов;
— эхогенность пораженных ЛУ возрастает на фоне химиотерапии в связи с процессами гибели опухолевых клеток и их замещением на фиброзную ткань [49, 54];
— гиперэхогенная эхоструктура ЛУ наблюдается при больших размерах метастаза, когда зоны опухолевой инфильтрации чередуются с нормальными участками лимфоидной ткани [11];
— анэхогенное изображение ЛУ может быть обусловлено часто встречающимися участками некроза при метастазах ороговевающего плоскоклеточного рака, либо при папиллярных раках щитовидной железы [11];
— полиморфная неоднородная эхоструктура может возникать за счет чередования гиперэхогенных участков (как следствие коагуляционного некроза) и участков кистозной дегенерации встречается при туберкулезных поражениях ЛУ [69];
— выраженное кальцинирование кортикального слоя встречается при гранулематозных заболеваниях, или после химиотерапии и облучения при метатастазах в ЛУ [11];
— микрокальцинаты внутри узла нередко выявляются при эхографии при папиллярном или медуллярном раках щитовидной железы [11];
Недавно для оценки состояния поверхностных ЛУ стали использовать импульсноволновую допплерографию и цветовое допплеровское картирование (ЦДК).
Особенно это относится к тканевому кровотоку в малых периферических сосудах области коры ЛУ. Вот почему выявленный с помощью ЦДК кровоток не может отражать действительную перфузию ЛУ. На фантомных исследованиях было подтверждено, что максимальные скорости кровотока обратно пропорциональны диаметру малых сосудов [159, 160]. Именно это является основным препятствием к реальной оценке скоростей в мелких сосудах с помощью ЦДК.
Разнообразие сосудистых изменений при различных стадиях заболеваний ЛУ привело к тому, что многие исследователи отказались от подсчета этих индексов. В работах Riccabona М. (2000 г) отмечается, что точная дифференцировка между воспалительными процессами в сравнении с инфильтрирующим злокачественным поражением даже с помощью допплеровских методик, в том числе и энергетического допплера, невозможна [120].
Tschammler А. (1995 г), анализируя природу поражения поверхностных ЛУ при сопоставлении эхоморфологических критериев, полученных в В-режиме, результатов спектрального анализа (импульсноволнового допплера) и данных Ц(Э)ДК о внутриузловом кровотоке ЛУ, указывает на субьективность классификации сосудистого рисунка и возможность некоторой предвзятости в оценке их диагностической ценности, на отсутствие строгой стандартизации проведения исследований и на разную диагностическую возможность УЗ аппаратуры [157].
Имеется явное противоречие: с одной стороны, данные о высокой диагностической значимости Ц(Э)ДК в оценке информации о васкуляризации паренхиматозных органов, с другой стороны – противоречивость результатов, полученные в ряде работ применительно к Ц(Э)ДК ЛУ [1, 9, 12, 104, 106, 120, 115, 171].
Введение цветных допплеровских методик увеличило количество информации, получаемой при эхографии ЛУ [59, 115, 154, 173, 171]. Однако и сейчас ясно, что сосудистые изменения в ЛУ происходят еще более непредсказуемо, чем даже морфологическая перестройка паренхимы и стромы.
Эхографическая аппаратура различных фирм и классов отличается большим разбросом диагностических возможностей, поэтому необходимо уточнить рамки этих возможностей при заболеваниях ЛУ. В связи с этим, необходимо и дальше изучать и оценивать возможности новых технологий эхографии в В-режиме и допплеровских методик.
Так, согласно последним исследованиям, дифференциально-диагностическая эффективность эхографии повышается при применении методов тканевой гармоники, трехмерного изображения и контрастного препарата [13, 168, 35]. Применение контраста с интенсификацией допплеровского сигнала даже на 20 децибелл, позволяет повысить диагностическую значимость эхографии для разрешения проблемы дифференциальной диагностики доброкачественных и злокачественных лимфаденопатий. [64, 131, 128, 130, 108]. Однако результаты одного из последних исследований (2003 г) по применению ультразвукового контрастного препарата показали, что, несмотря на выявление большего количества сосудов, использование контраста не повышает диагностического значения ЦДК и ЭК при увеличении поверхностных ЛУ [131]. Измерение объема ЛУ с использованием трехмерной автоматической программы, по мнению некоторых исследователей, может дать дополнительную информацию для дифференциальной диагностики злокачественных и доброкачественных лимфаденопатий; поскольку объем узлов, пораженных опухолью, варьирует от 0,444 до 4.442 куб. см., а при доброкачественных процессах объем ЛУ от 0,143 до 1.176 куб. см. [93].
7. Воспалительные, реактивные лимфадениты.
Проникновение инфекции в ЛУ далеко не всегда вызывает их реальное воспаление – лимфаденит, для которого морфологически характерны гиперемия, выраженный отек и воспалительная лейкоцитарная инфильтрация ЛУ. В значительной части случаев возникает ответная реакция ЛУ в виде гиперплазии, которая морфологически проявляется умеренной гиперемией узла и пролиферацией зрелых клеточных элементов лимфоидного ряда. Именно эта реакция обеспечивает выполнение ЛУ барьерной функции. В зависимости от длительности поступления инфекции, а также от соотношения вирулентности флоры и адекватности реакции иммунной системы, воспалительная гиперплазия ЛУ может быть острой или хронической [5].
Согласно общепринятой классификации, воспаление ЛУ может протекать в варианте острого серозного лимфаденита, хронического лимфаденита и обострения хронического лимфаденита. Однако многие авторы относят хронический лимфаденит к воспалительной гиперплазии ЛУ, поскольку для него морфологически свойственны не столько явления гиперемии, отека и воспалительной лейкоцитарной инфильтрации ЛУ, сколько гиперплазия его лимфоидных элементов и пролиферация соединительной ткани [5].
В зависимости от индивидуальной реактивности организма, состояния его иммунной системы, агрессивности инфекции возможно несколько вариантов изображения воспалительного процесса в ЛУ [7, 8, 15, 22].
Сложность оценки воспалительных процессов в ЛУ связана с широким применением антибиотиков и противовоспалительных препаратов. Применение этих средств на ранних стадиях лимфаденитов приводит к приостановке увеличения размеров ЛУ и быстрой нормализации его эхоструктуры.
При сниженном иммунитете в ответ на инфекционный процесс реактивные и гиперпластические изменения в ЛУ минимальны, что не позволяет при эхографии отличить их от нормального ЛУ.
Как в неизмененном ЛУ, так и при реактивной лимфаденопатии при эхографии всегда выявляется гиперэхогенная сердцевина и гипоэхогенный краевой синус. Это связано с тем, что в результате большинства воспалительных и реактивных изменений (за исключением гранулематозной инфекции типа туберкулеза) происходит диффузное и однородное вовлечение в процесс различных отделов ЛУ без значительного увеличения размеров, что позволяет ему сохранить овальную форму [11,15].
Подострый лимфаденит с большей, чем при реактивных изменениях, выраженностью воспалительного процесса при ультразвуковом исследовании характеризуется стиранием четкости дифференциации структур в области ворот на фоне снижения общей эхогенности ЛУ. Размеры ЛУ увеличены, ширина гипоэхогенного изображения краевого синуса и соотношение поперечного и продольного диаметров практически не изменяются, однако характерна множественность вовлеченных в процесс ЛУ, визуализируемых в виде «четок».
Ультразвуковая картина острого лимфаденита характеризуется увеличением размеров, шарообразной формой, значительным понижением эхогенности (вплоть до анэхогенности), резкой болезненностью при надавливании датчиком [20, 113]. Нередко анэхогенное изображение ЛУ указывает на его гнойное расплавление, что подтверждается данными пункции. Если при этом капсула ЛУ остается сохранной, то формируется абсцесс, а в случае расплавления капсулы и выхода гноя в окружающие ткани развивается аденофлегмона. Развитие отека и инфильтрации окружающей ЛУ ткани определяется как «периаденит» [15].
На фоне адекватной противовоспалительной терапии происходит изменение внутренней структуры ЛУ. Уменьшаются его размеры, повышается общая эхогенность за счет уменьшения отека и клеточной инфильтрации. При завершении воспалительного процесса в ЛУ он либо перестает дифференцироваться на фоне окружающих тканей, либо его ультразвуковое изображение не отличается от строения здорового ЛУ [11].
8. Изменения лимфатических узлов при отдельных инфекциях.
При вирусных инфекциях у детей нередко наблюдается увеличение ЛУ шеи, поднижнечелюстных и околоушно-жевательных областей. Эти изменения имеют ряд специфических черт. Во-первых, при аденовирусных инфекциях поражаются ЛУ нескольких анатомических областей, что объясняется гематогенным распространением инфекции. Этим вирусные лимфадениты отличаются от бактериальных лимфаденитов, при которых инфицирование региональных ЛУ происходит лимфогенным путем через «входные ворота». Во-вторых, ЛУ нередко достигают больших размеров (до 2-2,5 см), и у одного пациента одновременно может быть выявлено несколько крупных узлов. В-третьих, при столь крупных размерах ЛУ обычно имеют среднюю степень снижения эхогенности, что скорее указывает на пролиферацию лимфоидной ткани в них, нежели на отек и воспалительную инфильтрацию.
Увеличение регионарных ЛУ можно считать ведущим клиническим признаком болезни кошачьих царапин. Лимфаденопатия возникает в ближайшем от царапины регионе, она бывает односторонней и асимметричной. В процесс могут вовлекаться несколько лимфоузлов, хотя ряд авторов чаще отмечали моноаденит. Однако у 10-20% больных может быть не только регионарная, но генерализованная лимфаденопатия, причем могут увеличиваться и мезентериальные, и паратрахеальные узлы. Последнее явление свидетельствует о прорыве инфекцией регионального иммунологического барьера. Размеры ЛУ варьируют от 1 до 5 и даже 10 см в диаметре [121]. Лимфаденопатия, как правило, персистирует – длится от 2 до 4 месяцев, а иногда от полугода до 2-х лет. Примерно у 1 из 10 больных может иметь место нагноение увеличенного ЛУ, иногда с прорывом гноя наружу. Паталогоанатомические изменения при болезни кошачьей царапины в ЛУ неспецифичны (гиперплазия ретикулярных клеток, редко – гигантские клетки, образование гранулем, множественные микро/макроабсцессы), специфическая серологическая диагностика окончательно не разработана, поэтому нередко возникает необходимость дифференциации с лимфогранулематозом, туляремией, бруцеллезом, туберкулезом, венерической гранулемой. Эхографически, по данным литературы, изменения также не являлись специфическими и характеризовались нечеткими внешними контурами ЛУ, значительно сниженной эхогенностью, наличием центральных гиперэхогенных участков с неровными контурами (эхогенных ворот) и/или центральных анэхогенных зон (участков некроза) [53, 115, 122].
Дистальное усиление эхосигнала достоверно связано с большими размерами узла или с его нагноением. Другие авторы с высокой достоверностью указывают на отсутствие изменений в окружающих тканях при фелинозе [122]. По данным Ц(Э)ДК, встречается разнообразное строение сосудистой сети, причем преобладающим признаком является высокая васкуляризация [115, 53].
Инфекционный мононуклеоз является одним из наиболее часто упоминающихся заболеваний в этиологии лимфаденопатий, особенно среди детей дошкольного и младшего школьного возраста. По данным литературы, ЛУ при инфекционном мононуклеозе имели следующие эхографические признаки – округлая форма (85%), широкий эхогенный центральный эхокомплекс, повторяющий внешние контуры узла, по данным ЦДК центрально-радиальное расположение сосудов хилуса (75%) [13,115].
9. Поражение лимфатических узлов злокачественными опухолями.
При лимфогенном метастазировании опухолевые клетки первичной опухоли с током лимфы достигают коры ЛУ, а затем области ворот ЛУ. В результате микротромботизации лимфатических сосудов опухолевый эмбол оседает в ЛУ и начинает расти [138]. Только эхография в состоянии выявить субклинический метастаз (очаг размером от 3 мм) [46]. В большинстве случаев метастатический процесс характеризуется, в первую очередь, вовлечением коры ЛУ с мультифокальным ее поражением [176]. Опухолевое замещение лимфоидной ткани приводит к округлению формы ЛУ и изменению соотношения поперечного и продольного диаметров [19, 44, 126, 138, 151, 163, 164, 89]. Вместе с этим отмечается неоднородность структуры ЛУ. На начальных этапах замещения собственной ткани ЛУ на опухолевую контуры его четкие, с тенденцией нарастания неровности по мере увеличения размеров метастаза [46]. При дальнейшем прогрессировании опухолевого процесса и выходе его за пределы капсулы ЛУ часто наблюдается объединение нескольких пораженных ЛУ в конгломерат. Экстракапсулярный рост метастаза в ЛУ часто приводит к вовлечению в опухолевый процесс окружающих тканей [66]. При вовлечении в опухолевый процесс сосудов выявляется их смещение или сдавливание, а также снижение четкости границ сосуда при инфильтрации или обрастании его опухолевым конгломератом [31]. Чем меньше остается нормальных элементов ЛУ, а значит, чем больше опухолевой ткани, тем однороднее структура образования и ниже его эхогенность [46]. Чем разнороднее внутренняя структура метастаза, тем больше отражающих поверхностей, тем богаче и неоднороднее эхоструктура ЛУ. Для некоторых гистологических форм опухолей характерно повышение общей эхогенности пораженного ЛУ при метастазах больших размеров [80].
Согласно данным литературы [118, 7, 8, 19], три гистологические формы – метастазы плоскоклеточного рака, меланомы и железистого рака щитовидной железы – при ультразвуковом исследовании отличаются друг от друга с высокой степенью достоверности – 91,4%. При метастазах плоскоклеточного рака в ЛУ чаще встречается кистозно-солидный тип строения (67,7%), неоднородная внутренняя структура (80%) [151]. При метастазах железистого рака чаще наблюдается «солидный» тип строения (68%), однородная внутренняя структура (77%), эхогенность от средней до повышенной (77%). При раке щитовидной железы отмечается идентичность строения метастаза эхоструктуре опухоли тиреоидной ткани [20, 151]. Для метастазов меланомы характерен кистозно-солидный тип строения (60%) и кистозный (40%), неоднородная внутренняя структура (56%), практически анэхогенное изображение внутренней структуры (62%) [11, 73, 138].
Злокачественные лимфомы являются наиболее частым опухолевым поражением ЛУ у больных в возрасте от 20 до 40 лет. По данным литературы, окончательный дифференциальный диагноз между лимфомой и лимфаденитом часто невозможен на основе УЗИ в В-режиме и в режиме ЦДК. Поэтому клиническая оценка и биопсия обязательны в большинстве случаев. [74, 75, 59, 140]. Тем не менее, многими авторами отмечены эхографические признаки; 1) округлая форма, т.е. соотношение длинного диаметра к короткому менее 2,0 (78%), 2) отсутствие или сужение хилуса (100%), 3) выявление множественных ЛУ, 4) тенденция к слиянию, 5) неровный контур, 6) наличие гипоэхогенных масс с гетерогенными внутренними эхосигналами, 7) повышенная перфузия как в центре, так и по периферии [1, 135], 8) редко встречающиеся периферические подкапсульные сосуды (возможно, за исключением редких подтипов с высокой степенью злокачественности) [32, 74, 115, 142].
Подводя итог данному обзору, можно сделать вывод, что технический прогресс существенно расширил возможности неинвазивной ультразвуковой диагностики патологии ЛУ. Однако четко ее место в диагностическом комплексе пока не определено, что особенно видно в литературе, посвященной педиатрической практике [115]. В доступной литературе нет достаточной информации о сравнительной эффективности различных методик эхографии в условиях применения современной аппаратуры. Мало изучены возможности эхографии в оценке эффективности противоопухолевой терапии. Таким образом, эхографическая диагностика лимфаденопатий полна противоречий, не вполне понятно место и значимость допплеровских методик эхографии в дифференциальной диагностике. Все это послужило основанием для планирования данного исследования.