коитархе что это такое
Как собирается гинекологический анамнез, основные составляющие и план опроса
Содержание
Гинекологический анамнез является совокупностью данных, включающей в себя широкий круг факторов, которые соотносятся с состояние репродуктивной и половой системы женского организма. Особое внимание требуется уделять характеру половой, менструальной, репродуктивной и секреторной функциям, также перенесенным в прошлом заболеваниям и различным хирургическим вмешательствам.
Проведение опроса
Во время проведения опроса пациентки необходимо организовывать его в соответствии со следующей схемой:
После завершения сбора информации для составления гинекологического анамнеза врач дает оценку общему состоянию пациентки — измеряется её артериальное давление и определяется частота пульса, затем организуется осмотр всего тела, прослушиваются легкие и сердце и т.д. Затем врач переходит к двуручному обследованию и по показаниям используются другие диагностические методы.
При возникновении срочной необходимости хирургического вмешательства при острых состояниях специалист зачастую лишается возможности провести дополнительное исследование, а также не может наблюдать полноценную картину заболевания в динамике. Большое внимание уделяется возрасту пациентки.
Роль менструального цикла в анамнезе
Основное и первичное звено при сборе гинекологического анамнеза — это оценка функции менструации, которое впоследствии играет важную роль для диагностики заболевания.
При проведении оценки менструальной функции основным становится рассмотрение следующих моментов:
Время начала менструации говорит о степени развития половой системы у девушки — проходит ли этот процесс нормально или с отклонениями. К примеру, появление первых месячных в возрасте после 16 лет и сопутствующие болевые ощущения свидетельствуют об инфантилизме половой системы. На это указывает и время, которое ушло на установлении менструации — более полугода. Одновременно необходимо учитывать наследственные факторы.
Протекание менструального цикла и менструаций дают возможность специалисту сделать вывод о возможности наличия болезней у пациентки. Как пример гинекологического анамнеза, если у больной наблюдаются обильные и длительные кровотечения, то это может говорить о развитии воспалений матки или нарушении работы яичников, неправильном положении матки и других патологиях, которые соотносятся с застоем крови в малом тазу. Что касается негинекологических проблем, врач может заподозрить инфекционные патологии, нарушения кровотока или гиповитаминоз.
Появление кровотечения между менструациями могут говорить о признаках развития опухоли, полипов в матке или яичниках или же о результате нарушения гормонального баланса в женском организме.
Отсутствие менструации у женщины репродуктивного возраста увеличивает подозрения врача на наличие поликистоза яичников, нейроэндокринных отклонений и интоксикаций в организме.
Иногда боль при менструации считается последствием инфантилизма половой системы, неправильного расположения матки или воспаления половых органов. Отягощенный гинекологический анамнез требует проведения более тщательного обследования пациентки.
В связи с перечисленными отклонениями, можно сделать вывод, что очень важно при посещении врача рассказать ему, как можно больше информации о цикле менструации. Комплексный подход к лечению патологии помогает диагностировать возможные отклонения на ранних этапах их развития и сделать лечебный процесс максимально эффективным.
Основные составляющие анамнеза
Специальный гинекологический анамнез является широким понятием и представляет собой не только информацию о менструальном цикле. Врач при этом должен установить особенности половой жизни женщины, а именно — полноценность полового влечения, потому что его уменьшение или полное отсутствие в репродуктивном возрасте может свидетельствовать об анатомических сбоях строения органов половой системы и о некоторых сложных гинекологических заболеваниях.
Специалист должен уточнить у женщины, не бывает ли нарушений в процессе полового акта, не вызывает ли он болевых ощущений. Также гинеколог уделяет внимание вопросам контрацепции, используемой пациенткой. К примеру, внутриматочные контрацептивы могут провоцировать боль при менструациях, обильные кровотечения и т.п.
Информация о ранее перенесенных гинекологических и венерологических патология, получаемая в процессе сбора данных анамнеза, помогает врачу выяснить главную причину жалоб. Осложненный гинекологический анамнез возникает и тогда, когда не долеченные в прошлом заболевания проявляются через определенное время.
Если врач владеет информацией о проблемах пациентки в прошлом, то его не затруднит выявить это и за короткие сроки разработать подходящее лечение. При этом пациентке необходимо строго придерживаться всех рекомендаций и периодически посещать специалиста для проведения контрольного обследования.
Тактика ведения пациенток с цервикальными интраэпителиальными неоплазиями и необходимость применения противовирусной терапии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В статье приведена тактика ведения пациенток с цервикальными интраэпителиальными неоплазиями и рассмотрена необходимость применения противовирусной терапии
Каждые 2 мин в мире одна женщина умирает от рака шейки матки (РШМ), в среднем в год погибают 275 тыс. женщин (данные GLOBOCAN, 2008). РШМ занимает 2-е место среди злокачественных опухолей женских репродуктивных органов, уступая лишь раку молочной железы, 1-е место по сокращению лет жизни женщины и 4–е место в структуре онкологической заболеваемости женского населения в мире. Ежегодно РШМ диагностируется у 530 тыс. женщин.
В России РШМ занимает 2-е место по распространенности среди злокачественных новообразований у женщин до 45 лет и 1-е – по количеству потерянных лет жизни. Важно отметить, что в последние годы в Российской Федерации обозначился рост заболеваемости РШМ у женщин в возрастной группе до 29 лет. За последние 12 лет в Московской области (МО) наблюдается рост заболеваемости РШМ с 7,9 до 21,1 на 100 тыс. женского населения. В 2014 г. в МО было выявлено 799 случаев РШМ. Стоит отметить, что 12,3% заболевших женщин умерли от РШМ на 1-м году наблюдения. Смертность от РШМ в МО, к сожалению, также выросла, в 2007 г. она составила 4,7 на 100 тыс. женщин, а в 2014 г. – уже 7,3.
К заболеваниям шейки матки, предшествующим инвазивному РШМ, относят дисплазии эпителия или цервикальные интраэпителиальные неоплазии (CIN). Они характеризуются нарушением дифференцировки клеток эпителия в результате пролиферации камбиальных элементов с развитием их атипии, утратой полярности и нарушением гистоструктуры [1–3].
По определению ВОЗ, «дисплазия – это изменение, при котором часть толщи эпителия замещена клетками с различной степенью атипии, утратой стратификации и полярности без изменения стромы».
Распространенность в мире CIN I степени, по данным ВОЗ, составляет 30 млн случаев, а CIN II–III степени – 10 млн [4, 5]. Наиболее часто диагностируют CIN II степени, частота перехода CIN в карциному in situ (CIS) варьирует от 40 до 64%.
В 2008 г. Г. Цур Хаузену из Немецкого центра исследования рака в Гейдельберге Нобелевский комитет присудил премию по физиологии и медицине за открытие вирусов папилломы человека (ВПЧ), вызывающих РШМ [6–9]. Однако впервые теорию о роли вирусов в появлении опухолевого роста изложил российский ученый Л.А. Зильбер в 1935 г. [5, 10].
Папилломавирусная инфекция
Папилломавирусная инфекция (ПВИ) является одной из самых распространенных и социально значимых инфекций, передающихся половым путем, способной вызывать: рак аногенитальной области, такие его виды, как плоскоклеточный РШМ, аденокарцинома шейки матки, рак вульвы и влагалища, полового члена и ануса; рак головы и шеи, аногенитальные кондиломы, а также рецидивирующий респираторный папилломатоз гортани.
Каждый год выявляемость и заболеваемость ПВИ во всем мире увеличиваются и, по данным ВОЗ, составляют около 2,5–3,0 млн случаев. Более 660 млн людей на планете инфицированы ВПЧ [3].
Известно около 200 типов ВПЧ. Современная медицина описывает более 70 разновидностей ВПЧ, вызывающих различные заболевания кожи или слизистых оболочек у человека. В зависимости от степени онкогенного риска ВПЧ делятся на группы:
– низкого онкогенного риска (6, 11, 42, 43, 44 и др.);
– высокого онкогенного риска (16, 18, 31, 33, 35, 39, 45, 48, 51, 52, 58, 56, 59, 68).
Среди всех случаев РШМ 70–80% составляет плоскоклеточный рак, а 10–25% – аденокарцинома. Наиболее распространенные генотипы ВПЧ в этиологии РШМ – 16, 18, 45, 31 и 33.
Аденокарцинома происходит из железистого эпителия эндоцервикса [11, 12], диагностируется у 30% женщин моложе 35 лет и характеризуется сложностью диагностики и большим риском раннего метастазирования [13, 14]. Исследования Международной ассоциации по биологическому изучению РШМ (IBSCC) показали, что ВПЧ, преимущественно 16-го и 18-го типов, содержится в 97% образцов РШМ.
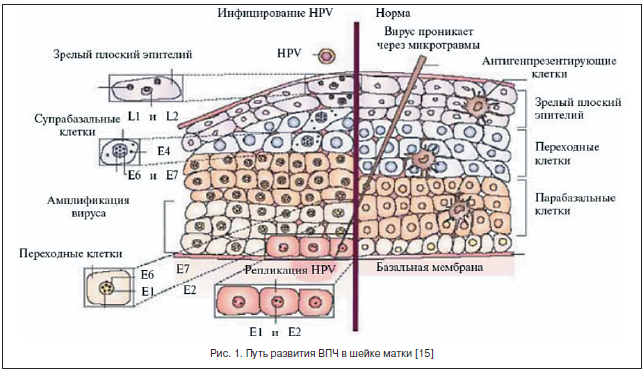
ВПЧ относится к подгруппе А семейства Papoviridae, поражающей человека, крупный рогатый скот и птиц. Мелкий ДНК-содержащий вирус, особенностью которого является пролиферативное влияние на эпителиоциты кожи, слизистых оболочек гениталий и других органов (гортань, бронхи, ротовая полость, глаза), не имеет внешней оболочки. Геном вируса представлен двуспиральной кольцевидно скрученной ДНК. В процессе репликационного цикла он экспрессирует от 8 до 10 белковых продуктов. Ранние белки контролируют репликацию, транскрипцию и клеточную трансформацию, в частности, за онкогенные свойства вируса ответственны онкобелки Е-6 и Е-7. Путь развития ВПЧ в шейке матки показан на рисунке 1 [15].
Поздние гены кодируют структурные белки вириона. Гены Е-6 и Е-7 всегда выявляются в опухолевых клетках, зараженных ВПЧ, в то время как другие фрагменты вирусного генома могут быть утеряны в процессе его длительной персистенции в организме.
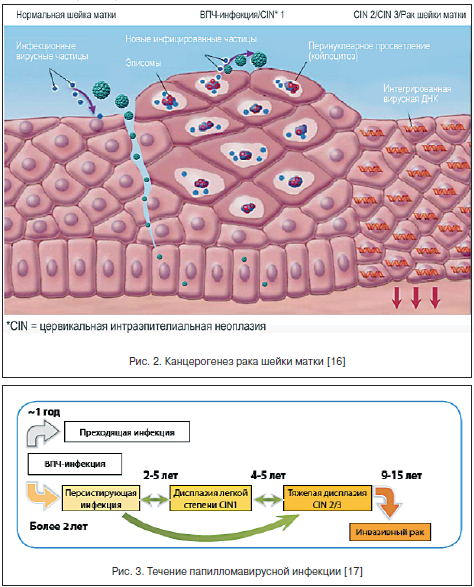
ВПЧ инфицирует пролиферирующие эпителиальные клетки базального слоя эпителия и отличается высоким тропизмом именно к этому типу клеток. Инфицирование многослойного плоского эпителия происходит через микроповреждения (механические, бактериальные и др.), когда глубина их достигает базального слоя, где и обнаруживается эписомальный вирусный геном (рис. 2). При этом репликация ДНК ВПЧ происходит только в клетках базального слоя, эти клетки являются постоянным источником инфицирования эпителиальных клеток, а в клетках других слоев вирусные частицы лишь персистируют.
Папилломатозные разрастания формируются в роговом слое в локусах максимальной репродукции вируса (рис. 3). В зараженных клетках вирусный геном может существовать в 2-х формах: эписомальной (вне хромосом) и интегрированной в клеточный геном [16, 17].
Репликация ДНК вируса и синтез связанных с ней капсидных белков изменяют клеточный цикл и приводят к клеточной атипии, что занимает от 1 до 3-х лет.
Пока вирус находится в эписомальном состоянии, наблюдаются доброкачественные процессы. После инфицирования ВПЧ в эпителиальных клетках нарушается нормальный процесс дифференцировки, особенно в клетках шиповатого слоя, в котором наблюдается клональная экспансия инфицированных ВПЧ-клеток базального слоя, прошедших только первичную стадию дифференцировки. Эта клональная экспансия связана с их трансформацией и последующей малигнизацией. В стадии развитой инфекции наблюдается синтез вирусной ДНК в клетках шиповатого слоя при переходе в зернистый слой. Причем экспрессия поздних генов L1 и L2 на этом этапе отсутствует. Она наступает только на конечной стадии дифференцировки, где и наблюдаются активная сборка зрелых вирусных частиц, их выделение из клеток и почкование прямо на поверхности при формировании кондилом. Именно эти участки инфекционно опасны в отношении контактного заражения.
Однако многие авторы приходят к выводу, что инфицирование эпителиальных клеток ВПЧ – необходимое, но недостаточное событие для ракового перерождения. Для формирования необратимой неоплазии дополнительно необходимы:
– активная экспрессия генов Е-6 и Е-7 вируса;
– индукция метаболических механизмов конверсии эстрадиола в 16,2-гидроксистерон (16,2-ОН);
– индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Крайне неблагоприятна сочетанная персистенция ВПЧ с вирусом простого герпеса 2-го типа, цитомегаловирусом, вирусом Эпштейна – Барр, вирусом иммунодефицита человека, хламидиями и микоплазмами.
Развитие РШМ – не молниеносный процесс, он занимает 10–15 лет. Из всех факторов риска РШМ огромное значение имеет возраст сексуального дебюта. По данным D.R. Brown et al. (2005) [18], раннее начало половой жизни в сочетании с ВПЧ-инфекцией увеличивает риск РШМ в 22 раза. По результатам исследований F.X. Bosh et al. (2006) [19], 13% женщин с РШМ начали половую жизнь ранее 14 лет против 3,5% женщин с РШМ, имевших коитархе в возрасте 20 лет.
Несмотря на то что лица 15–19 лет составляют лишь 25% сексуально активного населения, более 50% сексуально-трансмиссивных заболеваний, в т. ч. ВПЧ, возникают именно в этой возрастной группе. ВПЧ-инфекция чаще встречается среди лиц 15–19 лет с кумулятивной частотой заболевания 17% в течение 1 года и 35,7% – в течение 3-х лет с момента коитархе.
По результатам нескольких современных эпидемиологических исследований изучена распространенность ВПЧ-инфекции в подростковой популяции. У лиц в возрастной группе от 13 до 21 года частота инфицирования равна 38,2%, причем пациентки 13–18 лет приблизительно в 2 раза чаще инфицированы ВПЧ, чем в возрасте 19–21 года [20].
Пути передачи и инфицирования ВПЧ
1. Половой путь. Инфицирование ВПЧ происходит при генитально- генитальном половом акте, мануально-генитальном и орально-генитальном контактах.
2. Вертикальный путь. Доказаны повышенная чувствительность эпителия шейки матки к ВПЧ в период беременности, а также возможность внутриутробного инфицирования плода и новорожденного.
3. Бытовой путь. Возможна передача вируса через нижнее белье, хирургические перчатки, хирургический инструментарий для биопсии и другие предметы, обсемененные ВПЧ. Медперсонал может инфицироваться ВПЧ во время лазерной деструкции генитальных бородавок, вдыхая образующийся дым.
Инкубационный период составляет 1–6 мес., максимальное содержание вируса в пораженных тканях обнаруживается на 6-й мес.
Частота передачи ВПЧ от матери к плоду, по данным разных исследователей, различается весьма существенно – от 4 до 87%. При этом ВПЧ в течение многих лет может персистировать в клетках слизистой оболочки рта ребенка и являться причиной участившегося в последнее время рецидивирующего респираторного папилломатоза гортани.
Течение ПВИ
Большинство случаев выявления ПВИ и характерные изменения, наблюдаемые при цитологическом исследовании, нередко разрешаются самостоятельно в течение 1 года (преходящая, или латентная, инфекция), не оставляя повреждений и присутствия ПВИ [16, 21–23].
При наличии ВПЧ в организме более 2-х лет развивается персистирующая инфекция, которая приводит к развитию CIN [24].
По мнению L.G. Koss (1987), патология шейки матки подобна айсбергу: лишь незначительная часть процессов находится на поверхности и может быть замечена глазом [25, 26]. Рутинный осмотр шейки матки в зеркалах далеко не всегда позволяет выявить наличие патологии. Принципы диагностики давно изучены и не представляют сложностей. Основными методами обследования являются цитологический метод (РАР-тест), расширенная кольпоскопия, проведение ВПЧ-тестирования (качественного и количественного), гистологическое исследование биоптата шейки матки и выскабливание цервикального канала шейки матки. Обследование на урогенитальную инфекцию (УГИ): микроскопия мазка, посев на условно-патогенную флору, ПЦР-диагностика ИППП также включены в перечень необходимых исследований при патологии шейки матки.
Тактика ведения пациенток с CIN
Терапия должна быть комплексной, поэтапной и предусматривать возможность возникновения частых и агрессивных по течению рецидивов ПВИ после проведения деструктивного лечения. Устойчивый и упорный характер ПВИ заставляет специалистов продолжать поиски более эффективных схем и комбинаций средств лечения.
Системная терапия сочетанных форм инфекции должна включать в себя лечение УГИ комбинированными противомикробными препаратами широкого спектра действия, дополняться препаратами местного действия для санации влагалища в виде свечей, гелей или кремов. С целью уменьшения рецидивов нарушения микробного биоценоза пациенткам обязательно назначаются эубиотики для восстановления микробиоценоза влагалища.
С учетом высокой инфицированности женщин патогенными вирусами препараты противовирусного действия необходимо включать в комплексную терапию воспалительных заболеваний малого таза [27–29].
В зависимости от клинической картины при выявлении вирусных агентов применяют противовирусные и иммуномодулирующие препараты, эффективность которых при лечении больных с хроническими инфекционными процессами является доказанной [20, 30, 31].
Одним из современных препаратов, обладающих комбинированным механизмом действия и не требующих обязательного проведения иммунологических исследований, является применяемый онкологами при ведении пациенток с CIN 3 и микроинвазивным РШМ синтетический аналог инозина – Inosine Pranobex (Изопринозин).
Inosine Pranobex (Изопринозин) оказывает двойное действие – иммуномодулирующее и противовирусное, состоит из 2-х компонентов: активного компонента – инозина, метаболита пурина (1,9-дигидро-9-в-D-рибофуранозило-6Н-пурин-6-OH) и вспомогательного компонента, повышающего доступность инозина для лимфоцитов (соли 4-ацетамидобензойной кислоты с N,N–диметиламино-2-пропанолом). Препарат подавляет репликацию ДНК и РНК ВПЧ посредством связывания с рибосомой клетки и изменения ее стереохимического строения и способствует восстановлению клеточного звена иммунитета. Inosine Pranobex (Изопринозин) включен в европейские стандарты лечения больных с ПВИ и считается иммуномодулятором универсального стимулирующего типа с преобладанием тимомиметических эффектов, активирует пролиферацию Т-лимфоцитов, Т-хелперов, естественных клеток (NK)-киллеров, уравновешивает баланс клеточного и гуморального звеньев в иммунной системе [27, 29, 32].
Рекомендуемая доза препарата взрослым составляет 50 мг/кг/сут, разделенные на 3–4 приема. При ПВИ взрослым препарат назначают по 2 таблетки 3 р./сут в 3–4 приема в течение 14–28 дней в виде монотерапии. При CIN, ассоциированной с ВПЧ, назначают по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней [30, 33].
Ряд авторов сообщают об эффективности комбинированного лечения ВПЧ-ассоциированных заболеваний. На первом этапе лечения больные по поводу CIN и по показаниям подвергались деструктивным методам лечения (электрокоагуляция, криодеструкция, лазеровапоризация, электроконизация). На втором этапе проводилось противовирусное лечение, т. к. персистенция вируса является ключевым фактором возникновения рецидива заболевания [28, 30]. Было отмечено, что применение Inosine Pranobex (Изопринозин) до операции (1000 мг 3 р./сут в течение 10 дней) сопровождается значительным снижением вирусной нагрузки ВПЧ 16-го и 18-го типов, определяемых при ПЦР-диагностике [28, 33].
В 2008 г. была разработана и внедрена программа «АСТРА» – общероссийская многоцентровая программа мониторинга, обобщения и формирования статистической отчетности об особенностях и результатах применения Изопринозина при лечении заболеваний, ассоциированных с ВПЧ, в условиях обычной медицинской практики. В исследование был включен 6191 пациент (5896 женщин и 295 мужчин). Комбинированное лечение CIN I оказалось эффективно у 90% пациенток, комбинированное лечение CIN II – в 82% случаев, при лечении субклинической формы ВПЧ эффективность достигала 91% [34].
Для лечения CIN используют методы аблации и методы эксцизии. Аблация (син.: деструкция, коагуляция), при которой CIN разрушается, включает электро-, лазерную и криоаблацию. Недостатком аблации является невозможность гистологического исследования ткани, поэтому перед лечением требуются тщательное кольпоскопическое исследование и биопсия для исключения инвазивного заболевания [5].
Эксцизионные методы, которые обеспечивают образец ткани для гистологического исследования, включают конизацию скальпелем, лазерную конизацию и петлевую электрохирургическую эксцизионную процедуру (LEEP или LLETZ).
Наиболее приемлемым методом, с позиции акушеров-гинекологов, является радиоволновой метод, при котором весь удаленный материал доступен гистологическому исследованию. Это принципиально отличает его от лазерной и криодеструкции, где материала нет, и от электроножевого лечения, при которым происходит обугливание тканей. Удаление патологических участков вульвы, влагалища и шейки матки проводится под местным обезболиванием радиохирургическим методом (Surgitron) с использованием радиопетли в режиме «разрез и коагуляция» (мощностью 2–4 ед.). Применение высокочастотных волн (3,8 МГц) обеспечивает бесконтактный разрез ткани и позволяет проводить биопсию, эксцизию шейки матки бескровно, безболезненно, без травматизации окружающих тканей и получить полноценный материал для гистологического исследования [5, 35].
При выполнении эксцизии следует удалять зону трансформации (ЗТ) единым блоком, т. к. удаление несколькими фрагментами может затруднить ее гистопатологическую оценку, а в случае микроинвазивного заболевания – сделать невозможным определение точной глубины инвазии или полноты эксцизии во фрагментированных эксцизионных образцах. Эксцизию следует с осторожностью применять у молодых женщин, поскольку данные анализа свидетельствуют, что эта процедура является фактором риска преждевременных родов.
Выбор метода лечения в каждом отдельном случае зависит от многих факторов: тяжести поражения, типа ЗТ, возраста, планирования беременности, анамнеза, оснащенности клиники и опыта врача.
а
Принципы лечения CIN
Лечить всю ЗТ на глубину не менее 7 мм (при экзоцервикальных поражениях). При наличии ЗТ III типа, если ЗТ полностью не визуализируется, присутствуют признаки железистого поражения или инвазии, имеется расхождение результатов цитологии и биопсии, аблация противопоказана! В этом случае необходима конусовидная эксцизия.
В России лечение CIN III и cаncer in situ входит в функции онкогинеколога.
Тактика ведения женщин с CIN I в биоптате
CIN I характеризуется высоким уровнем спонтанной регрессии и низким уровнем прогрессии этих поражений. Алгоритм ведения пациенток с CIN I четко не определен. Ведение пациенток с CIN I требует активного наблюдения с использованием цитологического исследования и кольпоскопии, однако хирургическое лечение, как правило, можно не проводить в течение 1,5–2 лет ввиду возможной спонтанной регрессии у молодых женщин [36].
Существуют два тактических варианта, выбор одного из них основан на предпочтениях пациентки и врача:
1. Наблюдение CIN I с цитологическим контролем через 6 и 12 мес. или ВПЧ-тестированием через 12 мес. После 2-х последовательных отрицательных цитологических результатов или негативного ВПЧ-теста пациентка подлежит рутинному скринингу, в случае повторного результата цитологического исследования, соответствующего >ASC-US, или положительного ВПЧ-теста – направлению на кольпоскопию.
Проводятся лечение УГИ, бактериального вагиноза, обязательное восстановление микробиоценоза влагалища. Назначается Изопринозин по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней.
Лечение CIN I проводится с использованием методов аблации или эксцизии. Оба метода приемлемы при удовлетворительной кольпоскопии (ЗТ I или II типа).
2. В случае неудовлетворительной кольпоскопии (ЗТ III типа), при наличии поражения в эндоцервикальном образце и у женщин с рецидивом CIN рекомендуется диагностическая эксцизия.
Активное ведение пациенток с CIN I с применением аблации или эксцизии рекомендовано при:
– неудовлетворительных результатах кольпоскопии;
– обширном поражении;
– персистенции CIN I > 18 мес.;
– возрасте пациентки > 35 лет;
– нежелании женщины посещать врача регулярно.
Тактика ведения женщин с CIN II–III в биоптате
Поражения эпителия тяжелой степени (HSIL) сопровождаются значительным риском трансформации в РШМ, поэтому требуют активного лечения.
CIN II–III считаются предраковыми поражениями, они чаще персистируют и прогрессируют, чем регрессируют, и поэтому должны подвергаться лечению (исключение составляют CIN II–III у беременных и CIN II у юных женщин).
Предпочтение, безусловно, следует отдавать эксцизионным методам лечения (петлевая эксцизия или конизация), а не деструктивным, поскольку конизация позволяет, как уже упоминалось, получить биоматериал, пригодный для гистологического исследования, что гарантирует врачу объективные данные о стадии патологического процесса [37].
Эксцизия необходима при:
– большой площади поражения;
– несовпадении цитологического и кольпоскопического заключений;
– рецидиве заболевания;
– неудовлетворительной кольпоскопии (ЗТ III типа, когда поражение локализуется внутри цервикального канала и недоступно визуализации при кольпоскопии); лечение пациенток с CIN III проводят онкогинекологи.
Особенности тактики ведения CIN у девочек-подростков и юных женщин
У юных женщин с CIN I предпочтительна тактика наблюдения, только при наличии CIN III – лечение. Девочки-подростки и юные женщины с CIN I наблюдаются в течение 2-х лет с повторными цитологическими исследованиями через 12 и 24 мес. Кольпоскопическое исследование необходимо, если в мазке через 12 мес. >HSIL или через 24 мес. >ASC-US (атипичные изменения клеток плоского эпителия неясного значения).
Особенности ведения пациенток с CIN в постменопаузе
Наибольший уровень заболеваемости РШМ наблюдается у женщин старше 45 лет. В то же время диагностика заболевания шейки матки в постменопаузе может быть затруднена. Эстрогенная недостаточность приводит к развитию атрофии слизистой цервикса и втягиванию зоны стыка эпителия в эндоцервикс. До наступления менопаузы только 8% CIN находятся эндоцервикально, после менопаузы 48% CIN располагаются в цервикальном канале. Поэтому при кольпоскопическом выявлении ЗТ III и наличии аномального цитологического мазка необходимо проведение кюретажа эндоцервикса (тестирование на ВПЧ) и конизации шейки матки. При подозрении на поражение низкой степени CIN I необходимо проведение санации и гормонального лечения до повторного исследования. При получении аномального мазка высокой степени проводятся санация и кюретаж эндоцервикса, конизация. Рекомендуется применение Изопринозина по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней или без перерыва курсом 30 дней.
Использование эстрогенной терапии – наиболее простой способ улучшить эффективность кольпоскопии. Эстрогены способствуют вывороту эндоцервикальной слизистой оболочки, расширению цервикального канала с образованием слизи, которая благодаря своей прозрачности улучшает визуализацию эндоцервикса. Маленькие дозы эстрогенов достаточны для коррекции атрофии, исчезновения небольших атипий CIN I–II, связанных с атрофией. Предварительная санация влагалища и местная гормональная терапия в течение 15 дней улучшают условия обследования женщин в постменопаузе и облегчают интерпретацию проведенного цитологического исследования мазков и кольпоскопического исследования.
Наблюдение после лечения CIN
Уровень остаточных поражений и рецидивов после лечения CIN составляет 5–15%, большинство из них обнаруживают в течение первых 2-х послеоперационных лет.
В период наблюдения после лечения используют те же методы, что и для диагностики перед лечением: цитологию, кольпоскопию и ВПЧ-тестирование. Чувствительность ВПЧ-теста в идентификации остаточных или рецидивных CIN II–III и прогностическая ценность его негативного результата превосходят аналогичные показатели цитологического исследования.
Отрицательный ВПЧ-тест через 6 мес. после лечения CIN II–III или 3 последовательных негативных цитологических результата, полученных с 6-месячным интервалом, позволяют перевести пациентку на ежегодное цитологическое исследование. При положительном ВПЧ-тесте или цитологии >ASC-US необходимо кольпоскопическое исследование.
Если CIN II–III присутствует в краях иссеченного конуса или в материале, полученном из оставшейся части канала сразу после эксцизии, необходимо цитологическое исследование с получением эндоцервикального образца через 4–6 мес., для женщин старшего возраста предпочтительна повторная процедура эксцизии. У женщин с гистологически верифицированной остаточной или рецидивной CIN II–III допустимы повторная процедура эксцизии или гистерэктомия.
Профилактика – вакцинация
Международная организация по исследованиям в области рака (IARC) определила, что ПВИ – вакциноуправляемая инфекция, а предотвращение заражения и персистенции ВПЧ однозначно можно считать профилактикой РШМ [6, 18, 20, 37, 38].
В настоящее время в мире и, в частности, в России зарегистрировано 2 вакцины против ВПЧ: бивалентная и квадривалентная.
Профилактическая вакцина зарегистрирована в 117 странах мира. Национальные программы ВПЧ-вакцинации рекомендованы в 60 странах, причем в 6 странах рекомендуется и вакцинация мальчиков.
Обе вакцины в установленном порядке зарегистрированы Министерством здравоохранения РФ, в 2007 г. в России вакцинация против РШМ одобрена правительством страны. ВОЗ рекомендует проведение массовой вакцинации от ВПЧ для первичной профилактики ВПЧ- ассоциированных раков.