ксенон 129 что такое
Изотопы ксенона
В природе встречаются девять изотопов ксенона. Из них стабильными являются семь: 126Xe (ксенон-126), 128Xe (ксенон-128), 129Xe (ксенон-129), 130Xe (ксенон-130), 131Xe (ксенон-131), 132Xe (ксенон-132), 134Xe (ксенон-134). Еще два изотопа — 124Xe (ксенон-124) и 136Xe (ксенон-136) — имеют огромные периоды полураспада, много больше возраста Вселенной,1,8×1022 лет и 2,165×1021 лет соответственно.
Остальные изотопы — их 41 с массовыми числами от 108 до 147 (количество протонов 54, нейтронов от 54 до 93) — искусственные. Из них самые долгоживущие — 127Xe (ксенон-127) с периодом полураспада 36,345 суток и 133Xe (ксенон-133) с периодом полураспада 5,2475 суток). Период полураспада остальных изотопов не превышает 20 часов.
124Xe
126Xe
128Xe
129Xe
130Xe
131Xe
132Xe
134Xe
136Xe
Основные сферы использования: научные исследования, астрономия, масс-спектрометрия, медицина, лазерная техника, метрология, металлургия.
По данным открытых источников
124Xe
— изготовление стандартов изотопного состава;
— получение радиоизотопа 125I (йод-125) для использования в медицине (терапия рака простаты) и изготовления источников излучения;
— получение радиоизотопа 123I (йод-123) для использования в медицине (диагностика);
— стабилизация частот оптических квантовых генераторов (лазеров) в лазерной спектрометрии
126Xe
— химико-физические исследования;
— получение радиоактивного изотопа 128Ba (барий-128)
128Xe
129Xe
— создание эталонов изотопного состава;
— стабилизация частот оптических квантовых генераторов (лазеров) в лазерной спектрометрии
— проведение спектроскопических исследований;
— проведение калибровочных измерений;
— отработка методик масс-спектрометрических измерений применительно к задачам исследования состава атмосфер планет;
— изготовление полиядерных фильтров;
— применение в ЯМР томографии и визуализации органов человеческого организма;
— используется в методах изотопного разбавления
— получение 129Xe (ксенон-129) для магнитно-резонансной томографии (МРТ-диагностика заболеваний легких)
130Xe
131Xe
— спектроскопические исследования физики мощных газовых лазеров
132Xe
— спектроскопические исследования физики мощных газовых лазеров;
— получение радиоизотопа 133Xe (ксенон-133), применяемого в медицине для диагностических целей (изучение легочной вентиляции, изучение особенностей кровотока, миелография). Ксенон-133 не усваивается организмом и быстро выводится из крови через легкие
134Xe
136Xe
— изготовление стандартов изотопного состава;
— выполнение спектроскопических исследований;
— проведение исследовательских работ в области лазерной техники;
— продувка оборудования при определении состава атмосферы Венеры с высокой точностью;
— датчик для поиска безнейтринного двойного бета-распада
— исследование низкотемпературной плазмы;
— исследование систем оптической накачки предусилителя слабых сигналов инфракрасного изображения, а также кинетики процессов в лазерных средах
По вопросам приобретения обращаться к специалистам отдела продаж:
Варлакова Мария Владимировна
Тел. +7 (39169) 9-49-11
Добровольский Алексей Владимирович
Тел. +7 (39169) 9-49-03
Рябченко Оксана Сергеевна
Тел. +7 (39169) 9-31-73
Ксенон
(молярная масса)
(первый электрон)
0,005894 (при 0 °C) г/см³
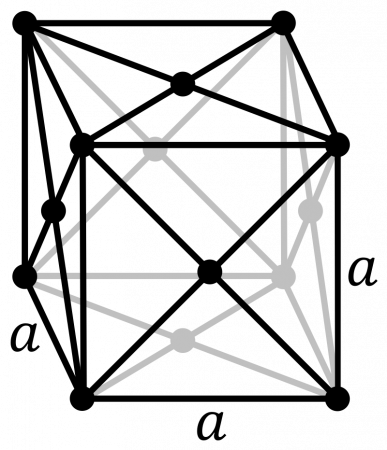
гранецентрированая
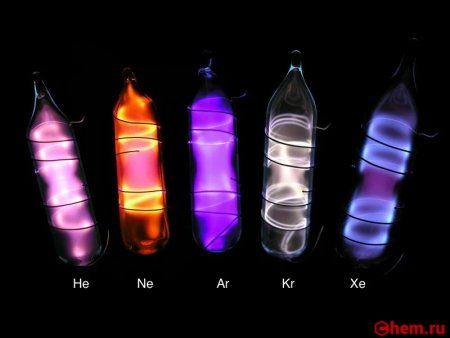
Ксенон — элемент 18-й группы (по устаревшей классификации — элемент главной подгруппы VIII группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 54. Обозначается символом Xe (лат. Xenon ). Простое вещество ксенон — благородный одноатомный газ без цвета, вкуса и запаха.
Содержание
История
Открыт в 1898 году британскими учёными Уильямом Рамзаем и Морисом Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Ксенон был обнаружен как небольшая примесь к криптону. За открытие инертных газов (в частности ксенона) и определение их места в периодической таблице Менделеева Рамзай получил в 1904 году Нобелевскую премию по химии.
Происхождение названия
Распространённость
Ксенон — весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086—0,087 см 3 ксенона.
В Солнечной системе
Земная кора
Ксенон содержится в земной атмосфере в крайне незначительных количествах, 0,087 ± 0,001 миллионной доли по объёму (мкл/л), или 1 часть на 11,5 млн. Он также встречается в газах, выделяемых водами некоторых минеральных источников. Некоторые радиоактивные изотопы ксенона, например 133 Xe и 135 Xe, получаются в результате нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии с длиной волны 467,13 нм и 462,43 нм ). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Свойства
Физические свойства
В электрическом разряде светится синим цветом (462 и 467 нм). Жидкий ксенон является сцинтиллятором.
Слабо растворим в воде (0,242 л/кг при 0 °C, 0,097 л/кг при 25 °C).
Химические свойства
Ксенон стал первым инертным газом, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 году. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
Изотопы
Известны изотопы ксенона с массовыми числами от 108 до 147 (количество протонов 54, нейтронов от 54 до 93), и 12 ядерных изомеров.
9 изотопов встречаются в природе. Из них стабильными являются семь: 126 Xe, 128 Xe, 129 Xe, 130 Xe, 131 Xe, 132 Xe, 134 Xe. Еще два изотопа ( 124 Xe и 136 Xe) имеют огромные периоды полураспада, много больше возраста Вселенной.
Остальные изотопы искусственные, самые долгоживущие — 127 Xe (период полураспада 36,345 суток) и 133 Xe (5,2475 суток), период полураспада остальных изотопов не превышает 20 часов. Среди ядерных изомеров наиболее стабильны 131 Xe m с периодом полураспада 11,84 суток, 129 Xe m (8,88 суток) и 133 Xe m (2,19 суток).
Изотоп ксенона с массовым числом 135 (период полураспада 9,14 часа) имеет максимальное сечение захвата тепловых нейтронов среди всех известных веществ — примерно 3 миллиона барн для энергии 0,069 эВ, его накопление в ядерных реакторах в результате цепочки β-распадов ядер теллура-135 и йода-135 приводит к эффекту так называемого отравления ксеноном (см. также Иодная яма).
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0,1—0,2 % криптоно-ксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В дальнейшем ксеноно-криптоновый концентрат может быть разделён дистилляцией на криптон и ксенон, подробнее см. Криптон#Получение.
Из-за своей малой распространённости ксенон гораздо дороже более лёгких инертных газов. В 2009 году цена ксенона составляла около 20 евро за литр газообразного вещества при стандартном давлении.
Ксенон
Ксено́н / Xenon (Xe), 54
[Kr] 4d 10 5s 2 5p 6
3,52 (при −107,05 °C); 0,005894 (при 0 °C) г/см³
Ксено́н — элемент главной подгруппы восьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 54. Обозначается символом Xe (лат. Xenon ). Простое вещество ксенон (CAS-номер: 7440-63-3) — инертный одноатомный газ без цвета, вкуса и запаха.
Содержание
История
Открыт в 1898 году английскими учеными У.Рамзаем и У. Рэлей как небольшая примесь к криптону.
Происхождение названия
От греч. ξένος — чужой. Открыт в 1898 английскими исследователями У. Рамзаем и М. Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Ксенон был обнаружен как примесь к криптону, с чем связано его название. Ксенон — весьма редкий элемент. При нормальных условиях 1000 м 3 воздуха содержат около 87 см 3 ксенона.
Распространённость
В солнечной системе
Земная кора
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0,087±0,001 миллионной доли (μL/L), а также встречается в газах, испускаемых некоторыми минеральными источниками. Некоторые радиоактивные изотопы ксенона, например, 133 Xe и 135 Xe, получаются как результат нейтронного облучения ядерного топлива в реакторах.
Определение
Свойства
Физические
Температура плавления −112 °C, температура кипения −108 °C, свечение в разряде фиолетовым цветом.
Химические
Первый инертный газ, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 г. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
Изотопы
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0.1-0.2 % криптоно-ксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В заключение, ксеноно-криптоновый концентрат может быть разделён дистилляцией на криптон и ксенон, подробнее здесь.
Из-за своей малой распространенности, ксенон гораздо дороже более легких инертных газов.
Применение
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
Биологическая роль
Ксенон не играет никакой биологической роли.
Физиологическое действие
Примечания
Ссылки
Полезное
Смотреть что такое «Ксенон» в других словарях:
Ксенон Z3 — Zenon: Z3 … Википедия
КСЕНОН — (символ Хе), газообразный неметаллический элемент, один из инертных газов. Открыт в 1898 г. Ксенон присутствует в земной атмосфере (в соотношении около 1:20000000) и может быть получен РЕКТИФИКАЦИЕЙ (разделением на фракции) жидкого воздуха.… … Научно-технический энциклопедический словарь
КСЕНОН — (гр. xenon.). Элемент из группы аргона; в ничтожн. количестве входит в состав воздуха. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ксенон (гр. xenos чужой (впервые был найден как примесь к криптону)) хим.… … Словарь иностранных слов русского языка
КСЕНОН — (Xenon), Xe химический элемент VIII группы периодической системы, атомный номер 54, атомная масса 131,29; относится к благородным газам. Ксенон открыли английские ученые У. Рамзай и М. Траверс в 1898 … Современная энциклопедия
Ксенон — (Xenon), Xe химический элемент VIII группы периодической системы, атомный номер 54, атомная масса 131,29; относится к благородным газам. Ксенон открыли английские ученые У. Рамзай и М. Траверс в 1898. … Иллюстрированный энциклопедический словарь
Ксенон — Xe (от греч. xenos чужой * a. xenon; н. xenon; ф. xenon; и. xenon), хим. элемент VIII группы периодич. системы Менделеева, относится к инертным газам, ат.н. 54, ат. м. 131,3. Природный K. смесь девяти стабильных изотопов, среди к рых… … Геологическая энциклопедия
КСЕНОН — КСЕНОН, а, муж. Химический элемент, инертный газ без цвета и запаха, применяемый в мощных осветительных приборах. | прил. ксеноновый, ая, ое. Ксеноновая трубка. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
КСЕНОН — (Xenon), Хе, хим. элемент VIII группы периодич. системы элементов, инертный газ. Ат. номер 54, ат. масса 131,30. Природный К. состоит из 9 стабильных изотопов: 124 Хе (0,10%), 126 Хе (0,09%), 128 Хе (1,91%), 129 Хе (26,4%), 130 Хе (4,1%), 131 Хе… … Физическая энциклопедия
ксенон — сущ., кол во синонимов: 2 • газ (55) • элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
КСЕНОН (ХЕ) — инертный газ нулевой гр. периодической системы, порядковый № 54. К. земной атмосферы состоит из 9 стабильных изотопов. Обогащенный тяжелыми изотопами, К. обнаружен в урановых м лах, где он образуется при спонтанном делении изотопов урана. См.… … Геологическая энциклопедия
О ядерном взрыве и естественном ядерном реакторе на Марсе
И вот, новая информация, которую публикуют многие зарубежные и отечественные СМИ: по мнению американского ученого, жизнь на Марсе была уничтожена в результате ядерного взрыва. Сейчас мы попробуем разобраться в этом вопросе.
Если изучить вопрос глубже, то можно натолкнуться на следующую информацию.
Впервые ксенон-129 был обнаружен в атмосфере Марса после анализа данных атмосферы планеты, проведенного спускаемым аппаратом «Викинг» в 1976 году. Первые данные были опубликованы в статье журнала Science 17 декабря 1976 года под названием «Атмосфера Марса: открытие криптона и ксенона» (The Atmosphere on Mars: Detection of Krypton and Xenon). Уже тогда заговорили о том, что концентрация данного изотопа довольно велика (ошибочно некоторые СМИ пишут, что информация о повышенной концентрации ксенона-129 была получена недавно).
Идем дальше. На основе данных, собранных в ходе миссии «Викинг», Джон Бранденбург пришел к заключению, что высокая концентрация ксенона-129 свидетельствует о мощном ядерном взрыве, произошедшем в далеком прошлом. В качестве укрепления своей теории он приводит данные о повышенной концентрации ксенона-129 в атмосфере Земли после аварии Чернобыльской АЭС в 1986 году.
Таким образом, особой новости, публикуемой зарубежными и отечественными СМИ, нет. Информация, изложенная выше уже была известна несколькими годами ранее. Но не все о ней знали.
Скорее всего для одного из агентств материал показался новым. Цепная реакция, и материал распространился по всей сети. Особую роль сыграли фрагменты о погибшей марсианской цивилизации и космической ядерной атаке. Было бы удивительно, если бы СМИ не отреагировали на такую информацию. Вот только не упомянули о естественных ядерных реакторах, которые ставят под сомнение существование разумной жизни на Марсе.
Ксенон, Xenon, Xe
Этот газ, названный «чужим», практически перевернул с ног на голову представления химиков об инертных газах. С самого начала он проявил «странные» свойства: в отличие от других инертных газов, ксенон первым вступил в химическую реакцию, первым же образовал устойчивое соединение. И заодно сделал неуместным сам термин «инертные газы». Благодаря вновь открытому веществу ранее созданная «нулевая» группа периодической системы перестала существовать.
В поисках «чужого»
После того как были открыты гелий, неон, аргон и криптон, завершающие четыре первых периода таблицы Менделеева, уже не вызывало сомнений, что пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м 3 воздуха 9,3 л аргона и всего лишь 0,08 мл ксенона.
Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон. Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха. Индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см 3 этого газа. Необычайная для того времени тонкость эксперимента!
Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит «чужой»: в криптоновой фракции воздуха он действительно выглядел чужаком. Любопытно, что с точки зрения химика ксенон на самом деле оказался «чужим» среди инертных газов. Он первым вступил в химическую реакцию, первым образовал устойчивое соединение. И потому сделал неуместным сам термин «инертные газы».
Синтез первых соединений ксенона поставил перед химиками вопрос о месте инертных газов в периодической системе. Прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности. Но, когда ксенон вступил в химическую реакцию, когда стал известен его высший фторид, в котором валентность ксенона равна восьми (а это вполне согласуется со строением его электронной оболочки), инертные газы решили перенести в VIII группу. Нулевая группа перестала существовать.
Свойства ксенона
Ксенон, как и все инертные газы VIII группы таблицы Менделеева, состоит из одноатомных молекул, не имеет ни запаха, ни цвета, не горит и не поддерживает горение, не взрывоопасен, слабо растворяется в воде и очень быстро выделяется из организма через легкие.
Ксенон в природе
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли, хотя содержание 129 Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. У Юпитера, напротив, необычно высокая концентрация ксенона в атмосфере — почти в два раза выше, чем у Солнца.
Получение ксенона
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0,1–0,2% криптоноксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. Как заключение, ксеноно-криптоновый концентрат может быть разделен дистилляцией на криптон и ксенон.
Основными поставщиками сырья (криптон-ксенонового концентрата) являются крупные промышленные центры металлургической промышленности России. Для получения чистого ксенона используется криптон-ксеноновый концентрат, который подвергается криогенной ректификации на газоразделительных установках, обеспечивающих получение ксенона высокой чистоты (99,999%). Из-за своей малой распространенности ксенон гораздо дороже более легких инертных газов.
Ксенон на практике
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев. Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов.
С конца XX века ксенон стал применяться как средство для общего наркоза (достаточно дорогой, но абсолютно нетоксичный, точнее — не вызывает химических последствий — как инертный газ). Первые диссертации о технике ксенонового наркоза в России появились в 1993 г. В качестве лечебного наркоза ксенон эффективно применяется для снятия острых абстинентных состояний и лечения наркомании, а также психических и соматических расстройств.
Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а также в качестве компонентов газовых смесей для лазеров.
В изотопе ксенон-129 возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния, называемого гиперполяризацией.