левофлоксацин или моксифлоксацин что эффективнее при ковиде
Моксифлоксацин при тяжелой внебольничной пневмонии: первая возможность монотерапии?
К тяжелой внебольничной пневмонии обычно относят случаи заболевания, требующие лечения в отделениях реанимации и интенсивной терапии (ОРИТ) [1]. Данное определение не совсем точно характеризует данное состояние, так как в разных странах обычно имеются различия в критериях госпитализации больных с бронхо-легочной патологией в ОРИТ. Нам представляется более точным следующее определение тяжелой внебольничной пневмонии:
Тяжелая внебольничная пневмония – это особая форма заболевания различной этиологии, проявляющаяся выраженной дыхательной недостаточностью и/или признаками тяжелого сепсиса или септического шока, характеризующаяся плохим прогнозом и требующая проведение интенсивной терапии.
Внебольничная пневмония относится к наиболее частым бактериальным инфекциям человека и является наиболее частой причиной смерти среди инфекционных заболеваний. Летальность при внебольничной пневмонии различается в зависимости от тяжести заболевания, и составляет от Литература
1. Niederman MS, Mandell LA, Anzueto A, et al. American Thoracic Society: guidelines for the management of adults with community-acquired pneumoniae: diagnosis, assessment of severity, antimicrobial therapy and prevention. Am J Resp Crit Care Med 2001; 163: 1730-54.
2. Read RC, Pennington JE. Respiratory tract infection. Health Press Limited, Oxford, UK, 1998.
3. Donowitz GR, Mandell GL. Acute pneumoniae. In: Principles and Practice of Infectious Diseases, 5 th edition. Ed. By GL Mandell, JE Bennett, R Dolin. Churchill Livingstone, Philadelphia, US, 2000. – pp. 717-43.
4. Leroy O, Santre C, Beuscart C. A 5-year study of severe community-acquired pneumonia with emphasis on prognosis in patients admitted to an ICU. Intens Care Med 1995; 21: 24-31.
5. Fine MJ, Auble TE, Yealy DM, et al. A prediction rule to identify low-risk patient with community-acquired pneumonia. N Engl J Med 1997; 336: 243-50.
6. Ewig S, Schafer H, Torres A. Severity assessment of community-acquired pneumonia. Eur Respir J 2000; 16: 1193-201.
7. Fine MJ, Orloff JJ, Arisumi D, et al. Prognosis of patients hospitalized with community-acquired pneumonia. Am J Med 1990; 88: S1N-S8N.
8. El-Solh AA, Sikka P, Ramadan F, et al. Etiology of severe pneumonia in the very elderly. Am J respir crit Care Med 2001; 163: 645-51.
9. Baldwin DR, Macfarlane JT. Community-acquired pneumoniae. In: Infectious Diseases, ed. By D.Armstrong, J,Cohen. Mosby, Harcourt Publishers Ltd, London, UK, 1999. – chapter 27, pp. 27.1-27.10.
10. Luna CM, Famiglietti A, Absi R, et al. Community-acquired pneumonia: etiology, epidemiology, and outcome in teaching hospital in Argentina. Chest 2000; 118: 1344-54.
11. Fine MT, Smith MA, Carson CA, et al. Prognosis and outcomes of patients with community-acquired pneumonia. JAMA 1996; 275: 134-42.
12. Bartlett JG. Management of respiratory tract infections. 3 rd ed. Lippincott Williams & Wilkins. Philadelphia, USA, 2001.
13. Bartlett JG, Dowell SF, Mandell LA, et al. Practice guidelines for the management of community-acquired pneumonia in adults. Clin Infect Dis 2000; 31: 347-82.
14. The British Thoracic Society. Guidelines for the management of community-acquired pneumonia in adults admitted to the hospital. Br J Hosp Med 1993; 49: 346-50.
15. Mandell LA, Marrie TJ, Grossman RE, et al. Canadian guidelines for the initial management of community-acquired pneumonia. Clin Infect Dis 2000; 31: 383-421.
16. Навашин С.М., Чучалин А.Г., Белоусов Ю.Б. и др. Антибактериальная терапия пневмоний у взрослых. Учебно-методическое пособие для врачей. Москва, «РМ-Вести», 1998.
17. O’Donnell JA, Gelone SP. Fluoroquinolones. Infect Dis Clin North Amer 2000; 14: 489-513.
18. Blondeau JM. Expanded activity and utility of the new fluoroquinolones: a review. Clin Therap 1999; 21 (1): 3-40.
19. Падейская Е.Н., Яковлев В.П. Антимикробные препараты группы фторхинолонов в клинической практике. М.: ЛОГАТА, 1998. – 352 с.
20. Яковлев В.П., Падейская Е.Н., Яковлев С.В. Ципрофлоксацин в клинической практике. М.: Информэлектро 2000. – 272 с.
21. Saravolatz L, Manzor O, Check C, et al. Antimicrobial activity of moxifloxacin, gatifloxacin and six fluoroquinolones against Streptococcus pneumoniae. J Antimicrob Chemother 2001; 47: 875-7.
22. Schentag JJ. Pharmacokinetic and pharmacodynamic predictors of antimicrobial efficacy: moxifloxacin and Streptococcus pneumoniae. J Chemotherapy 2002; 14 (Suppl 2): 13-21.
23. Felmingham D, Robbins MJ, Leakey A, et al. In vitro activity of moxifloxacin (BAY 12-8039), a novel 8-methoxyquinolone, compared with ofloxacin and other antibiotics. In: Moxifloxacin in practice. Volume 1 / Ed. by D.Adam, R.Finch. – Oxford: Maxim Medical Magdalene Centre, 1999: 27-37.
24. Hakenbeck R. Pre-clinical microbiology – Streptococcus pneumoniae. In: Proceedings of the First International Moxifloxacin Symposium / Ed. by L.Mandell. – Berlin: Springer-Verlag, 1999: 21-6.
25. Tillotson GS, Blondeau JM. Today’s community respiratiry tract infections: a challenge appropriate for moxifloxacin. In: Moxifloxacin in practice. Volume 1 / Ed. by D.Adam, R.Finch. – Oxford: Maxim Medical Magdalene Centre, 1999: 1-11.
26. MacGowan AP. Pharmacodynamics of moxifloxacin. In: Moxifloxacin in practice. Volume 2. – Oxford: Maxim Medical Magdalen Centre, 1999: 5-13.
27. Read RC. Clinical overview: moxifloxacin in community respiratory tract infections. In: Moxifloxacin in practice. Volume 3 / Ed. by D.Adam, R.Finch. – Oxford: Maxim Medical Magdalene Centre, 2000: 1-13.
28. Finch R, Colins O, Kubin R, et al. Moxifloxacin IV/PO compared with amoxicillin/clavulanate IV/PO with or without clarithromycin in the treatment of community-acquired pneumonia. Clin Microbiol Infect 2001; 7 (Suppl 1): 167.
29. Drummond M, Finch R, Duprat-Lomon I, et al. Superior outcomes with moxifloxacin IV/PO monotherapy compared to IV/PO amoxicillin/clavulanate +/- clarithromycin in the treatment of community-acquired pneumonia [Poster 864]. 41 st Interscience Conference on Antimicrobial Agents and Chemotherapy, Chicago, USA, 16-19 December, 2001.
30. Grossman C, Choudhri S, Haverstock D, et al. Moxifloxacin (IV/PO) for patients with severe community-acquired pneumonia [Poster 124]. 39 th Annual Meeting on the Infectious Disease Society of America, San Francisco, USA, 25-28 October, 2001.
Таблица 1 Критерии тяжелого течения внебольничной пневмонии и факторы неудовлетворительного прогноза
Таблица 2 Летальность при внебольничной пневмонии [11, в модификации]
Применение моксифлоксацина ассоциировано с высокой частотой госпитализаций в связи с развитием побочных реакций
20 августа 2013 года в журнале Pharmacoepidemiology & Drug Safety было опубликовано исследование, в котором проводилось сравнение числа госпитализаций в связи с развитием реакций гиперчувствительности при использовании антибиотиков фторхинолонового ряда: моксифлоксацина (Авелокс, Вигамокс), ципрофлоксацина (Ципро, Цилоксан) и левофлоксацина (Левакин). Авторы делают вывод, что применение моксифлоксацина ассоциировано с высоким риском развития реакций гиперчувствительности по сравнению с левофлоксацином и ципрофлоксацином.
Моксифлоксацин (Авелокс, Вигамокс) – антибиотик фторхинолонового ряда, используемый для лечения инфекции верхних и нижних отделов дыхательных путей: острого синусита, обострения хронического бронхита, внебольничной пневмонии, инфекции кожи и мягких тканей, бактериального конъюнктивита. Первым представителем моксифлоксацина был Авелокс (Bayer), который был разрешен FDA к применению 10 декабря 1999 года.
Используя базу данных FAERS (c 11.01.1997 по 12.31.2012) было выявлено 1058 случаев развития реакций гиперчувствительности при назначении моксифлоксацина и его дженериков, что привело к 197 госпитализациям и 14 смертям пациентов.
Ципрофлоксацин (Ципро, Цилоксан) – антибиотик фторхинолонового ряда, назначаемый при инфекциях почек и мочевыводящих путей: острого неосложненного цистита у женщин, хронического бактериального простатита; инфекций нижних дыхательных путей; острого синусита; инфекций опорно-двигательного аппарата; инфекций кожных покровов, слизистых оболочек и мягких тканей; инфекционных диарей; перитонита и сепсиса. Ципро был первым препаратом ципрофлоксацина, одобренным FDA 22 октября 1987 года.
Используя базу данных FAERS (c 11.01.1997 по 12.31.2012) было зафиксировано 357 случаев развития реакций гиперчувствительности при применении ципрофлоксацина и его дженериков, что привело к 118 госпитализациям и 24 смертям пациентов.
Левофлоксацин (Левакин) – фторхинолоновый антибиотик, применяемый для лечения пневмонии, острого бактериального синусита, обострения хронического бронхита, хронического бактериального простатита, острого пиелонефрита, инфекций кожи и мягких тканей (нагноившиеся атеромы, абсцессы, фурункулы). Левакин является первым левофлоксацином, одобренным FDA 20 декабря 1996 года.
Используя базу данных FAERS (c 11.01.1997 по 12.31.2012) было выявлено 413 случаев развития реакций гиперчувствительности при применении левофлоксацина и его дженериков, что привело к 139 госпитализациям и 26 смертям пациентов.
Источник: The Adverse Events Research Team. Study Shows Moxifloxacin Associated with High Rates of Hospitalizations due to Drug Reactions. August 26, 2013.
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
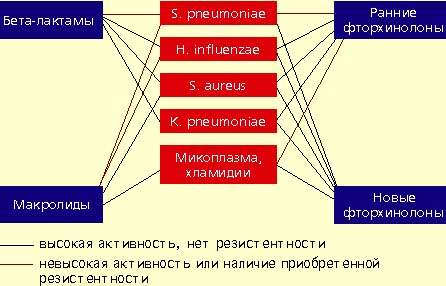 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Моксифлоксацин: настоящее и будущее в ступенчатой терапии
Опубликовано в журнале:
Клиническая микробиология и антимикробная терапия, № 1, 2003 Л.С. Страчунский, А.В. Веселов, В.А. Кречиков
НИИ антимикробной химиотерапии, Смоленск, Россия
Контактный адрес: 214019, Россия, Смоленск, а/я 5
Факс: (0812) 61 12 94
Эл. почта: str@antibiotic.ru
Абстракт
Моксифлоксацин – новый 8-метоксихинолон широкого спектра действия с высокой активностью в отношении как грам(+) и грам(-) аэробной микрофлоры, так и внутриклеточных возбудителей и анаэробов. Обладает активностью в отношении микроорганизмов, резистентных к другим классам антибактериальных препаратов, включая макролидо- и пенициллинорезистентные пневмококки и b-лактамазопродуцирующие штаммы Haemophilus influenzae.
Высокая активность против перечисленных возбудителей и хороший фармакокинетический профиль позволяют применять моксифлоксацин для терапии респираторных инфекций. Одним из подходов является ступенчатая терапия, при которой моксифлоксацин по данным многочисленных контролируемых клинических исследований продемонстрировал высокую клиническую эффективность и безопасность у пациентов с внебольничной пневмонией.
Несмотря на имеющиеся доказательные данные в отношении его высокой эффективности при респираторных заболеваниях, моксифлоксацин на сегодняшний день не нашел широкого применения при других инфекциях.
В данной статье представлен обзор результатов клинических исследований ступенчатой терапии моксифлоксацином при лечении внебольничной пневмонии и сделана попытка оценить возможные перспективы его дальнейшего применения.
Ключевые слова: моксифлоксацин, фторхинолоны, пневмония
Moxifloxacin: the Present and the Future in the Sequential Therapy
L.S. Stratchounski, A.V. Veselov, V.A. Kretchikov
Research Institute of Antimicrobial Chemotherapy, Smolensk, Russia
Abstract
Moxifloxacin – new broad spectrum 8-methoxiquinolon with high activity against Gram(+) and Gram(-) microorganisms as well as against anaerobes and intracellular pathogens. It is also active against microorganisms that are resistant to other classes of antimicrobials, including penicillin- and macrolide-resistant pneumococci and b-lactamase-producing Haemophilus influenzae.
An excellent activity against that pathogens and good pharmacokinetic profile allowed using moxifloxacin in the therapy of respiratory tract infections. High clinical efficacy and safety of moxifloxacin have been demonstrated for community-acquired pneumonia while using sequential therapy in the large number of controlled clinical trials. In spite of available evidence based data of moxifloxacin efficacy in respiratory infections he is not widely use in another types of infection processes.
In the article the literature review of clinical trials on sequential (IV/PO) moxifloxacin therapy in patients with community-acquired pneumonia is presented. An attempt to analyze the perspectives of moxifloxacin usage is made.
Key words: moxifloxacin, quinolones, pneumonia
Введение
В настоящее время хинолоны из небольшой группы препаратов, ранее использовавшихся исключительно для лечения инфекций мочевыводящих путей, превратились в один из доминирующих классов антимикробных препаратов (АМП). Вторая волна в развитии хинолонов связана с появлением фторированных производных, обладающих гораздо более высокой активностью в отношении широкого спектра микроорганизмов, включая грамположительных возбудителей (Staphylococcus aureus) и грамотрицательную флору, улучшенной фармакокинетикой, появлением форм для парентерального введения и, вследствие этого, расширением показаний для применения. «Золотым стандартом» хинолонов II поколения стал ципрофлоксацин, который с большим успехом используется для лечения многих инфекций. Существенным недостатком препаратов этого поколения является низкая активность в отношении пневмококков, внутриклеточных возбудителей (хламидий, микоплазм) и анаэробов. Эта проблема была разрешена с разработкой новых фторхинолонов III-IV поколений. Первым препаратом этой группы был левофлоксацин, который превосходил по активности против пневмококка и атипичных возбудителей предыдущие фторхинолоны, в связи с чем, данное поколение получило название «респираторные» или «антипневмококковые» фторхинолоны. Дальнейшие модификации химической структуры привели к появлению соединений активных и в отношении анаэробов. Ряд новых препаратов (темафлоксацин, тровафлоксацин, гатифлоксацин, гемифлоксацин) были потеряны, вследствие развития тяжелых нежелательных лекарственных реакций (НЛР). Единственным представителем фторхинолонов IV поколения применяющимся в настоящем времени является моксифлоксацин.
Хороший фармакокинетический профиль моксифлоксацина и наличие форм выпуска, как для парентерального применения, так и для приема внутрь, позволяют использовать данный препарат для ступенчатой антимикробной терапии (САТ) различных инфекций, включая инфекционные заболевания дыхательных путей.
Моксифлоксацин – характеристика препарата
Механизм действия
Моксифлоксацин, как и все фторхинолоны, оказывает бактерицидное действие за счет ингибирования ферментов класса топоизомераз – ДНК-гиразы (топоизомеразы II) и топоизомеразы IV. Основной мишенью моксифлоксацина в грамположительных микроорганизмах преимущественно является топоизомераза IV, а в грамотрицательных бактериях – ДНК-гираза [1].
Моксифлоксацин обладает высокой активностью против грамположительных и грамотрицательных микроорганизмов (включая микроорганизмы, устойчивые к другим классам АМП), атипичных возбудителей и анаэробов. Кроме того, в настоящее время отсутствуют данные о резистентности к моксифлоксацину основных возбудителей внебольничной пневмонии.
Спектр активности
Streptococcus pneumoniae. Моксифлоксацин высокоактивен в отношении S. pneumoniae. По данным одного из самых больших исследований, включавшем 5640 штаммов, 99,8% из них были чувствительны к препарату, 0,1% – умереннорезистентны, 0,1% – устойчивы; МПК90 составила 0,25 мг/л [2]. Также моксифлоксацин обладает высокой активностью в отношении полирезистентных пневмококков: МПК90 моксифлоксацина для 138 штаммов, устойчивых к пенициллину, эритромицину и тетрациклину, составила 0,5 мг/л [3].
По активности в отношении пневмококка моксифлоксацин превосходит другие фторхинолоны (за исключением ситафлоксацина и гемифлоксацина): он в 2 раза активнее спарфлоксацина [2] и гатифлоксацина [4], в 4-8 раз активнее левофлоксацина [2, 5], в 8 раз активнее ципрофлоксацина и офлоксацина [ 5]. По сравнению с бета-лактамами и макролидами активность моксифлоксацина в отношении полирезистентных S. pneumoniae значительно выше [2].
Streptococcus pyogenes. Значение МПК90 моксифлоксацина для S. pyogenes (b-гемолитический стрептококк группы А) составляет 0,06–0,25 мг/л. Моксифлоксацин в 2-4 раза активнее офлоксацина, ципрофлоксацина и левофлоксацина, обладает одинаковой активностью с гатифлоксацином [6, 7]. Наличие резистентности к макролидам не влияет на активность моксифлоксацина [ 7].
| 1 MRSA – метициллинорезистентный S. aureus 2 MSSA – метициллиночувствительный S. aureus |
Staphylococcus aureus. Для метициллиночувствительных S.aureus МПК90 моксифлоксацина находится в диапазоне 0,06–0,125 мг/л, в то время как для метициллинорезистентных штаммов (MRSA 1 ) МПК90 по данным разных авторов значительно различается: от 0,06 до 8 мг/л [8]. По российским данным МПК90 моксифлоксацина для MRSA составила 0,06 мг/л, а диапазон МПК 0,03–2 мг/л [9]. Моксифлоксацин в 8 раз активнее ципрофлоксацина и в 2-4 раза активнее левофлоксацина против MSSA 2 [6, 8]. По данным Jones и соавт. моксифлоксацин является одним из самых активных в отношении стафилококков фторхинолоном: МПК90 моксифлоксацина для MRSA, резистентных к ципрофлоксацину, составила 2 мг/л, что было равно МПК90 ванкомицина [8].
Haemophilus influenzae, Moraxella catarrhalis. Моксифлоксацин имеет очень высокую активность по отношению к H. influenzae и M. catarrhalis, включая штаммы резистентные к аминопенициллинам вследствие продукции b-лактамаз.
Важно отметить, что у определенной категории пациентов, особенно пожилого возраста, высок риск развития внебольничной пневмонии, вызванной грамотрицательными возбудителями, в частности Klebsiella pneumoniae и Escherichia coli, которые также наряду с P. aeruginosa выступают этиологической причиной нозокомиальной пневмонии.
Escherichia coli. Как и все другие фторхинолоны моксифлоксацин обладает высокой активностью по отношению к E. coli, однако in vitro несколько уступает ципрофлоксацину, что, однако, не имеет клинического значения [10, 11].
Klebsiella spp. Моксифлоксацин более активен чем большинство b-лактамных АМП, близок по активности к офлоксацину и незначительно уступает ципрофлоксацину [10, 11]. На штаммы E. coli и K. pneumoniae, резистентные к ципрофлоксацину, моксифлоксацин не действует [12].
Pseudomonas aeruginosa. Моксифлоксацин уступает ципрофлоксацину по активности против синегнойной палочки. МПК90 моксифлоксацина по данным разных авторов находится в диапазоне от 8 до 32 мг/л и более, а МПК90 ципрофлоксацина – от 0,5 до 16 мг/л [4, 10, 11].
Neisseria gonorrhoeae. Для моксифлоксацина характерна очень высокая активность против N. gonorrhoeae, которая in vitro лишь несколько ниже, чем у ципрофлоксацина [11].
Таблица 1. Активность моксифлоксацина в отношении аэробных грамположительных и грамотрицательных микроорганизмов
| Микроорганизм [ссылка] | Диапазон МПК, мг/л | МПК90, мг/л |
| Грамположительные микроорганизмы | ||
| S. pneumoniae [2] | 32 | |
Chlamydia spp. В отношении C. trachomatis моксифлоксацин превосходит эритромицин, азитромицин, доксициклин и ципрофлоксацин, офлоксацин, что открывает перспективы для его применения в лечении урогенитальных инфекций.
По активности против C. pneumoniae моксифлоксацин находится на одном уровне с левофлоксацином и более активен по сравнению с ципрофлоксацином.
Mycoplasma pneumoniae. Моксифлоксацин обладает большей активностью чем тетрациклин (МПК90=0,25 мг/л), доксициклин, ципрофлоксацин и левофлоксацин, однако уступает кларитромицину и азитромицину [13, 14].
Mycoplasma hominis. По активности против M. hominis моксифлоксацин значительно превосходит доксициклин, кларитромицин, левофлоксацин и ципрофлоксацин [14].
Ureaplasma urealyticum. Моксифлоксацин незначительно уступает кларитромицину и проявляет высокую активность как в отношении чувствительных (МПК90 0,25 мг/л), так и резистентных к доксициклину штаммов (МПК90 0,5 мг/л). Моксифлоксацин активнее доксициклина, эритромицина, ципрофлоксацина и левофлоксацина [14, 15].
Legionella spp. Моксифлоксацин превосходит по активности ципрофлоксацин и такой классический АМП для лечения легионеллезной инфекции как эритромицин, но несколько уступает кларитромицину и рифампицину [16, 17].
Таблица 2. Активность моксифлоксацина в отношении внутриклеточных возбудителей
флоксацин
флоксацин
флоксацин
мицин
ромицин
ромицин
циклин
Mycobacterium spp. Моксифлоксацин активен в отношении как чувствительных, так и полирезистентных штаммов M. tuberculosis и превосходит ципрофлоксацин, офлоксацин и левофлоксацин. МПК90 моксифлоксацина для полирезистентных штаммов составляет 0,5 мг/л [18, 19].
По отношению к атипичным микобактериям (M. kansasii и M. avium-intracellulare) моксифлоксацин превосходит ципрофлоксацин и левофлоксацин [18].
Анаэробы. В отличие от фторхинолонов II-III поколений (ципрофлоксацина, офлоксацина, левофлоксацина) моксифлоксацин обладает высокой активностью против анаэробов, причем как неспорообразующих, так и спорообразующих. По своей антианаэробной активности моксифлоксацин сравним с имипенемом, метронидазолом и клиндамицином [20, 21].
Клиническая фармакология
Фармакокинетика
Моксифлоксацин практически полностью всасывается из желудочно-кишечного тракта при приеме внутрь, биодоступность составляет от 86% [22] до 91,8% [23]. При внутривенном введении 400 мг в течение 1 часа значения максимальной концентрации препарата в плазме (Cmax) и площади под фармакокинетической кривой (ПФК) незначительно больше чем при приеме 400 мг внутрь [22, 24].
Максимальная концентрация препарата в плазме (Cmax) в исследовании Stass и соавт. [22] составила 2,5 мг/л через 2 часа после приема внутрь 400 мг. В то же время в исследованиях Wise с соавт. [24] и Lubasch с соавт. [25] максимальные концентрации были 4,34-4,98 мг/л и достигались через 1 час. Прием пищи, включая молочные продукты, не влияет на всасывание моксифлоксацина [26, 27].
При приеме внутрь моксифлоксацин имеет большой объем распределения (Vd): 3,08–3,55 л/кг [22] и достигает высоких концентраций в тканях и жидкостях организма: в бронхиальном секрете, альвеолярных макрофагах, тканях верхнечелюстной пазухи и жидкости, покрывающей эпителий бронхов (табл. 3).
Таблица 3. Концентрации моксифлоксацина в жидкостях и тканях организма*
| Локус [ссылка] | Максимальная концентрация (соотношение ткань / плазма) | Концентрация через 24 часа (соотношение ткань / плазма) |
| Слизистая верхнечелюстной пазухи [44] | 7,47 мг/кг (1,9) | 1,47 мг/кг (2,5) |
| Бронхиальный секрет [45] | 5,4 мг/кг (1,7) | 1,1 мг/кг (2,1) |
| Альвеолярные макрофаги [45] | 56,7 мг/л (18,6) | 35,9 мг/л (70,0) |
| Жидкость, покрывающая эпителий бронхов [45] | 20,7 мг/л (6,8) | 3,6 мг/л (1,4) |
* после приема 400 мг препарата внутрь
Концентрация моксифлоксацина в жидкостях дыхательных путей значительно превышает МПК90 для основных возбудителей респираторных инфекций.
Моксифлоксацин связывается с белками плазмы на 39,4–48%, что несколько выше, чем у ципрофлоксацина (35%). Метаболизируется в печени путем коньюгации с образованием двух метаболитов: М1 (ацетилглюкуронид) и М2 (сульфо-производное моксифлоксацина) [22].
При однократном приеме 400 мг моксифлоксацина внутрь более 96% дозы выводится через почки и ЖКТ, при этом с мочой экскретируется 15,1–35,4% препарата [22, 24]. В неизмененном виде через почки выводится 19,4% дозы, в виде метаболита М1 2,5% и в виде метаболита М2 13,6%. С фекалиями в неизмененном виде выводится 25,4% дозы и 35,5% в виде метаболита М1.
По данным большинства авторов период полувыведения составляет 12-13 час, что больше чем у ципрофлоксацина, офлоксацина и левофлоксацина. Длительный период полувыведения позволяет принимать препарат 1 раз в сутки [22, 24, 25].
Влияние возраста, заболеваний печени и почек
У взрослых возраст практически не влияет на фармакокинетические свойства моксифлоксацина, но значения максимальной концентрации препарата в плазме и площади под фармакокинетической кривой (ПФК) несколько выше у пожилых женщин по сравнению с молодыми и пожилыми мужчинами [28].
В отличие от офлоксацина и левофлоксацина при легкой почечной недостаточности (клиренс креатинина ³30 мл/мин/1,73 м 2 ) период полувыведения остается неизменным и составляет 14,5 час [29]. Однако пока нет достаточной информации о применении моксифлоксацина при клиренсе креатинина 2 или при гемодиализе, поэтому препарат не следует назначать этим категориям пациентов.
У пациентов с легкой и среднетяжелой печеночной недостаточностью (N=8) значения Cmax, ПФК и T1/2 оказались меньше, чем у здоровых добровольцев (N=10): Cmax – 2,55 и 3,02 мг/л; ПФК – 25,1 и 32,8 мг/л/час; T1/2 – 11,7 и 13,4 час соответственно [30]. В целом, на сегодняшний день мало данных о применении моксифлоксацина у пациентов с печеночной недостаточностью.
Существенных различий между фармакокинетическими параметрами при приеме моксифлоксацина внутрь и при внутривенном введении нет. Это позволяет использовать моксифлоксацин в САТ с ранним переходом на прием препарата внутрь.
Фармакодинамика
В настоящее время большее внимание уделяется фармакодинамическим свойствам АМП, которые значительно влияют на их эффективность. Считается, что для фторхинолонов условиями эффективности являются [31, 32]:
По результатам исследований с использованием in vitro моделирования с использованием респираторных патогенов значения ПФК/МПК и ПФК/МПКнесвяз для моксифлоксацина выше, чем для других фторхинолонов (табл. 4).
Таблица 4. Фармакодинамические свойства моксифлоксацина* [31]
*Данные получены в in vitro модели с использованием полирезистентных штаммов S. pneumoniae
ПФК – площадь под фармакокинетической кривой
Понятие о ступенчатой антимикробной терапии
 |  |
Рис. 1. Традиционный и ступенчатый подход к лечению тяжелой внебольничной пневмонии
(Ramirez J.A. Diagn Microbiol Infect Dis 1995; 22:219-223)
Несмотря на очевидные преимущества САТ, в силу разных причин (отсутствие пероральных АМП, сомнения в их эффективности, сложившиеся стереотипы и т.д.) она не всегда применяется на практике. По данным R.Quintiliani и соавт. [36], 75% госпитализированных пациентов с различными инфекциями могли быть переведены с парентерального на пероральный путь введения АМП. Перечень заболеваний, при которых проведены контролируемые клинические испытания САТ, включает пневмонию, инфекции урогенитального тракта, инфекции кожи и мягких тканей, остеомиелит, интраабдоминальные инфекции [37, 38]. Однако наибольшее число работ проведено по САТ внебольничной пневмонии.
Преимущества САТ
Для пациента:
Для стационара:
Ограничения ступенчатой терапии
Лекарственные взаимодействия, существенно влияя на биодоступность отдельных пероральных АМП, могут быть причиной снижения их эффективности. Так, антациды, препараты железа и кальций (молочные продукты) снижают всасывание пероральных фторхинолонов, тетрациклина, поэтому пациенту, получающему эти препараты, следует делать двухчасовой интервал между ними и приемом вышеуказанных АМП.
Относительные экономические недостатки САТ связаны с ранней выпиской и продолжением лечения в амбулаторных условиях, что вынуждает самого пациента покупать препарат для завершения курса лечения. Однако это меньше касается пациентов, имеющих медицинскую страховку (полис) или льготы на приобретение лекарственных препаратов.
Таблица 5. Критерии перевода больного на пероральный АМП [41 с изменениями]
Хорошая переносимость при пероральном приеме
Длительный интервал дозирования
Варианты ступенчатой терапии
В зависимости от орального АМП выделяют 4 варианта САТ [43]: (I) парентерально и внутрь назначают один и тот же АМП; пероральный АМП обладает хорошей биодоступностью; (II) парентерально и внутрь назначают один и тот же АМП; пероральный препарат имеет низкую биодоступность; (III) парентерально и внутрь назначают разные АМП; оральный АМП обладает хорошей биодоступностью; (IV) парентерально и внутрь назначают разные АМП; пероральный препарат имеет низкую биодоступность. Идеальным является первый вариант. Например, фторхинолон (ципрофлоксацин, пефлоксацин, левофлоксацин, моксифлоксацин) внутривенно, а далее – внутрь.
Таким образом, САТ является фармакоэкономически обоснованным режимом терапии, обеспечивающим преимущества как для пациента, так и стационара. САТ может применяться в любых лечебных учреждениях, она не влечет за собой дополнительных вложений и затрат, а требует лишь изменения привычных подходов врачей к проводимой антибактериальной терапии.
САТ при внебольничной пневмонии: данные клинических исследований
Эффективность моксифлоксацина в САТ
Grossman C. и соавт. сравнили вышеуказанные режимы терапии при тяжелой внебольничной пневмонии. Клиническая эффективность в группе моксифлоксацина была равна 79%, в группе сравнения – 80%. Уровень эрадикации в отношении S.pneumoniae составил 82% и 85%, а в отношении H.influenzae – 71% и 60%, соответственно [46].
Таблица 7. Эффективность моксифлоксацина при ступенчатой терапии внебольничной пневмонии (сводные данные)
Заслуживают внимания данные относительно эффективности моксифлоксацина при внебольничной пневмонии, вызванной атипичными возбудителями. S. Larsen при анализе сводных данных, полученных при сравнении САТ моксифлоксацином с комбинацией амоксициллин/клавуланата ± кларитромицин или фторхинолонами (алатрофлоксацин/тровафлоксацин или левофлоксацин), показали, что частота эрадикации в отношении M. pneumoniae и C. pneumoniae составила для обеих групп 96%/97% и 93%/92%, соответственно. В отношении L. pneumophila моксифлоксацин превзошел по уровню эрадикации препараты сравнения – 100% и 83%, соответственно (табл. 8) [47].
Таблица 8. Эффективность ступенчатой терапии моксифлоксацином при внебольничной пневмонии, вызванной атипичными возбудителями (сводные данные)
Моксифлоксацин 400/400 мг 1 р/сут
* Амоксициллин/клавуланат 1200/625 мг 3 р/сут ± Кларитромцин 500 мг 2 р/сут или
Алатрофлоксацин/Тровафлоксацин 200 мг 1 р/сут или Левофлоксацин 500 мг 1 р/сут
Переносимость моксифлоксацина при САТ
В клинических исследованиях частота НЛР при приеме моксифлоксацина была аналогична частоте при приеме препаратов сравнения: кларитромицина [48, 49, 50, 51], амоксициллина [52]. Только по данным Burke T. и соавт. при приеме моксифлоксацина чаще встречалась тошнота, чем при приеме цефуроксим аксетила (11% и 4% соответственно, p=0,003) [53]. Частота возникновения других НЛР оказалось аналогичной в группах сравнения.
При исследовании САТ для лечения тяжелой внебольничной пневмонии у 158 пациентов наиболее частые НЛР по данным Grossman C. и соавт. были представлены реакциями в месте введения препарата (6%) и диареей (6%) (табл. 9) [46].
Таблица 9. Нежелательные лекарственные реакции при ступенчатой терапии моксифлоксацином тяжелой внебольничной пневмонии [47]
Моксифлоксацин (n=83),
кол-во (%)
Группы сравнения (n=75),
кол-во (%)*
Реакции в месте введения препарата
Кандидоз ротовой полости
* Алатрофлоксацин / Тровафлоксацин 200 мг 1 р/сут или Левофлоксацин 500 мг 1 р/сут
Mandell L и соавт. показали, что наиболее частые НЛР были связаны с желудочно-кишечным трактом и включали: диарею (6%), отклонения в показателях функции печени (5%) и тошноту (3%), в то время как реакции в месте введения препарата имели место только у 2% пациентов. Не было зарегистрировано ни одного случая фото- и нефротоксичности [54].
Из 10,5 млн пациентов, которым был назначен моксифлоксацин (сегодня это число приближается к 19 миллионам), только у 2634 были подтверждены НЛР. Три из 4 описанных случаев пируэтной тахикардии были документально подтверждены и возникали у пациентов с заболеваниями сердечно-сосудистой системы, нарушениями электролитного состава крови и на фоне приема аритмогенных препаратов (табл. 10) [55].
Таблица 10. Профиль безопасности пероральной формы моксифлоксацина [56]
| Исследование | Количество пациентов | Частота НЛР | Наиболее частые НЛР | |||
| Тошнота | Диарея | Головокружение | Сыпь | |||
| IV фаза (США) | 18 374 | 14,3% | 5,3% | 2,2% | 2,0% | — |
| ПРН в амбулаторных условиях (Германия) | 16 007 | 2% | 0,5% | 0,4% | 0,2% | — |
| ПРН в стационарах (Германия) | 2 188 | 3% | 1% | — | 0,1% | 0,2% |
| Мета-анализ 30 клинических исследований моксифлоксацина | 7 368 | 25% | 7% | 5% | 3% | — |
| Препараты сравнения | 5 678 | 23% | 5% | 4% | 2% | — |
ПРН – пострегистрационные наблюдения
Влияние на сердечно-сосудистую систему
При исследовании безопасности САТ при внебольничной пневмонии у 550 пациентов группы моксифлоксацина не было зафиксировано ни одного эпизода развития нежелательной лекарственной реакции со стороны сердечно-сосудистой системы, связанного с удлинением интервала QT. После внутривенного введение моксифлоксацина изменения продолжительности QT составили 3 ± 29 мсек, причем коррегированный интервал QT не отличался от показателей при пероральном приеме моксифлоксацина. Корреляции между концентрацией моксифлоксацина в плазме и частотой развития аритмий, связанных с удлинением QT, отмечено не было [54].
Перспективы САТ моксифлоксацином
САТ моксифлоксацином уже доказала свою эффективность при лечении внебольничной пневмонии. Однако, учитывая широкий спектр активности данного препарата, который включает наряду с респираторными патогенами и другую флору, в частности возбудителей нозокомиальных инфекций, анаэробов, возбудителей инфекций кожи и мягких тканей, интраабдоминальных и гинекологических инфекций, проводятся дальнейшие клинические исследования с целью определить место моксифлоксацина в лечении данных заболеваний.
При лечении инфекций кожи и мягких тканей по данным трех рандомизированных двойных слепых исследований моксифлоксацин не уступал по клинической и бактериологической эффективности цефалексину и комбинации цефалексина с метронидазолом [56, 57, 58].
При терапии неосложненных воспалительных заболеваний органов малого таза у женщин моксифлоксацин (400 мг/1 р./сутки, 14 дней) был сравним по клинической эффективности (96,6% и 98,0%) с комбинацией ципрофлоксацина (500 мг однократно), доксициклина (100 мг/2 р./сутки) и метронидазола (500 мг/3 р./сутки) в течение 14 дней [59]. Бактериологическая эффективность моксифлоксацина была выше 3 чем в группе сравнения (92,5% и 88,2% соответственно).
Естественно, что при тяжелых инфекциях требуется начальная терапия парентеральными препаратами с последующим переходом на прием внутрь. В связи с этим необходимо дальнейшее изучение моксифлоксацина как препарата потенциально способного оказать эффект при его ступенчатом использовании не только в отношении респираторных заболеваний, но и тяжелых инфекционных поражениях, включая сепсис, нозокомиальную пневмонию, интраабдоминальные инфекции.
| 3 Данных о статистической значимости различий нет |
Заключение
Моксифлоксацин является новым фторхинолоном IV поколения, обладающим высокой активностью в отношении большинства клинически значимых возбудителей, включая респираторные патогены, грамположительные и грамотрицательные микроорганизмы ответственные за развитие нозокомиальных инфекций, анаэробы.
Благодаря отсутствию существенных различий между фармакокинетическими параметрами моксифлоксацина при в/в и пероральном введении сегодня стало возможным применять его в САТ с ранним переходом на прием препарата внутрь. САТ позволяет снизить длительность пребывания пациента в стационаре, уменьшая как общую стоимость терапии, так и частоту НЛР, связанных с парентеральным применением АМП.
Обладая оптимальной фармакокинетикой, позволяющей принимать препарат 1 раз в сутки, хорошей переносимостью и высокой клинической эффективностью при лечении внебольничной пневмонии (более быстрое достижение апирексии, хорошая эффективность при тяжелом статусе пациента, включая эпизоды бактериемии) имеется большая перспектива использования моксифлоксацина для САТ при других инфекционных заболеваниях.
† Interscience Conference on Antimicrobial Agents and Chemotherapy
¨ European Congress of Clinical Microbiology and Infectious Diseases
‡ International Congress on Infectious Diseases